神经前体细胞表达发育下调蛋白4-1在胰腺癌组织中的表达和临床意义
DOI: 10.3969/j.issn.1001-5256.2022.03.024
Expression of neural precursor cell expressed developmentally downregulated 4-1 in pancreatic cancer tissue and its clinical significance
-
摘要:
目的 探讨泛素化E3连接酶神经前体细胞表达发育下调蛋白4-1(NEDD4-1)在胰腺癌组织中的表达及临床意义。 方法 选取2017年1月—2019年12月于徐州市中心医院行手术治疗的病理学检查确诊为胰腺导管腺癌患者58例。采用免疫组化法检测胰腺癌组织标本中NEDD4-1的表达情况,分析NEDD4-1的表达与胰腺癌临床病理特征的相关性。使用Western Blot检测正常胰腺导管上皮HPDE6-C7细胞及胰腺癌SW1990、BxPC-3、PANC-1细胞中NEDD4-1的表达水平。计量资料两组间比较采用t检验。计数资料两组间比较采用χ2检验。采用Kaplan-Meier检验绘制生存曲线,log-rank检验进行生存分析。采用Cox回归分析预后相关因素。 结果 NEDD4-1在胰腺癌组织里的表达水平较癌旁组织中明显升高(79.31% vs 19.05%,χ2=35.614,P=0.001),且NEDD4-1在胰腺癌细胞株中的蛋白表达水平较正常胰腺导管上皮细胞明显上调(P值均<0.01)。NEDD4-1的表达分别与胰腺癌患者的远处转移、肿瘤分化程度和肿瘤TNM分期相关(χ2值分别为5.089、9.071、8.882,P值分别为0.04、0.003、0.003)。NEDD4-1阳性表达患者的平均存活时间明显短于阴性表达患者[(13.61±0.95)个月vs (22.22±2.20)个月,P=0.001]。Cox回归分析结果显示,NEDD4-1表达(HR=2.312,95% CI: 1.010~5.295,P=0.047)、淋巴结转移(HR=2.981,95% CI: 1.556~5.712,P=0.001)及肿瘤分化程度(HR=2.144,95% CI: 1.155~3.979,P=0.016)为胰腺癌患者预后的独立危险因素。 结论 NEDD4-1在胰腺癌组织及细胞内的阳性表达明显升高,且NEDD4-1阳性表达与预后不良相关,或可作为胰腺癌预后的一个预测因子和潜在治疗靶点。 Abstract:Objective To investigate the expression of the E3 ubiquitin ligase neural precursor cell expressed developmentally downregulated 4-1 (NEDD4-1) in pancreatic cancer tissue and its clinical significance. Methods Clinical data were collected from 58 patients who underwent surgical treatment in Xuzhou Central Hospital from January 2017 to December 2019 and were diagnosed with pancreatic ductal adenocarcinoma based on pathological examination. Immunohistochemistry was used to measure the expression of NEDD4-1 in pancreatic cancer tissue samples, and the association between the expression of NEDD4-1 and the clinicopathological features of pancreatic cancer was analyzed. Western blot was used to measure the protein expression level of NEDD4-1 in normal pancreatic ductal epithelial HPDE6-C7 cells and pancreatic cancer SW1990, BxPC-3, and PANC-1 cells. The t-test was used for comparison of continuous data between two groups, and the chi-square test was used for comparison of categorical data between two groups. The Kaplan-Meier method was used to plot survival curves, and the log-rank test was used for survival analysis. The Cox proportional-hazards regression model was used to investigate the factors associated with prognosis. Results The expression level of NEDD4-1 in pancreatic cancer tissue was significantly higher than that in adjacent tissue (79.31% vs 19.05%, χ2=35.614, P < 0.01), and the protein expression of NEDD4-1 in pancreatic cancer cells was significantly higher than that in normal pancreatic ductal epithelial cells (P < 0.01). In the patients with pancreatic cancer, the expression of NEDD4-1 was associated with distant metastasis (χ2=5.089, P=0.040), tumor differentiation (χ2=9.071, P=0.003), and TNM stage (χ2=8.882, P=0.003). The patients with high NEDD4-1 expression had a significantly shorter mean survival time than those with low expression (13.61±0.95 months vs 22.22±2.20 months, P=0.001). The Cox regression analysis showed that NEDD4-1 expression (hazard ratio [HR]=2.312, 95% confidence interval [CI]: 1.010-5.295, P=0.047), degree of tumor differentiation (HR=2.981, 95% CI: 1.556-5.712, P=0.001), and lymph node metastasis (HR=2.144, 95% CI: 1.155-3.979, P=0.016) were independent risk factors for the prognosis of patients with pancreatic cancer. Conclusion There is a significant increase in the expression of NEDD4-1 in pancreatic cancer tissue and cells, and the high expression of NEDD4-1 is associated with poor prognosis. Therefore, it can be used as a prognostic biomarker and a therapeutic target for pancreatic cancer. -
Key words:
- Pancreatic Neoplasms /
- Ubiquitin-Protein Ligases /
- Pathology, Clinical /
- Prognosis
-
胰腺癌是一种来源于胰腺腺管上皮细胞,恶性水平非常高的消化道肿瘤。近年来,胰腺癌患病人数逐渐增多,在美国恶性肿瘤致死人数排名中高居第4位[1], 在我国居第6位[2]。据报道[3-4],2020年美国预计有57 600例新发胰腺癌病例,且因胰腺癌死亡的人数达到4705例。预计至2030年,胰腺癌将超过乳腺癌、前列腺癌和结直肠癌,升至恶性肿瘤致死率排名第2位,仅低于肺癌。目前,手术切除仍然是胰腺癌治疗的主要手段,但根治术后5年存活率仅15%~25%[5],且复发和转移率很高。由于耐药高发,亦导致化疗效果大打折扣[6]。因此,探索胰腺癌发生进展机制,寻找敏感治疗靶点尤为重要。神经前体细胞表达发育下调蛋白4-1(neural precursor cell expressed, developmentally down-regulated 4-1,NEDD4-1)在真核生物的细胞核和细胞质内表达,通过调节泛素化的活化水平而发挥多种生物学功效。研究[7-9]发现,NEDD4-1在60%的乳腺癌组织中呈高表达,在80%的非小细胞肺癌患者中呈高表达,在晚期胃癌患者中显著上调且与肿瘤的远处转移、复发等紧密相关。但NEDD4-1在胰腺癌中的表达水平及临床意义尚未明确,本研究旨在分析NEDD4-1在胰腺癌组织中的表达及与多种临床病理特点和疾病预后的相关性。
1. 资料与方法
1.1 研究对象
选取2017年1月—2019年12月于徐州市中心医院行手术治疗的58例胰腺癌患者及其中42例对应的胰腺癌旁组织,病理学检查均确诊为胰腺导管腺癌。所有患者术前均未接受过放化疗或新型辅助治疗。其中,男31例,女27例; ≤60岁20例,>60岁38例; 高中分化腺癌26例,低分化腺癌32例; 淋巴结转移27例,淋巴结未转移31例; 远处脏器转移21例,无远处转移37例; 参照美国癌症联合委员会第八版胰腺癌TNM分期指南[10],TNMⅠ/Ⅱ期31例,Ⅲ/Ⅳ期27例。
1.2 免疫组化及评分标准
胰腺癌组织标本脱蜡水化,使用DAB显色及苏木紫染色方案进行:1∶ 300抗NEDD4-1抗体一抗孵育过夜,1∶ 5000二抗反应30 min,最后使用显微镜进行观察评判。染色结果判定:NEDD4-1蛋白阳性染色主要集中在细胞质中。染色强度评分:无染色计0分; 微弱染色(表现为淡黄色)计1分; 中等染色(表现为棕黄色)计2分; 强染色(表现为棕褐色)计3分。阳性染色比例评分:阳性染色细胞占比0~5%计0分; 6%~30%计1分; 31%~50%计2分; 51%~70%计3分; ≥71%计4分。染色结果判定总分=染色强度分值×阳性染色比例分值。总分为0分者计为阴性表达; 1~2分者计为弱阳性表达; 3~6分者计为中阳性表达; >6分者计为强阳性表达。
1.3 Western Blot检测蛋白表达水平
收集处在对数生长期的正常胰腺导管上皮HPDE6-C7细胞及胰腺癌SW1990、BxPC-3、PANC-1细胞,应用细胞裂解液提取细胞中的蛋白,采用BCA试剂盒进行蛋白含量测定,10% SDS分离胶电泳分离总蛋白后转移至PVDF膜,封闭处理后分别孵育NEDD4-1及GAPDH一抗,使用二抗孵育后进行显色。最终取得的条带采用Image J软件进行灰度值分析。
1.4 统计学处理
采用SPSS 19.0统计软件进行数据分析。计量资料以x ±s表示,两组间比较采用t检验。计数资料两组间比较采用χ2检验。采用Kaplan-Meier检验绘制生存曲线,log-rank检验进行生存分析。采用Cox回归分析预后相关因素。P<0.05为差异有统计学意义。
2. 结果
2.1 NEDD4-1在胰腺癌组织及细胞内的表达
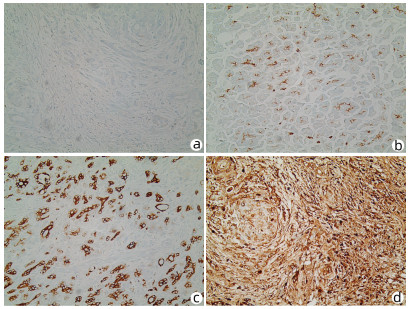
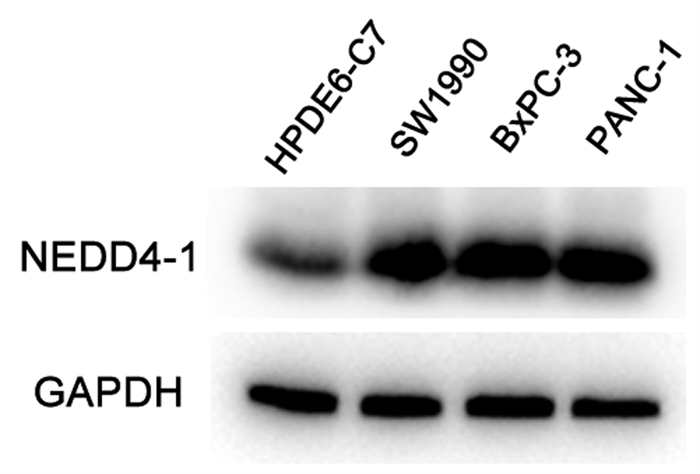
在58例胰腺癌组织中,28例呈强阳性表达,12例呈中阳性表达,6例呈弱阳性表达,阳性表达率达79.31%;在对应的42例胰腺癌旁组织中,7例呈弱阳性表达,1例呈中阳性表达,34例呈阴性表达,阳性表达率仅为19.05%。与胰腺癌旁组织相比,胰腺癌组织中NEDD4-1的阳性表达率明显升高(χ2=35.614,P=0.001)(图 1)。Western Blot结果显示,NEDD4-1在胰腺癌细胞株SW1990 (1.18±0.14)、BxPC-3(1.40±0.21)及PANC-1(1.29±0.15) 内的蛋白相对表达水平相较于正常胰腺导管上皮HPDE6-C7(0.61±0.09)细胞明显上升(t值分别为0.004、0.004、0.003,P值均<0.01)(图 2)。
2.2 NEDD4-1表达与胰腺癌患者临床病理特征的相关性
胰腺癌组织中NEDD4-1表达水平与胰腺癌远处转移、肿瘤分化程度和TNM分期相关(P值均<0.05)(表 1)。
表 1 胰腺癌组织内NEDD4-1表达水平患者的临床病理特征比较临床因素 例数 NEDD4-1表达 χ2值 P值 阳性 阴性 年龄[例(%)] 0.602 0.515 ≤60岁 20 17(85.0) 3(15.0) >60岁 38 29(76.3) 9(23.7) 性别[例(%)] 1.063 0.348 男 31 23(74.2) 8(25.8) 女 27 23(85.2) 4(14.8) 肿瘤大小[例(%)] 2.425 0.156 ≤4 cm 43 32(74.4) 11(25.6) >4 cm 15 14(93.3) 1(6.7) 淋巴结转移[例(%)] 2.825 0.115 有 31 22(71.0) 9(29.0) 无 27 24(88.9) 3(11.0) 远处转移[例(%)] 5.089 0.040 有 37 26(70.3) 11(29.7) 无 21 20(95.2) 1(4.8) 肿瘤分化程度[例(%)] 9.071 0.003 高/中分化 26 16(61.5) 10(38.5) 低分化 32 30(93.8) 2(6.2) TNM分期[例(%)] 8.882 0.003 Ⅰ+Ⅱ 31 20(64.5) 11(35.5) Ⅲ+Ⅳ 27 26(96.3) 1(3.7) 2.3 NEDD4-1表达和胰腺癌患者预后的相关性
本研究末次随访时间为2020年6月,若患者死亡则随访结束。Kaplan-Meier曲线显示,胰腺癌患者总体生存时间为(15.45±1.00)个月,中位生存时间为(15.00±0.91)个月。NEDD4-1阳性表达患者平均存活(13.61 ±0.95)个月,中位生存时间为(13.00±0.92)个月; NEDD4-1阴性表达患者平均存活时间可达到(22.22±2.20)个月,中位生存时间为(19.00±5.20)个月。与NEDD4-1阴性表达患者相比,NEDD4-1阳性表达患者平均存活时间明显短缩(χ2=10.348,P=0.001)(图 3)。
2.4 影响胰腺癌预后的危险因素分析
单因素Cox分析结果显示,远处转移、TNM分期、NEDD4-1表达、淋巴结转移和分化程度与胰腺癌的预后相关(P值均<0.05)。多因素Cox分析结果显示,NEDD4-1表达、分化程度和淋巴结转移为胰腺癌患者预后的独立危险因素(P值均<0.05)(表 2)。
表 2 影响胰腺癌患者预后的Cox比例风险模型分析参数 单因素分析 多因素分析 HR 95% CI P值 HR 95% CI P值 年龄 0.791 0.445~1.408 0.426 - - - 性别 1.107 0.634~1.933 0.721 - - - 肿瘤大小 1.324 0.602~2.916 0.485 - - - 远处转移 2.894 1.572~5.328 0.001 1.947 0.663~5.717 0.225 TNM分期 2.582 1.442~4.621 0.001 0.640 0.214~1.913 0.425 NEDD4-1表达 3.474 1.598~7.552 0.002 2.312 1.010~5.295 0.047 淋巴结转移 3.102 1.718~5.599 0.001 2.981 1.556~5.712 0.001 分化程度 1.912 0.946~3.041 0.036 2.144 1.155~3.979 0.016 3. 讨论
目前,胰腺癌全球患病率逐年递增[11]。我国胰腺癌患病人数、死亡率也呈上升趋势[12],且这种趋势将随着多种因素继续上升[13]。胰腺癌的早期临床诊断较难,虽然越来越多的科研人员针对胰腺癌的病理学、诊断学开展积极研究探索,但目前临床上仍缺乏灵敏度、特异度高的诊断标志物,被广泛认可的诊断指标仍只有CA19-9[14]。因此,亟需探明胰腺癌的发生发展和预后相关特异性分子标志物,以指导靶向药物的开发,提升临床治疗水平。
泛素连接酶E3作为泛素-蛋白酶体系统的一个关键组成部分,具有调节细胞内的基因转录、降解细胞中错误表达的蛋白并稳定细胞质的膜蛋白等重要生物学功能,同时还具有抑制恶性肿瘤病程进展的特异性作用[15]。NEDD4家族是目前研究最多、最清楚的一类E3连接酶,且NEDD4-1作为NEDD4家族中重要的成员之一,同样也具备上述一系列功能。既往NEDD4-1相关研究多关注于细胞膜钠离子通道状态的调控和神经细胞发育等方面,如调节细胞的增殖、T淋巴细胞的功能、神经肌肉接头处的成熟发育、中枢神经系统的生长发育及轴突传导等[16]。近段时间以来,NEDD4-1在肿瘤发生发展过程中的作用受到越来越多的学界关注[17]。NEDD4-1作为一种原癌基因,被发现在人类多种恶性肿瘤(如结肠癌、肺癌)的组织中呈异常的表达上调,还可作为前列腺癌、乳腺癌预后的独立预测因子,有望成为一种新的肿瘤治疗靶点[18]。Weng等[19]研究发现,NEDD4在胰腺癌细胞株中的表达明显上调且与细胞的侵袭迁移能力密切相关。然而,目前尚未见有NEDD4-1在人胰腺癌组织中的表达及其与病程发生发展关系的报道。本研究证实了胰腺癌组织中NEDD4-1的表达水平较癌旁组织明显升高,且胰腺癌细胞株中NEDD4-1的表达相较于正常胰腺导管上皮细胞明显上调; 组织内NEDD4-1表达改变与胰腺癌患者的远处转移、肿瘤分化程度及肿瘤TNM分期紧密相关; NEDD4-1表达升高可影响胰腺癌患者的存活率,且与胰腺癌的不良预后密切相关,其或可作为胰腺癌预后的一个预测因子。
本研究的不足之处在于纳入样本量有限,且病理类型较为单一,希望后续开展多中心、更大样本量的研究证实相关结论。
综上所述,NEDD4-1在胰腺癌中高表达,且可能成为评判胰腺癌预后的潜在标志物,进一步探究NEDD4-1可能为揭示胰腺癌病程进展及预后所涉及的相关分子机制提供一定的推进作用,也将为胰腺癌的诊治提供一个新的思路。
-
表 1 胰腺癌组织内NEDD4-1表达水平患者的临床病理特征比较
临床因素 例数 NEDD4-1表达 χ2值 P值 阳性 阴性 年龄[例(%)] 0.602 0.515 ≤60岁 20 17(85.0) 3(15.0) >60岁 38 29(76.3) 9(23.7) 性别[例(%)] 1.063 0.348 男 31 23(74.2) 8(25.8) 女 27 23(85.2) 4(14.8) 肿瘤大小[例(%)] 2.425 0.156 ≤4 cm 43 32(74.4) 11(25.6) >4 cm 15 14(93.3) 1(6.7) 淋巴结转移[例(%)] 2.825 0.115 有 31 22(71.0) 9(29.0) 无 27 24(88.9) 3(11.0) 远处转移[例(%)] 5.089 0.040 有 37 26(70.3) 11(29.7) 无 21 20(95.2) 1(4.8) 肿瘤分化程度[例(%)] 9.071 0.003 高/中分化 26 16(61.5) 10(38.5) 低分化 32 30(93.8) 2(6.2) TNM分期[例(%)] 8.882 0.003 Ⅰ+Ⅱ 31 20(64.5) 11(35.5) Ⅲ+Ⅳ 27 26(96.3) 1(3.7) 表 2 影响胰腺癌患者预后的Cox比例风险模型分析
参数 单因素分析 多因素分析 HR 95% CI P值 HR 95% CI P值 年龄 0.791 0.445~1.408 0.426 - - - 性别 1.107 0.634~1.933 0.721 - - - 肿瘤大小 1.324 0.602~2.916 0.485 - - - 远处转移 2.894 1.572~5.328 0.001 1.947 0.663~5.717 0.225 TNM分期 2.582 1.442~4.621 0.001 0.640 0.214~1.913 0.425 NEDD4-1表达 3.474 1.598~7.552 0.002 2.312 1.010~5.295 0.047 淋巴结转移 3.102 1.718~5.599 0.001 2.981 1.556~5.712 0.001 分化程度 1.912 0.946~3.041 0.036 2.144 1.155~3.979 0.016 -
[1] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI: 10.3322/caac.21442. [2] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI: 10.3322/caac.21338. [3] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI: 10.3322/caac.21590. [4] SAAD AM, TURK T, AL-HUSSEINI MJ, et al. Trends in pancreatic adenocarcinoma incidence and mortality in the United States in the last four decades; a SEER-based study[J]. BMC Cancer, 2018, 18(1): 688. DOI: 10.1186/s12885-018-4610-4. [5] CHEN RF, ZHONG CR, ZHOU QB. Current status and perspectives of minimally invasive surgical treatment of pancreatic head carcinoma[J]. J Chin Hepatol, 2019, 35(5): 953-957. DOI: 10.3969/j.issn.1001-5256.2019.05.004.陈汝福, 钟诚锐, 周泉波. 胰头癌微创手术治疗的现状及展望[J]. 临床肝胆病杂志, 2019, 35(5): 953-957. DOI: 10.3969/j.issn.1001-5256.2019.05.004. [6] GE WY, WANG HX. Immunotherapy for pancreatic ductal adenocarcinoma: Challenges and opportunities[J]. J Clin Hepatol, 2019, 35(5): 958-963. DOI: 10.3969/j.issn.1001-5256.2019.05.005.葛伟玉, 王红霞. 胰腺导管腺癌的免疫治疗——挑战与机遇并存[J]. 临床肝胆病杂志, 2019, 35(5): 958-963. DOI: 10.3969/j.issn.1001-5256.2019.05.005. [7] CHEN Y, van de VIJVER MJ, HIBSHOOSH H, et al. PTEN and NEDD4 in human breast carcinoma[J]. Pathol Oncol Res, 2016, 22(1): 41-47. DOI: 10.1007/s12253-015-9971-2. [8] AMODIO N, SCRIMA M, PALAIA L, et al. Oncogenic role of the E3 ubiquitin ligase NEDD4-1, a PTEN negative regulator, in non-small-cell lung carcinomas[J]. Am J Pathol, 2010, 177(5): 2622-2634. DOI: 10.2353/ajpath.2010.091075. [9] SUN A, YU G, DOU X, et al. Nedd4-1 is an exceptional prognostic biomarker for gastric cardia adenocarcinoma and functionally associated with metastasis[J]. Mol Cancer, 2014, 13: 248. DOI: 10.1186/1476-4598-13-248. [10] YANG YM. Evaluation of American Joint Commission on Cancer (8th edition) and Japanese Pancreas Society(7th edition) changes for T and N staging in patients with pancreatic adenocarcinoma[J]. Chin J Surg, 2017, 55(1): 20-23. DOI: 10.3760/cma.j.issn.0529-5815.2017.01.006.杨尹默. AJCC第八版及日本胰腺学会第七版胰腺癌TNM分期的更新要点及内容评介[J]. 中华外科杂志, 2017, 55(1): 20-23. DOI: 10.3760/cma.j.issn.0529-5815.2017.01.006. [11] WANG D, CUI M, YU J. Research advances of precision treatment for pancreatic cancer[J]. Chin J Dig Surg, 2021, 20(4): 385-394. DOI: 10.3760/cma.J.cn115610-20210223-00089.汪栋, 崔铭, 余俊. 胰腺癌精准治疗的研究进展[J]. 中华消化外科杂志, 2021, 20(4): 385-394. DOI: 10.3760/cma.J.cn115610-20210223-00089. [12] WEI W, ZENG H, ZHENG R, et al. Cancer registration in China and its role in cancer prevention and control[J]. Lancet Oncol, 2020, 21(7): e342-342, e349. DOI: 10.1016/S1470-2045(20)30073-5. [13] FENG RM, ZONG YN, CAO SM, et al. Current cancer situation in China: Good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun (Lond), 2019, 39(1): 22. DOI: 10.1186/s40880-019-0368-6. [14] MAO N, HUANG ZJ, LIN ZT, et al. Current status of the application of translational medicine in the early diagnosis of pancreatic cancer[J]. Chin J Dig Surg, 2021, 20(4): 466-470. DOI: 10.3760/cma.j.cn115610-20210117-00029.毛宁, 黄子健, 林志涛, 等. 转化医学在胰腺癌早期诊断中的应用现状[J]. 中华消化外科杂志, 2021, 20(4): 466-470. DOI: 10.3760/cma.j.cn115610-20210117-00029. [15] MOGK A, SCHMIDT R, BUKAU B. The N-end rule pathway for regulated proteolysis: Prokaryotic and eukaryotic strategies[J]. Trends Cell Biol, 2007, 17(4): 165-172. DOI: 10.1016/j.tcb.2007.02.001. [16] BALZAC F, AVOLIO M, DEGANI S, et al. E-cadherin endocytosis regulates the activity of Rap1: A traffic light GTPase at the crossroads between cadherin and integrin function[J]. J Cell Sci, 2005, 118(Pt 20): 4765-4783. DOI: 10.1242/jcs.02584. [17] YANG CL, LI QQ, XIA RL, et al. Effects of NEDD4 on proliferation, migration, and invasion of bladder cancer cells[J]. Shandong Med J, 2019, 59(16): 37-40. DOI: 10.3969/j.issn.1002-266X.2019.16.010.杨传来, 李巧巧, 夏任兰, 等. NEDD4基因沉默对膀胱癌细胞增殖、迁移和侵袭的影响[J]. 山东医药, 2019, 59(16): 37-40. DOI: 10.3969/j.issn.1002-266X.2019.16.010. [18] LUHTALA S, STAFF S, KALLIONIEMI A, et al. Clinicopathological and prognostic correlations of HER3 expression and its degradation regulators, NEDD4-1 and NRDP1, in primary breast cancer[J]. BMC Cancer, 2018, 18(1): 1045. DOI: 10.1186/s12885-018-4917-1. [19] WENG M, LUO ZL, WU XL, et al. The E3 ubiquitin ligase NEDD4 is translationally upregulated and facilitates pancreatic cancer[J]. Oncotarget, 2017, 8(12): 20288-20296. DOI: 10.18632/oncotarget.15446. 期刊类型引用(2)
1. 刘岩,张嫚嫚,毕亭亭. NEDD4-1调控JAK2/STAT3通路参与胰腺癌发生、发展的研究. 医学研究杂志. 2024(04): 154-158+14 .  百度学术
百度学术2. 毕亭亭,刘通,夏天,刘岩. NEDD4-1通过JAK2/STAT3通路促进胰腺癌上皮间质转化. 医学研究杂志. 2024(11): 132-138 .  百度学术
百度学术其他类型引用(0)
-




 PDF下载 ( 3129 KB)
PDF下载 ( 3129 KB)


 下载:
下载:


 下载:
下载:

 百度学术
百度学术




