慢加急性肝衰竭的定义、预后评估及诊治进展
DOI: 10.3969/j.issn.1001-5256.2022.07.041
Definition, prognostic assessment, and advances in the diagnosis and treatment of acute-on-chronic liver failure
-
摘要: 慢加急性肝衰竭(ACLF)是一种在慢性肝病基础上发生肝功能急性失代偿的临床综合征,目前全球尚无统一定义标准。其显著特征是肝病进展迅速,常伴发多器官功能衰竭,短期病死率高。慢性肝病以慢性病毒性肝炎和酒精性肝病最为常见。感染、酒精、肝毒性药物等是其发生的主要诱因,但有高达40%~50%的ACLF病例没有可识别的诱发因素。早期发现并准确评估病情对ACLF患者至关重要,但目前仍缺乏早期预警并准确评估病情的理想方法。目前的治疗方法主要为器官支持和并发症的治疗,肝移植是唯一能够改善预后的治疗手段,但如何选择合适的患者以及肝移植的时机仍存在一定争议。Abstract: Acute-on-chronic liver failure (ACLF) is a clinical syndrome with acute decompensation of liver function on the basis of chronic liver diseases, and at present, there is still no unified definition standard for this disease in the world. ACLF is characterized by rapid progression of liver disease, multiple organ failure, and high short-term mortality. Chronic viral hepatitis and alcoholic liver disease are the most common chronic liver diseases, and infection, alcohol, and hepatotoxic drugs are the main predisposing factors for this disease, but up to 40%-50% of ACLF cases have no identifiable predisposing factors. Early identification and accurate assessment of disease conditions are crucial to ACLF patients, but there is still a lack of ideal assessment methods for early warning and accurate assessment. Currently, the main treatment methods are organ support and treatment of complications, and liver transplantation is the only treatment method that can improve prognosis; however, there are still controversies over the selection of appropriate patients and the timing of liver transplantation.
-
Key words:
- Acute-on-Chronic Liver Failure /
- Prognosis /
- Diagnosis /
- Therapeutics
-
慢性HBV感染者如不接受有效的抗病毒治疗可能会发展为肝硬化,代偿期乙型肝炎肝硬化患者中位生存期约为12年,而当病情发展至失代偿期乙型肝炎肝硬化,患者的中位生存期仅有2年左右[1]。研究[2-3]证实有效的抗病毒治疗可以改善失代偿期乙型肝炎肝硬化患者的肝功能,使部分患者达到再代偿状态。国外有研究[4]对使用替诺福韦抗病毒治疗的失代偿期乙型肝炎肝硬化患者进行了随访,发现有48.6%的患者在抗病毒治疗2年后出现肝功能逆转,实现再代偿。但是目前对于失代偿期乙型肝炎肝硬化再代偿的影响因素尚不完全明确,笔者对核苷类药物治疗的初次失代偿期乙型肝炎肝硬化患者进行了回顾性分析,以期了解患者再代偿的影响因素。
1. 资料与方法
1.1 研究对象
本研究纳入2011年9月1日—2019年12月31日就诊于本院的首次失代偿期乙型肝炎肝硬化住院患者,根据随访结束时患者的结局分为再代偿组和持续失代偿组。纳入标准:(1)年龄≥18周岁;(2)所有患者均在首次失代偿事件发生前3个月内或第1次发生后立刻使用核苷类药物抗病毒治疗;(3)失代偿期乙型肝炎肝硬化诊断符合《慢性乙型肝炎防治指南(2019年版)》[5];(4)再代偿乙型肝炎肝硬化符合《肝硬化诊治指南》[6],即失代偿期乙型肝炎肝硬化患者经过有效的病因治疗及对症治疗后失代偿并发症(腹水,消化道出血,肝性脑病,自发性腹膜炎及肝衰竭)消失并维持超过1年;(5)持续病毒学应答(SVR)(即HBV DNA持续低于检测下限)符合本文作者所在单位检测标准,2018年6月前HBV DNA检测下限为500 IU/mL,2018年6月后检测下限为20 IU/mL。排除标准:(1)除HBV外合并其他嗜肝病毒感染;(2)合并自身免疫性肝病、酒精性肝病、药物性肝病等其他肝脏疾病;(3)既往有肝细胞癌病史或首次入院后6个月内诊断为肝细胞癌患者;(4)同时患有其他显著影响患者生存率的疾病,包括其他血液病、免疫性疾病或恶性肿瘤等其他重大疾病;(5)有脾切除手术史,经颈静脉肝内门体分流术史或随访过程中行肝移植手术的患者。
1.2 数据收集及随访
人口统计学资料来自于电子病历系统。实验室检查资料为患者住院期间首次检查的临床或生物化学资料,根据患者门诊和住院记录及出院后电话随访记录患者情况。以患者首次因失代偿期乙型肝炎肝硬化入院时间为起始时间,患者死亡、失访以及研究结束时(2020年12月31日)仍生存为截尾数据。
1.3 观察指标
一般情况包括性别、年龄、家族史,抗病毒药物有阿德福韦(正大天晴药业集团股份有限公司),替比夫定(北京诺华制药有限公司),恩替卡韦(中美上海施贵宝制药有限公司,正大天晴药业集团股份有限公司),替诺福韦(正大天晴药业集团股份有限公司、葛兰素史克有限公司),丙酚替诺福韦(吉利德科学公司);实验室指标包括血常规,肝功能,肾功能,电解质,HBV DNA定量(检测法:Taqman实时荧光定量PCR法,试剂:厦门安普利乙型肝炎病毒检测试剂盒,检测灵敏度:2018年6月前为500 IU/mL,2018年6月后为20 IU/mL),国际标准化比值(INR)和甲胎蛋白(AFP);肝功能评价指标包括CTP评分和终末期肝病模型(MELD)评分。
1.4 统计学方法
采用SPSS 23.0对数据进行统计分析。所有计量资料均为非正态分布,采用M(P25~P75) 表示,2组间比较采用Mann-Whitney U检验。计数资料组间比较采用χ2检验。Cox风险比例回归模型用于分析与再代偿相关的影响因素。采用Kaplan-Meier法绘制生存曲线,log-rank检验生存曲线。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
本研究共纳入患者438例,平均年龄51(44~62)岁,男282例(64.4%),女156例(35.6%)。73例有乙型肝炎家族史。首次失代偿事件为腹水有300例(68.5%),消化道出血99例(22.6%),肝性脑病41例(9.4%),自发性腹膜炎37例(8.4%)。所有患者初次失代偿事件仅有1件的有366例(83.6%)。随访过程中实现SVR患者261例(59.6%)。101例(23.0%)患者最终死亡,其中78例(77.2%)患者死于肝硬化失代偿并发症,23例(22.8%)患者死于原发性肝癌。
2.2 再代偿患者基本临床特征
如表 1所示,438例首次失代偿期乙型肝炎肝硬化患者中实现再代偿患者199例(45.4%),男127例(63.8%),女72例(36.2%)。
表 1 再代偿患者与持续失代偿患者临床基线资料比较Table 1. Clinical baseline data for recompensated patients and persistent decompensation patients项目 再代偿组(n=199) 持续失代偿组(n=239) 统计值 P值 男/女(例) 127/72 155/84 χ2=0.005 0.941 年龄(岁) 50(44~59) 51(44~64) Z=4.797 0.101 随访时间(月) 23.0(15.0~45.0) 20.5(9.0~60.8) Z=-0.227 0.820 家族史[例(%)] 32(16.1) 41(17.2) χ2=0.009 0.764 SVR(例) 162/37 99/140 χ2=72.093 <0.001 首次失代偿事件 单个/多个并发症(例) 179/20 187/52 χ2=9.834 0.002 腹水[例(%)] 145(72.9) 155(64.9) χ2=3.299 0.072 消化道出血[例(%)] 34(17.1) 65(27.2) χ2=6.346 0.012 肝性脑病[例(%)] 13(6.5) 28(11.7) χ2=0.438 0.064 自发性腹膜炎[例(%)] 14(7.0) 23(9.6) χ2=0.941 0.332 Scr(μmol/L) 59(49~70) 62(51~76) Z=-1.035 0.011 INR 1.44(1.23~1.62) 1.46(1.23~1.64) Z=-0.545 0.461 Alb(g/L) 32.4(29.2~36.7) 31.7(27.7~36.4) Z=0.793 0.119 TBil(μmol/L) 32.5(21.0~60.7) 30.7(18.3~54.8) Z=-1.423 0.590 Na(mmol/L) 140.0(137.7~142.0) 139.0(136.6~141.6) Z=-1.606 0.019 WBC(×109/L) 3.6(2.7~5.0) 3.7(2.6~5.6) Z=-0.735 0.620 Hb(g/L) 116(99~133) 112(88~127) Z=1.455 0.006 NLR 2.06(1.36~3.53) 2.28(1.51~4.40) Z=-0.965 0.087 PLT(×109/L) 69(49~102) 64(46~96) Z=-0.312 0.332 ALT(U/L) 56(32~110) 41(23~70) Z=-2.194 <0.001 AFP(ng/mL) 11.30(3.49~71.84) 10.25(3.19~70.46) Z=-2.032 0.243 MELD评分 10.42(6.66~14.29) 10.77(7.18~15.50) Z=0.384 0.251 CTP评分 7(6~9) 7(6~9) Z=-0.085 0.160 CTP分级[例(%)] χ2=4.297 0.117 A级 83(41.7) 77(32.2) B级 74(37.2) 106(44.4) C级 42(21.1) 56(23.4) 注:Scr,血清肌酐;NLR, 中性粒细胞与淋巴细胞比值。 进一步分析,在首次失代偿后第1年即获得再代偿的患者有45例(22.6%),在第2、3、4、5年获得再代偿的患者分别有71例(35.7%)、23例(11.6%)、24例(12.1%)、18例(9.0%),首次失代偿超过5年才出现再代偿的患者有18例(9.0%)。
同时发现,199例再代偿患者中,78例再次失代偿。首次失代偿后第2、3、4、5年发生再次失代偿的患者分别有28、18、12、10例,再代偿组患者2、3、4、5年的累积再次失代偿率分别为14.1%、23.1%、29.1%、34.2%。78例再次失代偿的患者再代偿持续时间18(16~22)个月。
2.3 再代偿患者与持续失代偿患者的比较
如表 1所示,239例持续失代偿患者中位随访期为20.5个月(9.0~ 60.8个月),与再代偿患者随访时间无明显差异。199例再代偿患者中达到SVR的有162例,基线仅有1个并发症的患者有179例,239例持续失代偿患者达到SVR的有99例,基线并发症数量1个的患者有187例,两组患者的SVR率(81.4% vs 41.4%, P<0.001)及并发症数量(92.5% vs 82.0%,P=0.002)有显著差异。再代偿患者Scr值显著低于失代偿组患者(P=0.011),而Hb、ALT及血钠水平显著高于失代偿组患者(P值均<0.05)。
2.4 再代偿的相关影响因素分析
Cox多因素回归分析显示,SVR、ALT及Scr是再代偿的独立影响因素(P值均<0.05)。其中,SVR及ALT是再代偿的保护因素,Scr是实现再代偿的危险因素(表 2)。
表 2 再代偿相关影响因素的多因素分析Table 2. Multivariate analysis of the influencing factors related to recompensation自变量 β值 SE Wald OR 95%CI P值 ALT 0.002 0.001 6.802 1.002 1.000~1.003 0.009 单个并发症 -0.412 0.354 1.358 0.662 0.331~1.324 0.244 SVR 1.751 0.235 55.516 5.760 3.634~9.129 <0.001 Scr -0.010 0.005 3.955 0.990 0.981~1.000 0.047 Hb 0.004 0.004 1.065 1.004 0.996~1.012 0.302 2.5 不同代偿状态对患者长期生存率的影响
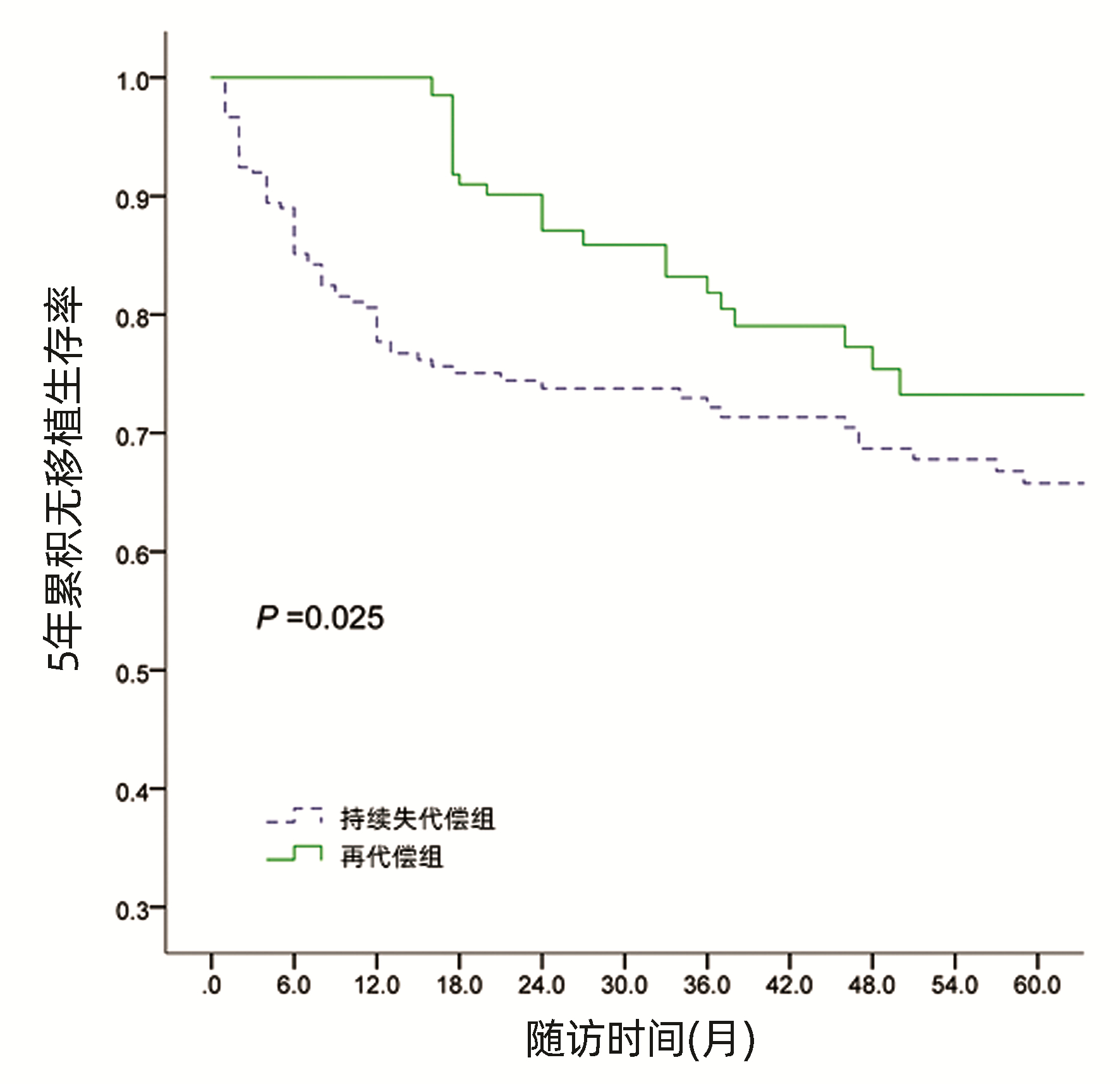
经Kaplan-Meier生存曲线分析显示,再代偿患者5年累积无移植生存率87.9%,显著高于持续失代偿组5年累积无移植生存率72.0%(χ2=9.886,P=0.025)(图 1)。
3. 讨论
目前已有较多研究证实失代偿期乙型肝炎肝硬化患者经过包括抗病毒治疗在内的综合治疗后生存期显著改善[7-8],部分患者可逆转为再代偿状态[9],但对实现再代偿的相关影响因素仍未完全明确。
本研究对438例首次失代偿期乙型肝炎肝硬化患者进行回顾性分析,结果显示199例患者获得再代偿,再代偿率45.4%,第1年再代偿率22.6%。而另一项与本研究同样针对初治失代偿期乙型肝炎肝硬化的研究[10]显示,1年再代偿率49%,高于本研究,考虑这一差异可能与再代偿的定义不同有关。该研究定义再代偿为抗病毒治疗1年后CTP评分下降至少2分。这也提示需统一失代偿期肝硬化获得再代偿的评判标准,为后期关于再代偿的研究提供参考。
本研究发现199例再代偿患者最终仍有78例出现再次失代偿,占再代偿患者的39.1%。同时还发现再次失代偿多发生在再代偿后的第2年,这提示对已经获得再代偿的患者也要积极治疗,密切监控相关指标,预防患者再次失代偿。
本研究发现了基线ALT、Scr水平及是否达到SVR与失代偿期乙型肝炎肝硬化患者实现再代偿密切相关。ALT是失代偿期乙型肝炎肝硬化患者实现再代偿的独立影响因素。Chang等[11]研究发现初次失代偿期肝硬化ALT≥5倍正常值上限的患者比ALT正常的患者长期预后更好。其原因可能与ALT水平高的患者抗HBV免疫反应活跃并且再代偿能力更强有关。Scr是失代偿期乙型肝炎肝硬化患者实现再代偿的另一个独立影响因素。Scr可以有效的预测失代偿期肝硬化患者的预后,有研究[12-13]发现Scr水平高的患者更易于发生慢加急性肝衰竭及肝肾综合征,预后不佳,这与本研究结果基本一致。笔者前期研究[14]表明实现SVR的失代偿期乙型肝炎肝硬化患者长期预后较好。本文进一步发现实现SVR的患者更容易实现再代偿。有研究[15-16]发现失代偿期乙型肝炎肝硬化患者中,与未达到SVR的患者相比,达到SVR的患者长期生存率更高且5年肝癌发生率更低。说明抗病毒治疗实现SVR的患者肝功能得到进一步改善,进而促进患者实现再代偿。
令人感兴趣的是,既往有研究[17]认为MELD评分与失代偿期肝硬化患者实现再代偿相关,而本研究未观察到该结果。这一差异可能与再代偿的评判标准及患者的病因不一致等因素有关。
本研究尚存在一些不足。如单中心回顾性临床研究,样本量较少,病例存在偏倚等,后期笔者团队将采取前瞻性研究,进一步证实本研究结果的可靠性。
综上所述,初次失代偿期乙型肝炎肝硬化患者经过综合治疗后能否实现再代偿与基线ALT、Scr水平及是否达到SVR密切相关。其中,实现SVR和基线ALT高水平的患者更容易实现再代偿,而基线高Scr的患者不易实现再代偿。临床上应关注以上指标,对于失代偿期肝硬化患者,密切观察病情,规范治疗管理,防止并发症发生。
-
表 1 ACLF患者的预后评分系统
Table 1. Prognostic scoring systems used in patients with ACLF
评分系统 年份 开发目的 评价指标 评分公式 CTP 1964年 预测门静脉曲张手术风险 HE、腹水、TBil、Alb、PT 无 MELD 2000年 评估行TIPS的肝硬化患者短期预后 TBil、INR、Cr、病因 3.8×ln TBil+11.2×ln INR+9.6×ln Cr+6.4×病因(胆汁性或酒精性0、其他1) MELD-Na 2006年 MELD评分的发展 TBil、INR、Cr、病因、血清Na+ MELD+1.59×(135 -血清Na+) iMELD 2007年 MELD评分的发展 TBil、INR、Cr、病因、血清Na+、年龄 MELD+(0.3×年龄)-(0.7×血清Na+)+100 CLIF-SOFA 2013年 专门用于评估ACLF患者预后 TBil、Cr、HE分级、INR、平均动脉压、PaO2/FiO2或SpO2/FiO2 无 CLIF-C OF 2014年 CLIF-C SOFA的简化版,用于ACLF诊断和分级 TBil、Cr、HE分级、INR、平均动脉压、PaO2/FiO2或SpO2/FiO2 无 CLIF-C ACLF 2014年 评价ACLF预后 TBil、Cr、HE分级、INR、平均动脉压、PaO2/FiO2或SpO2/FiO2、年龄、WBC 10×(0.33×CLIF-OF+0.04×年龄+0.63×ln WBC-2) COSSH-ACLF 2018年 评价HBV-ACLF预后 TBil、Cr、HE分级、INR、平均动脉压、PaO2/FiO2或SpO2/FiO2、年龄 0.741×INR+0.523×HBV-SOFA+0.026×年龄+0.003×TBil 注:TIPS,经颈静脉肝内门体分流术;Cr,肌酐;PaO2,氧分压;FiO2,吸入气体氧含量;SpO2,动脉血氧饱和度。 -
[1] WU T, LI J, SHAO L, et al. Development of diagnostic criteria and a prognostic score for hepatitis B virus-related acute-on-chronic liver failure[J]. Gut, 2018, 67(12): 2181-2191. DOI: 10.1136/gutjnl-2017-314641. [2] SARIN SK, KEDARISETTY CK, ABBAS Z, et al. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the Study of the Liver (APASL) 2014[J]. Hepatol Int, 2014, 8(4): 453-471. DOI: 10.1007/s12072-014-9580-2. [3] SARIN SK, CHOUDHURY A, SHARMA MK, et al. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific association for the study of the liver (APASL): an update[J]. Hepatol Int, 2019, 13(4): 353-390. DOI: 10.1007/s12072-019-09946-3. [4] MOREAU R, JALAN R, GINES P, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis[J]. Gastroenterology, 2013, 144(7): 1426-1437, 1437. e1-9. DOI: 10.1053/j.gastro.2013.02.042. [5] BAJAJ JS, O'LEARY JG, REDDY KR, et al. Survival in infection-related acute-on-chronic liver failure is defined by extrahepatic organ failures[J]. Hepatology, 2014, 60(1): 250-256. DOI: 10.1002/hep.27077. [6] O'LEARY JG, REDDY KR, GARCIA-TSAO G, et al. NACSELD acute-on-chronic liver failure (NACSELD-ACLF) score predicts 30-day survival in hospitalized patients with cirrhosis[J]. Hepatology, 2018, 67(6): 2367-2374. DOI: 10.1002/hep.29773. [7] HERNAEZ R, KRAMER JR, LIU Y, et al. Prevalence and short-term mortality of acute-on-chronic liver failure: a national cohort study from the USA[J]. J Hepatol, 2019, 70(4): 639-647. DOI: 10.1016/j.jhep.2018.12.018. [8] BAJAJ JS, O'LEARY JG, LAI JC, et al. Acute-on-chronic liver failure clinical guidelines[J]. Am J Gastroenterol, 2022, 117(2): 225-252. DOI: 10.14309/ajg.0000000000001595. [9] Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, Chinese Medical Association; Severe Liver Disease and Arificial Liver Group, Chinese Society of Hepatology, Chinese Medical Association. Guideline for diagnosis and treatment of liver failure(2018)[J]. J Clin Hepatol, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007.中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2018年版)[J]. 临床肝胆病杂志, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007. [10] FERNÁNDEZ J, ACEVEDO J, WIEST R, et al. Bacterial and fungal infections in acute-on-chronic liver failure: prevalence, characteristics and impact on prognosis[J]. Gut, 2018, 67(10): 1870-1880. DOI: 10.1136/gutjnl-2017-314240. [11] MVCKE MM, RUMYANTSEVA T, MVCKE VT, et al. Bacterial infection-triggered acute-on-chronic liver failure is associated with increased mortality[J]. Liver Int, 2018, 38(4): 645-653. DOI: 10.1111/liv.13568. [12] LIU XQ, ZHANG XY, YING Y, et al. The role of prophylactic antibiotics in hepatitis B virus-related acute-on-chronic liver failure patients at risk of bacterial infection: a retrospective study[J]. Infect Dis Poverty, 2021, 10(1): 44. DOI: 10.1186/s40249-021-00830-7. [13] ZACCHERINI G, WEISS E, MOREAU R. Acute-on-chronic liver failure: Definitions, pathophysiology and principles of treatment[J]. JHEP Rep, 2021, 3(1): 100176. DOI: 10.1016/j.jhepr.2020.100176. [14] LIU XY, HU JH, LI C, et al. Clinical features of patients with acute-on-chronic liver failure and bacterial infection and influencing factors for prognosis[J]. J Clin Hepatol, 2021, 37(9): 2148-2152. DOI: 10.3969/j.issn.1001-5256.2021.09.028.刘晓燕, 胡瑾华, 李晨, 等. 慢加急性肝衰竭合并细菌感染患者的临床特征及预后影响因素分析[J]. 临床肝胆病杂志, 2021, 37(9): 2148-2152. DOI: 10.3969/j.issn.1001-5256.2021.09.028. [15] TREBICKA J, BORK P, KRAG A, et al. Utilizing the gut microbiome in decompensated cirrhosis and acute-on-chronic liver failure[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(3): 167-180. DOI: 10.1038/s41575-020-00376-3. [16] BERNAL W, JALAN R, QUAGLIA A, et al. Acute-on-chronic liver failure [J]. The Lancet, 2015, 386(10003): 1576-1587. DOI: 10.1016/s0140-6736(15)00309-8. [17] LO RE V 3rd, CARBONARI DM, LEWIS JD, et al. Oral azole antifungal medications and risk of acute liver injury, overall and by chronic liver disease status[J]. Am J Med, 2016, 129(3): 283-291. e5. DOI: 10.1016/j.amjmed.2015.10.029. [18] CHALASANI N, BONKOVSKY HL, FONTANA R, et al. Features and outcomes of 899 patients with drug-induced liver injury: the DILIN prospective study[J]. Gastroenterology, 2015, 148(7): 1340-1352. e7. DOI: 10.1053/j.gastro.2015.03.006. [19] DEVARBHAVI H, CHOUDHURY AK, SHARMA MK, et al. Drug-induced acute-on-chronic liver failure in asian patients[J]. Am J Gastroenterol, 2019, 114(6): 929-937. DOI: 10.14309/ajg.0000000000000201. [20] SUNDARAM V, JALAN R, AHN JC, et al. Class III obesity is a risk factor for the development of acute-on-chronic liver failure in patients with decompensated cirrhosis[J]. J Hepatol, 2018, 69(3): 617-625. DOI: 10.1016/j.jhep.2018.04.016. [21] DUSEJA A, DE A, TANEJA S, et al. Impact of metabolic risk factors on the severity and outcome of patients with alcohol-associated acute-on-chronic liver failure[J]. Liver Int, 2021, 41(1): 150-157. DOI: 10.1111/liv.14671. [22] LIU CR, LI YP, LUO S, et al. Influencing factors for the short-term prognosis of patients with HBV-related acute-on-chronic liver failure[J]. J Clin Hepatol, 2021, 37(1): 56-62. DOI: 10.3969/j.issn.1001-5256.2021.01.012.刘晨瑞, 李亚萍, 罗森, 等. HBV相关慢加急性肝衰竭患者短期预后的影响因素分析[J]. 临床肝胆病杂志, 2021, 37(1): 56-62. DOI: 10.3969/j.issn.1001-5256.2021.01.012. [23] PUGH RNH, MURRAY-LYON IM, DAWSON JL, et al. Transection of the oesophagus for bleeding oesophageal varices[J]. Br J Surg, 1973, 60: 646-649. [24] MALINCHOC M, KAMATH PS, GORDON FD, et al. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts[J]. Hepatology, 2000, 31(4): 864-871. DOI: 10.1053/he.2000.5852. [25] BIGGINS SW, KIM WR, TERRAULT NA, et al. Evidence-based incorporation of serum sodium concentration into MELD[J]. Gastroenterology, 2006, 130(6): 1652-1660. DOI: 10.1053/j.gastro.2006.02.010. [26] LUCA A, ANGERMAYR B, BERTOLINI G, et al. An integrated MELD model including serum sodium and age improves the prediction of early mortality in patients with cirrhosis[J]. Liver Transpl, 2007, 13(8): 1174-1180. DOI: 10.1002/lt.21197. [27] Chinese Society of Hepatology, Chinese Medical Association. Chinese guidelines on the management of liver cirrhosis[J]. J Clin Hepatol, 2019, 35(11): 2408-2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006.中华医学会肝病学分会. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35(11): 2408-2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006. [28] KAMATH PS, WIESNER RH, MALINCHOC M, et al. A model to predict survival in patients with end-stage liver disease[J]. Hepatology, 2001, 33(2): 464-470. DOI: 10.1053/jhep.2001.22172. [29] HERNAEZ R, LIU Y, KRAMER JR, et al. Model for end-stage liver disease-sodium underestimates 90-day mortality risk in patients with acute-on-chronic liver failure[J]. J Hepatol, 2020, 73(6): 1425-1433. DOI: 10.1016/j.jhep.2020.06.005. [30] ABDALLAH MA, KUO YF, ASRANI S, et al. Validating a novel score based on interaction between ACLF grade and MELD score to predict waitlist mortality[J]. J Hepatol, 2021, 74(6): 1355-1361. DOI: 10.1016/j.jhep.2020.12.003. [31] VINCENT JL, MORENO R, TAKALA J, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine[J]. Intensive Care Med, 1996, 22(7): 707-710. DOI: 10.1007/BF01709751. [32] ZHENG YX, ZHONG X, LI YJ, et al. Performance of scoring systems to predict mortality of patients with acute-on-chronic liver failure: A systematic review and meta-analysis[J]. J Gastroenterol Hepatol, 2017, 32(10): 1668-1678. DOI: 10.1111/jgh.13786. [33] ZHANG Y, NIE Y, LIU L, et al. Assessing the prognostic scores for the prediction of the mortality of patients with acute-on-chronic liver failure: a retrospective study[J]. Peer J, 2020, 8: e9857. DOI: 10.7717/peerj.9857. [34] JALAN R, SALIBA F, PAVESI M, et al. Development and validation of a prognostic score to predict mortality in patients with acute-on-chronic liver failure[J]. J Hepatol, 2014, 61(5): 1038-1047. DOI: 10.1016/j.jhep.2014.06.012. [35] LI N, HUANG C, YU KK, et al. Validation of prognostic scores to predict short-term mortality in patients with HBV-related acute-on-chronic liver failure: The CLIF-C OF is superior to MELD, CLIF SOFA, and CLIF-C ACLF[J]. Medicine (Baltimore), 2017, 96(17): e6802. DOI: 10.1097/MD.0000000000006802. [36] BAROSA R, ROQUE RAMOS L, PATITA M, et al. CLIF-C ACLF score is a better mortality predictor than MELD, MELD-Na and CTP in patients with Acute on chronic liver failure admitted to the ward[J]. Rev Esp Enferm Dig, 2017, 109(6): 399-405. DOI: 10.17235/reed.2017.4701/2016. [37] TONG JJ, ZHAO W, MU XY, et al. Predictive value of the Chinese group on the study of severe hepatitis B-acute-on-chronic liver failure score in the short-term prognosis of patients with hepatitis B virus-related acute-on-chronic liver failure[J]. Chin Med J (Engl), 2019, 132(13): 1541-1549. DOI: 10.1097/CM9.0000000000000298. [38] HERNAEZ R, SOLÀ E, MOREAU R, et al. Acute-on-chronic liver failure: an update[J]. Gut, 2017, 66(3): 541-553. DOI: 10.1136/gutjnl-2016-312670. [39] SOLÉ C, GUILLY S, DA SILVA K, et al. Alterations in gut microbiome in cirrhosis as assessed by quantitative metagenomics: relationship with acute-on-chronic liver failure and prognosis[J]. Gastroenterology, 2021, 160(1): 206-218. e13. DOI: 10.1053/j.gastro.2020.08.054. [40] ARROYO V, MOREAU R, JALAN R, et al. Acute-on-chronic liver failure: A new syndrome that will re-classify cirrhosis[J]. J Hepatol, 2015, 62(1 Suppl): S131-S143. DOI: 10.1016/j.jhep.2014.11.045. [41] LIU H, ZHANG Q, LIU L, et al. Effect of artificial liver support system on short-term prognosis of patients with hepatitis B virus-related acute-on-chronic liver failure[J]. Artif Organs, 2020, 44(10): E434-E447. DOI: 10.1111/aor.13710. [42] HUANG K, JI F, XIE Z, et al. Artificial liver support system therapy in acute-on-chronic hepatitis B liver failure: Classification and regression tree analysis[J]. Sci Rep, 2019, 9(1): 16462. DOI: 10.1038/s41598-019-53029-0. [43] Transplantation Immunology Committee of Branch of Organ Transplantation Physician of Chinese Medical Doctor Association, Enhanced Recovery of Liver Transplantation Group of Enhanced Recovery after Surgery Committee of Chinese Research Hospital Society. Expert consensus on perioperative management of liver transplantation in adults with acute-on-chronic liver failure[J]. Ogran Transplant, 2020, 11(5): 533-542. DOI: 10.3969/j.issn.1674-7445.2020.05.001.中国医师协会器官移植医师分会移植免疫学专业委员会, 中国研究型医院学会加速康复外科委员会肝移植加速康复学组. 成人慢加急性肝衰竭肝移植围手术期管理专家共识[J]. 器官移植, 2020, 11(5): 533-542. DOI: 10.3969/j.issn.1674-7445.2020.05.001. [44] SUNDARAM V, MAHMUD N, PERRICONE G, et al. Longterm outcomes of patients undergoing liver transplantation for acute-on-chronic liver failure[J]. Liver Transpl, 2020, 26(12): 1594-1602. DOI: 10.1002/lt.25831. [45] SUNDARAM V, JALAN R, WU T, et al. Factors associated with survival of patients with severe acute-on-chronic liver failure before and after liver transplantation[J]. Gastroenterology, 2019, 156(5): 1381-1391. e3. DOI: 10.1053/j.gastro.2018.12.007. [46] TOMESCU D, POPESCU M, BIANCOFIORE G. Liver transplantation for acute-on-chronic liver failure[J]. Best Pract Res Clin Anaesthesiol, 2020, 34(1): 25-33. DOI: 10.1016/j.bpa.2019.12.001. [47] HUEBENER P, STERNECK MR, BANGERT K, et al. Stabilisation of acute-on-chronic liver failure patients before liver transplantation predicts post-transplant survival[J]. Aliment Pharmacol Ther, 2018, 47(11): 1502-1510. DOI: 10.1111/apt.14627. [48] FAN Q, LI Z. Liver transplantation for acute-on-chronic liver failure[J]. Organ Transplantat, 2022, 13(3): 333-337. DOI: 10.3969/j.issn.1674-7445.2022.03.008.范祺, 李照. 慢加急性肝衰竭的肝移植治疗[J]. 器官移植, 2022, 13(3): 333-337. DOI: 10.3969/j.issn.1674-7445.2022.03.008. [49] SHI M, ZHANG Z, XU R, et al. Human mesenchymal stem cell transfusion is safe and improves liver function in acute-on-chronic liver failure patients[J]. Stem Cells Transl Med, 2012, 1(10): 725-731. DOI: 10.5966/sctm.2012-0034. [50] GARG V, GARG H, KHAN A, et al. Granulocyte colony-stimulating factor mobilizes CD34(+) cells and improves survival of patients with acute-on-chronic liver failure[J]. Gastroenterology, 2012, 142(3): 505-512. e1. DOI: 10.1053/j.gastro.2011.11.027. [51] ENGELMANN C, HERBER A, FRANKE A, et al. Granulocyte-colony stimulating factor (G-CSF) to treat acute-on-chronic liver failure: A multicenter randomized trial (GRAFT study)[J]. J Hepatol, 2021, 75(6): 1346-1354. DOI: 10.1016/j.jhep.2021.07.033. 期刊类型引用(9)
1. 赵勇娜,谢颖. 不同炎症因子对肝硬化腹水并发腹腔感染的预测效能研究. 中国医学工程. 2024(04): 8-12 .  百度学术
百度学术2. 曹志军,汪晓军. 中西医联合治疗乙肝肝硬化的临床进展. 世界复合医学(中英文). 2024(01): 189-194 .  百度学术
百度学术3. 石敏,郝彦琴. 失代偿期肝硬化患者发生再代偿的临床研究进展. 中国药物与临床. 2024(08): 539-544 .  百度学术
百度学术4. 牛日雨,尹伟,王益杰,李成忠. 失代偿期肝硬化再代偿的研究进展. 肝脏. 2024(07): 770-773 .  百度学术
百度学术5. 荣欣欣,徐缘媛,杨广德,王霞,傅涓涓,李丽,潘修成. 富马酸丙酚替诺福韦治疗首次失代偿期乙型肝炎肝硬化患者的效果和安全性分析. 临床肝胆病杂志. 2024(10): 2008-2013 .  本站查看
本站查看6. 刘晓金,刘晓明,陆旭. 肝硬化失代偿期患者并发肠梗阻的危险因素分析及临床管理对策研究. 黑龙江医学. 2024(24): 2981-2984+2987 .  百度学术
百度学术7. 钱盈,张笑涵. 血清锌浓度与肝硬化失代偿肝功能损伤程度的关联及对预后的预测效能. 实用医技杂志. 2023(05): 305-309 .  百度学术
百度学术8. 谢颖,赵勇娜. 肝硬化腹水患者肠道菌群变化对自发性腹膜炎的预测效能分析. 淮海医药. 2023(06): 580-584 .  百度学术
百度学术9. 宋木生,杨椿,李静,温婷. 慢性乙型肝炎肝硬化失代偿期患者发生医院感染的病原学特点与危险因素分析. 抗感染药学. 2023(11): 1196-1199 .  百度学术
百度学术其他类型引用(3)
-




 PDF下载 ( 1880 KB)
PDF下载 ( 1880 KB)

 下载:
下载:

 下载:
下载:  百度学术
百度学术