肝部分切除术后连续监测吲哚菁绿15分钟滞留率联合标准残肝体积对肝细胞癌患者肝功能不全的预测价值
DOI: 10.12449/JCH240615
Predictive value of continuous monitoring of indocyanine green retention rate at 15 minutes combined with standard residual liver volume for hepatic insufficiency in patients with hepatocellular carcinoma after partial hepatectomy
-
摘要:
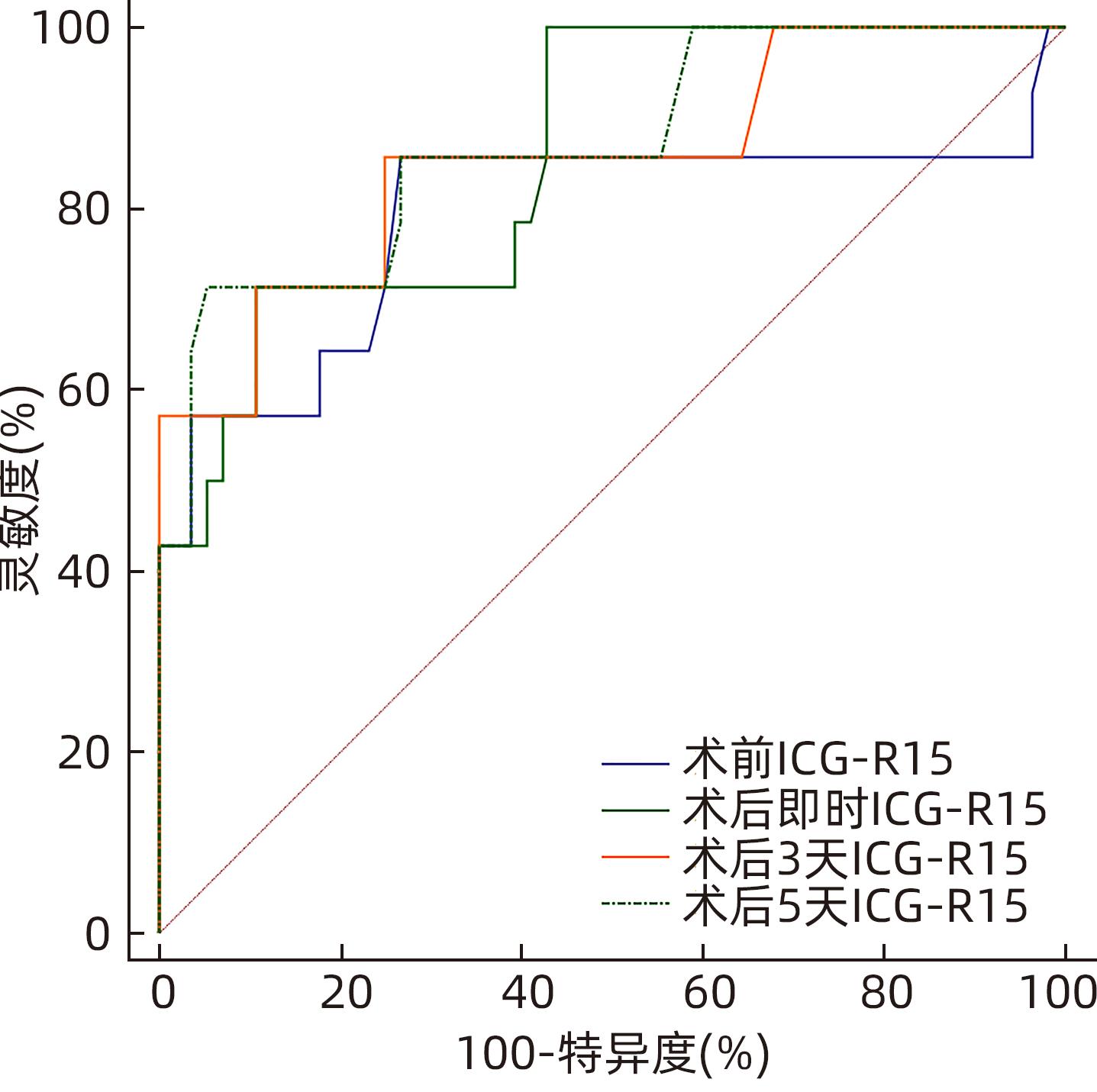
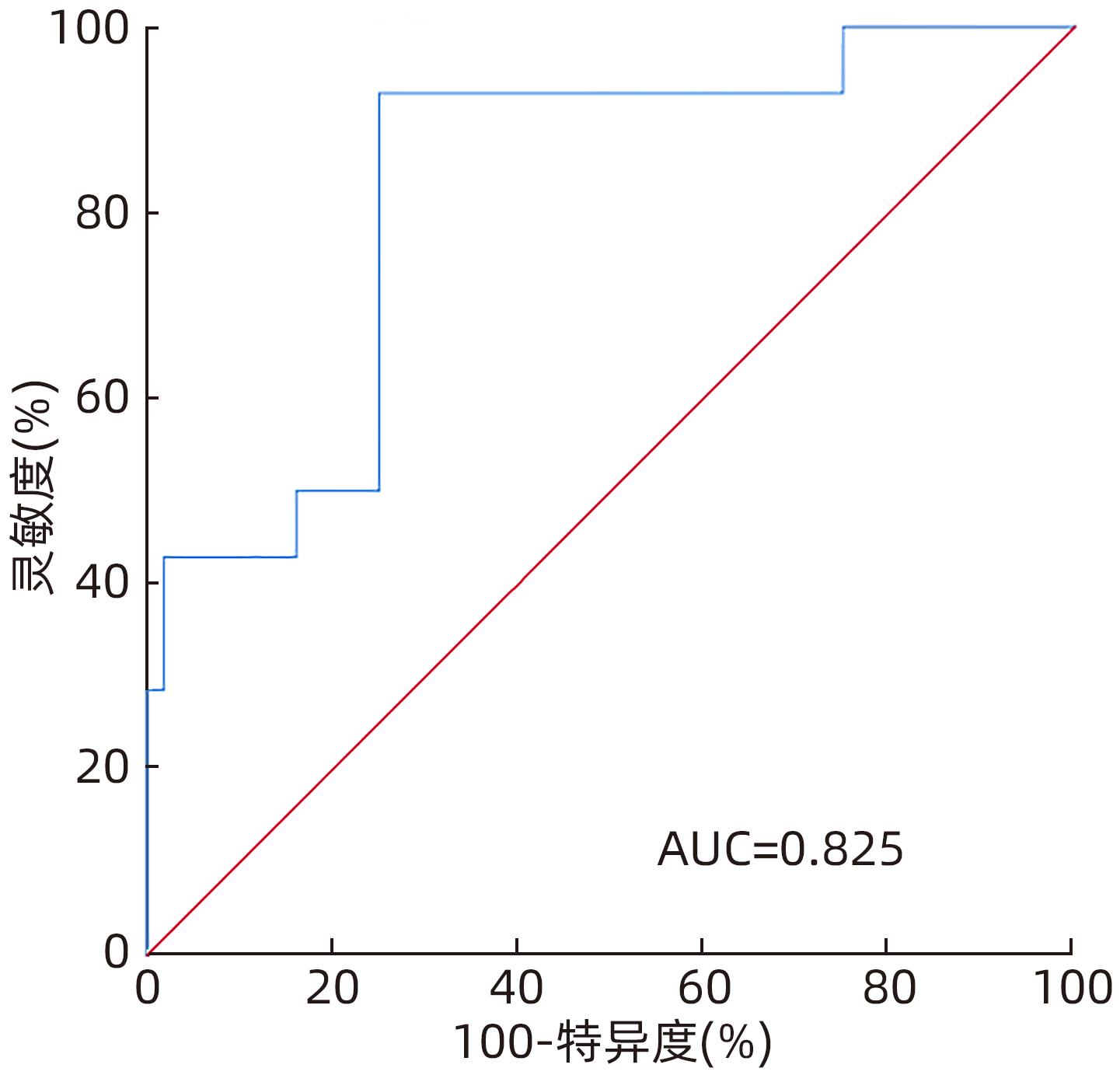
目的 探讨肝部分切除术后连续性监测吲哚菁绿15分钟滞留率(ICG-R15)联合标准残肝体积(SRLV)对术后肝功能不全发生率的预测价值。 方法 收集天津市第一中心医院肝胆外科2016年11月—2017年5月收治的70例肝细胞癌患者的临床资料。根据患者术后是否发生肝功能不全的情况,分为肝功能良好组(n=56)与肝功能不全组(n=14)。根据术前肝功能评估及强化CT计算切除肝体积和剩余肝体积以及肝脏三维重建,术中B超定位决定手术方案,根据术中情况决定采用选择性肝门入肝血流阻断或间断全肝门阻断,CUSA联合双极滴水电凝镊离断肝实质。计算SRLV并连续监测患者ICG-R15。计量资料两组间比较采用成组t检验;计数资料组间比较采用χ2检验;采用受试者工作特征曲线(ROC曲线)下面积(AUC)评估预测术后肝功能不全的准确性。多因素Logistic回归分析建立术后肝功能不全的预测模型,制订SLRV联合术后ICG-R15动态监测对术后肝功能不全的诊断标准。 结果 两组术前以及术后即时、3 d、5 d的ICG-R15,以及SRLV、Child分级比较,差异均有统计学意义(P值均<0.05)。术前、术后即时、术后3 d、术后5 d 患者术后肝功能不全发生率均随ICG-R15升高而升高(P值均<0.001)。进一步两两比较,术前、术后即时、术后3 d、术后5 d ICG-R15>20%组与其他两组患者肝功能不全发生率比较,差异均有统计学意义(P值均<0.001);术后即时,ICG-R15<10%组与10%≤ICG-R15≤20%组肝功能不全发生率比较,差异有统计学意义(P<0.001)。术前ICG-R15、术后即时ICG-R15、术后3 d ICG-R15、术后5 d ICG-R15预测术后肝功能不全的AUC分别为0.790、0.857、0.855、0.870,术后即时、3 d、5 d ICG-R15的AUC均大于术前,差异均有统计学意义(P值均<0.05)。多因素分析结果显示,SRLV以及ICG-R15术后动态监测(术后即时、术后3 d、术后5 d)水平升高均为术后肝功能不全的独立危险因素,术前BMI升高则为独立保护因素(P值均<0.05)。建立多因素Logistic回归预测模型,依据预测模型分别对术后(术后即时、术后3 d、术后5 d)肝功能不全进行预测,ROC曲线显示术后即时、术后3 d、术后5 d预测模型的AUC分别为0.963、0.967、0.967(P值均<0.01)。制订SLRV联合术后ICG-R15动态监测对于术后肝功能不全的诊断标准:SLRV>1 240 mL/m2、术后即时ICG-R15>20%、术后3 d或5 d ICG-R15>25%,符合其中任意一项即可诊断术后肝功能不全,灵敏度100%,特异度60.71%,符合度68.57%。 结论 连续性监测术前及术后ICG-R15水平对于术后肝功能不全的预估均具有指导意义,术后5 d ICG-R15的准确性相对最高;SRLV联合术后ICG-R15动态检测能有效预测肝切除术后肝功能不全的发生,可指导临床医生预估肝癌患者术后肝功能不全的发生,并尽早进行临床干预。 Abstract:Objective To investigate the value of continuous monitoring of indocyanine green retention rate at 15 minutes (ICG-R15) combined with standard residual liver volume (SRLV) in predicting hepatic insufficiency after partial hepatectomy. Methods Clinical data and SRLV data were collected from 70 patients with hepatocellular carcinoma who were admitted to Department of Hepatobiliary Surgery, Tianjin First Central Hospital, from November 2016 to May 2017. According to the presence or absence of hepatic insufficiency after surgery, the patients were divided into good liver function group with 56 patients and hepatic insufficiency group with 14 patients. Based on preoperative liver function evaluation and contrast-enhanced CT scans, resected liver volume and residual liver volume were calculated, and three-dimensional reconstruction of the liver was performed. Intraoperative ultrasound localization was performed to determine the surgical regimen, and selective hepatic inflow occlusion or intermittent hepatic portal occlusion was selected based on intraoperative conditions. CUSA combined with BIPOLAR drip electric coagulation forceps were used for the partition of liver parenchyma. SRLV was calculated, and ICG-R15 was monitored continuously. The independent-samples t test was used for comparison of continuous data between two groups, and the chi-square test was used for comparison of categorical data between two groups; the area under the ROC curve (AUC) was used to investigate the accuracy in predicting hepatic insufficiency after surgery. A multivariate Logistic regression analysis was used to establish a predictive model for postoperative hepatic insufficiency, and diagnostic criteria were developed for SLRV combined with postoperative ICG-R15 dynamic monitoring in the diagnosis of postoperative hepatic insufficiency. Results There were significant differences between the two groups in ICG-R15 before surgery, immediately after surgery, and on days 3 and 5 after surgery, as well as significant differences in SRLV and Child class (all P<0.05). The incidence rate of postoperative hepatic insufficiency increased with the increase in ICG-R15 before surgery, immediately after surgery, and on days 3 and 5 after surgery (all P<0.001). Further comparison between two groups showed that there was a significant difference in the incidence rate of hepatic insufficiency between the ICG-R15>20% group and the other two groups before surgery, immediately after surgery, and on days 3 and 5 after surgery (all P<0.001), and there was a significant difference in the incidence rate of hepatic insufficiency between the ICG-R15<10% group and the 10%≤ICG-R15≤20% group immediately after surgery (P<0.001). ICG-R15 before surgery, ICG-R15 immediately after surgery, ICG-R15 on day 3 after surgery, and ICG-R15 on day 5 after surgery had an AUC of 0.790, 0.857, 0.855, and 0.870, respectively, in predicting postoperative hepatic insufficiency, and ICG-R15 immediately after surgery and on days 3 and 5 after surgery had a significantly larger AUC than ICG-R15 before surgery (all P<0.05). The multivariate analysis showed that increases in SRLV and postoperative ICG-R15 dynamic monitoring (immediately after surgery and on days 3 and 5 after surgery) were independent risk factors for postoperative hepatic insufficiency, while increased body mass index before surgery was an independent protective factor (all P<0.05). A multivariate Logistic regression predictive model was established and was used to predict hepatic insufficiency after surgery (immediately after surgery and on days 3 and 5 after surgery), and the ROC curve analysis showed that the model had an AUC of 0.963, 0.967, and 0.967, respectively, in predicting hepatic insufficiency immediately after surgery and on days 3 and 5 after surgery (all P<0.01). Diagnostic criteria were developed for SLRV combined with postoperative ICG-R15 dynamic monitoring in the diagnosis of postoperative hepatic insufficiency, i.e., SLRV>1 240 mL/m2, ICG-R15>20% immediately after surgery, or ICG-R15>25% on day 3 or 5 after surgery, and postoperative hepatic insufficiency could be diagnosed if a patient met any one criterion. These diagnostic criteria had a sensitivity of 100%, a specificity of 60.71%, and a conformity degree of 68.57%. Conclusion Continuous monitoring of ICG-R15 before and after surgery is of guiding significance for predicting postoperative hepatic insufficiency, and ICG-R15 on day 5 after surgery has the highest accuracy. SRLV combined with postoperative ICG-R15 dynamic monitoring can effectively predict the onset of hepatic insufficiency after hepatectomy and can guide clinicians to predict the onset of postoperative hepatic insufficiency in patients with liver cancer and perform clinical intervention as soon as possible. -
Key words:
- Liver Neoplasms /
- Hepatectomy /
- Indocyanine Green /
- Hepatic Insufficiency
-
肝癌作为我国常见的一种恶性程度较高的肿瘤,死亡率较高且呈上升趋势,位居全球癌症的第三位[1]。现临床多采用手术、放化疗等多种方法联合治疗,但治疗效果尚未达到预期。且相较于毒副反应较大的化学治疗,中医药作为肿瘤治疗常用的辅助治疗方式,其减毒增效的特点有利于提高患者的治疗效果及生存质量。
药对是中医临床医师在治疗过程中常用的一种独具特色的药物配伍方式,其组成相较方剂较为简单,但药对皆由“病、证、症”出发,精简配对,亦可发挥综合效用,增强疗效。本文研究基于国医大师刘尚义教授临床辨治肿瘤的数据挖掘分析。药对“川楝子-延胡索”是刘尚义教授临床常用的一组行气、止痛经方药对[2],二药既是药对,亦是名方金铃子散的组成。金铃子散出自于金元四大家之一刘完素所著医书《素问·病机气宜保命集》,其中川楝子可疏肝行气、清肝泻火;延胡索可行气活血、祛瘀止痛,两者配伍具有清肝泻热、活血散瘀定痛之效。此外,现代药理学研究[3-5]表明川楝子、延胡索均具有良好的抗肿瘤、抗炎镇痛作用。但目前研究尚未有完整、明确的药对“川楝子-延胡索”用于治疗肝癌的药效机制,故开展此次研究提供部分理论基础。
1. 方法
1.1 搜集、筛选药对“川楝子-延胡索”的成分及对应靶点
分别以“川楝子”“延胡索”为关键词在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)中检索搜集中药成分,以“口服生物利用度(OB)≥30%,化合物的类药性(DL)≥0.18”为条件筛选药物有效成分,查找有效成分的对应靶点,并通过Uniprot数据库(http://www.uniprot.org/)将所有作用靶点统一为对应基因名称。
1.2 查找、筛选药对“川楝子-延胡索”治疗肝癌的靶点基因
分别以“hepatic carcinoma”“hepatic cancer”“hepatocellular carcinomas”“liver cancer”为关键词在疾病靶点Genecards数据库(https://www.genecards.org/)中检索查找肝癌的相关基因并导出结果。在Excel表格中选用两倍中位数公式并删除重复靶点后筛选出与肝癌关系更为紧密的基因。最后将药对的药物基因、肝癌基因相映射得出交集基因,该交集基因即为药对治疗肝癌的靶点基因。
1.3 构建“药对-成分-靶点”网络
将药对中“川楝子”“延胡索”筛选后的药物活性成分及靶点基因导入Cytoscape 3.7.1软件中,从而构建药对药物-成分-靶点网络图。
1.4 构建靶点蛋白相互作用网络
将交集靶点基因上传至String数据库(https://string-db.org/),限定物种为“Homo sapiens”,分析药对“川楝子-延胡索”治疗肝癌的潜在靶点信息及靶点蛋白之间的相互作用关系,并借助Cytoscape 3.7.1软件将所得靶点蛋白信息进行可视化分析。
1.5 分析靶点通路
为了更进一步的分析、明确药对“川楝子-延胡索”的靶点基因在治疗肝癌过程中发挥的生物学功能及相关重要通路,将靶点基因输入至Metascape数据库(https://metascape.org/gp/index.html#/main/step1)进行GO富集分析(含生物过程、细胞组分、分子功能三部分)、KEGG信号通路富集分析,并通过易汉博生物信息在线做图网站Image GP(http://www.ehbio.com/ImageGP/)将分析结果进行可视化处理。
2. 结果
2.1 药对“川楝子-延胡索”的成分及对应作用靶点
在TCMSP数据库中以前述方法进行检索、筛选,得出川楝子有效活性成分9个,其中melianone(MOL002047)、Nimbolidin D(MOL002048)、Nimbolin A(MOL002053)无对应靶点,予以剔除,故其有效成分为6个,对应靶点为181个;延胡索有效活性成分49个,对应靶点1097个;两味中药共同成分1个,为quercetin(MOL000098),共同靶点基因154个。成分具体情况见表 1。
表 1 药对“川楝子-延胡索”中中药活性成分详情中药 简称 MOL ID 分子名称 OB(%) DL(%) 川楝子(简称:CLZ) CLZ1 MOL001494 Mandenol 42.00 0.19 CLZ2 MOL001495 Ethyl linolenate 46.10 0.20 CLZ3 MOL002045 Stigmasterol 43.41 0.76 CLZ4 MOL002056 (E)-3-[(2S, 3R)-2-(4-hydroxy-3-methoxy-phenyl)-7-methoxy-3-methylol-2, 3-dihydrobenzofuran-5-yl]acrolein 54.74 0.40 CLZ5 MOL002058 Medioresil 57.20 0.62 延胡索(简称:YHS) YHS1 MOL001454 Berberine 36.86 0.78 YHS2 MOL001458 Coptisine 30.67 0.86 YHS3 MOL001460 Cryptopin 78.74 0.72 YHS4 MOL001461 Dihydrochelerythrine 32.73 0.81 YHS5 MOL001463 Dihydrosanguinarine 59.31 0.86 YHS6 MOL001474 Sanguinarine 37.81 0.86 YHS7 MOL000217 (S)-Scoulerine 32.28 0.54 YHS8 MOL002670 Cavidine 35.64 0.81 YHS9 MOL002903 (R)-Canadine 55.37 0.77 YHS10 MOL000359 Sitosterol 36.91 0.75 YHS11 MOL004071 Hyndarin 73.94 0.64 YHS12 MOL004190 (-)-alpha-N-methylcanadine 45.06 0.80 YHS13 MOL004191 Capaurine 62.91 0.69 YHS14 MOL004193 Clarkeanidine 86.65 0.54 YHS15 MOL004195 Corydaline 65.84 0.68 YHS16 MOL004196 Corydalmine 52.50 0.59 YHS17 MOL004197 Corydine 37.16 0.55 YHS18 MOL004198 Corynoline 46.06 0.85 YHS19 MOL004199 Corynoloxine 38.12 0.60 YHS20 MOL004200 Methyl-[2-(3, 4, 6, 7-tetramethoxy-1-phenanthryl)ethyl]amine 61.15 0.44 YHS21 MOL004202 Dehydrocavidine 38.99 0.81 YHS22 MOL004203 Dehydrocorybulbine 46.97 0.63 YHS23 MOL004204 Dehydrocorydaline 41.98 0.68 YHS24 MOL004205 Dehydrocorydalmine 43.90 0.59 YHS25 MOL004208 Demethylcorydalmatine 38.99 0.54 YHS26 MOL004209 13-methyldehydrocorydalmine 35.94 0.63 YHS27 MOL004210 (1S, 8′R)-6, 7-dimethoxy-2-methylspiro[3, 4-dihydroisoquinoline-1, 7′-6, 8-dihydrocyclopenta [g][1, 3]benzodioxole]-8′-ol 43.95 0.72 YHS28 MOL004763 Izoteolin 39.53 0.51 YHS29 MOL004214 Isocorybulbine 40.18 0.66 YHS30 MOL004215 leonticine 45.79 0.26 YHS31 MOL004216 13-methylpalmatrubine 40.97 0.63 YHS32 MOL004220 N-methyllaurotetanine 41.62 0.56 YHS33 MOL004221 Norglaucing 30.35 0.56 YHS34 MOL004224 Pontevedrine 30.28 0.71 YHS35 MOL004225 Pseudocoptisine 38.97 0.86 YHS36 MOL004226 Pseudoprotopine 53.75 0.83 YHS37 MOL004228 Saulatine 42.74 0.79 YHS38 MOL004230 Stylopine 48.25 0.85 YHS39 MOL004231 Tetrahydrocorysamine 34.17 0.86 YHS40 MOL004232 Tetrahydroprotopapaverine 57.28 0.33 YHS41 MOL004233 Thaliporphine 31.87 0.56 YHS42 MOL004234 2, 3, 9, 10-tetramethoxy-13-methyl-5, 6- dihydroisoquinolino[2, 1-b]isoquinolin-8-one 76.77 0.73 YHS43 MOL000449 Stigmasterol 43.83 0.76 YHS44 MOL000785 Palmatine 64.60 0.65 YHS45 MOL000787 Fumarine 59.26 0.83 YHS46 MOL000790 Isocorypalmine 35.77 0.59 YHS47 MOL000791 Bicuculline 69.67 0.88 YHS48 MOL000793 Bulbocapnine 47.54 0.69 共同成分 A1 MOL000098 Quercetin 46.43 0.28 注:简称用于Cytocape软件制图。 将药对“川楝子-延胡索”对应靶点基因与Uniprot数据库中对应人类基因进行匹配,筛选后得出川楝子对应靶点164个,延胡索对应靶点961个,共同靶点143个,去重后药对“川楝子-延胡索”对应靶点基因共199个。
2.2 药对“川楝子-延胡索”治疗肝癌的靶点基因
检索肝癌的相关基因共42 992个,经两倍中位数及去重筛选后得出肝癌的相关基因共4340个;其中与药对“川楝子-延胡索”对应靶点基因相交集的基因共162个。
2.3 “药对-成分-靶点”网络
对川楝子、延胡索筛选药物活性成分,交集靶点基因导入至Cytoscape 3.7.1软件中构建“药对-成分-靶点”网络图(附录1)。该网络图中共含有254个节点(包括2味中药、54个化合物、162个潜在靶点基因),1180条边。分析该网络中相关节点的度值可知,中药活性成分中度值最大的是槲皮素(quercetin,A1),其次为(S)-金黄紫堇碱[(S)-Scoulerine,YHS7]、异紫堇杷明碱(Isocorypalmine,YHS46)、刺罂粟碱(stylopine、YHS30)、延胡索乙素(Hyndarin、YHS11),说明该药对在治疗肝癌的过程中发挥主要作用的可能是以上活性成分。
2.4 药对“川楝子-延胡索”治疗肝癌的靶点蛋白相互作用网络
将162个交集靶点基因上传至String数据库以分析蛋白之间的相互作用并构建PPI网络图。此外将该分析数据以TSV格式导出并保存。通过Cytoscape 3.7.1软件将该分析数据进行可视化分析,得出药对“川楝子-延胡索”治疗肝癌的靶点蛋白互作网络图(附录2)。分析数据可知,AKT1靶点蛋白中度值最高(118),其次为IL6(103)、TP53(100)、VEGFA(95)、TNF(90)、CASP3(88)、JUN(88)、MAPK1(88)、MYC(86)、EGFR(83),说明药对在治疗肝癌时以上基因发挥了重要作用。
2.5 药对“川楝子-延胡索”治疗肝癌的靶点基因的GO功能、KEGG信号通路分析
借助Metascape数据库分析162个交集靶点基因,筛选后得出GO富集条目共2606个(P值均 < 0.01),包括2321个生物学进程(BP),主要涉及对有毒物质、无机物、创伤愈合的反应;细胞对有机环状化合物、有机氮化合物及外界刺激的反应;细胞增殖的负调控、细胞死亡的正调控;血管生长发育、凋亡的信号通路等;186个分子功能(MF),主要涉及蛋白激酶结合、蛋白酶结合、磷酸酶结合、氧化还原酶活性、转录因子结合、细胞因子受体结合、蛋白质结构域特异性结合、蛋白质同聚活性、核受体活性、激素受体结合等;99类细胞组成(CC),主要涉及膜筏、质膜蛋白复合物、神经细胞体、转录因子复合物、细胞质核周区、细胞外基质、细胞顶部、黏着连接、溶质液泡、囊泡腔等(图 1)。此外,KEGG分析得出相关信号通路共351条,其中主要涉及癌症通路(Pathways in cancer)、AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、流体剪切应力与动脉粥样硬化(Fluid shear stress and atherosclerosis)、TNF信号通路(TNF signaling pathway)、NF-κB信号通路(NF-kappa B signaling pathway)、结直肠癌(Colorectal cancer)、甲状腺激素信号通路等(图 2)。
3. 讨论
随着网络药理学的发展,许多研究人员采用网络药理学方法分析中药成分、评估药理作用,并通过可视化分析药物分子间的网络关系及相关靶蛋白、通路数据,以探讨中药、方剂发挥疗效的可能分子机制[6-8]。如巩晓杰等[9]通过网络药理学研究薏苡仁治疗肝癌的有效活性成分;欧阳思露等[10]通过网络药理学分析莪术的抗癌机理;李菁等[11]应用网络药理学、分子对接探析四逆散治疗肝癌的潜在分子机制。因此,网络药理学对于中药的药效开发以及预测潜在的作用机制具有重要意义。
药对“川楝子-延胡索”现临床广泛应用于慢性肝炎、肝硬化、胆囊炎等肝胆疾病,此外亦用于癌症的治疗[12]。研究[13-14]表明,通过半仿生提取技术处理金铃子散并将其作用于人宫颈癌HeLa细胞、人肝癌HepG2细胞后,均表达了一定的抗癌作用,且对肝癌细胞作用更为突出;川楝子粗提取物可通过调节人结肠癌细胞SW480、小鼠大肠腺癌细胞CT26的凋亡进程以抑制癌细胞的增殖[15];延胡索粉末对小鼠H22肝癌具有明显抑制作用且与其浓度呈一定依赖性[16]。
此次研究通过网络药理学方法分析药对“川楝子-延胡索”中中药活性成分,构建成分、肝癌靶点相关网络,说明药对治疗肝癌是多个成分、多个靶点共同作用的综合过程。
通过上述分析发现药对中发挥重要作用的成分可能是槲皮素、(S)-金黄紫堇碱、异紫堇杷明碱、刺罂粟碱、延胡索乙素。槲皮素是多种中药的共有成分,也是肿瘤研究的热点成分。槲皮素属于黄酮类药物,其可通过调控细胞生长周期、降低细胞代谢活性、诱导细胞凋亡以抑制肝癌细胞增殖,从而发挥抗肝癌作用[17-20]。(S)-金黄紫堇碱、异紫堇杷明碱、刺罂粟碱、延胡索乙素均属于异喹啉类生物碱,此类生物碱为延胡索中的主要活性成分,药理研究[21-23]表明其具有抗肿瘤、镇静、抗炎等多种作用。在抗肿瘤作用方面,异喹啉类生物碱可发挥明显的抗肝癌效用,其主要机制在于通过不同通路促进肿瘤细胞发生凋亡与自噬,抑制细胞的增殖与侵袭转移,控制肿瘤血管生成[24-25]。
通过药对“川楝子-延胡索”治疗肝癌的靶点蛋白相互作用网络可知该网络关系中的主要作用包括AKT1、IL6、TP53、VEGFA、TNF、CASP3等靶点。分析以上主要发挥治疗肝癌作用的靶点及作用,可将其总结为以下几个方面。(1)炎症相关因子介导肿瘤进程(IL6、TNF):IL6是具有多种效应的的炎症细胞因子,当机体出现急性损伤时呈现高表达状态[26],且参与和调控了肺癌、肝癌等多种恶性肿瘤的发生、发展[27-28]。TNF包括TNFα和TNFβ,是一类能直接杀伤并造成肿瘤细胞死亡的细胞因子。其中TNFα在调控肿瘤的发展进程中具有双向调节作用,既具有抗肿瘤作用亦可促进肿瘤生长,而具体表现为何种作用取决于TNFα的浓度。当TNFα浓度较高时,可刺激其他相关炎症因子的释放、抑制肿瘤血管新生以最大程度发挥抗肿瘤效应;当TNFα浓度较低时可通过NF-κB信号通路诱导肿瘤细胞侵袭、转移发生以发挥促肿瘤作用[29-30]。(2)抑制血管新生:VEGFA属于血管内皮生长因子(VEGF),可升高血管内皮细胞通透性,影响血管内皮细胞增殖、存活、迁移以促进血管生成[31]。肝癌血供丰富,新生血管的生成可直接影响其病程发展与预后,因此降低VEGF的表达、抑制血管生成、改善肝癌微环境可有效控制肝癌的生长、转移[32]。(3)抑制肿瘤细胞增殖、促进肿瘤细胞凋亡(AKT1、TP53、CASP3):AKT1(即AKT)在PI3K/Akt信号通路中发挥重要作用,是通路中的关键因子。研究[33]表明,在多种肿瘤中均可发现PI3K/Akt信号通路对于促进肿瘤细胞的增殖、生长具有调控作用,这与AKT1的磷酸化被异常活化有紧密关系。此外,研究[34]表明该信号通路的活化与肝癌的生长有关,且与肝癌患者临床病理特征密切相关。TP53(即P53)是常见的抑癌基因,可抑制肿瘤细胞生长、诱导细胞凋亡[35]。研究[36]发现P53容易发生突变,人类约50%的癌症均存在P53突变。突变后P53丧失抑癌活性,在肿瘤细胞增殖中起促进作用,且抑制细胞凋亡,从而加速肿瘤发展[37]。CASP3(即Caspase 3)是Caspase家族中重要的一员,该家族在细胞凋亡的执行过程中具有不可或缺的作用[38-39],且Caspase 3的激活也标志着细胞的凋亡必然开始[40-41]。而肿瘤的发生发展与肿瘤细胞的凋亡密切相关,研究[42]表明可通过诱导细胞凋亡从而抑制肝癌细胞的增殖。
GO分子功能阐明药对发挥作用主要与细胞的增殖与凋亡、血管的生长发育有关;KEGG通路分析结果表明药对治疗肝癌过程涉及多个通路,与之相关的通路包括癌症通路、AGE-RAGE信号通路、TNF信号通路、NF-κB信号通路等。多项研究[43-48]表明NF-κB信号通路参与调控肿瘤的增殖、凋亡过程。NF-κB是细胞中的重要转录调节因子,在大多数细胞中,NF-κB表现为静息状态[49]。在炎症等刺激下,上游信号通路活化后可激活NF-κB,而激活后的NF-κB可与对应的靶序列在细胞核内结合并调控基因转录、调节细胞黏附分子等以发挥生物学效应[50-51]。AGE-RAGE信号通路、TNF信号通路均为其上游通路。在AGE-RAGE信号通路中,AGE与其受体RAGE结合后可活化NF-κB信号通路,使NF-κB呈现高表达状态,进而调控其下游基因IL6、TNFα的表达[52]。亦有研究[53-55]表明TNF与TNF受体1结合激活TNF信号通路后,可刺激细胞生长因子的表达以促进肝癌细胞的侵袭,诱导VEGF的表达上调以促进肝癌的血管新生从而加速肝癌的恶化,而此过程NF-κB信号通路具有中心主导作用。通路结果与重要靶点分析相吻合,互相验证了文中靶点、通路治疗肝癌的可能机制。
上述分析说明了药对“川楝子-延胡索”治疗肝癌是多种成分、多个靶点基因与信号通路之间相互影响、共同发挥作用的过程,其治疗过程主要是靶点通过介导相关通路调控肿瘤的增殖、凋亡。

-
表 1 术后肝功能良好组与肝功能不全组的临床指标比较
Table 1. Comparison of clinical indexes between normal liver function group and liver insufficiency group after operation
项目 肝功能良好组(n=56) 肝功能不全组(n=14) 统计值 P值 年龄(岁) 54.82±10.87 56.57±5.08 t=0.880 0.383 性别(例) χ2=0.036 0.850 男 36 10 女 20 4 Child分级(例) χ2=23.414 <0.001 A级 50 4 B级 6 10 肝脏体积(cm³) 1 667.83±537.92 1 978.70±538.96 t=1.933 0.057 SRLV(mL/m2) 1 132.38±199.66 1 374.62±173.28 t=4.160 <0.001 切除肝体积(cm3) 514.03±460.72 696.89±560.07 t=1.271 0.208 手术时间(min) 223.30±44.13 249.71±50.03 χ2=1.951 0.055 出血量(mL) 419.64±176.24 500.00±203.81 χ2=1.479 0.144 输血量(mL) 321.43±173.43 428.57±209.13 χ2=1.983 0.051 ICG-R15 术前 5.73%±4.31% 18.02%±13.48% t=3.368 0.005 术后即时 12.36%±7.41% 32.54%±18.67% t=3.966 0.001 术后3 d 11.51%±8.76% 34.73%±18.49% t=4.571 <0.001 术后5 d 9.60%±7.00% 25.34%±11.49% t=4.901 <0.001 表 2 术后连续性监测ICG-R15水平与肝功能不全发生率的关系
Table 2. Relationship between continuous monitoring of ICG-R15 level and incidence of liver insufficiency after surgery
组别 例数 肝功能良好[例(%)] 肝功能不全[例(%)] χ2值 P值 术前 22.374 <0.001 ICG-R15<10%组 54 48(88.9) 6(11.1)1) 10%≤ICG-R15≤20%组 10 8(80.0) 2(20.0)1) ICG-R15>20%组 6 0(0.0) 6(100.0) 术后即时 28.024 <0.001 ICG-R15<10%组 32 32(100.0) 0(0.0)1)2) 10%≤ICG-R15≤20%组 22 18(81.8) 4(18.2)1) ICG-R15>20%组 16 6(37.5) 10(62.5) 术后3 d 14.810 <0.001 ICG-R15<10%组 32 30(93.8) 2(6.3)1) 10%≤ICG-R15≤20%组 18 16(88.9) 2(11.1)1) ICG-R15>20%组 20 10(50.0) 10(50.0) 术后5 d 21.159 <0.001 ICG-R15<10%组 38 36(94.7) 2(5.3)1) 10%≤ICG-R15≤20%组 16 14(87.5) 2(12.5)1) ICG-R15>20%组 16 6(37.5) 10(62.5) 注:与ICG-R15>20%组比较,1)P<0.001;与10%≤ICG-R15≤20%组比较,2)P<0.001。 表 3 术前、术后连续性监测ICG-R15的AUC及95%CI
Table 3. The level of ICG-R15 and AUC and 95%CI were continuously monitored before and after operation
ICG-R15 AUC(95%CI) 截断值(%) 灵敏度(%) 特异度(%) 术前 0.790(0.676~0.878) 6.10 85.71 73.21 术后即时 0.857(0.752~0.929) 17.50 71.43 89.29 术后3 d 0.855(0.750~0.927) 14.30 85.71 75.00 术后5 d 0.870(0.768~0.938) 25.20 71.43 94.64 表 4 肝癌患者肝部分切除术后肝功能不全的多因素Logistic 回归分析
Table 4. Multivariate Logistic regression analysis of postoperative hepatic insufficiency
项目 OR(95%CI) P值 术后即时预测模型 术前BMI 0.448(0.246~0.816) <0.01 术后即时ICG-R15 1.118(1.007~1.241) <0.01 SRLV 1.020(1.004~1.036) <0.01 术后3 d预测模型 术前BMI 0.451(0.241~0.843) <0.01 术后3天ICG-R15 1.112(1.018~1.213) <0.01 SRLV 1.021(1.003~1.038) <0.01 术后5 d预测模型 术前BMI 0.464(0.253~0.849) <0.01 术后5天ICG-R15 1.150(1.026~1.288) <0.01 SRLV 1.017(1.002~1.033) <0.01 表 5 术后动态监测ICG-R15对术后肝功能不全的诊断折点
Table 5. Postoperative dynamic monitoring of ICG-R15 in the diagnosis of hepatic insufficiency
ICG-R15 诊断折点 灵敏度(%) 特异度(%) 约登指数1) 术后即时 >20.80% 71.4 89.3 0.607 术后3 d >14.35% 85.7 75.0 0.607 >25.05% 71.4 89.3 0.607 术后5 d >25.35% 71.4 94.6 0.660 >24.35% 71.4 92.9 0.643 >23.35% 71.4 91.1 0.625 >19.35% 71.4 89.3 0.607 >25.55% 64.3 96.4 0.607 注:1)列举约登指数较大的诊断折点。 表 6 SLRV联合术后ICG-R15动态监测对术后肝功能不全的诊断标准
Table 6. SLRV combined with ICG-R15 dynamic monitoring for the diagnosis of postoperative hepatic insufficiency
诊断标准 诊断条件 标准一 符合以下任意一项或多项: (1)SLRV>1 240 mL/m2; (2)术后即时ICG-R15>20%; (3)术后3 d或5 d ICG-R15>25% 标准二 符合以下所有项: (1)SLRV>1 240 mL/m2; (2)术后即时ICG-R15>20%; (3)术后3 d或5 d ICG-R15>25% 表 7 SLRV联合术后ICG-R15动态监测对术后肝功能不全的诊断性能评价
Table 7. Evaluation of SLRV combined with ICG-R15 dynamic monitoring in the diagnosis of postoperative hepatic insufficiency
诊断标准 肝功能不全(例) 肝功能良好(例) 灵敏度(%) 漏诊率(%) 特异度(%) 误诊率(%) 符合度(%) 标准一1) 14 34 100.00 0.00 60.71 39.29 68.57 标准二2) 9 56 64.29 35.71 100.00 0.00 92.85 注:1)另有22例符合标准一,但不符合金标准;2)另有5例符合金标准,但不符合标准2。 -
[1] RAHBARI NN, GARDEN OJ, PADBURY R, et al. Posthepatectomy liver failure: A definition and grading by the International Study Group of Liver Surgery(ISGLS)[J]. Surgery, 2011, 149( 5): 713- 724. DOI: 10.1016/j.surg.2010.10.001. [2] HAEGELE S, REITER S, WANEK D, et al. Perioperative non-invasive indocyanine green-clearance testing to predict postoperative outcome after liver resection[J]. PLoS One, 2016, 11( 11): e0165481. DOI: 10.1371/journal.pone.0165481. [3] DU ZG, LI B, FENG X, et al. Combined indocyanine green test and standard remnant liver volume to predict post-hepatectomy hepatic insufficiency for the patients with hepatocellular carcinoma[J]. Chin J Surg, 2010, 48( 3): 189- 192. DOI: 10.3760/cma.j.issn.0529-5815.2010.03.010.杜正贵, 李波, 冯曦, 等. 吲哚氰绿排泄试验及标准余肝体积与肝癌切除术后肝功能不全的相关性研究[J]. 中华外科杂志, 2010, 48( 3): 189- 192. DOI: 10.3760/cma.j.issn.0529-5815.2010.03.010. [4] DONG JH, ZHENG SS, CHEN XP, et al. Consensus on evaluation of hepatic functional reserve before hepatectomy(2011 edition)[J]. Chin J Dig Surg, 2011, 10( 1): 20- 25. DOI: 10.3760/cma.j.issn.1673-9752.2011.01.006.董家鸿, 郑树森, 陈孝平, 等. 肝切除术前肝脏储备功能评估的专家共识(2011版)[J]. 中华消化外科杂志, 2011, 10( 1): 20- 25. DOI: 10.3760/cma.j.issn.1673-9752.2011.01.006. [5] XU LN, XU YY, GAO DW. Impact of operative and peri-operative factors on the long-term prognosis of primary liver cancer patients undergoing hepatectomy[J]. J Huazhong Univ Sci Technolog Med Sci, 2016, 36( 4): 523- 528. DOI: 10.1007/s11596-016-1619-2. [6] TAKAHASHI K, KUROKAWA T, OSHIRO Y, et al. Postoperative decrease in platelet counts is associated with delayed liver function recovery and complications after partial hepatectomy[J]. Tohoku J Exp Med, 2016, 239( 1): 47- 55. DOI: 10.1620/tjem.239.47. [7] LIU Y, CHEN ZL, YU XX, et al. Risk factors for hepatic insufficiency after major hepatectomy in non-cirrhotic patients[J]. Asian J Surg, 2021, 44( 10): 1324- 1325. DOI: 10.1016/j.asjsur.2021.06.046. [8] APERS T, HENDRIKX B, BRACKE B, et al. Parenchymal-sparing hepatectomy with hepatic vein resection and reconstruction[J]. Acta Chir Belg, 2022, 122( 5): 334- 340. DOI: 10.1080/00015458.2021.1915021. [9] SØREIDE JA, DESHPANDE R. Post hepatectomy liver failure(PHLF)-Recent advances in prevention and clinical management[J]. Eur J Surg Oncol, 2021, 47( 2): 216- 224. DOI: 10.1016/j.ejso.2020.09.001. [10] HAYASHI H, BEPPU T, OKABE H, et al. Functional assessment versus conventional volumetric assessment in the prediction of operative outcomes after major hepatectomy[J]. Surgery, 2015, 157( 1): 20- 26. DOI: 10.1016/j.surg.2014.06.013. [11] MOON YJ, KIM SH, KIM JW, et al. Comparison of postoperative coagulation profiles and outcome for sugammadex versus pyridostigmine in 992 living donors after living-donor hepatectomy[J]. Medicine, 2018, 97( 11): e0129. DOI: 10.1097/MD.0000000000010129. [12] DE RUDDER M, DILI A, STÄRKEL P, et al. Critical role of LSEC in post-hepatectomy liver regeneration and failure[J]. Int J Mol Sci, 2021, 22( 15): 8053. DOI: 10.3390/ijms22158053. [13] ZHANG ZM, OUYANG GX, WANG P, et al. Safe standard remnant liver volume after hepatectomy in HCC patients in different stages of hepatic fibrosis[J]. BMC Surg, 2021, 21( 1): 57. DOI: 10.1186/s12893-021-01065-x. [14] YOSHIDA M, SHIRAISHI S, SAKAMOTO F, et al. Assessment of hepatic functional regeneration after hepatectomy using(99m)Tc-GSA SPECT/CT fused imaging[J]. Ann Nucl Med, 2014, 28( 8): 780- 788. DOI: 10.1007/s12149-014-0872-3. [15] FUNG J, POON RTP, YU WC, et al. Use of liver stiffness measurement for liver resection surgery: Correlation with indocyanine green clearance testing and post-operative outcome[J]. PLoS One, 2013, 8( 8): e72306. DOI: 10.1371/journal.pone.0072306. [16] CHEN ZS, LIN KC, LIU JF. Application of three-dimensional visualization in surgical operation for primary liver cancer[J]. J Clin Hepatol, 2022, 38( 3): 505- 509. DOI: 10.3969/j.issn.1001-5256.2022.03.003.陈昭硕, 林科灿, 刘景丰. 三维可视化技术在原发性肝癌外科手术中的应用[J]. 临床肝胆病杂志, 2022, 38( 3): 505- 509. DOI: 10.3969/j.issn.1001-5256.2022.03.003. [17] BOWEN SR, CHAPMAN TR, BORGMAN J, et al. Measuring total liver function on sulfur colloid SPECT/CT for improved risk stratification and outcome prediction of hepatocellular carcinoma patients[J]. EJNMMI Res, 2016, 6( 1): 57. DOI: 10.1186/s13550-016-0212-9. [18] ETRA JW, SQUIRES MH 3rd, FISHER SB, et al. Early identification of patients at increased risk for hepatic insufficiency, complications and mortality after major hepatectomy[J]. HPB, 2014, 16( 10): 875- 883. DOI: 10.1111/hpb.12270. [19] GAO YY, ZHANG X, LI FH, et al. Measurement of glycosylated albumin and its application value in liver cirrhosis patients with different Child-Pugh classes[J]. J Clin Hepatol, 2022, 38( 2): 347- 351. DOI: 10.3969/j.issn.1001-5256.2022.02.018.高艳颖, 张旭, 李凤慧, 等. 不同Child-Pugh分级肝硬化患者糖化白蛋白的测定及其应用价值[J]. 临床肝胆病杂志, 2022, 38( 2): 347- 351. DOI: 10.3969/j.issn.1001-5256.2022.02.018. [20] ZHAO D, YE JD, LI HL, et al. Application of liver three-dimensional visualized reconstruction technique in hepatectomy for children with compli-cated hepatoblastoma[J]. J Clin Hepatol, 2021, 37( 9): 2130- 2135. DOI: 10.3969/j.issn.1001-5256.2021.09.025.赵頔, 叶进冬, 李华丽, 等. 肝脏三维可视化重建技术在儿童复杂肝母细胞瘤肝切除术中的应用价值[J]. 临床肝胆病杂志, 2021, 37( 9): 2130- 2135. DOI: 10.3969/j.issn.1001-5256.2021.09.025. 期刊类型引用(2)
1. 唐侨,李保华. 自拟调肝活血化瘀方对脾虚血瘀型酒精性肝硬化(代偿期)患者中医证候评分及内毒素水平的影响. 四川中医. 2023(09): 119-123 .  百度学术
百度学术2. 顾知恩,王磊. 基于“营卫理论”浅谈昼夜节律与恶性肿瘤之间的关系. 吉林中医药. 2023(11): 1256-1261 .  百度学术
百度学术其他类型引用(3)
-




 PDF下载 ( 797 KB)
PDF下载 ( 797 KB)

 下载:
下载:


 下载:
下载:
 百度学术
百度学术



