冷冻消融联合卡瑞利珠单抗治疗肝细胞癌的效果及安全性分析
DOI: 10.12449/JCH240616
Efficacy and safety of cryoablation combined with Camrelizumab monoclonal antibody in treatment of hepatocellular carcinoma
-
摘要:
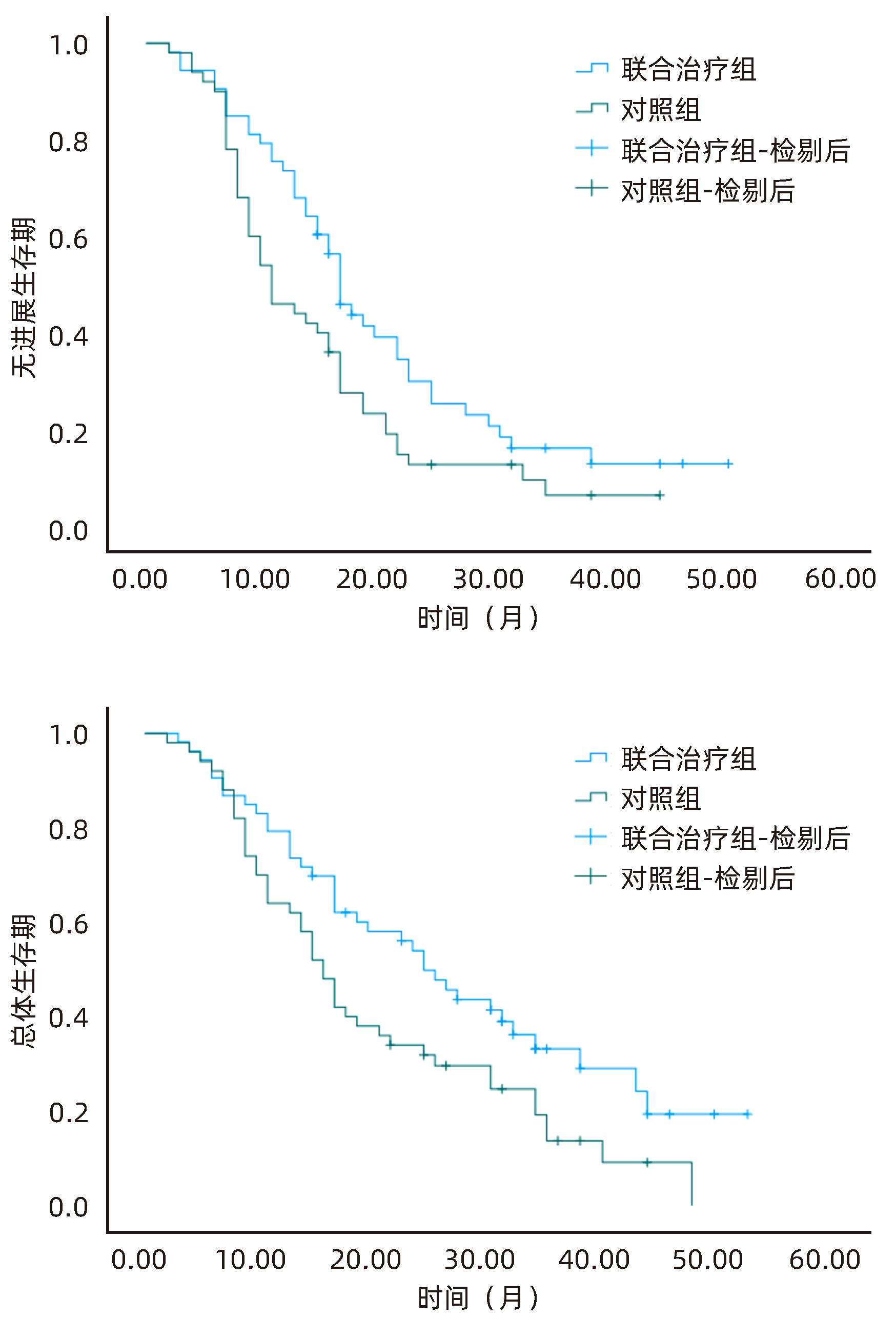
目的 探讨分析冷冻消融联合抑制剂卡瑞利珠单抗治疗肝细胞癌(HCC)的有效性和安全性。 方法 选取2020年6月—2023年6月河北医科大学第一医院收治的HCC患者103例为研究对象,将患者随机分为联合治疗组(53例)和对照组(50例)。对照组患者接受经皮氩氦刀冷冻消融术治疗,联合治疗组患者接受经皮氩氦刀冷冻消融术联合卡瑞利珠单抗治疗。比较两组患者近期疗效、治疗前后T淋巴细胞亚群变化、肝功能及AFP变化、随访无进展生存期及总体生存期。符合正态分布的计量资料两组间比较采用成组t检验;计数资料两组间比较采用χ2检验。Kaplan-Meier法绘制生存曲线,Log-rank检验比较两组生存时间差异。 结果 联合治疗组患者总缓解率、疾病控制率均明显高于对照组(χ2值分别为4.156、4.348,P值分别为0.042、0.037)。联合治疗组患者治疗后CD3+、CD4+T淋巴细胞百分比及CD4+/CD8+值较治疗前均明显升高(P<0.05),CD8+T淋巴细胞百分比较治疗前明显降低(P<0.05),而对照组患者治疗前、后T淋巴细胞亚群均无明显变化(P值均>0.05),且治疗后联合治疗组CD3+、CD4+T淋巴细胞百分比及CD4+/CD8+值均明显高于对照组(P值均<0.05),CD8+细胞百分比明显低于对照组(P<0.05)。两组患者治疗后ALT、AST、AFP水平较治疗前均明显降低(P值均<0.05),Alb水平较治疗前明显升高(P<0.05),且联合治疗组患者治疗后ALT、AST、AFP水平明显低于对照组(P值均<0.05),Alb水平明显高于对照组(P<0.05)。两组患者Ⅲ~Ⅳ级(中重度)不良反应发生率比较差异无统计学意义(P>0.05)。联合治疗组患者无进展生存中位时间(21.32个月 vs 15.31个月)、总体生存中位时间(28.36个月 vs 20.75个月)均明显优于对照组(χ2值分别为4.689、5.030,P值分别为0.030、0.025)。 结论 氩氦刀冷冻消融联合卡瑞利珠单抗可有效提升近期疗效,改善机体免疫功能,延长生存时间,且治疗安全性良好。 Abstract:Objective To investigate the efficacy and safety of cryoablation combined with Camrelizumab monoclonal antibody in the treatment of hepatocellular carcinoma (HCC). Methods A total of 103 HCC patients who were admitted to our hospital from June 2020 to June 2023 were enrolled and randomly divided into combined treatment group with 53 patients and control group with 50 patients. The patients in the control group received percutaneous argon-helium cryoablation, and those in the combined treatment group received percutaneous argon-helium cryoablation combined with Camrelizumab monoclonal antibody. The two groups were compared in terms of short-term response, changes in T lymphocyte subsets after treatment, changes in liver function and alpha-fetoprotein (AFP) after treatment, and progression-free survival and overall survival during follow-up. The t-test was used for comparison of normally distributed continuous data between groups, and the chi-square test was used for comparison of categorical data between groups. The Kaplan-Meier method was used to plot survival curves, and the log-rank test was used for comparison of survival time between the two groups. Results The combined treatment group had significantly higher overall response rate and disease control rate than the control group (χ2=4.156 and 4.348, P=0.042 and 0.037). After treatment, the combined treatment group had significant increases in the percentages of CD3+ and CD4+ T lymphocytes and CD4+/CD8+ ratio (P<0.05) and a significant reduction in the percentage of CD8+ T lymphocytes (P<0.05), while the control group had no significant changes in T lymphocyte subsets after treatment (P>0.05), and compared with the control group after treatment, the combined treatment group had significantly higher percentages of CD3+ and CD4+ T lymphocytes and CD4+/CD8+ ratio (all P<0.05) and a significantly lower percentage of CD8+ T lymphocytes (P<0.05). After treatment, both groups had significant reductions in the levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), and AFP (all P<0.05) and a significant increase in the level of albumin (Alb) (P>0.05), and compared with the control group after treatment, the combined treatment group had significantly lower levels of ALT, AST, and AFP (all P<0.05) and a significantly higher level of Alb (P<0.05). There were no significant differences in the incidence rates of grade Ⅲ—Ⅳ (moderate to severe) adverse reactions between the two groups (P>0.05). Compared with the control group, the combined treatment group had significantly better median progression-free survival (21.32 months vs 15.31 months, χ2=4.689, P=0.030) and median overall survival (28.36 months vs 20.75 months, χ2=5.030, P=0.025). Conclusion Argon-helium cryoablation combined with Camrelizumab monoclonal antibody can effectively improve short-term response, enhance immune function, and prolong survival time, with a favorable safety profile. -
Key words:
- Carcinoma, Hepatocellular /
- Cryosurgery /
- Immune Checkpoint Inhibitors
-
肝癌作为我国常见的一种恶性程度较高的肿瘤,死亡率较高且呈上升趋势,位居全球癌症的第三位[1]。现临床多采用手术、放化疗等多种方法联合治疗,但治疗效果尚未达到预期。且相较于毒副反应较大的化学治疗,中医药作为肿瘤治疗常用的辅助治疗方式,其减毒增效的特点有利于提高患者的治疗效果及生存质量。
药对是中医临床医师在治疗过程中常用的一种独具特色的药物配伍方式,其组成相较方剂较为简单,但药对皆由“病、证、症”出发,精简配对,亦可发挥综合效用,增强疗效。本文研究基于国医大师刘尚义教授临床辨治肿瘤的数据挖掘分析。药对“川楝子-延胡索”是刘尚义教授临床常用的一组行气、止痛经方药对[2],二药既是药对,亦是名方金铃子散的组成。金铃子散出自于金元四大家之一刘完素所著医书《素问·病机气宜保命集》,其中川楝子可疏肝行气、清肝泻火;延胡索可行气活血、祛瘀止痛,两者配伍具有清肝泻热、活血散瘀定痛之效。此外,现代药理学研究[3-5]表明川楝子、延胡索均具有良好的抗肿瘤、抗炎镇痛作用。但目前研究尚未有完整、明确的药对“川楝子-延胡索”用于治疗肝癌的药效机制,故开展此次研究提供部分理论基础。
1. 方法
1.1 搜集、筛选药对“川楝子-延胡索”的成分及对应靶点
分别以“川楝子”“延胡索”为关键词在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)中检索搜集中药成分,以“口服生物利用度(OB)≥30%,化合物的类药性(DL)≥0.18”为条件筛选药物有效成分,查找有效成分的对应靶点,并通过Uniprot数据库(http://www.uniprot.org/)将所有作用靶点统一为对应基因名称。
1.2 查找、筛选药对“川楝子-延胡索”治疗肝癌的靶点基因
分别以“hepatic carcinoma”“hepatic cancer”“hepatocellular carcinomas”“liver cancer”为关键词在疾病靶点Genecards数据库(https://www.genecards.org/)中检索查找肝癌的相关基因并导出结果。在Excel表格中选用两倍中位数公式并删除重复靶点后筛选出与肝癌关系更为紧密的基因。最后将药对的药物基因、肝癌基因相映射得出交集基因,该交集基因即为药对治疗肝癌的靶点基因。
1.3 构建“药对-成分-靶点”网络
将药对中“川楝子”“延胡索”筛选后的药物活性成分及靶点基因导入Cytoscape 3.7.1软件中,从而构建药对药物-成分-靶点网络图。
1.4 构建靶点蛋白相互作用网络
将交集靶点基因上传至String数据库(https://string-db.org/),限定物种为“Homo sapiens”,分析药对“川楝子-延胡索”治疗肝癌的潜在靶点信息及靶点蛋白之间的相互作用关系,并借助Cytoscape 3.7.1软件将所得靶点蛋白信息进行可视化分析。
1.5 分析靶点通路
为了更进一步的分析、明确药对“川楝子-延胡索”的靶点基因在治疗肝癌过程中发挥的生物学功能及相关重要通路,将靶点基因输入至Metascape数据库(https://metascape.org/gp/index.html#/main/step1)进行GO富集分析(含生物过程、细胞组分、分子功能三部分)、KEGG信号通路富集分析,并通过易汉博生物信息在线做图网站Image GP(http://www.ehbio.com/ImageGP/)将分析结果进行可视化处理。
2. 结果
2.1 药对“川楝子-延胡索”的成分及对应作用靶点
在TCMSP数据库中以前述方法进行检索、筛选,得出川楝子有效活性成分9个,其中melianone(MOL002047)、Nimbolidin D(MOL002048)、Nimbolin A(MOL002053)无对应靶点,予以剔除,故其有效成分为6个,对应靶点为181个;延胡索有效活性成分49个,对应靶点1097个;两味中药共同成分1个,为quercetin(MOL000098),共同靶点基因154个。成分具体情况见表 1。
表 1 药对“川楝子-延胡索”中中药活性成分详情中药 简称 MOL ID 分子名称 OB(%) DL(%) 川楝子(简称:CLZ) CLZ1 MOL001494 Mandenol 42.00 0.19 CLZ2 MOL001495 Ethyl linolenate 46.10 0.20 CLZ3 MOL002045 Stigmasterol 43.41 0.76 CLZ4 MOL002056 (E)-3-[(2S, 3R)-2-(4-hydroxy-3-methoxy-phenyl)-7-methoxy-3-methylol-2, 3-dihydrobenzofuran-5-yl]acrolein 54.74 0.40 CLZ5 MOL002058 Medioresil 57.20 0.62 延胡索(简称:YHS) YHS1 MOL001454 Berberine 36.86 0.78 YHS2 MOL001458 Coptisine 30.67 0.86 YHS3 MOL001460 Cryptopin 78.74 0.72 YHS4 MOL001461 Dihydrochelerythrine 32.73 0.81 YHS5 MOL001463 Dihydrosanguinarine 59.31 0.86 YHS6 MOL001474 Sanguinarine 37.81 0.86 YHS7 MOL000217 (S)-Scoulerine 32.28 0.54 YHS8 MOL002670 Cavidine 35.64 0.81 YHS9 MOL002903 (R)-Canadine 55.37 0.77 YHS10 MOL000359 Sitosterol 36.91 0.75 YHS11 MOL004071 Hyndarin 73.94 0.64 YHS12 MOL004190 (-)-alpha-N-methylcanadine 45.06 0.80 YHS13 MOL004191 Capaurine 62.91 0.69 YHS14 MOL004193 Clarkeanidine 86.65 0.54 YHS15 MOL004195 Corydaline 65.84 0.68 YHS16 MOL004196 Corydalmine 52.50 0.59 YHS17 MOL004197 Corydine 37.16 0.55 YHS18 MOL004198 Corynoline 46.06 0.85 YHS19 MOL004199 Corynoloxine 38.12 0.60 YHS20 MOL004200 Methyl-[2-(3, 4, 6, 7-tetramethoxy-1-phenanthryl)ethyl]amine 61.15 0.44 YHS21 MOL004202 Dehydrocavidine 38.99 0.81 YHS22 MOL004203 Dehydrocorybulbine 46.97 0.63 YHS23 MOL004204 Dehydrocorydaline 41.98 0.68 YHS24 MOL004205 Dehydrocorydalmine 43.90 0.59 YHS25 MOL004208 Demethylcorydalmatine 38.99 0.54 YHS26 MOL004209 13-methyldehydrocorydalmine 35.94 0.63 YHS27 MOL004210 (1S, 8′R)-6, 7-dimethoxy-2-methylspiro[3, 4-dihydroisoquinoline-1, 7′-6, 8-dihydrocyclopenta [g][1, 3]benzodioxole]-8′-ol 43.95 0.72 YHS28 MOL004763 Izoteolin 39.53 0.51 YHS29 MOL004214 Isocorybulbine 40.18 0.66 YHS30 MOL004215 leonticine 45.79 0.26 YHS31 MOL004216 13-methylpalmatrubine 40.97 0.63 YHS32 MOL004220 N-methyllaurotetanine 41.62 0.56 YHS33 MOL004221 Norglaucing 30.35 0.56 YHS34 MOL004224 Pontevedrine 30.28 0.71 YHS35 MOL004225 Pseudocoptisine 38.97 0.86 YHS36 MOL004226 Pseudoprotopine 53.75 0.83 YHS37 MOL004228 Saulatine 42.74 0.79 YHS38 MOL004230 Stylopine 48.25 0.85 YHS39 MOL004231 Tetrahydrocorysamine 34.17 0.86 YHS40 MOL004232 Tetrahydroprotopapaverine 57.28 0.33 YHS41 MOL004233 Thaliporphine 31.87 0.56 YHS42 MOL004234 2, 3, 9, 10-tetramethoxy-13-methyl-5, 6- dihydroisoquinolino[2, 1-b]isoquinolin-8-one 76.77 0.73 YHS43 MOL000449 Stigmasterol 43.83 0.76 YHS44 MOL000785 Palmatine 64.60 0.65 YHS45 MOL000787 Fumarine 59.26 0.83 YHS46 MOL000790 Isocorypalmine 35.77 0.59 YHS47 MOL000791 Bicuculline 69.67 0.88 YHS48 MOL000793 Bulbocapnine 47.54 0.69 共同成分 A1 MOL000098 Quercetin 46.43 0.28 注:简称用于Cytocape软件制图。 将药对“川楝子-延胡索”对应靶点基因与Uniprot数据库中对应人类基因进行匹配,筛选后得出川楝子对应靶点164个,延胡索对应靶点961个,共同靶点143个,去重后药对“川楝子-延胡索”对应靶点基因共199个。
2.2 药对“川楝子-延胡索”治疗肝癌的靶点基因
检索肝癌的相关基因共42 992个,经两倍中位数及去重筛选后得出肝癌的相关基因共4340个;其中与药对“川楝子-延胡索”对应靶点基因相交集的基因共162个。
2.3 “药对-成分-靶点”网络
对川楝子、延胡索筛选药物活性成分,交集靶点基因导入至Cytoscape 3.7.1软件中构建“药对-成分-靶点”网络图(附录1)。该网络图中共含有254个节点(包括2味中药、54个化合物、162个潜在靶点基因),1180条边。分析该网络中相关节点的度值可知,中药活性成分中度值最大的是槲皮素(quercetin,A1),其次为(S)-金黄紫堇碱[(S)-Scoulerine,YHS7]、异紫堇杷明碱(Isocorypalmine,YHS46)、刺罂粟碱(stylopine、YHS30)、延胡索乙素(Hyndarin、YHS11),说明该药对在治疗肝癌的过程中发挥主要作用的可能是以上活性成分。
2.4 药对“川楝子-延胡索”治疗肝癌的靶点蛋白相互作用网络
将162个交集靶点基因上传至String数据库以分析蛋白之间的相互作用并构建PPI网络图。此外将该分析数据以TSV格式导出并保存。通过Cytoscape 3.7.1软件将该分析数据进行可视化分析,得出药对“川楝子-延胡索”治疗肝癌的靶点蛋白互作网络图(附录2)。分析数据可知,AKT1靶点蛋白中度值最高(118),其次为IL6(103)、TP53(100)、VEGFA(95)、TNF(90)、CASP3(88)、JUN(88)、MAPK1(88)、MYC(86)、EGFR(83),说明药对在治疗肝癌时以上基因发挥了重要作用。
2.5 药对“川楝子-延胡索”治疗肝癌的靶点基因的GO功能、KEGG信号通路分析
借助Metascape数据库分析162个交集靶点基因,筛选后得出GO富集条目共2606个(P值均 < 0.01),包括2321个生物学进程(BP),主要涉及对有毒物质、无机物、创伤愈合的反应;细胞对有机环状化合物、有机氮化合物及外界刺激的反应;细胞增殖的负调控、细胞死亡的正调控;血管生长发育、凋亡的信号通路等;186个分子功能(MF),主要涉及蛋白激酶结合、蛋白酶结合、磷酸酶结合、氧化还原酶活性、转录因子结合、细胞因子受体结合、蛋白质结构域特异性结合、蛋白质同聚活性、核受体活性、激素受体结合等;99类细胞组成(CC),主要涉及膜筏、质膜蛋白复合物、神经细胞体、转录因子复合物、细胞质核周区、细胞外基质、细胞顶部、黏着连接、溶质液泡、囊泡腔等(图 1)。此外,KEGG分析得出相关信号通路共351条,其中主要涉及癌症通路(Pathways in cancer)、AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、流体剪切应力与动脉粥样硬化(Fluid shear stress and atherosclerosis)、TNF信号通路(TNF signaling pathway)、NF-κB信号通路(NF-kappa B signaling pathway)、结直肠癌(Colorectal cancer)、甲状腺激素信号通路等(图 2)。
3. 讨论
随着网络药理学的发展,许多研究人员采用网络药理学方法分析中药成分、评估药理作用,并通过可视化分析药物分子间的网络关系及相关靶蛋白、通路数据,以探讨中药、方剂发挥疗效的可能分子机制[6-8]。如巩晓杰等[9]通过网络药理学研究薏苡仁治疗肝癌的有效活性成分;欧阳思露等[10]通过网络药理学分析莪术的抗癌机理;李菁等[11]应用网络药理学、分子对接探析四逆散治疗肝癌的潜在分子机制。因此,网络药理学对于中药的药效开发以及预测潜在的作用机制具有重要意义。
药对“川楝子-延胡索”现临床广泛应用于慢性肝炎、肝硬化、胆囊炎等肝胆疾病,此外亦用于癌症的治疗[12]。研究[13-14]表明,通过半仿生提取技术处理金铃子散并将其作用于人宫颈癌HeLa细胞、人肝癌HepG2细胞后,均表达了一定的抗癌作用,且对肝癌细胞作用更为突出;川楝子粗提取物可通过调节人结肠癌细胞SW480、小鼠大肠腺癌细胞CT26的凋亡进程以抑制癌细胞的增殖[15];延胡索粉末对小鼠H22肝癌具有明显抑制作用且与其浓度呈一定依赖性[16]。
此次研究通过网络药理学方法分析药对“川楝子-延胡索”中中药活性成分,构建成分、肝癌靶点相关网络,说明药对治疗肝癌是多个成分、多个靶点共同作用的综合过程。
通过上述分析发现药对中发挥重要作用的成分可能是槲皮素、(S)-金黄紫堇碱、异紫堇杷明碱、刺罂粟碱、延胡索乙素。槲皮素是多种中药的共有成分,也是肿瘤研究的热点成分。槲皮素属于黄酮类药物,其可通过调控细胞生长周期、降低细胞代谢活性、诱导细胞凋亡以抑制肝癌细胞增殖,从而发挥抗肝癌作用[17-20]。(S)-金黄紫堇碱、异紫堇杷明碱、刺罂粟碱、延胡索乙素均属于异喹啉类生物碱,此类生物碱为延胡索中的主要活性成分,药理研究[21-23]表明其具有抗肿瘤、镇静、抗炎等多种作用。在抗肿瘤作用方面,异喹啉类生物碱可发挥明显的抗肝癌效用,其主要机制在于通过不同通路促进肿瘤细胞发生凋亡与自噬,抑制细胞的增殖与侵袭转移,控制肿瘤血管生成[24-25]。
通过药对“川楝子-延胡索”治疗肝癌的靶点蛋白相互作用网络可知该网络关系中的主要作用包括AKT1、IL6、TP53、VEGFA、TNF、CASP3等靶点。分析以上主要发挥治疗肝癌作用的靶点及作用,可将其总结为以下几个方面。(1)炎症相关因子介导肿瘤进程(IL6、TNF):IL6是具有多种效应的的炎症细胞因子,当机体出现急性损伤时呈现高表达状态[26],且参与和调控了肺癌、肝癌等多种恶性肿瘤的发生、发展[27-28]。TNF包括TNFα和TNFβ,是一类能直接杀伤并造成肿瘤细胞死亡的细胞因子。其中TNFα在调控肿瘤的发展进程中具有双向调节作用,既具有抗肿瘤作用亦可促进肿瘤生长,而具体表现为何种作用取决于TNFα的浓度。当TNFα浓度较高时,可刺激其他相关炎症因子的释放、抑制肿瘤血管新生以最大程度发挥抗肿瘤效应;当TNFα浓度较低时可通过NF-κB信号通路诱导肿瘤细胞侵袭、转移发生以发挥促肿瘤作用[29-30]。(2)抑制血管新生:VEGFA属于血管内皮生长因子(VEGF),可升高血管内皮细胞通透性,影响血管内皮细胞增殖、存活、迁移以促进血管生成[31]。肝癌血供丰富,新生血管的生成可直接影响其病程发展与预后,因此降低VEGF的表达、抑制血管生成、改善肝癌微环境可有效控制肝癌的生长、转移[32]。(3)抑制肿瘤细胞增殖、促进肿瘤细胞凋亡(AKT1、TP53、CASP3):AKT1(即AKT)在PI3K/Akt信号通路中发挥重要作用,是通路中的关键因子。研究[33]表明,在多种肿瘤中均可发现PI3K/Akt信号通路对于促进肿瘤细胞的增殖、生长具有调控作用,这与AKT1的磷酸化被异常活化有紧密关系。此外,研究[34]表明该信号通路的活化与肝癌的生长有关,且与肝癌患者临床病理特征密切相关。TP53(即P53)是常见的抑癌基因,可抑制肿瘤细胞生长、诱导细胞凋亡[35]。研究[36]发现P53容易发生突变,人类约50%的癌症均存在P53突变。突变后P53丧失抑癌活性,在肿瘤细胞增殖中起促进作用,且抑制细胞凋亡,从而加速肿瘤发展[37]。CASP3(即Caspase 3)是Caspase家族中重要的一员,该家族在细胞凋亡的执行过程中具有不可或缺的作用[38-39],且Caspase 3的激活也标志着细胞的凋亡必然开始[40-41]。而肿瘤的发生发展与肿瘤细胞的凋亡密切相关,研究[42]表明可通过诱导细胞凋亡从而抑制肝癌细胞的增殖。
GO分子功能阐明药对发挥作用主要与细胞的增殖与凋亡、血管的生长发育有关;KEGG通路分析结果表明药对治疗肝癌过程涉及多个通路,与之相关的通路包括癌症通路、AGE-RAGE信号通路、TNF信号通路、NF-κB信号通路等。多项研究[43-48]表明NF-κB信号通路参与调控肿瘤的增殖、凋亡过程。NF-κB是细胞中的重要转录调节因子,在大多数细胞中,NF-κB表现为静息状态[49]。在炎症等刺激下,上游信号通路活化后可激活NF-κB,而激活后的NF-κB可与对应的靶序列在细胞核内结合并调控基因转录、调节细胞黏附分子等以发挥生物学效应[50-51]。AGE-RAGE信号通路、TNF信号通路均为其上游通路。在AGE-RAGE信号通路中,AGE与其受体RAGE结合后可活化NF-κB信号通路,使NF-κB呈现高表达状态,进而调控其下游基因IL6、TNFα的表达[52]。亦有研究[53-55]表明TNF与TNF受体1结合激活TNF信号通路后,可刺激细胞生长因子的表达以促进肝癌细胞的侵袭,诱导VEGF的表达上调以促进肝癌的血管新生从而加速肝癌的恶化,而此过程NF-κB信号通路具有中心主导作用。通路结果与重要靶点分析相吻合,互相验证了文中靶点、通路治疗肝癌的可能机制。
上述分析说明了药对“川楝子-延胡索”治疗肝癌是多种成分、多个靶点基因与信号通路之间相互影响、共同发挥作用的过程,其治疗过程主要是靶点通过介导相关通路调控肿瘤的增殖、凋亡。

-
表 1 两组患者一般资料比较
Table 1. Comparison of general data between two groups of patients
项目 联合治疗组(n=53) 对照组(n=50) 统计值 P值 性别(例) χ2=0.172 0.679 男 37 33 女 16 17 年龄(岁) 64.59±7.21 65.26±8.35 t=0.437 0.663 肿瘤最大径(cm) 8.39±2.37 8.48±2.10 t=0.204 0.839 Child-Pugh分级(例) χ2=0.006 0.938 A级 41 39 B级 12 11 CNLC分期(例) χ2=0.329 0.566 Ⅱa~Ⅱb期 31 32 Ⅲa~Ⅲb期 22 18 肿瘤个数(例) χ2=0.160 0.689 单发 40 36 多发 13 14 其他综合性抗癌方案(例) 放疗 7 9 χ2=0.397 0.529 化疗 14 15 χ2=0.119 0.731 TACE 7 10 χ2=0.785 0.376 无 29 24 χ2=0.465 0.495 注:TACE,经肝动脉化疗栓塞。 表 2 两组患者T淋巴细胞亚群变化
Table 2. Changes of T lymphocyte subsets in two groups of patients
组别 例数 CD3+ T淋巴细胞百分比(%) CD4+ T淋巴细胞百分比(%) CD8+ T淋巴细胞百分比(%) CD4+/CD8+值 联合治疗组 53 治疗前 41.28±4.47 23.15±2.56 29.38±2.18 0.79±0.16 治疗后 54.92±7.251) 34.95±3.111) 23.42±3.051) 1.50±0.321) t值 11.659 21.326 11.574 14.448 P值 <0.001 <0.001 <0.001 <0.001 对照组 50 治疗前 40.92±4.53 22.97±2.74 30.52±2.33 0.75±0.19 治疗后 40.85±4.11 23.41±2.93 29.74±3.42 0.78±0.22 t值 0.081 0.776 1.333 0.730 P值 0.936 0.440 0.186 0.467 注:1)与同期对照组比较,P<0.05。 表 3 两组患者肝功能及AFP水平比较
Table 3. Comparison of liver function and AFP levels between the two groups of patients
组别 例数 ALT(U/L) AST(U/L) Alb(g/L) AFP(ng/mL) 联合治疗组 53 治疗前 141.84±15.33 156.28±25.63 15.96±3.75 369.48±57.06 治疗后 55.63±10.761) 67.50±13.951) 38.69±7.301) 97.68±21.781) t值 33.510 22.149 20.164 32.398 P值 <0.001 <0.001 <0.001 <0.001 对照组 50 治疗前 143.52±16.46 159.84±28.79 16.15±2.97 379.65±65.34 治疗后 94.52±10.21 108.57±15.62 29.85±4.16 174.53±30.69 t值 17.888 11.068 18.952 20.092 P值 <0.001 <0.001 <0.001 <0.001 注:1)与同期对照组比较,P<0.05。 -
[1] RUMGAY H, ARNOLD M, FERLAY J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040[J]. J Hepatol, 2022, 77( 6): 1598- 1606. DOI: 10.1016/j.jhep.2022.08.021. [2] WANG T, WANG CY, LIU JY, et al. Effectiveness and safety of ultrasound-guided ablation in treatment of primary liver cancer in dangerous areas[J]. J Clin Hepatol, 2021, 37( 7): 1594- 1598. DOI: 10.3969/j.issn.1001-5256.2021.07.023.王婷, 王春妍, 刘建勇, 等. 超声引导下局部消融治疗危险区域原发性肝癌的效果及安全性分析[J]. 临床肝胆病杂志, 2021, 37( 7): 1594- 1598. DOI: 10.3969/j.issn.1001-5256.2021.07.023. [3] MAO B, MA JD, DUAN SB, et al. Preoperative classification of primary and metastatic liver cancer via machine learning-based ultrasound radiomics[J]. Eur Radiol, 2021, 31( 7): 4576- 4586. DOI: 10.1007/s00330-020-07562-6. [4] ZHAI HG, XIAO ZH, YANG SL. Effect of CT-guided cryoablation with Argon-helium cryoablation on hepatic blood flow changes in primary liver cancer[J]. Chin J CT MRI, 2021, 19( 9): 96- 99, 110. DOI: 10.3969/j.issn.1672-5131.2021.09.030.翟焕阁, 肖正红, 杨双林. CT引导下氩氦刀冷冻消融术辅助治疗原发性肝癌对肿瘤组织血流变化的影响[J]. 中国CT和MRI杂志, 2021, 19( 9): 96- 99, 110. DOI: 10.3969/j.issn.1672-5131.2021.09.030. [5] LI X, MA LN, CHENG XZ, et al. Effect and safety of chemotherapy-based PD-1 inhibitors in the treatment of advanced lung adenocarcinoma[J]. J Pract Med, 2021, 37( 3): 365- 368. DOI: 10.3969/j.issn.1006-5725.2021.03.018.李兴, 马丽娜, 程小珍, 等. 基于化疗的PD-1抑制剂在晚期肺腺癌治疗中效果及安全性分析[J]. 实用医学杂志, 2021, 37( 3): 365- 368. DOI: 10.3969/j.issn.1006-5725.2021.03.018. [6] WANG Y, LUO D, LEI M, et al. Effect of silencing PD-1 gene on AAV8-mediated T cell immune response in HBV-infected rats[J]. Chin J Nosocomiology, 2021, 31( 17): 2584- 2588.王燕, 罗丹, 雷敏, 等. 沉默PD-1基因对AAV8介导的HBV感染大鼠T细胞免疫应答的影响[J]. 中华医院感染学杂志, 2021, 31( 17): 2584- 2588. [7] WEYKAMP F, HOEGEN P, REGNERY S, et al. Long-term clinical results of MR-guided stereotactic body radiotherapy of liver metastases[J]. Cancers(Basel), 2023, 15( 10): 2786. DOI: 10.3390/cancers15102786. [8] XU HC, WANG FL, XIE LH. Current status and perspectives in clinical treatment of intermediate and advanced primary hepatocellular carcinoma[J]. J Changchun Univ Chin Med, 2024, 40( 1): 103- 107. DOI: 10.13463/j.cnki.cczyy.2024.01.024.许华晨, 王凤玲, 谢林虎. 中晚期原发性肝细胞癌的临床治疗现状与展望[J]. 长春中医药大学学报, 2024, 40( 1): 103- 107. DOI: 10.13463/j.cnki.cczyy.2024.01.024. [9] LIU Y, ZHENG JX, HAO JL, et al. Global burden of primary liver cancer by five etiologies and global prediction by 2035 based on global burden of disease study 2019[J]. Cancer Med, 2022, 11( 5): 1310- 1323. DOI: 10.1002/cam4.4551. [10] LUO J, LYU CH, YANG YP. Clinical efficacy and safety of percutaneous cryoablation combined with percutaneous ethanol injection in elderly patients with hepatocellular carcinoma aged 70 years or older[J]. J Clin Hepatol, 2022, 38( 2): 365- 371. DOI: 10.3969/j.issn.1001-5256.2022.02.021.罗婧, 吕采红, 杨永平. 经皮冷冻消融联合无水酒精注射治疗70岁以上老年肝细胞癌患者的效果及安全性分析[J]. 临床肝胆病杂志, 2022, 38( 2): 365- 371. DOI: 10.3969/j.issn.1001-5256.2022.02.021. [11] JIN ZQ, LIU YX, LIANG M, et al. Comparison of efficacy and safety between cryoballoon ablation and radiofrequency catheter ablation in the treatment of paroxysmal atrial fibrillation[J]. Clin J Med Offic, 2021, 49( 10): 1079- 1082. DOI: 10.16680/j.1671-3826.2021.10.05.金志清, 刘艳霞, 梁明, 等. 冷冻球囊消融术与射频导管消融术治疗阵发性心房颤动疗效及安全性比较[J]. 临床军医杂志, 2021, 49( 10): 1079- 1082. DOI: 10.16680/j.1671-3826.2021.10.05. [12] MA JB, WANG FM, ZHANG WQ, et al. Percutaneous cryoablation for the treatment of liver cancer at special sites: An assessment of efficacy and safety[J]. Quant Imaging Med Surg, 2019, 9( 12): 1948- 1957. DOI: 10.21037/qims.2019.11.12. [13] DONNE R, LUJAMBIO A. The liver cancer immune microenvironment: Therapeutic implications for hepatocellular carcinoma[J]. Hepatology, 2023, 77( 5): 1773- 1796. DOI: 10.1002/hep.32740. [14] MERELLI B, MASSI D, CATTANEO L, et al. Targeting the PD1/PD-L1 axis in melanoma: Biological rationale, clinical challenges and opportunities[J]. Crit Rev Oncol Hematol, 2014, 89( 1): 140- 165. DOI: 10.1016/j.critrevonc.2013.08.002. [15] HEINRICH S, CRAIG AJ, MA LC, et al. Understanding tumour cell heterogeneity and its implication for immunotherapy in liver cancer using single-cell analysis[J]. J Hepatol, 2021, 74( 3): 700- 715. DOI: 10.1016/j.jhep.2020.11.036. [16] FREEMAN GJ, LONG AJ, IWAI Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation[J]. J Exp Med, 2000, 192( 7): 1027- 1034. DOI: 10.1084/jem.192.7.1027. [17] TOPALIAN SL, HODI FS, BRAHMER JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366( 26): 2443- 2454. DOI: 10.1056/nejmoa1200690. [18] FINN RS, ZHU AX. Evolution of systemic therapy for hepatocellular carcinoma[J]. Hepatology, 2021, 73( Suppl 1): 150- 157. DOI: 10.1002/hep.31306. [19] CHEN EB, YI J, JIANG J, et al. Identification and validation of a fatty acid metabolism-related lncRNA signature as a predictor for prognosis and immunotherapy in patients with liver cancer[J]. BMC Cancer, 2022, 22( 1): 1037. DOI: 10.1186/s12885-022-10122-4. [20] LAI FT. Clinical efficacy and safety of carrizumab in the treatment of advanced primary liver cancer[J]. Shanxi Med J, 2021, 50( 15): 2269- 2272.赖奉庭. 卡瑞利珠单抗治疗晚期原发性肝癌临床效果及安全性研究[J]. 山西医药杂志, 2021, 50( 15): 2269- 2272. [21] LEE YY, LUO SC, LEE CH, et al. Optimizing tumor-associated antigen-stimulated autologous dendritic cell and cytokine-induced killer cell coculture to enhance cytotoxicity for cancer immunotherapy in manufacturing[J]. BMC Immunol, 2023, 24( 1): 14. DOI: 10.1186/s12865-023-00552-5. 期刊类型引用(2)
1. 唐侨,李保华. 自拟调肝活血化瘀方对脾虚血瘀型酒精性肝硬化(代偿期)患者中医证候评分及内毒素水平的影响. 四川中医. 2023(09): 119-123 .  百度学术
百度学术2. 顾知恩,王磊. 基于“营卫理论”浅谈昼夜节律与恶性肿瘤之间的关系. 吉林中医药. 2023(11): 1256-1261 .  百度学术
百度学术其他类型引用(3)
-




 PDF下载 ( 883 KB)
PDF下载 ( 883 KB)

 下载:
下载:


 下载:
下载:
 百度学术
百度学术



