经皮经肝胃冠状静脉栓塞术单独或联合部分脾动脉栓塞术治疗肝硬化门静脉高压出血效果比较的Meta分析
DOI: 10.12449/JCH240116
Efficacy of percutaneous transhepatic variceal embolization alone or in combination with partial splenic embolization in treatment of portal hypertensive hemorrhage in liver cirrhosis: A Meta-analysis
-
摘要:
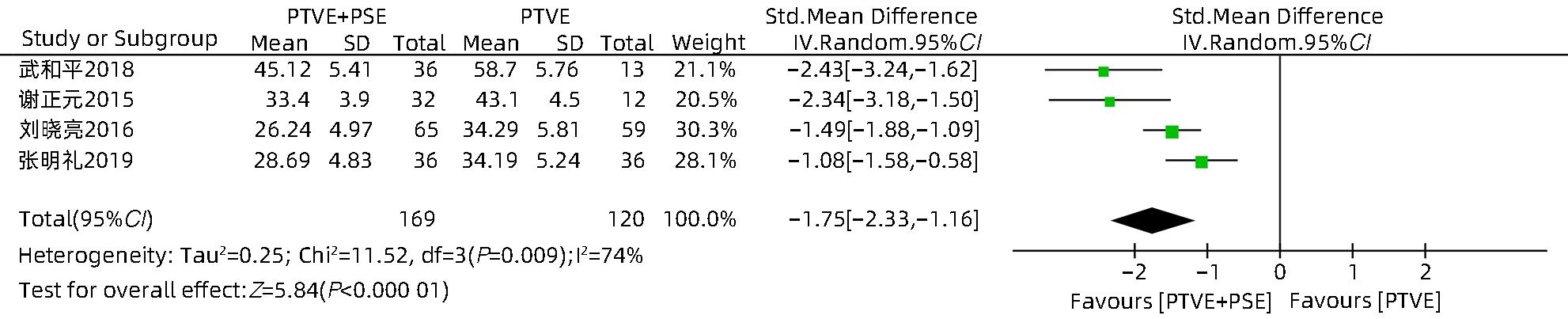
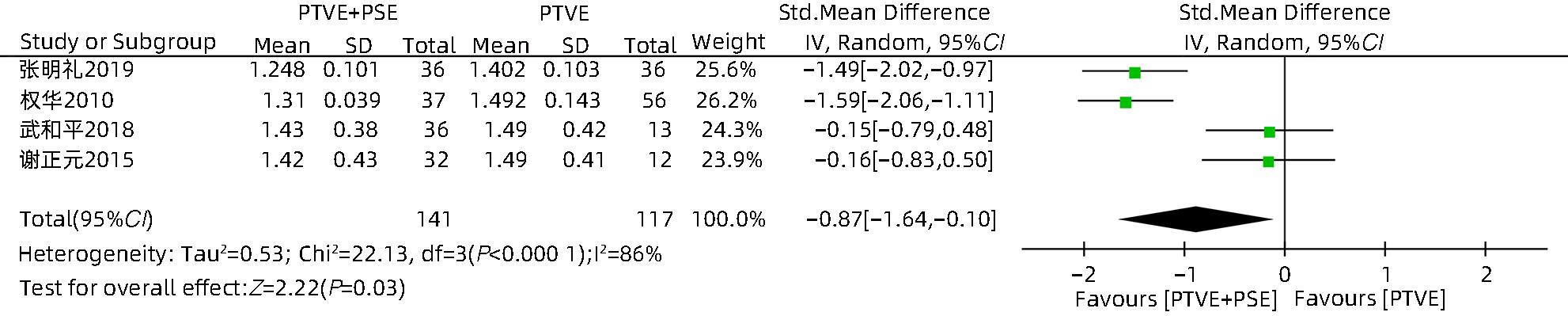
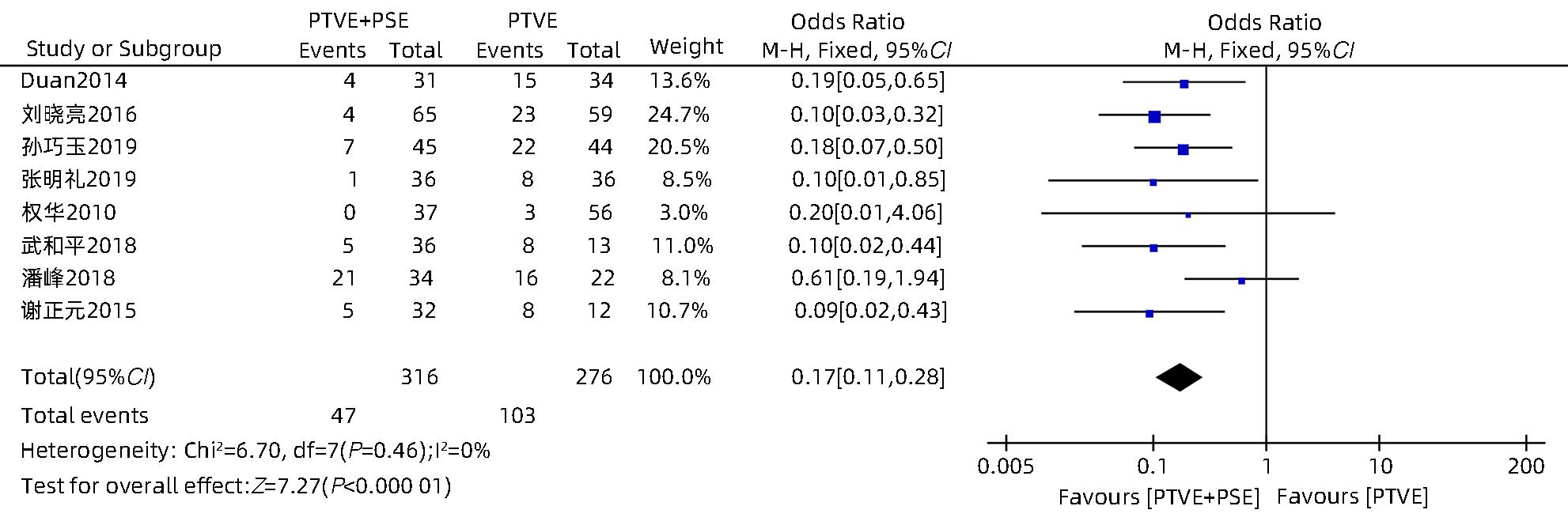
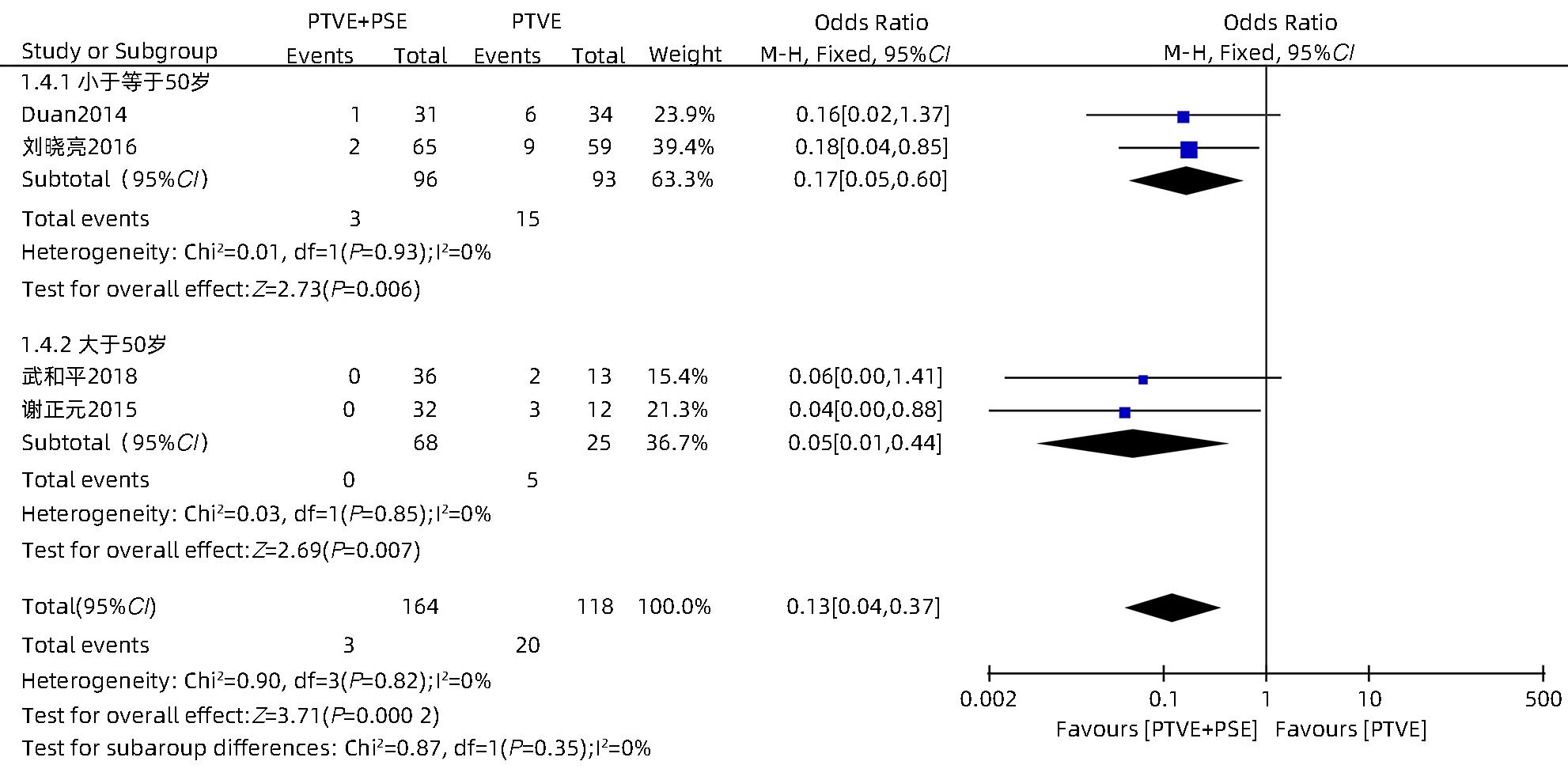
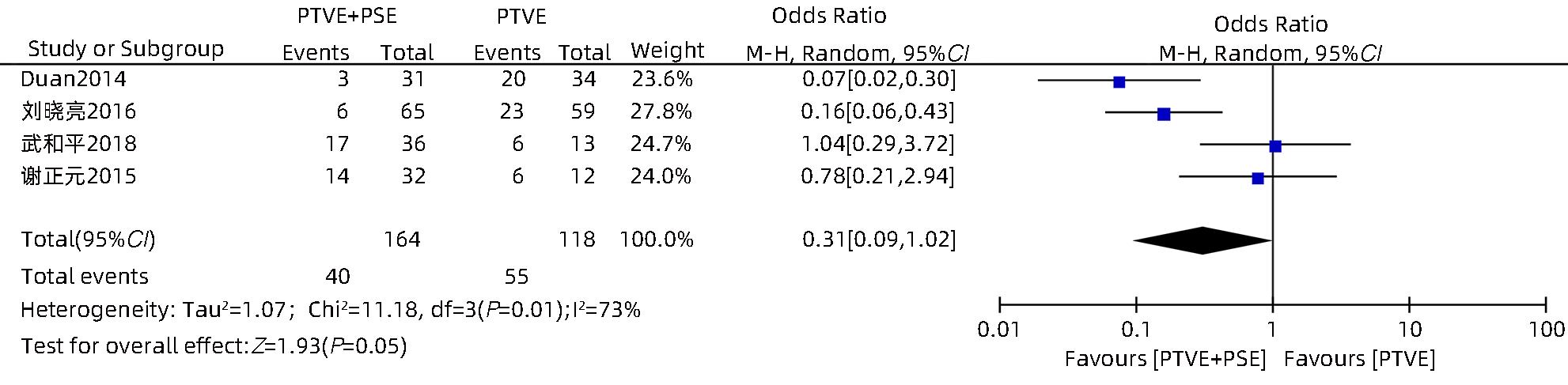
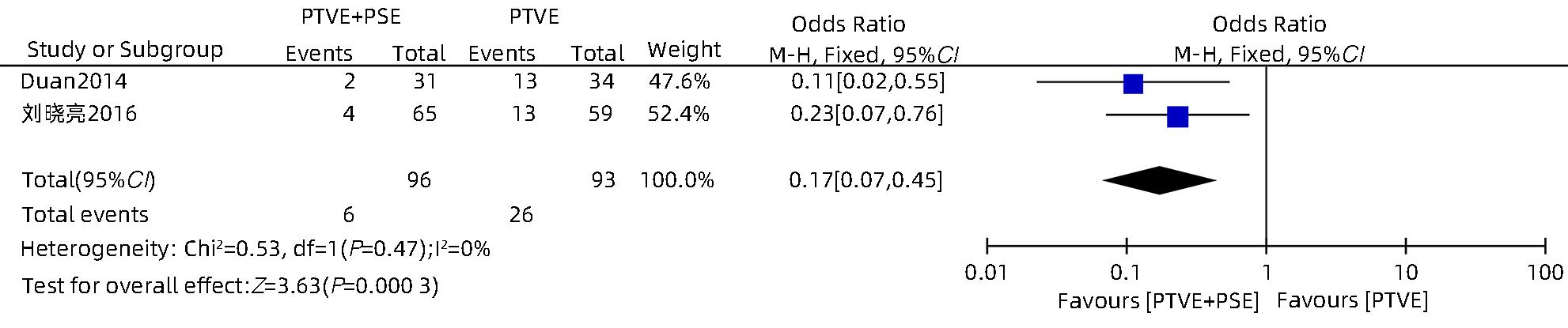
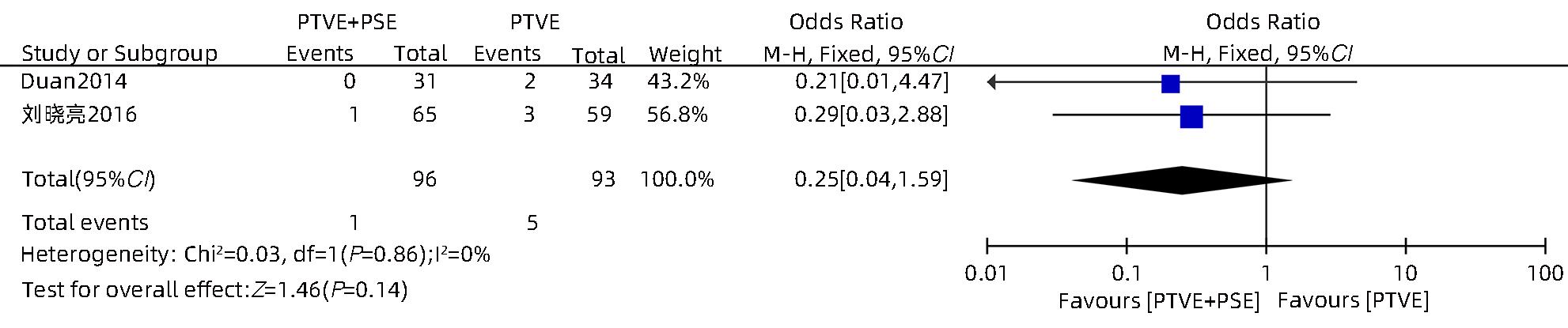
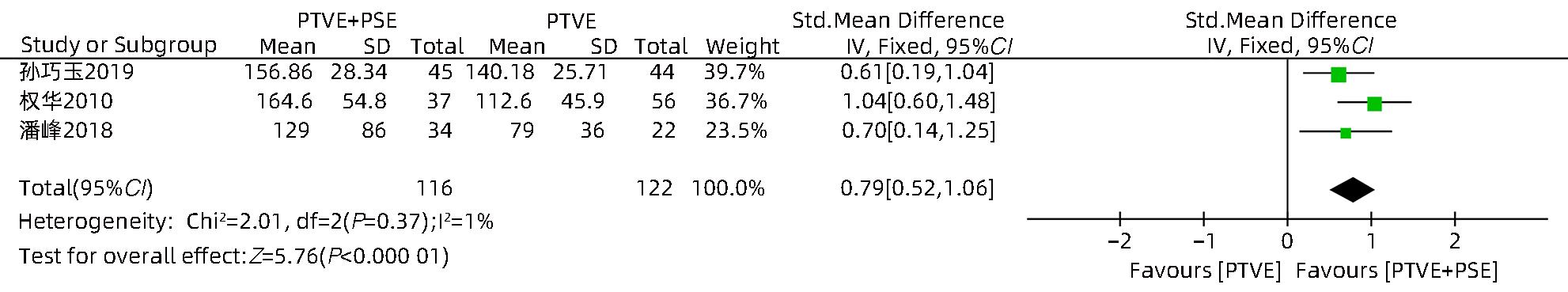
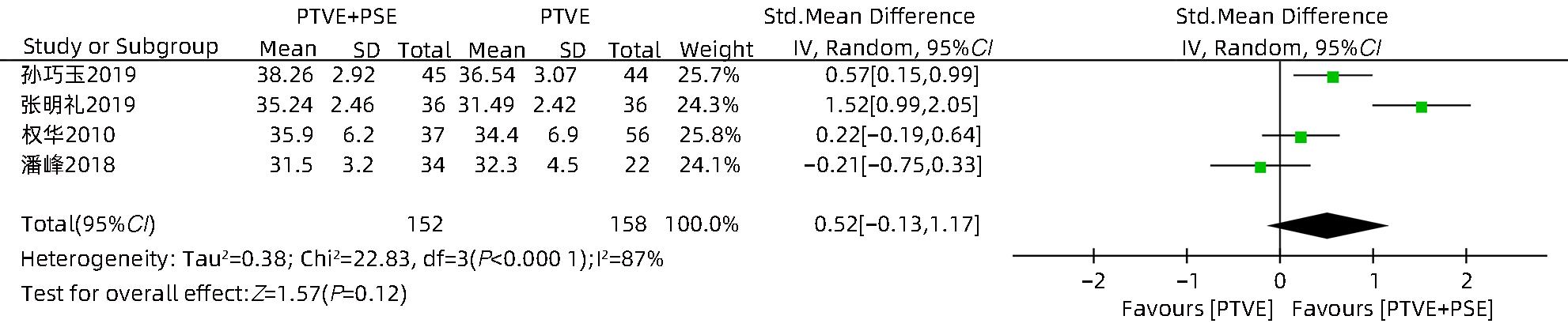
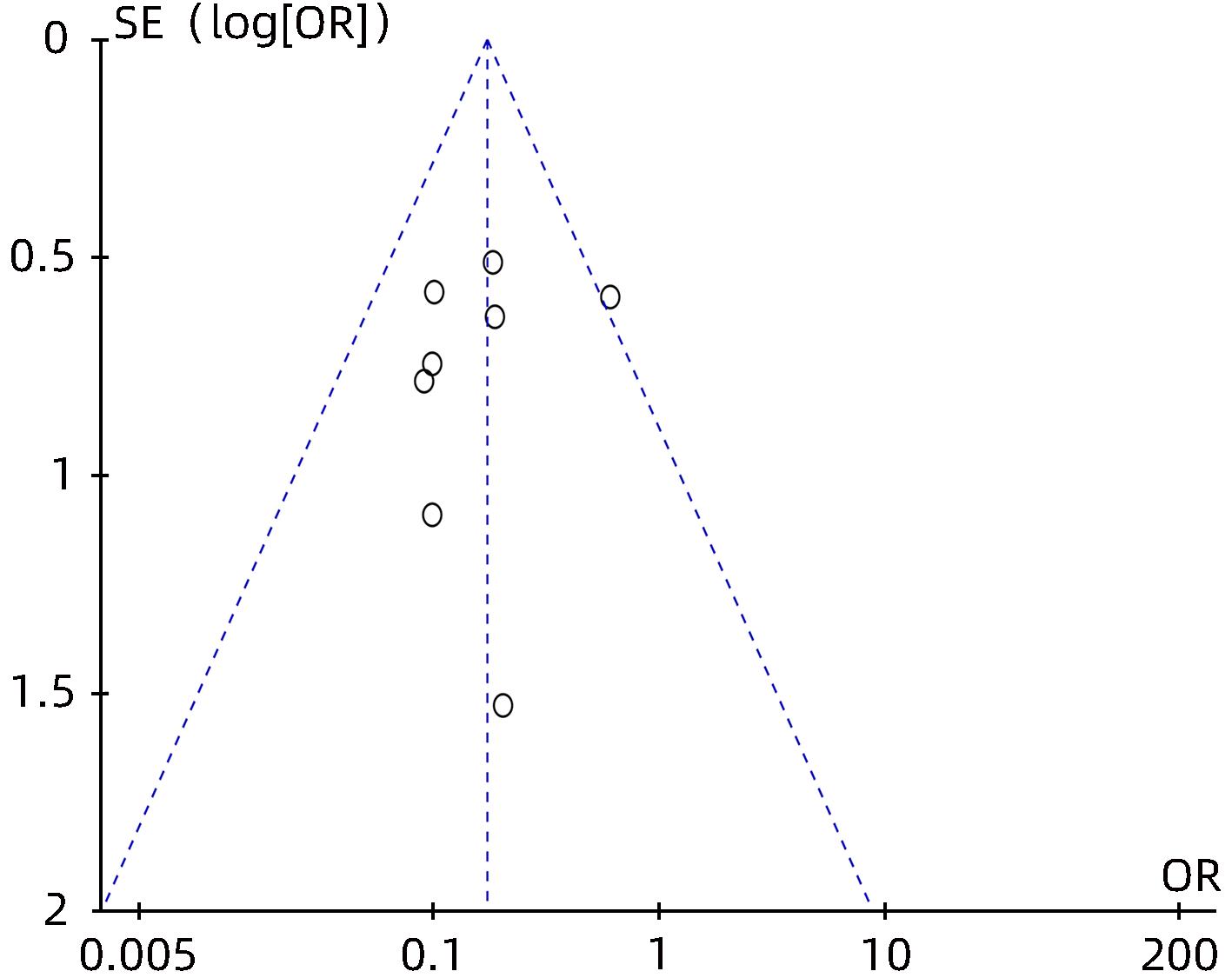
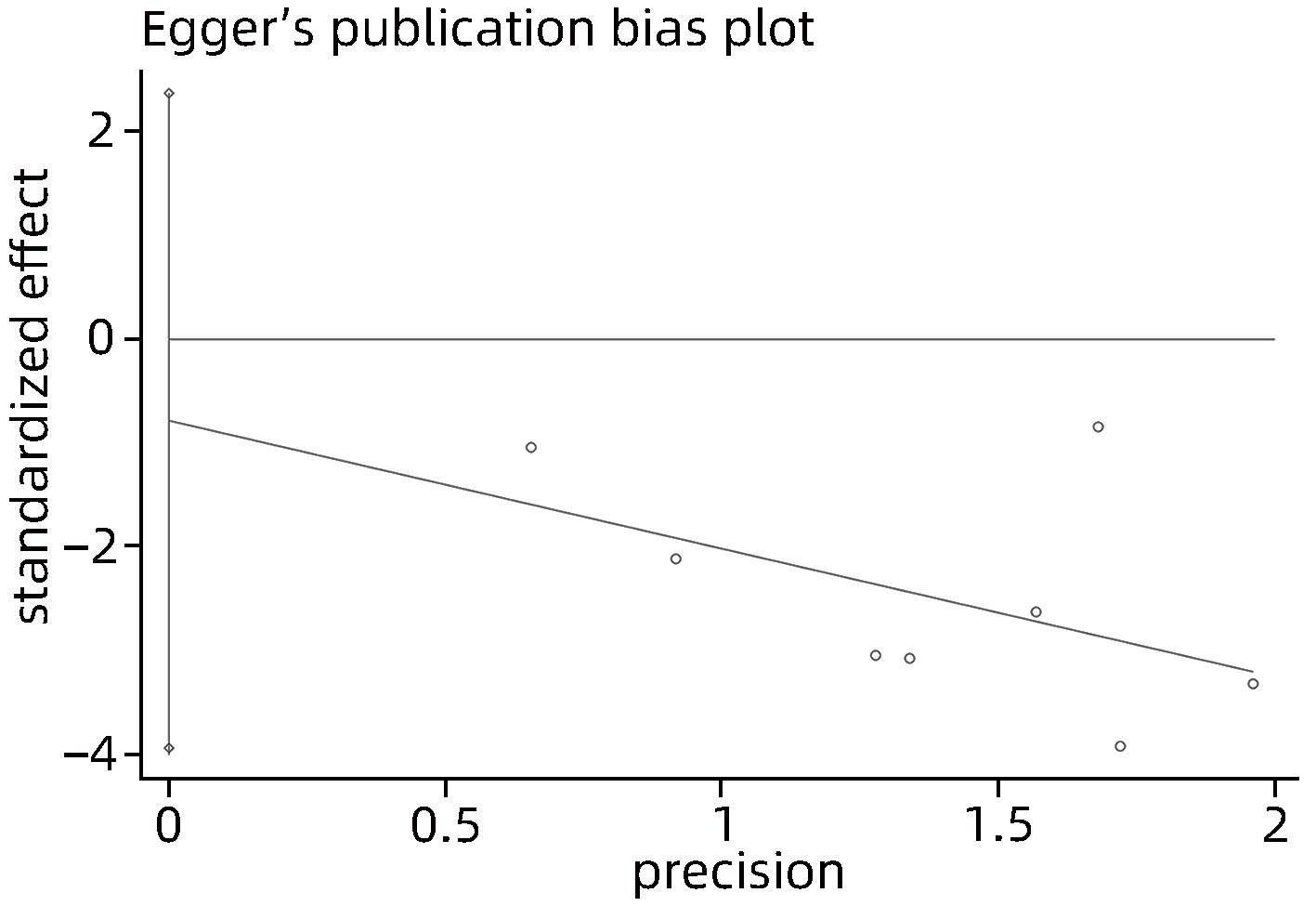
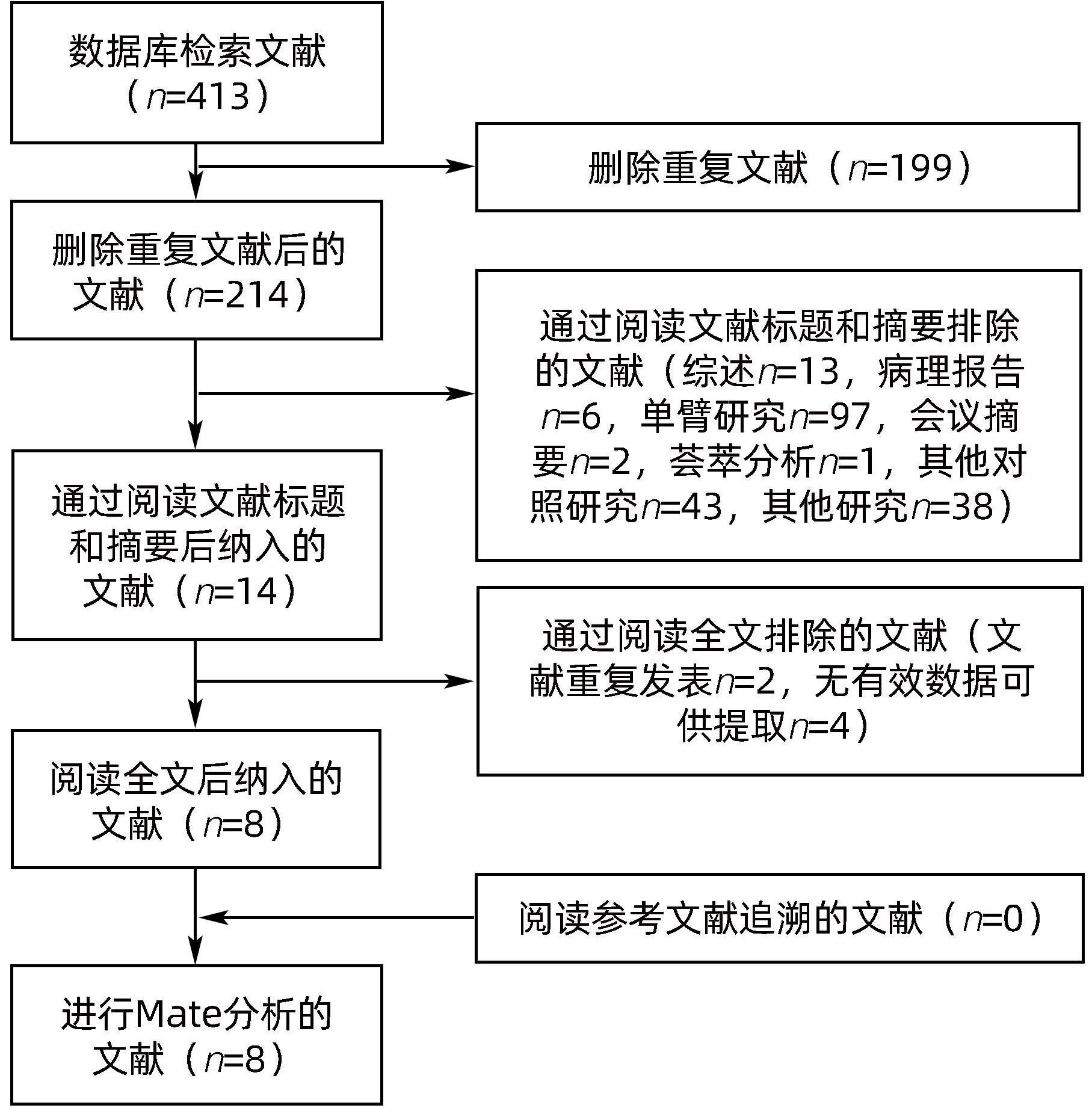
目的 采用Meta分析对比经皮经肝胃冠状静脉栓塞术(PTVE)联合部分脾动脉栓塞术(PSE)与单独PTVE治疗肝硬化门静脉高压出血的疗效。 方法 本研究根据PRISMA指南完成,PROSPERO注册号:CRD42023396690。检索万方医学网、中国知网、中国生物医学文献数据库、维普数据库、PubMed、Embase、Cochrane Library、Web of Science自建库至2022年12月23日有关对比PTVE联合PSE与单独PTVE两种手术方式治疗肝硬化门静脉高压出血的相关文献;依据纳入及排除标准筛选文献,并提取相关数据,采用RevMan 5.4.1统计分析软件进行Meta分析。 结果 最终纳入文献8篇,总样本量为592例,包括PTVE联合PSE组316例,单独PTVE组276例。Meta分析结果显示,PTVE联合PSE组术后门静脉压力(SMD=-1.75,95%CI:-2.33~-1.16,P<0.05)、术后门静脉内径(SMD=-0.87,95%CI:-1.64~-0.10,P<0.05)、术后再出血率(OR=0.17,95%CI:0.11~0.28,P<0.05)、病死率(OR=0.13,95%CI:0.04~0.37,P<0.05)、术后门静脉高压性胃肠病发生率(OR=0.17,95%CI:0.07~0.45,P<0.05)均低于单独PTVE组;术后血小板水平(SMD=0.79,95%CI:0.52~1.06,P<0.05)高于单独PTVE组。 结论 PTVE联合PSE较单独PTVE可有效降低肝硬化门静脉高压再出血率、病死率、门静脉高压性胃肠病发生率、门静脉压力,缩短门静脉内径,提高血小板水平,是治疗肝硬化门静脉高压出血的有效介入手段。 Abstract:Objective To investigate the efficacy of percutaneous transhepatic variceal embolization (PTVE) alone or in combination with partial splenic embolization (PSE) in the treatment of portal hypertensive hemorrhage in liver cirrhosis through a meta-analysis. Methods This study was conducted according to PRISMA guideline, with a PROSPERO registration number of CRD42023396690. Wanfang Med Online, CNKI, CBM, VIP Databases, PubMed, Embase, the Cochrane Library, and Web of Science databases were searched for articles on PTVE alone or in combination with PSE in the treatment of portal hypertensive hemorrhage in liver cirrhosis published up to December 23, 2022. The articles were selected based on inclusion and exclusion criteria, and related data were extracted. The RevMan 5.4.1 statistical analysis software was used to perform the meta-analysis. Results Eight articles were finally included, with a total sample size of 592 cases, among which there were 316 cases in the PTVE+PSE group and 276 cases in the PTVE group. The meta-analysis showed that compared with the PTVE group, the PTVE+PSE group had significantly lower postoperative portal vein pressure (standardized mean difference [SMD]=-1.75, 95% confidence interval [CI]: -2.33 to -1.16, P<0.05), postoperative diameter of the portal vein (SMD=-0.87, 95%CI: -1.64 to -0.10, P<0.05), postoperative rebleeding rate (odds ratio [OR]=0.17, 95%CI: 0.11 — 0.28, P<0.05), mortality rate (OR=0.13, 95%CI: 0.04 — 0.37, P<0.05), and incidence rate of postoperative portal hypertensive gastrointestinal disease (OR=0.17, 95%CI: 0.07 — 0.45, P<0.05], as well as a significantly higher postoperative platelet level (SMD=0.79, 95%CI: 0.52 — 1.06, P<0.05), while there were no significant differences between the two groups in the incidence rates of postoperative ascites. Conclusion Compared with PTVE alone, PTVE combined with PSE can effectively reduce the rebleeding rate and mortality rate of portal hypertensive hemorrhage in liver cirrhosis, the incidence rate of portal hypertensive gastrointestinal disease, and portal vein pressure, and it can also shorten the diameter of the portal vein and increase platelet level. Therefore, it is an effective interventional method for the treatment of portal hypertension hemorrhage in liver cirrhosis. -
Key words:
- Liver Cirrhosis /
- Hypertension, Portal /
- Hemorrhage /
- Treatment Outcome /
- Meta-Analysis
-
表 1 8篇纳入文献的基本特征及质量评价
Table 1. Basic characteristics and quality evaluation of 8 included literature
第一作者 发表 年份 研究类型 组别 样本量(例) 男/女(例) 年龄(岁) 肝功能Child-Pugh分级(A/B/C,例) 随访时间(月) 文献质量 权华[9] 2010 随机对照 PTVE+PSE组 PTVE组 37 56 62/31 18~67 47/36/10 48~69 中等 Duan[16] 2014 回顾性 PTVE+PSE组 PTVE组 31 34 21/10 23/11 40.1±10.9 39.7±9.9 4/21/6 6/23/5 6~24 高 谢正元[15] 2015 回顾性 PTVE+PSE组 PTVE组 32 12 25/7 10/2 52.1±10.2 50.5±10.0 4/25/3 2/9/1 6 中等 刘晓亮[12] 2016 回顾性 PTVE+PSE组 PTVE组 65 59 79/45 41.8±5.7 21/78/25 6~18 中等 潘峰[13] 2018 回顾性 PTVE+PSE组 PTVE组 34 22 23/11 14/8 58.0±14.0 51.0±19.0 31/17/8 3~24 高 武和平[14] 2018 回顾性 PTVE+PSE组 PTVE组 36 13 21/15 8/5 52.35±5.24 50.65±5.21 6/25/5 3/10/0 6 中等 张明礼[10] 2019 随机对照 PTVE+PSE组 PTVE组 36 36 28/8 27/9 47.75±4.01 47.72±3.93 0/25/11 0/22/14 中等 孙巧玉[11] 2019 随机对照 PTVE+PSE组 PTVE组 45 44 29/16 30/14 66.32±10.71 64.25±9.84 12/24/9 12/25/7 3~12 中等 -
[1] DING HG, XU XY, LINGHU EQ, et al. Interpretation of guidelines for the diagnosis and treatment of esophageal and gastric variceal bleeding in cirrhotic portal hypertension[J]. J Clin Hepatol, 2016, 32( 2): 220- 222. DOI: 10.3969/j.issn.1001-5256.2016.02.003.丁惠国, 徐小元, 令狐恩强, 等.《肝硬化门静脉高压食管胃静脉曲张出血的防治指南》解读[J]. 临床肝胆病杂志, 2016, 32( 2): 220- 222. DOI: 10.3969/j.issn.1001-5256.2016.02.003. [2] WANG J, TIAN XG, LI Y, et al. Comparison of modified percutaneous transhepatic variceal embolization and endoscopic cyanoacrylate injection for gastric variceal rebleeding[J]. World J Gastroenterol, 2013, 19( 5): 706- 714. DOI: 10.3748/wjg.v19.i5.706. [3] CHEN X, LI JH, XU JR, et al. Percutaneous transhepatic variceal embolization combined with partial splenic embolization for treatment of esophagogastric variceal bleeding in patients with liver cirrhosis[J]. Chin J Gastroenterol, 2016, 21( 4): 197- 201. DOI: 10.3969/j.issn.1008-7125.2016.04.002.陈翔, 李金辉, 许建荣, 等. 经皮经肝食管胃底曲张静脉栓塞术联合部分脾栓塞术治疗肝硬化食管胃底静脉曲张破裂出血疗效观察[J]. 胃肠病学, 2016, 21( 4): 197- 201. DOI: 10.3969/j.issn.1008-7125.2016.04.002. [4] FENG K, ZHANG CQ, LIU FL, et al. Double embolization and pericardial devascularization with splenectomy in the treatment of portal hypertension: A comparative study[J]. J Shandong Univ Heath Sci, 2007, 45( 7): 677- 680. DOI: 10.3969/j.issn.1671-7554.2007.07.008.冯凯, 张春清, 刘福利, 等. 门脉高压症的双介入栓塞术与外科断流加脾切除疗效对比研究[J]. 山东大学学报(医学版), 2007, 45( 7): 677- 680. DOI: 10.3969/j.issn.1671-7554.2007.07.008. [5] ZHANG M, ZHUGE YZ. Selection and application of interventional therapy methods for esophageal and gastric variceal bleeding[J]. Chin J Dig Endosc, 2022, 39( 5): 358- 361. DOI: 10.3760/cma.j.cn321463-20210811-00495.张明, 诸葛宇征. 介入治疗在食管胃静脉曲张破裂出血中的选择与运用[J]. 中华消化内镜杂志, 2022, 39( 5): 358- 361. DOI: 10.3760/cma.j.cn321463-20210811-00495. [6] ZHANG CQ, LIU FL, LIANG B, et al. A modified percutaneous transhepatic varices embolization with 2-octyl cyanoacrylate in the treatment of bleeding esophageal varices[J]. J Clin Gastroenterol, 2009, 43( 5): 463- 469. DOI: 10.1097/MCG.0b013e31817ff90f. [7] ZHANG CQ, LIU FL, LIANG B, et al. A modified percutaneous transhepatic variceal embolization with 2-octyl cyanoacrylate versus endoscopic ligation in esophageal variceal bleeding management: Randomized controlled trial[J]. Dig Dis Sci, 2008, 53( 8): 2258- 2267. DOI: 10.1007/s10620-007-0106-9. [8] YU CH, HUANG CC, ZHANG ZS. Effect of partial splenic embolization in prevention of gastroesophageal variceal rebleeding[J]. J First Mil Med Univ, 2010, 30( 5): 1138- 1140, 1143. DOI: 10.12122/j.issn.1673-4254.2010.05.061.于长辉, 黄纯炽, 张振书. 部分脾动脉栓塞术预防肝硬化食管胃底静脉曲张再出血的临床评价[J]. 南方医科大学学报, 2010, 30( 5): 1138- 1140, 1143. DOI: 10.12122/j.issn.1673-4254.2010.05.061. [9] QUAN H, QUAN QZ, XIE ZG, et al. The long-term outcomes of embolization of coronary gastric veins and short gastric veins combined with PSE in the management of related varices and hypersplenism[J]. Pract J Med Pharm, 2010, 27( 10): 865- 868. DOI: 10.14172/j.cnki.issn1671-4008.2010.10.028.权华, 权启镇, 谢宗贵, 等. 胃冠状及胃短静脉加脾动脉栓塞治疗相关门静脉高压症的长期疗效[J]. 实用医药杂志, 2010, 27( 10): 865- 868. DOI: 10.14172/j.cnki.issn1671-4008.2010.10.028. [10] ZHANG ML. Observation on PTVE combined with PSE in the treatment of portal hypertension complicated with upper gastrointestinal bleeding in liver cirrhosis[J]. Pract Clin J Integr Tradit Chin West Med, 2019, 19( 5): 24- 26. DOI: 10.13638/j.issn.1671-4040.2019.05.012.张明礼. PTVE联合PSE治疗肝硬化门脉高压并上消化道出血的观察[J]. 实用中西医结合临床, 2019, 19( 5): 24- 26. DOI: 10.13638/j.issn.1671-4040.2019.05.012. [11] SUN QY, LAI XZ, HE YY. Analysis of the effect of PTVE combined with PSE on portal hypertension complicated with upper gastrointestinal hemorrhage[J]. Mod Dig Interv, 2019, 24( 8): 837- 841, 846. DOI: 10.3969/j.issn.1672-2159.2019.08.005.孙巧玉, 赖雪珍, 河源媛. 门脉高压合并上消化道出血采用PTVE联合PSE手术的效果分析[J]. 现代消化及介入诊疗, 2019, 24( 8): 837- 841, 846. DOI: 10.3969/j.issn.1672-2159.2019.08.005. [12] LIU XL. Effect of percutaneous transhepatic variceal embolization and partial splenic embolization on acute gastrointestinal hematorrhea caused by portal hypertension[J]. Chin Hepatol, 2016, 21( 7): 532- 535. DOI: 10.14000/j.cnki.issn.1008-1704.2016.07.003.刘晓亮. 急诊PTVE-PSE治疗门静脉高压症导致的急性消化道大出血的效果观察[J]. 肝脏, 2016, 21( 7): 532- 535. DOI: 10.14000/j.cnki.issn.1008-1704.2016.07.003. [13] PAN F, ZHOU GF, LIANG B, et al. Percutaneous transhepatic variceal embolization or together with partial splenic embolization for acute esophagogastric bleeding due to rupture of varicose veins: A clinical observation[J]. J Interv Radiol, 2018, 27( 4): 316- 321. DOI: 10.3969/j.issn.1008-794X.2018.04.007.潘峰, 周国锋, 梁斌, 等. 经皮肝穿刺胃曲张静脉栓塞术联合或不联合部分脾动脉栓塞术治疗急性食管胃底曲张静脉破裂出血临床观察[J]. 介入放射学杂志, 2018, 27( 4): 316- 321. DOI: 10.3969/j.issn.1008-794X.2018.04.007. [14] WU HP. Clinical observation of gastric coronary vein embolization by different interventional approaches in the treatment of portal hypertension bleeding due to liver cirrhosis[J]. Mod Dig Interv, 2018, 23( 2): 208- 210. DOI: 10.3969/j.issn.1672-2159.2018.02.024.武和平. 不同介入途径胃冠状静脉栓塞术治疗肝硬化门静脉高压出血的临床疗效观察[J]. 现代消化及介入诊疗, 2018, 23( 2): 208- 210. DOI: 10.3969/j.issn.1672-2159.2018.02.024. [15] XIE ZY, LYU K, XIONG K, et al. Comparison of therapeutic effects of gastric coronary vein embolization with different interventional approaches in the treatment of portal hypertension bleeding due to liver cirrhosis[J]. Guangdong Med J, 2015, 36( 3): 407- 410. DOI: 10.13820/j.cnki.gdyx.2015.03.023.谢正元, 吕珂, 熊恺, 等. 不同介入途径胃冠状静脉栓塞术治疗肝硬化门静脉高压出血的效果比较[J]. 广东医学, 2015, 36( 3): 407- 410. DOI: 10.13820/j.cnki.gdyx.2015.03.023. [16] DUAN XH, ZHANG K, HAN XW, et al. Comparison of percutaneous transhepatic variceal embolization(PTVE) followed by partial splenic embolization versus PTVE alone for the treatment of acute esophagogastric variceal massive hemorrhage[J]. J Vasc Interv Radiol, 2014, 25( 12): 1858- 1865. DOI: 10.1016/j.jvir.2014.08.019. [17] DUAN XH, HAN XW, REN JZ, et al. Percutaneous transhepatic variceal embolization followed with partial splenic embolization for the acute variceal massive hemorrhage in cirrhosis[J]. Chin J Hepatol, 2015, 23( 5): 372- 375. DOI: 10.3760/cma.j.issn.1007-3418.2015.05.011.段旭华, 韩新巍, 任建庄, 等. 经皮胃冠状静脉栓塞术序贯脾栓塞治疗肝硬化消化道大出血的疗效观察[J]. 中华肝脏病杂志, 2015, 23( 5): 372- 375. DOI: 10.3760/cma.j.issn.1007-3418.2015.05.011. [18] YANG JH, WU BY, LI JB, et al. Emergency PTVE treatment of liver cirrhosis complicated with esophageal and gastric varices bleeding[J]. J Ptact Hepatol, 2013, 16( 6): 548- 549. DOI: 10.3969/j.issn.1672-5069.2013.06.025.杨卷红, 吴博云, 李金保, 等. 急诊PTVE治疗肝硬化并发食管胃底静脉曲张破裂出血[J]. 实用肝脏病杂志, 2013, 16( 6): 548- 549. DOI: 10.3969/j.issn.1672-5069.2013.06.025. [19] YU P, WANG ZY, YANG YP, et al. Study on the effect of interventional portal devascularization on hemodynamics in patients with liver cirrhosis and portal hypertension[J]. J Clin Exp Med, 2015, 14( 18): 1534- 1536. DOI: 10.3969/j.issn.1671-4695.2015.18.018.于平, 王哲影, 杨艳萍, 等. 介入性门脉断流术对肝硬化门脉高压症患者血流动力学的影响[J]. 临床和实验医学杂志, 2015, 14( 18): 1534- 1536. DOI: 10.3969/j.issn.1671-4695.2015.18.018. [20] LI ZR, SHAN H, ZHU KS, et al. Clinical quantitative study of therapeutic effect of partial splenic embolization(PSE) on portal vein hemodynamics[J]. Chin J Radiol, 2002, 36( 10): 913- 917. DOI: 10.3760/j.issn: 1005-1201.2002.10.013.李征然, 单鸿, 朱康顺, 等. 部分性脾栓塞术改变门脉血流动力学的定量研究[J]. 中华放射学杂志, 2002, 36( 10): 913- 917. DOI: 10.3760/j.issn: 1005-1201.2002.10.013. [21] DUAN LW, SUN H, CHEN YS, et al. Hemodynamic effects of partial splenic artery embolization in patients with liver cirrhosis and portal hypertension[J]. J Clin Hepatol, 2013, 29( 2): 142- 145. DOI: 10.3969/j.issn.1001-5256.2013.02.018.段立伟, 孙寒, 陈永胜, 等. 部分脾动脉栓塞术对肝硬化门静脉高压症血流动力学的影响[J]. 临床肝胆病杂志, 2013, 29( 2): 142- 145. DOI: 10.3969/j.issn.1001-5256.2013.02.018. [22] QIN ZY, CHENG CS. Correlation between direct measurement of portal venous pressure and esophageal gastric varices and degrees of portal venous expansion[J]. J Chengdu Med Coll, 2013, 8( 5): 620- 621. DOI: 10.3969/j.issn.1674-2257.2013.05.034.覃祖云, 程昌盛. 门静脉压力的直接测量与食管胃底静脉曲张及门静脉扩张程度的相关性[J]. 成都医学院学报, 2013, 8( 5): 620- 621. DOI: 10.3969/j.issn.1674-2257.2013.05.034. [23] LI XQ, WANG YB, GONG JP, et al. Partial splenic embolization in treatment of hypersplenism secondary to liver cirrhosis: Meta-analysis[J]. Chin J Interv Imag Ther, 2018, 15( 3): 160- 166. DOI: 10.13929/j.1672-8475.201704001.李学强, 王运兵, 龚建平, 等. 部分脾动脉栓塞治疗肝硬化继发脾功能亢进的Meta分析[J]. 中国介入影像与治疗学, 2018, 15( 3): 160- 166. DOI: 10.13929/j.1672-8475.201704001. [24] GUO WW, CHENG CS, YANG HF, et al. Efficacy of percutaneous gastric coronary vein embolization combined with splenic artery closure in the treatment of patients with liver cirrhosis complicated with splenic artery steal syndrome[J]. J Pract Hepatol, 2017, 20( 6): 775- 776. DOI: 10.3969/j.issn.1672-5069.2017.06.039.郭稳稳, 程昌盛, 杨红芳, 等. 经皮胃冠状静脉栓塞术联合脾动脉主干截流术治疗肝硬化盗血综合征临床研究[J]. 实用肝脏病杂志, 2017, 20( 6): 775- 776. DOI: 10.3969/j.issn.1672-5069.2017.06.039. -



 PDF下载 ( 1357 KB)
PDF下载 ( 1357 KB)

 下载:
下载: