肝癌类器官的研究进展
DOI: 10.12449/JCH240730
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:赵丽负责选题,总结文献,撰写文章;郭梓琪负责查阅文献,修改论文;杨勇、杨宏新负责校正并最后定稿。
-
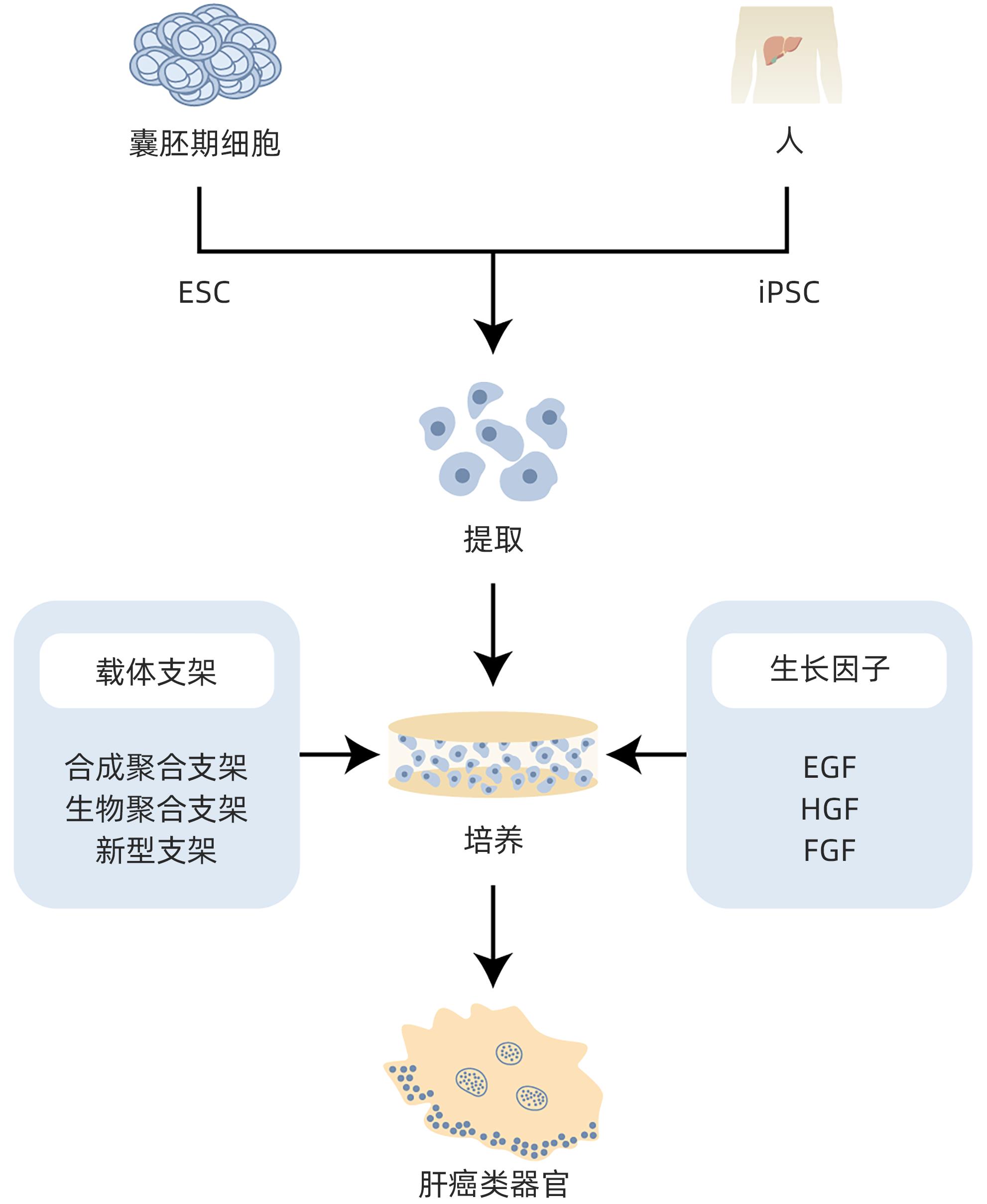
摘要: 类器官是一种由干细胞或恶性肿瘤自我组装形成并用于临床研究的新型疾病模型,类似于体内的组织与器官,且具有部分功能的3D细胞结构。传统的肝癌模型有两种:一是通过诱导构建动物肝癌模型,即体内模型;二是在体外通过相应细胞系进行细胞学实验研究。类器官集合了传统模型的优点,在肿瘤研究方面具有独特的优势。传统模型由于不能真实反映细胞微环境,常导致与临床研究结果不一致,而新型研究模型的出现,为肝癌研究提供了一个新的方向。本文对肝癌类器官的研究进展进行综述,旨在为今后肝癌研究提供全新的视角。Abstract: Organoids are a novel disease model that is self-assembled from stem cells or malignant tumors and is used in clinical research. They are similar to tissues and organs in the body and have partially functional 3D cell structures. There are two types of traditional models for liver cancer research, i.e., in vivo models (animal models of liver cancer established by induction) and in vitro cell experiments using corresponding cell lines. Organoids have the advantages of the two types of traditional models and show unique advantages in tumor research. Traditional models cannot fully reflect the microenvironment of cells, which often leads to the inconsistency with clinical research findings, and the emergence of new research models provides a new direction for the research on liver cancer. This article reviews the research advances in liver cancer organoids, in order to provide a new perspective for future research on liver cancer.
-
Key words:
- Liver Neoplasms /
- Organoids /
- Cell Culture Techniques
-
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68( 6): 394- 424. DOI: 10.3322/caac.21492. [2] RUMGAY H, ARNOLD M, FERLAY J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040[J]. J Hepatol, 2022, 77( 6): 1598- 1606. DOI: 10.1016/j.jhep.2022.08.021. [3] SUN M, SHANG PY, BAI JT, et al. High-intensity focused ultrasound ablation combined with transcatheter arterial chemoembolization improves long-term efficacy and prognosis of primary liver cancer[J]. J Clin Lab Anal, 2021, 35( 2): e23633. DOI: 10.1002/jcla.23633. [4] SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71( 3): 209- 249. DOI: 10.3322/caac.21660. [5] ZONG JJ, QING X, FAN Z, et al. Progress in the treatment of primary liver cancer[J]. J Southeast Univ(Med Sci Edi), 2021, 40( 4): 542- 547. DOI: 10.3969/j.issn.1671-6264.2021.04.021.宗静静, 卿鑫, 樊哲, 等. 原发性肝癌治疗进展[J]. 东南大学学报(医学版), 2021, 40( 4): 542- 547. DOI: 10.3969/j.issn.1671-6264.2021.04.021. [6] GALLUZZI L, HUMEAU J, BUQUÉ A, et al. Immunostimulation with chemotherapy in the era of immune checkpoint inhibitors[J]. Nat Rev Clin Oncol, 2020, 17( 12): 725- 741. DOI: 10.1038/s41571-020-0413-z. [7] WEI WQ, ZENG HM, ZHENG RS, et al. Cancer registration in China and its role in cancer prevention and control[J]. Lancet Oncol, 2020, 21( 7): e342- e349. DOI: 10.1016/S1470-2045(20)30073-5. [8] LI J, LI R, ZHAO HY, et al. Organoid: A new model for antitumor drug research[J]. Pharmacol Clin Chin Mater Med, 2022, 38( 5): 200- 208. DOI: 10.13412/j.cnki.zyyl.20220926.001.李娇, 李睿, 赵海洋, 等. 类器官——抗肿瘤药物研究的新模型[J]. 中药药理与临床, 2022, 38( 5): 200- 208. DOI: 10.13412/j.cnki.zyyl.20220926.001. [9] LIAO YL, LIU ZY, WANG H. Research progress on cultivation and application of liver cancer organoid[J]. J Med Postgrad, 2022, 35( 6): 664- 667. DOI: 10.16571/j.cnki.1008-8199.2022.06.018.廖晏蔺, 刘正芸, 王欢. 肝癌类器官的培养及应用研究进展[J]. 医学研究生学报, 2022, 35( 6): 664- 667. DOI: 10.16571/j.cnki.1008-8199.2022.06.018. [10] MARQUARDT JU, ANDERSEN JB, THORGEIRSSON SS. Functional and genetic deconstruction of the cellular origin in liver cancer[J]. Nat Rev Cancer, 2015, 15( 11): 653- 667. DOI: 10.1038/nrc4017. [11] SCHULZE K, NAULT JC, VILLANUEVA A. Genetic profiling of hepatocellular carcinoma using next-generation sequencing[J]. J Hepatol, 2016, 65( 5): 1031- 1042. DOI: 10.1016/j.jhep.2016.05.035. [12] CAO XD, SUN MY, ZHANG HY, et al. Research progress on molecular pathogenesis of primary liver cancer[J]. J Hepatobiliary Surg, 2019, 27( 2): 153- 156. DOI: 10.3969/j.issn.1006-4761.2019.02.023.曹学冬, 孙明瑜, 张海阳, 等. 原发性肝癌的分子发病机制研究进展[J]. 肝胆外科杂志, 2019, 27( 2): 153- 156. DOI: 10.3969/j.issn.1006-4761.2019.02.023. [13] WANG RT, WANG X, SHEN B. Application and progress of organoids in tumor translational medicine[J]. China Oncol, 2022, 32( 11): 1105- 1114. DOI: 10.19401/j.cnki.1007-3639.2022.11.009.王若彤, 王欣, 沈波. 类器官在肿瘤转化医学中的应用和进展[J]. 中国癌症杂志, 2022, 32( 11): 1105- 1114. DOI: 10.19401/j.cnki.1007-3639.2022.11.009. [14] NUCIFORO S, HEIM MH. Organoids to model liver disease[J]. JHEP Rep, 2020, 3( 1): 100198. DOI: 10.1016/j.jhepr.2020.100198. [15] HUCH M, KOO BK. Modeling mouse and human development using organoid cultures[J]. Development, 2015, 142( 18): 3113- 3125. DOI: 10.1242/dev.118570. [16] BI GY, ZHANG HY. Study on the formation mechanism and application of liver organoids[J]. Chin J Cell Biol, 2022, 44( 11): 2214- 2222. DOI: 10.11844/cjcb.2022.11.0018.毕国贇, 张海燕. 肝脏类器官的构建及应用研究[J]. 中国细胞生物学学报, 2022, 44( 11): 2214- 2222. DOI: 10.11844/cjcb.2022.11.0018. [17] MCCRACKEN KW, CATÁ EM, CRAWFORD CM, et al. Modelling human development and disease in pluripotent stem-cell-derived gastric organoids[J]. Nature, 2014, 516( 7531): 400- 404. DOI: 10.1038/nature13863. [18] HATTORI N. Cerebral organoids model human brain development and microcephaly[J]. Mov Disord, 2014, 29( 2): 185. DOI: 10.1002/mds.25740. [19] YAMADA M, UTOH R, OHASHI K, et al. Controlled formation of heterotypic hepatic micro-organoids in anisotropic hydrogel microfibers for long-term preservation of liver-specific functions[J]. Biomaterials, 2012, 33( 33): 8304- 8315. DOI: 10.1016/j.biomaterials.2012.07.068. [20] WU FF, WU D, REN Y, et al. Generation of hepatobiliary organoids from human induced pluripotent stem cells[J]. J Hepatol, 2019, 70( 6): 1145- 1158. DOI: 10.1016/j.jhep.2018.12.028. [21] BROUTIER L, MASTROGIOVANNI G, VERSTEGEN MM, et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening[J]. Nat Med, 2017, 23( 12): 1424- 1435. DOI: 10.1038/nm.4438. [22] WANG L, QIU YL, WANG JS. Advances in research and application of liver organoids[J]. J Clin Hepatol, 2019, 35( 10): 2342- 2345. DOI: 10.3969/j.issn.1001-5256.2019.10.047.王利, 丘倚灵, 王建设. 肝类器官研究及应用进展[J]. 临床肝胆病杂志, 2019, 35( 10): 2342- 2345. DOI: 10.3969/j.issn.1001-5256.2019.10.047. [23] MUN SJ, RYU JS, LEE MO, et al. Generation of expandable human pluripotent stem cell-derived hepatocyte-like liver organoids[J]. J Hepatol, 2019, 71( 5): 970- 985. DOI: 10.1016/j.jhep.2019.06.030. [24] SUN GC, LI HY, CHEN J, et al. Research progress and application of organoids in biomedical field[J]. Clin J Med Offic, 2023, 51( 11): 1206- 1210. DOI: 10.16680/j.1671-3826.2023.11.28.孙广晨, 李宏宇, 陈江, 等. 类器官在生物医学中研究进展及应用[J]. 临床军医杂志, 2023, 51( 11): 1206- 1210. DOI: 10.16680/j.1671-3826.2023.11.28. [25] BHATIA SN, UNDERHILL GH, ZARET KS, et al. Cell and tissue engineering for liver disease[J]. Sci Transl Med, 2014, 6( 245): 245sr2. DOI: 10.1126/scitranslmed.3005975. [26] HOSSEINI V, MAROUFI NF, SAGHATI S, et al. Current progress in hepatic tissue regeneration by tissue engineering[J]. J Transl Med, 2019, 17( 1): 383. DOI: 10.1186/s12967-019-02137-6. [27] ZHANG L, GUAN Z, YE JS, et al. Research progress in liver tissue engineering[J]. Biomed Mater Eng, 2017, 28( s1): S113- S119. DOI: 10.3233/BME-171632. [28] TAKAHASHI K, YAMANAKA S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126( 4): 663- 676. DOI: 10.1016/j.cell.2006.07.024. [29] PRIOR N, INACIO P, HUCH M. Liver organoids: From basic research to therapeutic applications[J]. Gut, 2019, 68( 12): 2228- 2237. DOI: 10.1136/gutjnl-2019-319256. [30] NG SS, SAEB-PARSY K, BLACKFORD SJI, et al. Human iPS derived progenitors bioengineered into liver organoids using an inverted colloidal crystal poly(ethylene glycol) scaffold[J]. Biomaterials, 2018, 182: 299- 311. DOI: 10.1016/j.biomaterials.2018.07.043. [31] TYSOE OC, JUSTIN AW, BREVINI T, et al. Isolation and propagation of primary human cholangiocyte organoids for the generation of bioengineered biliary tissue[J]. Nat Protoc, 2019, 14( 6): 1884- 1925. DOI: 10.1038/s41596-019-0168-0. [32] VERSTEGEN MMA, WILLEMSE J, van den HOEK S, et al. Decellularization of whole human liver grafts using controlled perfusion for transplantable organ bioscaffolds[J]. Stem Cells Dev, 2017, 26( 18): 1304- 1315. DOI: 10.1089/scd.2017.0095. [33] GEETHA BAI R, MUTHOOSAMY K, MANICKAM S, et al. Graphene-based 3D scaffolds in tissue engineering: Fabrication, applications, and future scope in liver tissue engineering[J]. Int J Nanomedicine, 2019, 14: 5753- 5783. DOI: 10.2147/IJN.S192779. [34] WEI GF, WANG JW, LV Q, et al. Three-dimensional coculture of primary hepatocytes and stellate cells in silk scaffold improves hepatic morphology and functionality in vitro[J]. J Biomed Mater Res A, 2018, 106( 8): 2171- 2180. DOI: 10.1002/jbm.a.36421. [35] WANG SY, WANG X, TAN ZL, et al. Human ESC-derived expandable hepatic organoids enable therapeutic liver repopulation and pathophysiological modeling of alcoholic liver injury[J]. Cell Res, 2019, 29( 12): 1009- 1026. DOI: 10.1038/s41422-019-0242-8. [36] BROUTIER L, ANDERSSON-ROLF A, HINDLEY CJ, et al. Culture and establishment of self-renewing human and mouse adult liver and pancreas 3D organoids and their genetic manipulation[J]. Nat Protoc, 2016, 11( 9): 1724- 1743. DOI: 10.1038/nprot.2016.097. [37] DRIEHUIS E, KRETZSCHMAR K, CLEVERS H. Establishment of patient-derived cancer organoids for drug-screening applications[J]. Nat Protoc, 2020, 15( 10): 3380- 3409. DOI: 10.1038/s41596-020-0379-4. [38] ZHENG WJ, YAO DF, ZHANG J, et al. In-vitro construction method of liver cancer organ model: CN110004109B[P]. 2023-01-17.郑文杰, 姚登福, 张捷, 等. 一种肝癌类器官模型的体外构建方法: CN110004109B[P]. 2023-01-17. [39] BROUTIER L, MASTROGIOVANNI G, VERSTEGEN MM, et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening[J]. Nat Med, 2017, 23( 12): 1424- 1435. DOI: 10.1038/nm.4438. [40] SHIOTA J, SAMUELSON LC, RAZUMILAVA N. Hepatobiliary organoids and their applications for studies of liver health and disease: Are we there yet?[J]. Hepatology, 2021, 74( 4): 2251- 2263. DOI: 10.1002/hep.31772. [41] CAO WL, LIU JY, WANG L, et al. Modeling liver cancer and therapy responsiveness using organoids derived from primary mouse liver tumors[J]. Carcinogenesis, 2019, 40( 1): 145- 154. DOI: 10.1093/carcin/bgy129. [42] FUJII M, CLEVERS H, SATO T. Modeling human digestive diseases with CRISPR-Cas9-modified organoids[J]. Gastroenterology, 2019, 156( 3): 562- 576. DOI: 10.1053/j.gastro.2018.11.048. [43] WANG Y, TAKEISHI K, LI Z, et al. Microenvironment of a tumor-organoid system enhances hepatocellular carcinoma malignancy-related hallmarks[J]. Organogenesis, 2017, 13( 3): 83- 94. DOI: 10.1080/15476278.2017.1322243. [44] WANG HC, CALVISI DF, CHEN X. Organoids for the study of liver cancer[J]. Semin Liver Dis, 2021, 41( 1): 19- 27. DOI: 10.1055/s-0040-1719176. [45] WANG YX, ZHU YJ, WANG HY, et al. Advances and applications of liver organoids[J]. Chin J Cell Biol, 2021, 43( 6): 1132- 1141. DOI: 10.11844/cjcb.2021.06.0003.王溢贤, 朱妍静, 王红阳, 等. 肝脏类器官研究进展与应用[J]. 中国细胞生物学学报, 2021, 43( 6): 1132- 1141. DOI: 10.11844/cjcb.2021.06.0003. [46] LI L, KNUTSDOTTIR H, HUI K, et al. Human primary liver cancer organoids reveal intratumor and interpatient drug response heterogeneity[J]. JCI Insight, 2019, 4( 2): e121490. DOI: 10.1172/jci.insight.121490. [47] DROST J, CLEVERS H. Organoids in cancer research[J]. Nat Rev Cancer, 2018, 18( 7): 407- 418. DOI: 10.1038/s41568-018-0007-6. [48] YU JH, MA S. Organoids as research models for hepatocellular carcinoma[J]. Exp Cell Res, 2022, 411( 1): 112987. DOI: 10.1016/j.yexcr.2021.112987. [49] HU HL, GEHART H, ARTEGIANI B, et al. Long-term expansion of functional mouse and human hepatocytes as 3D organoids[J]. Cell, 2018, 175( 6): 1591- 1606. DOI: 10.1016/j.cell.2018.11.013. [50] PENG WC, LOGAN CY, FISH M, et al. Inflammatory cytokine TNFα promotes the long-term expansion of primary hepatocytes in 3D culture[J]. Cell, 2018, 175( 6): 1607- 1619. DOI: 10.1016/j.cell.2018.11.012. [51] SAMPAZIOTIS F, MURARO D, TYSOE OC, et al. Cholangiocyte organoids can repair bile ducts after transplantation in the human liver[J]. Science, 2021, 371( 6531): 839- 846. DOI: 10.1126/science.aaz6964. [52] LI YQ, TANG PY, CAI SJ, et al. Organoid based personalized medicine: From bench to bedside[J]. Cell Regen, 2020, 9( 1): 21. DOI: 10.1186/s13619-020-00059-z. [53] BROOKS A, LIANG X, ZHANG Y, et al. Liver organoid as a 3D in vitro model for drug validation and toxicity assessment[J]. Pharmacol Res, 2021, 169: 105608. DOI: 10.1016/j.phrs.2021.105608. [54] GUAN Y, CHEN XY, WU MH, et al. The phosphatidylethanolamine biosynthesis pathway provides a new target for cancer chemotherapy[J]. J Hepatol, 2020, 72( 4): 746- 760. DOI: 10.1016/j.jhep.2019.11.007. [55] LIN L, LEI M, LIN JM, et al. Advances and applications in liver organoid technology[J]. Sci Sin Vitae, 2023, 53( 2): 185- 195.林丽, 雷妙, 林佳漫, 等. 肝脏类器官的研究进展及应用[J]. 中国科学: 生命科学, 2023, 53( 2): 185- 195. [56] LI LY, QIAN MX, CHEN IH, et al. Acquisition of cholangiocarcinoma traits during advanced hepatocellular carcinoma development in mice[J]. Am J Pathol, 2018, 188( 3): 656- 671. DOI: 10.1016/j.ajpath.2017.11.013. [57] TIRIAC H, BELLEAU P, ENGLE DD, et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer[J]. Cancer Discov, 2018, 8( 9): 1112- 1129. DOI: 10.1158/2159-8290.CD-18-0349. [58] KONDO J, EKAWA T, ENDO H, et al. High-throughput screening in colorectal cancer tissue-originated spheroids[J]. Cancer Sci, 2019, 110( 1): 345- 355. DOI: 10.1111/cas.13843. [59] NUCIFORO S, FOFANA I, MATTER MS, et al. Organoid models of human liver cancers derived from tumor needle biopsies[J]. Cell Rep, 2018, 24( 5): 1363- 1376. DOI: 10.1016/j.celrep.2018.07.001. [60] XING JL, WANG YX, DU SD. Application and research progress of in vitro liver cancer cell culture models[J]. World Chin J Dig, 2021, 29( 11): 563- 570. DOI: 10.11569/wcjd.v29.i11.563.邢家利, 王禹歆, 杜顺达. 肝脏肿瘤体外培养模型的应用与研究进展[J]. 世界华人消化杂志, 2021, 29( 11): 563- 570. DOI: 10.11569/wcjd.v29.i11.563. [61] SAKABE K, TAKEBE T, ASAI A. Organoid medicine in hepatology[J]. Clin Liver Dis(Hoboken), 2020, 15( 1): 3- 8. DOI: 10.1002/cld.855. [62] HUCH M, DORRELL C, BOJ SF, et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration[J]. Nature, 2013, 494( 7436): 247- 250. DOI: 10.1038/nature11826. [63] JIN Y, KIM J, LEE JS, et al. Vascularized liver organoids generated using induced hepatic tissue and dynamic liver-specific microenvironment as a drug testing platform[J]. Adv Funct Mater, 2018, 28( 37): 1801954. DOI: 10.1002/adfm.201801954. [64] HILMI M, VIENOT A, ROUSSEAU B, et al. Immune therapy for liver cancers[J]. Cancers(Basel), 2019, 12( 1): 77. DOI: 10.3390/cancers12010077. [65] CAVALLONI G, PERALDO-NEIA C, VARAMO C, et al. Establishment and characterization of a human intrahepatic cholangiocarcinoma cell line derived from an Italian patient[J]. Tumour Biol, 2016, 37( 3): 4041- 4052. DOI: 10.1007/s13277-015-4215-3. [66] GU QY, ZHANG B, SUN HY, et al. Genomic characterization of a large panel of patient-derived hepatocellular carcinoma xenograft tumor models for preclinical development[J]. Oncotarget, 2015, 6( 24): 20160- 20176. DOI: 10.18632/oncotarget.3969. [67] HIDALGO M, AMANT F, BIANKIN AV, et al. Patient-derived xenograft models: An emerging platform for translational cancer research[J]. Cancer Discov, 2014, 4( 9): 998- 1013. DOI: 10.1158/2159-8290.CD-14-0001. [68] HOU JJ, ZHANG HY, SUN BC, et al. The immunobiology of hepatocellular carcinoma in humans and mice: Basic concepts and therapeutic implications[J]. J Hepatol, 2020, 72( 1): 167- 182. DOI: 10.1016/j.jhep.2019.08.014. [69] VOTANOPOULOS KI, FORSYTHE S, SIVAKUMAR H, et al. Model of patient-specific immune-enhanced organoids for immunotherapy screening: Feasibility study[J]. Ann Surg Oncol, 2020, 27( 6): 1956- 1967. DOI: 10.1245/s10434-019-08143-8. [70] HAI J, ZHANG H, ZHOU J, et al. Generation of genetically engineered mouse lung organoid models for squamous cell lung cancers allows for the study of combinatorial immunotherapy[J]. Clin Cancer Res, 2020, 26( 13): 3431- 3442. DOI: 10.1158/1078-0432.CCR-19-1627. -



 PDF下载 ( 820 KB)
PDF下载 ( 820 KB)

 下载:
下载:


