铁死亡在肝缺血再灌注损伤中的作用
DOI: 10.12449/JCH240830
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:梁佳新负责资料收集与分析,撰写论文;徐宝麟、魏勇、成雨负责拟定写作思路,指导撰写文章并最后定稿。
-
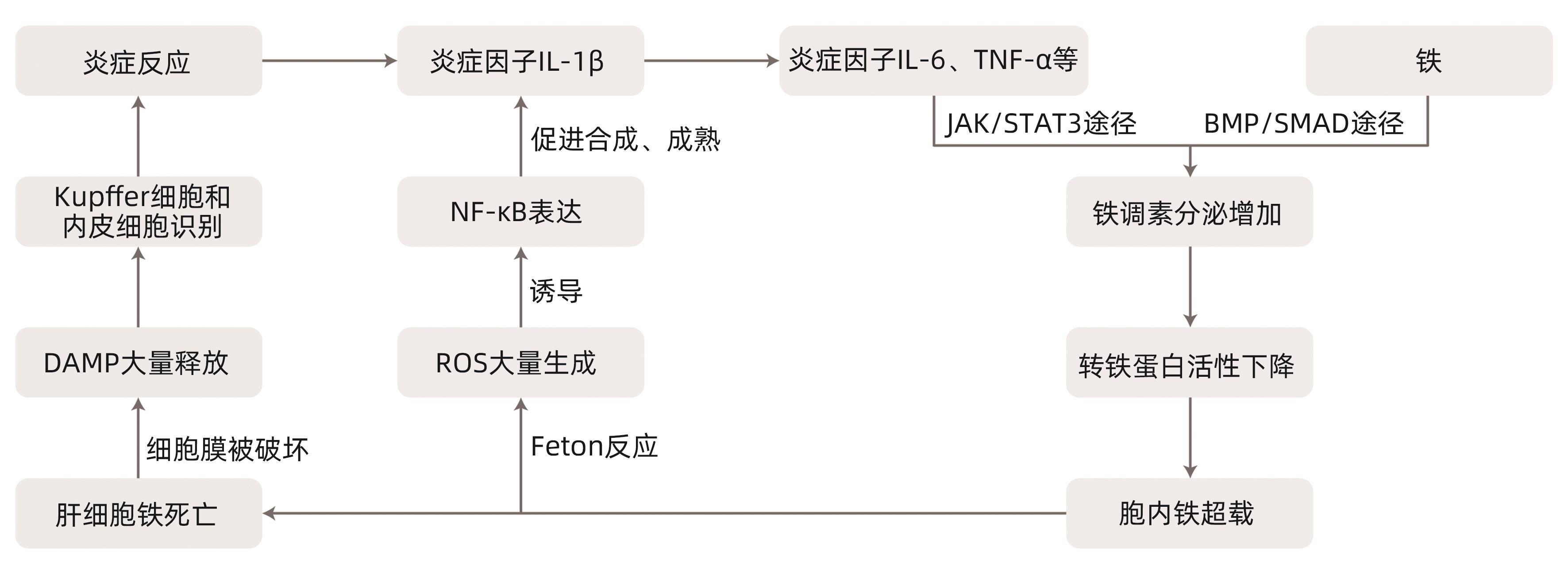
摘要: 铁死亡是一种新型调节性细胞死亡,主要由于各种诱导剂导致细胞内铁稳态的改变,促进铁离子依赖性的脂质过氧化反应的发生,由此引发了有毒的脂质过氧化物大量堆积,最终导致细胞死亡。肝缺血再灌注损伤是肝脏手术后常见且严重的并发症,主要机制包括无氧呼吸、线粒体损伤、氧化应激反应、炎症反应、钙超载、微循环功能障碍等。本文对铁死亡和肝缺血再灌注损伤的概念和机制进行介绍,并总结了与二者有关的部分治疗策略,为探索肝缺血再灌注损伤新的治疗手段提供参考。Abstract: Ferroptosis is a new type of regulatory cell death and is mainly caused by changes in intracellular iron homeostasis due to various inducers, which promotes the occurrence of iron ion-dependent lipid peroxidation, thereby leading to the accumulation of toxic lipid peroxides and finally resulting in cell death. Hepatic ischemia-reperfusion injury is a common and serious complication after liver surgery, with the main mechanisms of anaerobic respiration, mitochondrial injury, oxidative stress response, inflammatory response, calcium overload, and microcirculation dysfunction. This article introduces the concepts and mechanisms of ferroptosis and hepatic ischemia-reperfusion injury and summarizes some related treatment strategies, so as to provide a reference for exploring new treatment methods for hepatic ischemia-reperfusion injury.
-
Key words:
- Ferroptosis /
- Reperfusion Injury /
- Liver Diseases
-
[1] DIXON SJ, LEMBERG KM, LAMPRECHT MR, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149( 5): 1060- 1072. DOI: 10.1016/j.cell.2012.03.042. [2] GALLUZZI L, VITALE I, AARONSON SA, et al. Molecular mechanisms of cell death: Recommendations of the Nomenclature Committee on Cell Death 2018[J]. Cell Death Differ, 2018, 25( 3): 486- 541. DOI: 10.1038/s41418-017-0012-4. [3] YANG WS, SRIRAMARATNAM R, WELSCH ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156( 1-2): 317- 331. DOI: 10.1016/j.cell.2013.12.010. [4] CHEN X, KANG R, KROEMER G, et al. Broadening horizons: The role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18( 5): 280- 296. DOI: 10.1038/s41571-020-00462-0. [5] CHELI VT, CORREALE J, PAEZ PM, et al. Iron metabolism in oligodendrocytes and astrocytes, implications for myelination and remyelination[J]. ASN Neuro, 2020, 12: 1759091420962681. DOI: 10.1177/1759091420962681. [6] YAMADA N, KARASAWA T, WAKIYA T, et al. Iron overload as a risk factor for hepatic ischemia-reperfusion injury in liver transplantation: Potential role of ferroptosis[J]. Am J Transplant, 2020, 20( 6): 1606- 1618. DOI: 10.1111/ajt.15773. [7] WU LY, LU XL. Research advances in ferroptosis in the pathogenesis and treatment of nonalcoholic fatty liver disease[J]. J Clin Hepatol, 2023, 39( 7): 1687- 1695. DOI: 10.3969/j.issn.1001-5256.2023.07.025.吴龙云, 鲁晓岚. 铁死亡在非酒精性脂肪性肝病发病和治疗中的作用[J]. 临床肝胆病杂志, 2023, 39( 7): 1687- 1695. DOI: 10.3969/j.issn.1001-5256.2023.07.025. [8] HIRAO H, NAKAMURA K, KUPIEC-WEGLINSKI JW. Liver ischaemia-reperfusion injury: A new understanding of the role of innate immunity[J]. Nat Rev Gastroenterol Hepatol, 2022, 19( 4): 239- 256. DOI: 10.1038/s41575-021-00549-8. [9] URSINI F, MAIORINO M. Lipid peroxidation and ferroptosis: The role of GSH and GPx4[J]. Free Radic Biol Med, 2020, 152: 175- 185. DOI: 10.1016/j.freeradbiomed.2020.02.027. [10] DODSON M, CASTRO-PORTUGUEZ R, ZHANG DD. NRF2 plays a critical role in mitigating lipid peroxidation and ferroptosis[J]. Redox Biol, 2019, 23: 101107. DOI: 10.1016/j.redox.2019.101107. [11] TANG DL, CHEN X, KANG R, et al. Ferroptosis: Molecular mechanisms and health implications[J]. Cell Res, 2021, 31( 2): 107- 125. DOI: 10.1038/s41422-020-00441-1. [12] ZHANG Y, TAN H, DANIELS JD, et al. Imidazole ketone erastin induces ferroptosis and slows tumor growth in a mouse lymphoma model[J]. Cell Chem Biol, 2019, 26( 5): 623- 633. DOI: 10.1016/j.chembiol.2019.01.008. [13] LI SB, HE YP, CHEN KX, et al. RSL3 drives ferroptosis through NF-κB pathway activation and GPX4 depletion in glioblastoma[J]. Oxid Med Cell Longev, 2021, 2021: 2915019. DOI: 10.1155/2021/2915019. [14] GASCHLER MM, ANDIA AA, LIU HR, et al. FINO2 initiates ferroptosis through GPX4 inactivation and iron oxidation[J]. Nat Chem Biol, 2018, 14( 5): 507- 515. DOI: 10.1038/s41589-018-0031-6. [15] SUN YD, BERLETH N, WU WX, et al. Fin56-induced ferroptosis is supported by autophagy-mediated GPX4 degradation and functions synergistically with mTOR inhibition to kill bladder cancer cells[J]. Cell Death Dis, 2021, 12( 11): 1028. DOI: 10.1038/s41419-021-04306-2. [16] CHEN GW, LI C, ZHANG L, et al. Hydroxysafflor yellow A and anhydrosafflor yellow B alleviate ferroptosis and parthanatos in PC12 cells injured by OGD/R[J]. Free Radic Biol Med, 2022, 179: 1- 10. DOI: 10.1016/j.freeradbiomed.2021.12.262. [17] KIM KM, CHO SS, KI SH. Emerging roles of ferroptosis in liver pathophysiology[J]. Arch Pharm Res, 2020, 43( 10): 985- 996. DOI: 10.1007/s12272-020-01273-8. [18] HIRAO H, NAKAMURA K, KUPIEC-WEGLINSKI JW. Liver ischaemia-reperfusion injury: A new understanding of the role of innate immunity[J]. Nat Rev Gastroenterol Hepatol, 2022, 19( 4): 239- 256. DOI: 10.1038/s41575-021-00549-8. [19] DAR WA, SULLIVAN E, BYNON JS, et al. Ischaemia reperfusion injury in liver transplantation: Cellular and molecular mechanisms[J]. Liver Int, 2019, 39( 5): 788- 801. DOI: 10.1111/liv.14091. [20] KALOGERIS T, BAINES CP, KRENZ M, et al. Cell biology of ischemia/reperfusion injury[J]. Int Rev Cell Mol Biol, 2012, 298: 229- 317. DOI: 10.1016/B978-0-12-394309-5.00006-7. [21] LI J, LI RJ, LV GY, et al. The mechanisms and strategies to protect from hepatic ischemia-reperfusion injury[J]. Eur Rev Med Pharmacol Sci, 2015, 19( 11): 2036- 2047. [22] ABU-AMARA M, YANG SY, TAPURIA N, et al. Liver ischemia/reperfusion injury: Processes in inflammatory networks: A review[J]. Liver Transpl, 2010, 16( 9): 1016- 1032. DOI: 10.1002/lt.22117. [23] DENG YZ, NI LH. Research progress on the mechanism and prevention strategies of hepatic ischemia-reperfusion injury[J]. Chin J Microcirc, 2023, 33( 2): 109- 115. DOI: 10.3969/j.issn.1005-1740.2023.02.020.邓银芝, 倪利华. 肝脏缺血再灌注损伤的机制及防治策略的研究进展[J]. 微循环学杂志, 2023, 33( 2): 109- 115. DOI: 10.3969/j.issn.1005-1740.2023.02.020. [24] GNAIGER E, KUZNETSOV AV, RIEGER G, et al. Mitochondrial defects by intracellular calcium overload versus endothelial cold ischemia/reperfusion injury[J]. Transpl Int, 2000, 13( Suppl 1): S555- S557. DOI: 10.1007/s001470050401. [25] PERALTA C, JIMÉNEZ-CASTRO MB, GRACIA-SANCHO J. Hepatic ischemia and reperfusion injury: Effects on the liver sinusoidal milieu[J]. J Hepatol, 2013, 59( 5): 1094- 1106. DOI: 10.1016/j.jhep.2013.06.017. [26] CHANG CK, ZHANG X, XIAO C, et al. Research advances of hepcidin expression and its regulation mechanism—Review[J]. J Exp Hematol, 2012, 20( 4): 1030- 1033.常春康, 张曦, 肖超, 等. 铁调素的表达与调节机制研究进展[J]. 中国实验血液学杂志, 2012, 20( 4): 1030- 1033. [27] WUNDERER F, TRAEGER L, SIGURSLID HH, et al. The role of hepcidin and iron homeostasis in atherosclerosis[J]. Pharmacol Res, 2020, 153: 104664. DOI: 10.1016/j.phrs.2020.104664. [28] LUO LF, MO GH, HUANG DQ. Ferroptosis in hepatic ischemia-reperfusion injury: Regulatory mechanisms and new methods for therapy(Review)[J]. Mol Med Rep, 2021, 23( 3): 225. DOI: 10.3892/mmr.2021.11864. [29] LING MY, YE L, ZENG Q, et al. Ferrostatin-1 alleviates ventilator-induced lung injury by inhibiting ferroptosis[J]. Int Immunopharmacol, 2023, 120: 110356. DOI: 10.1016/j.intimp.2023.110356. [30] FANG XL, SHI JH, WANG JH, et al. The relationship between ferroptosis and inflammation[J]. Chin J Histochem Cytochem, 2023, 32( 2): 196- 201. DOI: 10.16705/j.cnki.1004-1850.2023.02.012.方晓苓, 石建华, 王金海, 等. 铁死亡与炎症的关系[J]. 中国组织化学与细胞化学杂志, 2023, 32( 2): 196- 201. DOI: 10.16705/j.cnki.1004-1850.2023.02.012. [31] LI YQ, XU HT, ZHAO WJ, et al. Ferroptosis and oxidative stress in hepatic cellular carcinoma[J]. Hans J Biomed, 2023, 9( 3): 293- 302.李雅琪, 徐弘庭, 赵维坚, 等. 肝细胞癌中的铁死亡与氧化应激[J]. 生物医学, 2023, 9( 3): 293- 302. [32] XIE Y, HOU W, SONG X, et al. Ferroptosis: Process and function[J]. Cell Death Differ, 2016, 23( 3): 369- 379. DOI: 10.1038/cdd.2015.158. [33] MIOTTO G, ROSSETTO M, DI PAOLO ML, et al. Insight into the mechanism of ferroptosis inhibition by ferrostatin-1[J]. Redox Biol, 2020, 28: 101328. DOI: 10.1016/j.redox.2019.101328. [34] SEO MY, LEE SM. Protective effect of low dose of ascorbic acid on hepatobiliary function in hepatic ischemia/reperfusion in rats[J]. J Hepatol, 2002, 36( 1): 72- 77. DOI: 10.1016/s0168-8278(01)00236-7. [35] COTGREAVE IA. N-acetylcysteine: Pharmacological considerations and experimental and clinical applications[J]. Adv Pharmacol, 1997, 38: 205- 227. [36] DULUNDU E, OZEL Y, TOPALOGLU U, et al. Alpha-lipoic acid protects against hepatic ischemia-reperfusion injury in rats[J]. Pharmacology, 2007, 79( 3): 163- 170. DOI: 10.1159/000098953. [37] GIAKOUSTIDIS DE, ILIADIS S, TSANTILAS D, et al. Blockade of Kupffer cells by gadolinium chloride reduces lipid peroxidation and protects liver from ischemia/reperfusion injury[J]. Hepatogastroenterology, 2003, 50( 53): 1587- 1592. [38] WANG B, XU H, LI J, et al. Complement depletion with cobra venom factor alleviates acute hepatic injury induced by ischemia-reperfusion[J]. Mol Med Rep, 2018, 18( 5): 4523- 4529. DOI: 10.3892/mmr.2018.9484. [39] FANG XX, ZHANG JW, LI Y, et al. Malic enzyme 1 as a novel anti-ferroptotic regulator in hepatic ischemia/reperfusion injury[J]. Adv Sci(Weinh), 2023, 10( 13): e2205436. DOI: 10.1002/advs. 202205436. [40] GUO JW, SONG ZH, YU J, et al. Hepatocyte-specific TMEM16A deficiency alleviates hepatic ischemia/reperfusion injury via suppressing GPX4-mediated ferroptosis[J]. Cell Death Dis, 2022, 13( 12): 1072. DOI: 10.1038/s41419-022-05518-w. [41] WU Y, JIAO HK, YUE YB, et al. Ubiquitin ligase E3 HUWE1/MULE targets transferrin receptor for degradation and suppresses ferroptosis in acute liver injury[J]. Cell Death Differ, 2022, 29( 9): 1705- 1718. DOI: 10.1038/s41418-022-00957-6. [42] WU LL, TIAN X, ZUO HW, et al. MiR-124-3p delivered by exosomes from heme oxygenase-1 modified bone marrow mesenchymal stem cells inhibits ferroptosis to attenuate ischemia-reperfusion injury in steatotic grafts[J]. J Nanobiotechnology, 2022, 20( 1): 196. DOI: 10.1186/s12951-022-01407-8. [43] ZHONG C, YANG J, ZHANG YY, et al. TRPM2 mediates hepatic ischemia-reperfusion injury via Ca2+-induced mitochondrial lipid peroxidation through increasing ALOX12 expression[J]. Research(Wash D C), 2023, 6: 0159. DOI: 10.34133/research.0159. -



 PDF下载 ( 859 KB)
PDF下载 ( 859 KB)

 下载:
下载:


