年龄≤30岁转氨酶正常的慢性乙型肝炎肝纤维化患者无创诊断模型的建立
DOI: 10.12449/JCH240912
Establishment of a noninvasive diagnostic model for chronic hepatitis B liver fibrosis patients with normal aminotransferases aged ≤30 years
-
摘要:
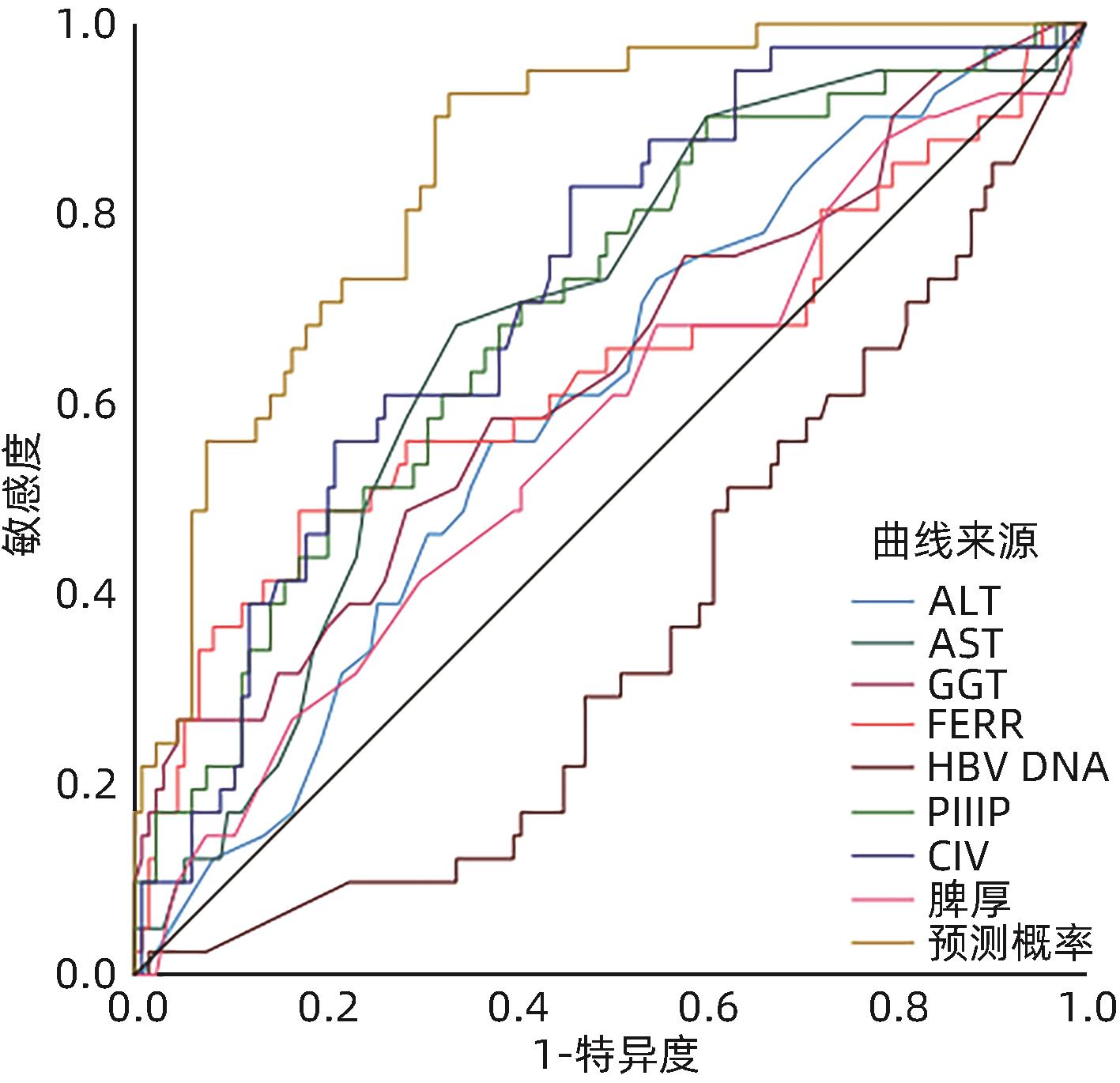
目的 从慢性乙型肝炎(CHB)患者的临床、生化及影像学等常用无创伤性指标中筛选出特定指标,构建年龄≤30岁、ALT水平正常CHB患者肝纤维程度无创性诊断模型,在一定程度上避免该类患者行有创的肝穿刺活检,从而指导其抗病毒治疗时机。 方法 收集2019年1月—2022年1月在深圳市第三人民医院及长沙市第一医院行肝穿刺活检的年龄≤30岁ALT正常的CHB患者251例,其中模型组175例,验证组76例,根据临床经验及相关文献筛选出临床常用指标,计量资料组间比较采用成组t检验或两独立样本Mann-Whitney U秩和检验;计数资料采用χ2检验。经Spearman等级相关逐一分析各指标与肝纤维化之间的关联性,筛选出有关联的指标(P<0.01,r>0.200),采用Logistic回归创建无创诊断模型,使用受试者工作特征曲线(ROC曲线)评价其能力并进行验证,将该模型与目前广泛使用的模型APRI及FIB-4进行比较。病理结果一致性采用诊断试验的Kappa一致性检验。 结果 筛选17项临床常用指标,其中9项指标[ALT、AST、GGT、铁蛋白(FERR)、血小板计数(PLT)、Ⅲ型前胶原氨基端肽(PⅢP)、Ⅳ胶原(CⅣ)、HBV DNA以及脾厚]与肝纤维化有关联(P<0.01,r>0.232),根据以上指标建立预测模型为:P=1/(1+e-γ),γ=-1.902+0.106×AST-0.011×PLT-0.265×HBV DNA+0.059×PⅢP(P为预测患者肝纤维化≥S2的概率值,γ为预测指数),单项指标与模型比较提示该模型曲线下面积最大为0.852,其敏感度为92.7%,特异度为76.9%;以76例患者进行验证,准确度为77.6%。该模型与模型APRI及FIB-4进行比较,显示该模型有较好的准确性。 结论 本研究创建的无创诊断模型相较于国际上常用模型APRI及FIB-4能更准确地判断该类患者肝纤维化程度,在一定程度上可替代肝组织活检,并指导其抗病毒治疗时机。 Abstract:Objective To establish a noninvasive diagnostic model for liver fibrosis in chronic hepatitis B (CHB) patients with normal alanine aminotransferase (ALT) and an age of ≤30 years by selecting specific indicators from the commonly used noninvasive indicators such as clinical, biochemical, and imaging indicators, to avoid invasive liver biopsy in such patients to some extent, and to guide the timing of antiviral therapy. Methods A total of 251 CHB patients with normal ALT and an age of ≤30 years who underwent liver biopsy in Shenzhen Third People’s Hospital and The First Hospital of Changsha from January 2019 to January 2022 were enrolled, with 175 patients in the model group and 76 patients in the validation group, and commonly used clinical indicators were obtained based on clinical experience and related articles. The two-independent-samples t test or the two-independent-samples Mann-Whitney U rank sum test was used for comparison of continuous data between groups, and the chi-square test was used for comparison of categorical data between groups. A Spearman rank correlation analysis was used to investigate the correlation between each indicator and liver fibrosis and identify the indicators with correlation (P<0.01, r>0.200); a Logistic regression analysis was used to establish a noninvasive diagnostic model, and the receiver operating characteristic (ROC) curve was used to evaluate its performance and perform validation of the model; this model was then compared with the widely used models of aspartate aminotransferase-to-platelet ratio index (APRI) and fibrosis-4 (FIB-4). The Kappa consistency test was used to investigate the consistency of pathological results. Results A total of 17 commonly used clinical indicators were obtained, among which 9 indicators (ALT, aspartate aminotransferase [AST], gamma-glutamyl transpeptidase [GGT], ferritin [FERR], platelet count [PLT], procollagen type Ⅲ amino-terminal peptide [PⅢP], collagen Ⅳ [CⅣ], HBV DNA, and spleen thickness) were correlated with liver fibrosis (P<0.01, r>0.232). Based on the above indicators, the predictive model was established as P=1/(1+e-γ), γ=-1.902+0.106×AST-0.011×PLT-0.265×HBV DNA+0.059×PⅢP, in which P was the probability for predicting ≥S2 liver fibrosis and γ was the predictive index. The comparison between each indicator and the model showed that the model had the largest area under the ROC curve of 0.852, with a sensitivity of 92.7% and a specificity of 76.9%. The model was validated in 76 patients and showed an accuracy of 77.600%. The model was compared with APRI and FIB-4, and the results showed that the model has good accuracy. Conclusion Compared with the models of APRI and FIB-4 commonly used in the world, this model can more accurately judge the degree of liver fibrosis in such patients, thereby replacing liver biopsy to some extent and guiding the timing of antiviral therapy. -
Key words:
- Age Groups /
- Hepatitis B, Chronic /
- Transaminases /
- Diagnosis
-
表 1 中国慢性肝炎分级分期系统
Table 1. Staging standard of liver fibrosis in chronic hepatitis
纤维化分期(S) 描述 S0 无 S1 汇管区纤维化扩大 S2 汇管区周围纤维化,纤维间隔形成,但小叶结构保留 S3 纤维间隔伴小叶结构紊乱,无肝硬化 S4 早期肝硬化 表 2 251例患者的一般资料
Table 2. General information of 251 patients
基本资料 模型组
(n=175)
验证组
(n=76)
统计值 P值 性别(例) χ2=1.769 0.208 男 111 41 女 64 35 HBeAg状态(例) χ2=0.449 0.653 阳性 86 35 阴性 89 41 HBV DNA(例) Z=0.440 0.660 ≥6.5 log10 IU/mL 67 26 5.7~6.5 log10 IU/mL 5 3 ≤5.7 log10 IU/mL 103 47 肝组织纤维化分期(例) Z=0.448 0.654 ≤S0~S1 111 51 S2 47 21 S3 12 3 S4 5 1 注:S0~S1为无肝纤维化组;≥S2(S2、S3、S4)为肝纤维化组。
表 3 单项参数与肝纤维化的相关性分析
Table 3. Correlation analysis between single parameter and hepatic fibrosis
指标 P值 r值 PLT <0.001 -0.485 AST <0.001 0.399 CⅣ 0.001 0.363 PⅢP 0.001 0.315 GGT 0.009 0.297 FERR 0.002 0.272 ALT <0.001 0.268 HBV DNA <0.001 -0.255 脾厚 <0.001 0.232 PV 0.001 0.184 TBil 0.574 0.043 Alb 0.821 0.018 ALP 0.312 0.077 TBA 0.161 0.106 WBC 0.235 -0.090 HV 0.525 0.050 LN 0.226 0.066 表 4 实验室指标诊断肝纤维化程度≥S2的多因素分析
Table 4. Multivariate analysis of laboratory indexes in diagnosis of liver fibrosis degree ≥S2
实验室指标 B值 SE Wald值 df P值 OR 95%CI ALT(U/L) -0.041 0.034 1.474 1 0.225 0.960 0.898~1.026 AST(U/L) 0.106 0.049 4.787 1 0.002 1.112 1.011~1.223 GGT(U/L) 0.022 0.014 2.601 1 0.107 1.022 0.995~1.050 FERR(ng/mL) 0.002 0.001 3.797 1 0.051 1.002 1.000~1.004 PLT(×109/L) -0.011 0.005 5.211 1 0.001 0.989 0.979~0.998 HBV DNA(log10 IU/mL) -0.265 0.085 9.593 1 0.002 0.767 0.649~0.907 PⅢP(ng/mL) 0.059 0.026 4.979 1 0.001 1.060 1.007~1.117 CⅣ(ng/mL) 0.013 0.018 0.500 1 0.479 1.013 0.978~1.049 脾厚(mm) 0.006 0.045 0.020 1 0.887 1.006 0.922~1.098 常量 -1.902 2.231 0.727 1 0.394 0.149 表 5 9项指标单项参数及模型预测低ALT水平CHB肝纤维化的AUC
Table 5. 9 indicators, single parameter and model to predict AUC of liver fibrosis in chronic hepatitis B with low ALT
实验室指标 AUC 95%CI 最佳诊断值 敏感度(%) 特异度(%) CⅣ(ng/mL) 0.739 0.635~0.804 16.030 82.9 45.9 PⅢP(ng/mL) 0.717 0.627~0.797 23.440 70.7 40.6 AST(U/L) 0.712 0.593~0.791 22.500 68.3 33.8 GGT(U/L) 0.680 0.539~0.762 44.500 56.8 14.5 FERR(ng/mL) 0.680 0.540~0.760 288.500 48.8 17.3 ALT(U/L) 0.598 0.502~0.693 26.500 56.1 37.6 脾厚(mm) 0.568 0.466~0.670 30.500 68.3 54.9 HBV DNA(log10 IU/mL) 0.460 0.311~0.489 5.805 37.1 40.5 PLT(×109/L) 0.400 0.922~1.098 225.000 26.8 60.2 模型 0.852 0.792~0.912 0.151 92.7 33.1 表 6 76例验证组模型(A)与APRI(B)及FIB-4(C)的比较
Table 6. Comparison of Model (A) with APRI(B) and FIB-4(C) in 76 validation groups
肝纤维化分级 例数 A诊断例数 准确度(%) B诊断例数 准确度(%) C诊断例数 准确度(%) ≤S1 51 39 76.470 51 100.000 51 100.000 ≥S2 25 20 80.000 1 4.000 4 16.000 总计 76 59 77.630 51 68.420 55 72.300 -
[1] Hepatology Branch of Chinese Medical Association, Infectious Diseases Branch of Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B(version 2022)[J]. Chin J Infect Dis, 2023, 41( 1): 3- 28. DOI: 10.3760/cma.j.cn311365-20230220-00050.中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 中华传染病杂志, 2023, 41( 1): 3- 28. DOI: 10.3760/cma.j.cn311365-20230220-00050. [2] SONNEVELD MJ, BROUWER WP, CHAN HL, et al. Optimisation of the use of APRI and FIB-4 to rule out cirrhosis in patients with chronic hepatitis B: Results from the SONIC-B study[J]. Lancet Gastroenterol Hepatol, 2019, 4( 7): 538- 544. DOI: 10.1016/S2468-1253(19)30087-1. [3] ZHOU XL, WANG YB, LU W, et al. Value of five noninvasive serum models in the diagnosis of chronic hepatitis B liver fibrosis[J]. J Clin Hepatol, 2021, 37( 7): 1567- 1571. DOI: 10.3969/j.issn.1001-5256.2021.07.018.周新兰, 王雁冰, 陆伟, 等. 5种血清无创模型对慢性乙型肝炎肝纤维化分期诊断价值的比较[J]. 临床肝胆病杂志, 2021, 37( 7): 1567- 1571. DOI: 10.3969/j.issn.1001-5256.2021.07.018. [4] FATTOVICH G, BORTOLOTTI F, DONATO F. Natural history of chronic hepatitis B: Special emphasis on disease progression and prognostic factors[J]. J Hepatol, 2008, 48( 2): 335- 352. DOI: 10.1016/j.jhep.2007.11.011. [5] WU XJ, WANG Y, CHEN J, et al. Baseline predictors of virological response for chronic hepatitis B patients[J]. World J Gastroenterol, 2009, 15( 34): 4311- 4315. DOI: 10.3748/wjg.15.4311. [6] CAO W, CHEN HD, YU YW, et al. Changing profiles of cancer burden worldwide and in China: A secondary analysis of the global cancer statistics 2020[J]. Chin Med J, 2021, 134( 7): 783- 791. DOI: 10.1097/CM9.0000000000001474. [7] LIU J, ZHANG SK, WANG QM, et al. Seroepidemiology of hepatitis B virus infection in 2 million men aged 21-49 years in rural China: A population-based, cross-sectional study[J]. Lancet Infect Dis, 2016, 16( 1): 80- 86. DOI: 10.1016/S1473-3099(15)00218-2. [8] LUO X, QU Y, CAI XB, et al. Effects of antiviral therapy on the reversal of liver fibrosis[J]. J Clin Hepatol, 2022, 38( 11): 2596- 2598. DOI: 10.3969/j.issn.1001-5256.2022.11.032.罗昕, 曲颖, 蔡晓波, 等. 抗病毒治疗对肝纤维化逆转的影响[J]. 临床肝胆病杂志, 2022, 38( 11): 2596- 2598. DOI: 10.3969/j.issn.1001-5256.2022.11.032. [9] MIAO L, JIA CH, CHEN HD, et al. Study on the factors influencing the reversal of liver fibrosis after the treatment of chronic hepatitis B with Entecavir received virological response[J]. Clin J Med Offic, 2024, 52( 2): 176- 179. DOI: 10.16680/j.1671-3826.2024.02.17.苗亮, 贾春辉, 陈寒冬, 等. 恩替卡韦治疗慢性乙型肝炎获得病毒学应答后肝纤维化逆转影响因素研究[J]. 临床军医杂志, 2024, 52( 2): 176- 179. DOI: 10.16680/j.1671-3826.2024.02.17. [10] LIU YN, LI MW, WANG LJ, et al. HBeAg-negative chronic HBV-infected individuals with normal alanine aminotransferase and an age of ≤30 years should be taken seriously when expanding anti-HBV treatment for chronic hepatitis B[J]. J Clin Hepatol, 2022, 38( 7): 1477- 1481. DOI: 10.3969/j.issn.1001-5256.2022.07.006.刘燕娜, 李明蔚, 王雷婕, 等. 扩大慢性乙型肝炎抗病毒治疗应重视ALT正常、年龄≤30岁的HBeAg阴性慢性HBV感染者[J]. 临床肝胆病杂志, 2022, 38( 7): 1477- 1481. DOI: 10.3969/j.issn.1001-5256.2022.07.006. [11] JURY TE. Easl international consensus conference on hepatitis B[J]. J Hepatol, 2003, 39( S1): 3- 25. [12] LOK A. Chronic hepatitis B[J]. Hepatology, 2001, 34( 6): 1225- 1241. DOI: 10.1053/jhep.2001.29401. [13] NONG CL, LONG TH, GUO Q. Characteristics of liver histology and the correlated index in patients with chronic hepatitis B and normal ALT levels[J]. J Pract Med, 2012, 28( 9): 1447- 1449. DOI: 10.3969/j.issn.1006-5725.2012.09.020.农村立, 龙腾河, 郭堑. ALT正常的慢性乙型肝炎肝组织学特点相关性无创指标分析[J]. 实用医学杂志, 2012, 28( 9): 1447- 1449. DOI: 10.3969/j.issn.1006-5725.2012.09.020. [14] YANG Q, LIU HE, YOU J, et al. Noninvasive diagnostic models for chronic hepatitis B liver fibrosis[J]. J Clin Hepatol, 2021, 37( 10): 2420- 2424. DOI: 10.3969/j.issn.1001-5256.2021.10.034.杨琴, 刘怀鄂, 游晶, 等. 慢性乙型肝炎肝纤维化的无创诊断模型[J]. 临床肝胆病杂志, 2021, 37( 10): 2420- 2424. DOI: 10.3969/j.issn.1001-5256.2021.10.034. [15] WEN Y, QU ZY, LU JN, et al. Value of liver-muscle signal intensity and serum markers in diagnosis of chronic hepatitis B liver fibrosis[J]. J Clin Hepatol, 2023, 39( 3): 573- 579. DOI: 10.3969/j.issn.1001-5256.2023.03.014.温雅, 屈兆宇, 鲁景楠, 等. 肝肌信号强度比及血清标志物对慢性乙型肝炎肝纤维化的诊断价值[J]. 临床肝胆病杂志, 2023, 39( 3): 573- 579. DOI: 10.3969/j.issn.1001-5256.2023.03.014. [16] LEE MH, CHEONG JY, UM SH, et al. Comparison of surrogate serum markers and transient elastography(fibroscan) for assessing cirrhosis in patients with chronic viral hepatitis[J]. Dig Dis Sci, 2010, 55( 12): 3552- 3560. DOI: 10.1007/s10620-010-1219-0. [17] ADINOLFI LE, GIORDANO MG, ANDREANA A, et al. Hepatic fibrosis plays a central role in the pathogenesis of thrombocytopenia in patients with chronic viral hepatitis[J]. Br J Haematol, 2001, 113( 3): 590- 595. DOI: 10.1046/j.1365-2141.2001.02824.x. [18] CHEN YC, HSU CW, JENG WJ, et al. Advanced liver fibrosis is associated with necroinflammatory grade but not hepatic steatosis in chronic hepatitis B patients[J]. Dig Dis Sci, 2021, 66( 12): 4492- 4500. DOI: 10.1007/s10620-020-06761-x. [19] DENG Y, ZHANG S, JI D. Research progress on low-level viremia in chronic hepatitis B[J]. Infect Dis Inf, 2021, 34( 4): 342- 346. DOI: 10.3969/j.issn.1007-8134.2021.04.014.邓亚, 张珊, 纪冬. 慢性乙型肝炎低水平病毒血症的研究进展[J]. 传染病信息, 2021, 34( 4): 342- 346. DOI: 10.3969/j.issn.1007-8134.2021.04.014. [20] LI YD, FAN RS. Analysis of indications for antiviral therapy in chronic HBV patients with persistent normal level of alanine aminotransferase[J/CD]. Electron J Emerg Infect Dis, 2023, 8( 1): 44- 47. DOI: 10.19871/j.cnki.xfcrbzz.2023.01.009.李延东, 范荣山. 谷丙转氨酶持续正常的慢性乙型肝炎病毒感染者肝脏病理特征及预测因素[J/CD]. 新发传染病电子杂志, 2023, 8( 1): 44- 47. DOI: 10.19871/j.cnki.xfcrbzz.2023.01.009. [21] ZHENG M, CAI WM, WENG HL, et al. ROC curve in evaluation of serum fibrosis index for diagnosing hepatic fibrosis[J]. Chin J Infect Dis, 2002, 20( 4): 225- 228. DOI: 10.3760/j.issn: 1000-6680.2002.04.009.郑敏, 蔡卫民, 翁红雷, 等. ROC曲线评价血清纤维化指标对诊断肝纤维化的价值[J]. 中华传染病杂志, 2002, 20( 4): 225- 228. DOI: 10.3760/j.issn:1000-6680.2002.04.009. -



 PDF下载 ( 831 KB)
PDF下载 ( 831 KB)

 下载:
下载:


