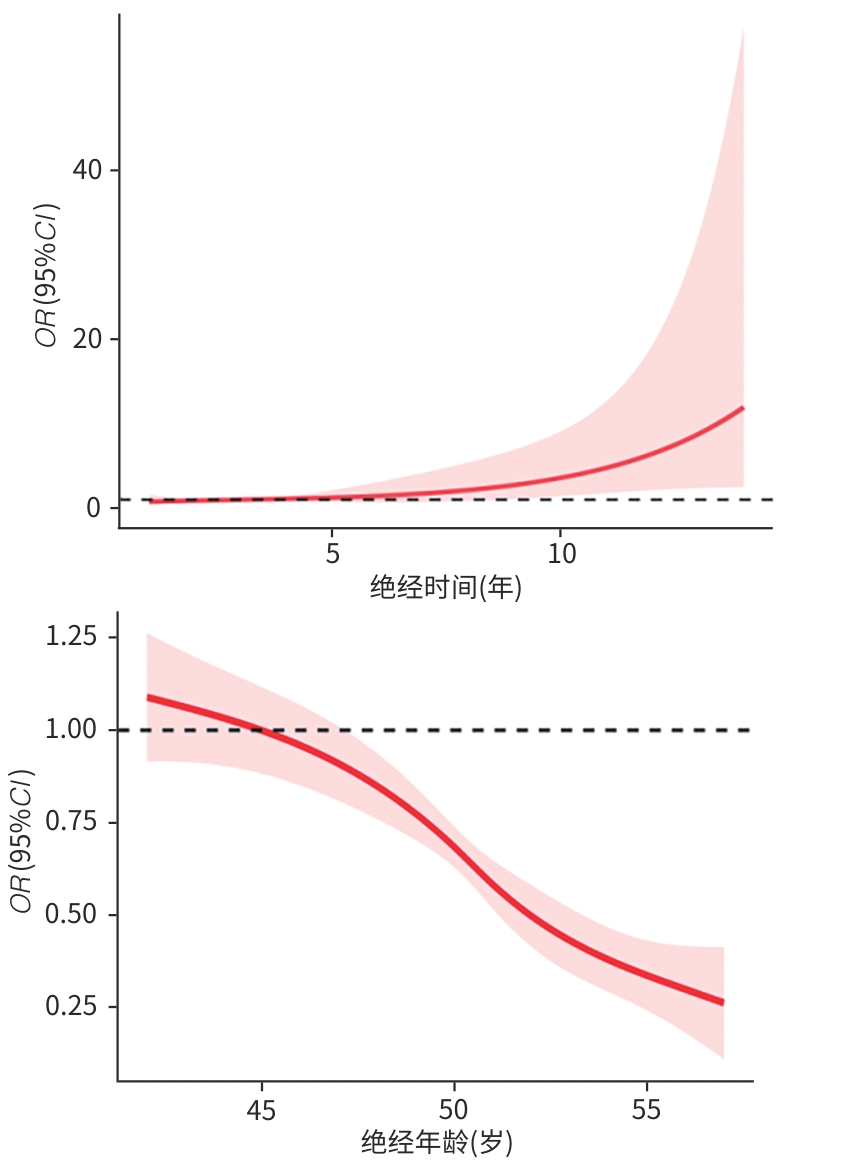
基于限制性立方样条模型分析绝经时间、绝经年龄与非酒精性脂肪性肝病的关系
DOI: 10.12449/JCH250209
Association of menopausal time and menopausal age with nonalcoholic fatty liver disease: An analysis based on a restricted cubic spline model
-
摘要:
目的 探讨绝经时间、绝经年龄与非酒精性脂肪性肝病(NAFLD)发病风险的关系,为临床早期防治NAFLD提供依据。 方法 收集2017年1月—2021年12月就诊于河南中医药大学第一附属医院脾胃肝胆病科门诊的373例绝经后女性患者的基本信息、绝经年龄、绝经时间及是否患有NAFLD。计数资料组间比较采用χ2检验;符合正态分布的计量资料两组间比较采用成组t检验,不符合正态分布的计量资料两组间比较采用Wilcoxon秩和检验;采用Logistic回归分析绝经时间、年龄与NAFLD风险的关联强度(OR)及95%CI,采用限制性立方样条法(RCS)分析绝经时间、年龄与NAFLD患病风险的剂量反应关系。 结果 与正常绝经和晚期绝经者相比,早期绝经者的NAFLD患病率、肝脂肪变性和肝纤维化分级程度均较高(P值均<0.05)。调整年龄、初潮年龄等混杂因素后,与绝经时间≤3年相比,绝经时间>3年者NAFLD患病风险为前者的4.80倍(95%CI:1.93~11.95,P=0.001);与正常绝经年龄者相比,早期绝经年龄者和晚期绝经年龄者NAFLD患病风险分别为前者的8.14倍(95%CI:1.77~37.58,P=0.007)和0.09倍(95%CI:0.03~0.32,P<0.001)。绝经时间、绝经年龄与NAFLD患病风险呈现剂量-反应关系,绝经时间与NAFLD患病关联强度呈正相关,而绝经年龄与NAFLD患病关联强度呈负相关。 结论 绝经时间越长、绝经年龄越早者患NAFLD风险越高。 Abstract:Objective To investigate the association of menopausal time and menopausal age with the risk of nonalcoholic fatty liver disease (NAFLD), and to provide a basis for the early prevention and treatment of NAFLD in clinical practice. Methods Related data were collected from 373 postmenopausal women who attended the outpatient service of Department of Spleen, Stomach, Liver and Gallbladder Diseases, The First Affiliated Hospital of Henan University of Chinese Medicine, from January 2017 to December 2021, including general information, menopausal age, menopausal time, and presence or absence of NAFLD. The chi-square test was used for comparison of categorical data; the independent-samples t test was used for comparison of normally distributed continuous data between groups, and the Wilcoxon rank-sum test was used for comparison of non-normally distributed continuous data between groups. A Logistic regression analysis was used to calculate the association intensity and 95% confidence interval (95%CI) of menopausal time and menopausal age for the risk of NAFLD, and the restricted cubic spline (RCS) method was used to investigate the dose-response relationship between menopausal time/age and the risk of NAFLD. Results Compared with the women with normal menopause or late menopause, the women with early menopause had a higher prevalence rate of NAFLD and a higher degree of steatosis and fibrosis (all P<0.05). After adjustment for the confounding factors such as age and age of menarche, the risk of NAFLD in women with a menopausal time of >3 years was 4.80 (95%CI: 1.93 — 11.95, P=0.001) times that in women with a menopausal time of ≤3 years, and the risk of NAFLD in women with early or late menopause was 8.14 times (95%CI: 1.77 — 37.58, P=0.007) and 0.09 times (95%CI: 0.03 — 0.32, P<0.001), respectively, that in those with a normal menopausal age. There is a dose-response relationship between menopausal time/age and the risk of NAFLD. Menopausal time is positively correlated with the association intensity of NAFLD, while menopausal age is negatively correlated with the association intensity of NAFLD. Conclusion The longer the menopause time and the earlier the menopause age, the ligher the risk of NAFLD. -
Key words:
- Non-alcoholic Fatty Liver Disease /
- Menopause /
- Restricted Cubic Spline
-
表 1 一般资料比较
Table 1. Comparison of general data
项目 NAFLD(n=266) 非NAFLD(n=107) 统计值 P值 年龄(岁) 54.88±7.28 54.72±5.80 t=0.151 0.880 初潮年龄(岁) 13.15±1.24 13.06±0.99 t=0.703 0.483 绝经年龄(岁) 49.50±4.05 51.31±3.85 t=0.839 <0.001 绝经时间(年) 3.00(1.00~9.00) 2.00(1.00~5.00) Z=-3.255 0.001 手术绝经[有/无,例(%)] 45(16.9)/221(83.1) 12(11.2)/95(88.8) χ2=1.917 0.166 BMI(kg/m2) 27.93±2.68 23.76±3.92 t=11.783 <0.001 腰围(cm) 91.82±14.03 79.92±8.95 t=8.129 <0.001 合并症[例(%)] 高血压 30(11.3) 11(10.3) χ2=0.078 0.781 2型糖尿病 23(8.6) 6(5.6) χ2=0.983 0.321 高脂血症 25(9.4) 6(5.6) χ2=1.439 0.230 高尿酸血症 10(3.8) 8(7.5) χ2=2.296 0.130 肥胖 117(44.0) 23(21.5) χ2=16.461 <0.001 焦虑 55(20.7) 14(13.1) χ2=2.918 0.088 围绝经期综合征 70(26.3) 23(21.5) χ2=0.947 0.330 实验室参数 ALT(U/L) 24.60(16.85~38.10) 15.70(11.23~21.68) Z=-6.369 <0.001 AST(U/L) 23.55(19.45~32.90) 18.80(14.70~20.30) Z=-7.748 <0.001 GGT(U/L) 22.40(15.85~31.65) 18.70(15.10~24.68) Z=-2.865 0.004 TG(mmol/L) 1.60±0.84 1.25±0.77 t=3.690 <0.001 TC(mmol/L) 4.94±1.16 4.48±0.95 t=3.636 <0.001 HDL(mmol/L) 1.27±0.27 1.36±0.18 t=-3.173 0.002 LDL(mmol/L) 3.02±1.00 2.43±0.80 t=5.445 <0.001 FFA(mmol/L) 0.58±0.32 0.47±0.28 t=3.069 0.002 UA(μmol/L) 302.78±78.46 283.34±78.89 t=2.160 0.031 FBG(mmol/L) 5.77±1.28 5.73±0.88 t=0.281 0.779 E2(pg/mL) 21.68±7.90 23.25±7.59 t=-1.762 0.079 肝脏评估 CAP(dB/m) 284.74±43.86 263.77±27.92 t=4.585 <0.001 LSM(kPa) 6.35±1.84 5.91±1.63 t=2.180 0.030 FIB-4 1.34(1.02~1.91) 1.11(0.78~1.36) Z=-5.313 <0.001 APRI 0.35(0.26~0.50) 0.22(0.18~0.27) Z=-8.007 <0.001 表 2 不同绝经年龄组NAFLD、肝脂肪变性、肝纤维化分级的百分比比较
Table 2. Comparison of the percentage of NAFLD, steatosis and fibrosis in different menopausal age groups
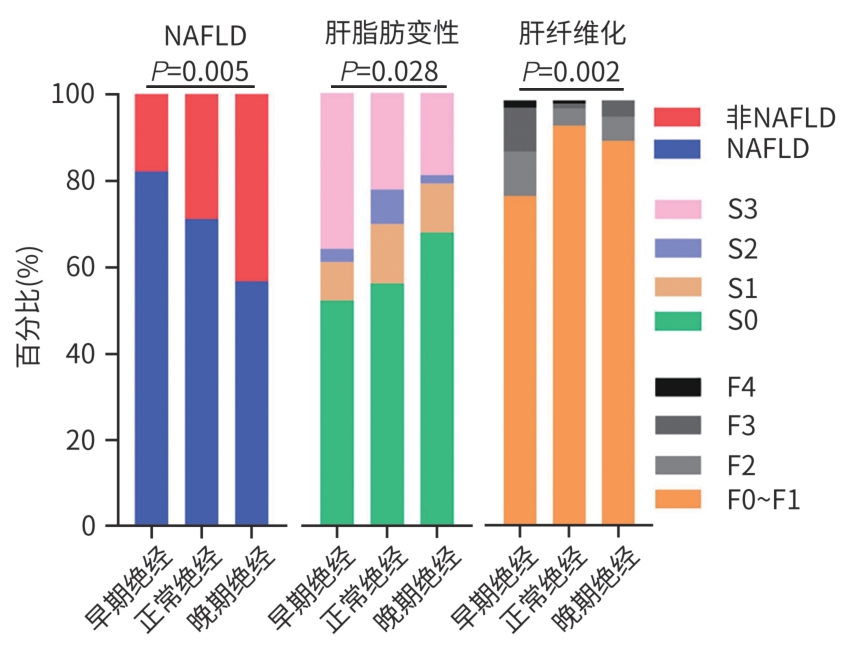
项目 早期绝经(n=67) 正常绝经(n=253) 晚期绝经(n=53) χ2值 P值 NAFLD[例(%)] 56(83.6) 180(71.1) 30(56.6) 10.539 0.005 非NAFLD[例(%)] 11(16.4) 73(28.9) 23(43.4) 肝脂肪变性分级[例(%)] 4.822 0.028 S0 35(52.2) 142(56.1) 36(67.9) S1 6(9.0) 35(13.8) 6(11.3) S2 2(3.0) 20(7.9) 1(1.9) S3 24(35.9) 56(22.1) 10(18.9) 肝纤维化分级[例(%)] 20.767 0.002 F0~F1 52(77.6) 238(94.1) 48(90.6) F2 7(10.4) 10(4.0) 3(5.7) F3 7(10.4) 3(1.2) 2(3.8) F4 1(1.5) 2(0.8) 0(0.0) 表 3 绝经时间、年龄与NAFLD患病风险的Logistic 回归分析
Table 3. Logistic regression analysis of menopausal time, age and risk of NAFLD
项目 模型1 模型2 模型3 crude OR(95%CI) P值 adjusted OR(95%CI) P值 adjusted OR(95%CI) P值 绝经时间 ≤3年 >3年 1.74(1.10~2.77) 0.018 3.11(1.72~5.62) <0.001 4.80(1.93~11.95) 0.001 绝经年龄 早期 2.07(1.02~4.16) 0.043 8.77(3.18~24.19) <0.001 8.14(1.77~37.58) 0.007 正常 晚期 0.53(0.29~0.97) 0.040 0.30(0.14~0.64) 0.002 0.09(0.03~0.32) <0.001 注:模型1为单因素模型;模型2调整了年龄、初潮年龄、绝经时间或绝经年龄;模型3在模型2的基础上调整了BMI、腰围、是否肥胖、ALT、AST、GGT、TG、TC、HDL、LDL、FFA、UA、E2、CAP、LSM、FIB-4、APRI。
-
[1] DISTEFANO JK. NAFLD and NASH in postmenopausal women: Implications for diagnosis and treatment[J]. Endocrinology, 2020, 161( 10): bqaa134. DOI: 10.1210/endocr/bqaa134. [2] BENCE KK, BIRNBAUM MJ. Metabolic drivers of non-alcoholic fatty liver disease[J]. Mol Metab, 2021, 50: 101143. DOI: 10.1016/j.molmet.2020.101143. [3] KLAIR JS, YANG JD, ABDELMALEK MF, et al. A longer duration of estrogen deficiency increases fibrosis risk among postmenopausal women with nonalcoholic fatty liver disease[J]. Hepatology, 2016, 64( 1): 85- 91. DOI: 10.1002/hep.28514. [4] Menopausal Group of Obstetrics and Gynecology Branch of Chinese Medical Association. The 2023 Chinese menopause symptom management and menopausal hormone therapy guidelines[J]. Chin J Obstet Gynecol, 2023, 58( 1): 4- 21. DOI: 10.3760/cma.j.cn112141-20221118-00706.中华医学会妇产科学分会绝经学组. 中国绝经管理与绝经激素治疗指南2023版[J]. 中华妇产科杂志, 2023, 58( 1): 4- 21. DOI: 10.3760/cma.j.cn112141-20221118-00706. [5] National Workshop on Fatty Liver and Alcoholic Liver Disease, Chinese Society of Hepatology, Chinese Medical Association; Fatty Liver Expert Committee, Chinese Medical Doctor Association. Guidelines of prevention and treatment for nonalcoholic fatty liver disease: A 2018 update[J]. J Clin Hepatol, 2018, 34( 5): 947- 957. DOI: 10.3969/j.issn.1001-5256.2018.05.007.中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 非酒精性脂肪性肝病防治指南(2018年更新版)[J]. 临床肝胆病杂志, 2018, 34( 5): 947- 957. DOI: 10.3969/j.issn.1001-5256.2018.05.007. [6] Liver Disease Committee, Chinese Association of Integrative Medicine. Guidelines for the diagnosis and treatment of liver fibrosis in integrative medicine practice(2019)[J]. J Clin Hepatol, 2019, 35( 7): 1444- 1449. DOI: 10.3969/j.issn.1001-5256.2019.07.007.中国中西医结合学会肝病专业委员会. 肝纤维化中西医结合诊疗指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35( 7): 1444- 1449. DOI: 10.3969/j.issn.1001-5256.2019.07.007. [7] EDDOWES PJ, SASSO M, ALLISON M, et al. Accuracy of FibroScan controlled attenuation parameter and liver stiffness measurement in assessing steatosis and fibrosis in patients with nonalcoholic fatty liver disease[J]. Gastroenterology, 2019, 156( 6): 1717- 1730. DOI: 10.1053/j.gastro.2019.01.042. [8] YOUNOSSI ZM, KOENIG AB, WYMER M, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64( 1): 73- 84. DOI: 10.1002/hep.28431. [9] ROBEVA R, MLADENOVIĆ D, VESKOVIĆ M, et al. The interplay between metabolic dysregulations and non-alcoholic fatty liver disease in women after menopause[J]. Maturitas, 2021, 151: 22- 30. DOI: 10.1016/j.maturitas.2021.06.012. [10] LOBO RA, GOMPEL A. Management of menopause: A view towards prevention[J]. Lancet Diabetes Endocrinol, 2022, 10( 6): 457- 470. DOI: 10.1016/S2213-8587(21)00269-2. [11] GEORGIOPOULOS G, KONTOGIANNIS C, STAKOS D, et al. Abdominal fat tissue echogenicity: A marker of morbid obesity[J]. J Clin Endocrinol Metab, 2019, 104( 2): 301- 311. DOI: 10.1210/jc.2018-01301. [12] JEONG HG, PARK H. Metabolic disorders in menopause[J]. Metabolites, 2022, 12( 10): 954. DOI: 10.3390/metabo12100954. [13] WANG XY, WANG LH, DI JL, et al. Prevalence and risk factors for menopausal symptoms in middle-aged Chinese women: A community-based cross-sectional study[J]. Menopause, 2021, 28( 11): 1271- 1278. DOI: 10.1097/GME.0000000000001850. [14] WU YJ, ZHANG WS, ZHU F, et al. Correlation between natural menopause age and postmenopausal metabolic syndrome[J]. Chin J Prev Med, 2023, 57( 3): 433- 437. DOI: 10.3760/cma.j.cn112150-20220601-00560.吴永君, 张维森, 朱峰, 等. 自然绝经年龄与绝经后代谢综合征的相关性研究[J]. 中华预防医学杂志, 2023, 57( 3): 433- 437. DOI: 10.3760/cma.j.cn112150-20220601-00560. [15] MENG X, LI SY, DUAN WH, et al. Secular trend of age at menarche in Chinese adolescents born from 1973 to 2004[J]. Pediatrics, 2017, 140( 2): e20170085. DOI: 10.1542/peds.2017-0085. [16] WU ZY, XU YW, ZHANG LM. Correlation analysis of liver fibrosis with menopausal time and estrogen deficiency time in female patients with NAFLD[J]. Chin Hepatol, 2019, 24( 10): 1182- 1184. DOI: 10.14000/j.cnki.issn.1008-1704.2019.10.032.吴宗妍, 徐优文, 张立梅. NAFLD女性患者肝纤维化与绝经时间和雌激素缺乏时间的相关性分析[J]. 肝脏, 2019, 24( 10): 1182- 1184. DOI: 10.14000/j.cnki.issn.1008-1704.2019.10.032. [17] WEGERMANN K, GARRETT ME, ZHENG JY, et al. Sex and menopause modify the effect of single nucleotide polymorphism genotypes on fibrosis in NAFLD[J]. Hepatol Commun, 2021, 5( 4): 598- 607. DOI: 10.1002/hep4.1668. [18] LEE YH, SON JY, KIM KS, et al. Estrogen deficiency potentiates thioacetamide-induced hepatic fibrosis in sprague-dawley rats[J]. Int J Mol Sci, 2019, 20( 15): 3709. DOI: 10.3390/ijms20153709. [19] DOTLIC J, NICEVIC S, KURTAGIC I, et al. Hormonal therapy in menopausal transition: Implications for improvement of health-related quality of life[J]. Gynecol Endocrinol, 2020, 36( 4): 327- 332. DOI: 10.1080/09513590.2019.1676409. [20] CAI XY, ZHANG ZJ. Pharmacological effects of phytoestrogens and research progress of related traditional Chinese medicine[J]. Res Pract Chin Med, 2020, 34( 2): 75- 78, 86. DOI: 10.13728/j.1673-6427.2020.02.015.蔡心银, 张紫佳. 植物雌激素药理作用及相关中药的研究进展[J]. 现代中药研究与实践, 2020, 34( 2): 75- 78, 86. DOI: 10.13728/j.1673-6427.2020.02.015. -



 PDF下载 ( 1241 KB)
PDF下载 ( 1241 KB)

 下载:
下载: