不同无创诊断模型对代偿期乙型肝炎肝硬化显著门静脉高压食管胃静脉曲张的诊断价值
DOI: 10.12449/JCH250211
Value of different noninvasive diagnostic models in the diagnosis of esophageal and gastric varices with significant portal hypertension in compensated hepatitis B cirrhosis
-
摘要:
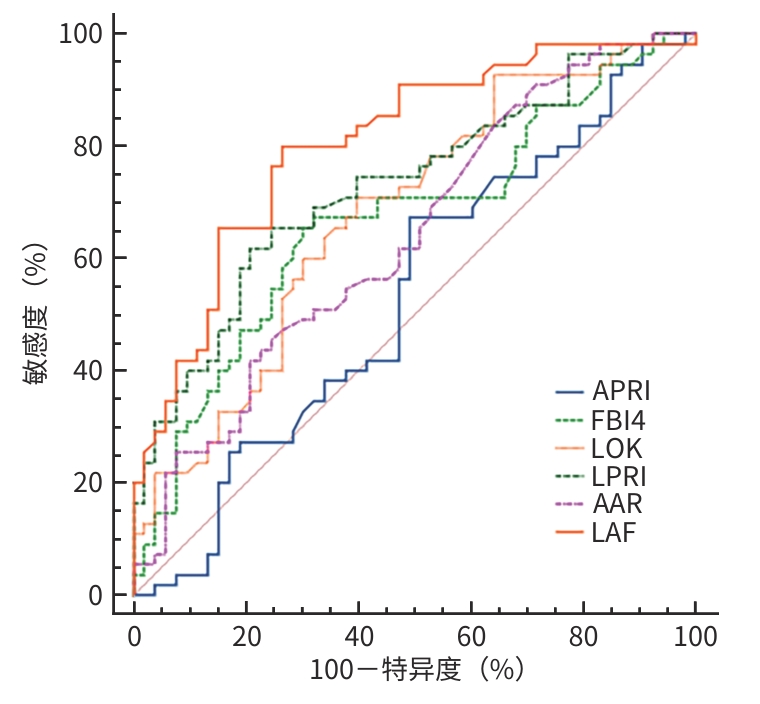
目的 代偿期乙型肝炎肝硬化显著门静脉高压患者发生食管胃静脉曲张(GOV)风险较大,通过评价不同无创诊断模型对GOV的诊断价值,为早期诊断GOV提供依据。 方法 选取2017年11月—2023年11月广东省中医院就诊的代偿期乙型肝炎肝硬化显著门静脉高压患者108例,根据胃镜下是否伴发GOV将患者分为GOV组和非GOV组(NGOV组)。收集患者的年龄、性别、影像学、实验室指标等结果。计数资料组间比较采用χ2检验;正态分布的计量资料两组间比较采用成组t检验;非正态分布的数据两组间比较采用Mann-Whitney U检验。采用受试者操作特征曲线(ROC曲线)评估FIB-4、LOK指数、LPRI、APRI、AAR等5种评分模型的诊断价值;利用二元Logistic回归构建联合模型,将联合模型与5种评分模型单独应用时的ROC曲线下面积(AUC)比较;采用Delong检验对各无创诊断模型的AUC值进行两两比较。 结果 GOV组55例,NGOV组53例。GOV组的年龄高于NGOV组[(52.64±1.44)岁 vs (47.96±1.68)岁],ALT[42.00(24.00~117.00) U/L vs 82.00(46.00~271.00) U/L]、AST[44.00(32.00~96.00) U/L vs 62.00(42.50~154.50) U/L]、PLT[100.00(69.00~120.00)×109/L vs 119.00(108.50~140.50)×109/L]低于NGOV组,差异均有统计学意义(统计值分别为3.230、-3.065、-2.351、-3.667,P值均<0.05)。ROC曲线分析显示,FIB-4、LOK指数、LPRI、AAR单独诊断GOV的AUC分别为0.667、0.681、0.730、0.639(P值均<0.05),GOV阳性诊断率分别为69.97%、65.28%、67.33%、58.86%,AUC值比较差异均无统计学意义(P值均>0.05),APRI单独应用无诊断价值(P>0.05)。利用二元Logistic回归构建联合模型LAF,AUC为0.805,GOV阳性诊断率为75.80%,明显高于FIB-4、LOK指数、LPRI、AAR单独应用时的AUC值(Z值分别为-2.773、-2.479、-2.206、-2.672,P值均<0.05)。 结论 FIB-4、LOK指数、LPRI、AAR对代偿期乙型肝炎肝硬化显著门静脉高压患者发生GOV诊断价值相似,APRI单独应用无诊断价值,联合模型LAF的诊断效能最佳,对临床推广和应用具有一定参考价值。 Abstract:Objective To investigate the value of different noninvasive diagnostic models in the diagnosis of esophageal and gastric varices since there is a high risk of esophageal and gastric varices in patients with compensated hepatitis B cirrhosis and significant portal hypertension, and to provide a basis for the early diagnosis of esophageal and gastric varices. Methods A total of 108 patients with significant portal hypertension due to compensated hepatitis B cirrhosis who attended Guangdong Provincial Hospital of Traditional Chinese Medicine from November 2017 to November 2023 were enrolled, and according to the presence or absence of esophageal and gastric varices under gastroscopy, they were divided into esophageal and gastric varices group (GOV group) and non-esophageal and gastric varices group (NGOV group). Related data were collected, including age, sex, imaging findings, and laboratory markers. The chi-square test was used for comparison of categorical data between groups; the least significant difference t-test was used for comparison of normally distributed continuous data between groups, and the Mann-Whitney U test was used for comparison of non-normally distributed continuous data between groups. The receiver operating characteristic (ROC) curve was plotted to evaluate the diagnostic value of five scoring models, i.e., fibrosis-4 (FIB-4), LOK index, LPRI, aspartate aminotransferase-to-platelet ratio index (APRI), and aspartate aminotransferase/alanine aminotransferase ratio (AAR). The binary logistic regression method was used to establish a combined model, and the area under the ROC curve (AUC) was compared between the combined model and each scoring model used alone. The Delong test was used to compare the AUC value between any two noninvasive diagnostic models. Results There were 55 patients in the GOV group and 53 patients in the NGOV group. Compared with the NGOV group, the GOV group had a significantly higher age (52.64±1.44 years vs 47.96±1.68 years, t=0.453, P<0.05) and significantly lower levels of alanine aminotransferase [42.00 (24.00 — 17.00) U/L vs 82.00 (46.00 — 271.00) U/L, Z=-3.065, P<0.05], aspartate aminotransferase [44.00 (32.00 — 96.00) U/L vs 62.00 (42.50 — 154.50) U/L,Z=-2.351, P<0.05], and platelet count [100.00 (69.00 — 120.00)×109/L vs 119.00 (108.50 — 140.50)×109/L, Z=-3.667, P<0.05]. The ROC curve analysis showed that FIB-4, LOK index, LPRI, and AAR used alone had an accuracy of 0.667, 0.681, 0.730, and 0.639, respectively, in the diagnosis of esophageal and gastric varices (all P<0.05), and the positive diagnostic rates of GOV were 69.97%, 65.28%, 67.33%, and 58.86%, respectively, with no significant differences in AUC values (all P>0.05), while APRI used alone had no diagnostic value (P>0.05). A combined model (LAF) was established based on the binary logistic regression analysis and had an AUC of 0.805 and a positive diagnostic rate of GOV of 75.80%, with a significantly higher AUC than FIB-4, LOK index, LPRI, and AAR used alone (Z=-2.773,-2.479,-2.206, and-2.672, all P<0.05). Conclusion FIB-4, LOK index, LPRI, and AAR have a similar diagnostic value for esophageal and gastric varices in patients with compensated hepatitis B cirrhosis and significant portal hypertension, and APRI alone has no diagnostic value. The combined model LAF had the best diagnostic efficacy, which provides a certain reference for clinical promotion and application. -
Key words:
- Liver Cirrhosis /
- Hepatitis B /
- Hypertension, Portal /
- Esophageal and Gastric Varices
-
表 1 两组患者基线资料比较
Table 1. Comparison of baseline characteristics among the two groups of patients
指标 GOV组(n=55) NGOV组(n=53) 统计值 P值 男/女(例) 48/7 39/14 χ2=3.230 0.072 年龄(岁) 52.64±1.44 47.96±1.68 t=0.453 0.037 LSM(kPa) 32.40(26.60~38.90) 29.90(26.70~35.80) Z=-1.025 0.306 ALT(U/L) 42.00(24.00~117.00) 82.00(46.00~271.00) Z=-3.065 0.002 AST(U/L) 44.00(32.00~96.00) 62.00(42.50~154.50) Z=-2.351 0.019 TBil(mmol/L) 24.30(15.80~36.18) 22.90(15.70~41.25) Z=-0.246 0.805 Alb(g/L) 39.36(34.00~43.50) 39.36(38.85~43.40) Z=-0.998 0.318 ALP(U/L) 110.00(84.00~126.00) 115.60(86.00~115.60) Z=-0.291 0.771 GGT(U/L) 88.00(43.00~120.27) 99.00(65.50~160.50) Z=-1.692 0.091 INR 1.18(1.13~1.22) 1.18(1.14~1.22) Z=-0.461 0.645 PLT(109/L) 100.00(69.00~120.00) 119.00(108.50~140.50) Z=-3.667 <0.001 表 2 各无创模型单独或联合应用对GOV诊断效能的比较
Table 2. Comparison of the diagnostic efficacy of non-invasive diagnostic models alone or in combination for esophageal and gastric varices
指标 临界值 AUC(95%CI) P值 敏感度(%) 特异度(%) 阳性预测值(%) 阴性预测值(%) P值1) FIB-4 3.425 0.667(0.564~0.770) 0.003 65.5 69.8 69.97 67.97 0.005 LOK 0.777 0.681(0.580~0.781) 0.001 70.9 60.4 65.28 61.90 0.014 LPRI 0.397 0.730(0.635~0.824) <0.001 66.5 75.5 67.33 77.42 0.028 AAR 0.245 0.639(0.535~0.743) 0.013 83.5 39.6 58.86 72.66 0.007 APRI 0.546 0.466(0.355~0.576) 0.537 96.4 13.2 53.54 80.82 <0.001 LAF -0.185 0.805(0.722~0.887) <0.001 80.0 73.6 75.80 56.56 注:1)P值表示联合模型LAF与其他模型AUC比较结果。
-
[1] MORRISON JD, MENDOZA-ELIAS N, LIPNIK AJ, et al. Gastric varices bleed at lower portosystemic pressure gradients than esophageal varices[J]. J Vasc Interv Radiol, 2018, 29( 5): 636- 641. DOI: 10.1016/j.jvir.2017.10.014. [2] Chinese Society of Hepatology, Chinese Society of Gastroenterology, and Chinese Society of Digestive Endoscopology of Chinese Medical Association. Guidelines on the management of esophagogastric variceal bleeding in cirrhotic portal hypertension[J]. J Clin Hepatol, 2023, 39( 3): 527- 538.中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会消化内镜学分会. 肝硬化门静脉高压食管胃静脉曲张出血的防治指南[J]. 临床肝胆病杂志, 2023, 39( 3): 527- 538. [3] de FRANCHIS R, BOSCH J, GARCIA-TSAO G, et al. Baveno VII-Renewing consensus in portal hypertension[J]. J Hepatol, 2022, 76( 4): 959- 974. DOI: 10.1016/j.jhep.2021.12.022. [4] DENG H, QI X, PENG Y, et al. Diagnostic accuracy of APRI, AAR, FIB-4, FI, and King Scores for diagnosis of esophageal varices in liver cirrhosis: A retrospective study[J]. Med Sci Monit, 2015, 21: 3961- 3977. DOI: 10.12659/msm.895005. [5] YAN YJ, LI Y, FAN CL, et al. A novel machine learning-based radiomic model for diagnosing high bleeding risk esophageal varices in cirrhotic patients[J]. Hepatol Int, 2022, 16( 2): 423- 432. DOI: 10.1007/s12072-021-10292-6. [6] GINES P, KRAG A, ABRAIDES JG, et al. Liver cirrhosis[J]. Lancet, 2021, 398( 10308): 1359- 1376. DOI: 10.1016/S0140-6736(21)01374-X [7] PARK JJ, PARK JY, KIM DY, et al. Prediction of significant fibrosis in chronic hepatitis C patients with normal ALT[J]. Hepatogastroenterology, 2011, 58( 109): 1321- 1327. DOI: 10.5754/hge11041. [8] Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B(version 2022)[J]. Chin J Infect Dis, 2023, 41( 1): 3- 28. DOI: 10.3760/cma.j.cn311365-20230220-00050.中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 中华传染病杂志, 2023, 41( 1): 3- 28. DOI: 10.3760/cma.j.cn311365-20230220-00050. [9] Chinese Society of Hepatology, Chinese Medical Association. Chinese guidelines on the management of liver cirrhosis[J]. J Clin Hepatol, 2019, 35( 11): 2408- 2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006.中华医学会肝病学分会. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35( 11): 2408- 2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006. [10] SUN DY. Predictive value of FIB-4, Lok and King scores for esophageal varices in liver cirrhosis[D]. Hefei: Anhui Medical University, 2021.孙迪一. FIB-4、Lok和King评分对肝硬化食管静脉曲张的预测价值[D]. 合肥: 安徽医科大学, 2021. [11] LI N, ZHENG SQ, ZHAO SS. Application of FibroS can, APRI, FIB-4 and GPR in prediction of esophageal varices in patients with liver cirrhosis[J]. J Pract Hepatol, 2020, 23( 4): 560- 563. DOI: 10.3969/j.issn.1672-5069.2020.04.027.李娜, 郑少秋, 赵守松. FibroScan联合多种预测模型预测肝硬化患者食管静脉曲张程度应用价值探讨[J]. 实用肝脏病杂志, 2020, 23( 4): 560- 563. DOI: 10.3969/j.issn.1672-5069.2020.04.027. [12] ZHU X, XI XL, HAN JT. Predictive value of serum fibrosis index-4 APRI AAR for esophageal and gastric varices in patients with hepatitis B cirrhosis[J]. Med Forum, 2024, 28( 1): 22- 25. DOI: 10.19435/j.1672-1721.2024.01.007.朱欣, 习晓丽, 韩江涛. 血清学指标纤维化指数-4 APRI AAR对乙型肝炎肝硬化患者食管胃底静脉曲张的预测价值[J]. 基层医学论坛, 2024, 28( 1): 22- 25. DOI: 10.19435/j.1672-1721.2024.01.007. [13] WANG SM, WANG N, YU Z, et al. Diagnostic values of APRI, AAR, and FIB-4 predictive models in autoimmune cirrhosis combined with esophagogastric fundal varices[J]. J Jilin Univ(Med Ed), 2024, 50( 2): 523- 528. DOI: 10.13481/j.1671-587X.20240227.王素梅, 王楠, 于珍, 等. APRI、AAR和FIB-4等预测模型对自身免疫性肝硬化伴食管胃底静脉曲张的诊断价值[J]. 吉林大学学报(医学版), 2024, 50( 2): 523- 528. DOI: 10.13481/j.1671-587X.20240227. [14] CHEN ZM, HUANG DY, LIU HY, et al. Clinical value of transient elastography combined with aspartate aminotransferase to platelet ratio index and fibrosis index based on four factors for predicting the severity of esophageal varices in hepatic cirrhosis[J]. Acad J Guangzhou Med Univ, 2016, 44( 2): 22- 25. DOI: 10.3969/j.issn.1008-1836.2016.02.006.陈志敏, 黄德扬, 刘惠媛, 等. 瞬时弹性成像联合天冬氨酸转氨酶/血小板比值指数和FIB-4指数预测肝硬化食管静脉曲张程度的临床价值[J]. 广州医科大学学报, 2016, 44( 2): 22- 25. DOI: 10.3969/j.issn.1008-1836.2016.02.006. [15] WAI CT, GREENSON JK, FONTANA RJ, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C[J]. Hepatology, 2003, 38( 2): 518- 526. DOI: 10.1053/jhep.2003.50346. [16] GIANNINI E, RISSO D, BOTTA F, et al. Validity and clinical utility of the aspartate aminotransferase-alanine aminotransferase ratio in assessing disease severity and prognosis in patients with hepatitis C virus-related chronic liver disease[J]. Arch Intern Med, 2003, 163( 2): 218- 224. DOI: 10.1001/archinte.163.2.218. [17] VALLET-PICHARD A, MALLET V, NALPAS B, et al. FIB-4: An inexpensive and accurate marker of fibrosis in HCV infection. comparison with liver biopsy and fibrotest[J]. Hepatology, 2007, 46( 1): 32- 36. DOI: 10.1002/hep.21669. [18] OHTA T, SAKAGUCHI K, FUJIWARA A, et al. Simple surrogate index of the fibrosis stage in chronic hepatitis C patients using platelet count and serum albumin level[J]. Acta Med Okayama, 2006, 60( 2): 77- 84. DOI: 10.18926/AMO/30729. [19] QI XS, LI HY, CHEN J, et al. Serum liver fibrosis markers for predicting the presence of gastroesophageal varices in liver cirrhosis: A retrospective cross-sectional study[J]. Gastroenterol Res Pract, 2015, 2015: 274534. DOI: 10.1155/2015/274534. [20] ZHOU JL, WANG BQ, SUN YM, et al. Application value of liver stiffness measurement-to-platelet ratio index score in diagnosis of hepatitis B liver fibrosis and liver cirrhosis[J]. J Clin Hepatol, 2022, 38( 7): 1529- 1533. DOI: 10.3969/j.issn.1001-5256.2022.07.014.周家玲, 王冰琼, 孙亚朦, 等. LPRI评分在乙型肝炎肝纤维化及肝硬化中的诊断价值[J]. 临床肝胆病杂志, 2022, 38( 7): 1529- 1533. DOI: 10.3969/j.issn.1001-5256.2022.07.014. [21] SEBASTIANI G, TEMPESTA D, FATTOVICH G, et al. Prediction of oesophageal varices in hepatic cirrhosis by simple serum non-invasive markers: Results of a multicenter, large-scale study[J]. J Hepatol, 2010, 53( 4): 630- 638. DOI: 10.1016/j.jhep.2010.04.019. [22] TAFAREL JR, TOLENTINO LHL, CORREA LM, et al. Prediction of esophageal varices in hepatic cirrhosis by noninvasive markers[J]. Eur J Gastroenterol Hepatol, 2011, 23( 9): 754- 758. DOI: 10.1097/MEG.0b013e3283488a88. [23] DENG H, QI XS, GUO XZ. Diagnostic accuracy of APRI, AAR, FIB-4, FI, king, lok, forns, and FibroIndex scores in predicting the presence of esophageal varices in liver cirrhosis: A systematic review and meta-analysis[J]. Medicine(Baltimore), 2015, 94( 42): e1795. DOI: 10.1097/MD.0000000000001795. [24] BERZIGOTTI A, GILABERT R, ABRALDES JG, et al. Noninvasive prediction of clinically significant portal hypertension and esophageal varices in patients with compensated liver cirrhosis[J]. Am J Gastroenterol, 2008, 103( 5): 1159- 1167. DOI: 10.1111/j.1572-0241.2008.01826.x. -



 PDF下载 ( 919 KB)
PDF下载 ( 919 KB)

 下载:
下载:


