五倍子酸对肝癌HepG2细胞索拉非尼化疗增敏作用
DOI: 10.12449/JCH250215
Effect of gallic acid in increasing the chemosensitivity of hepatocellular carcinoma HepG2 cells to sorafenib
-
摘要:
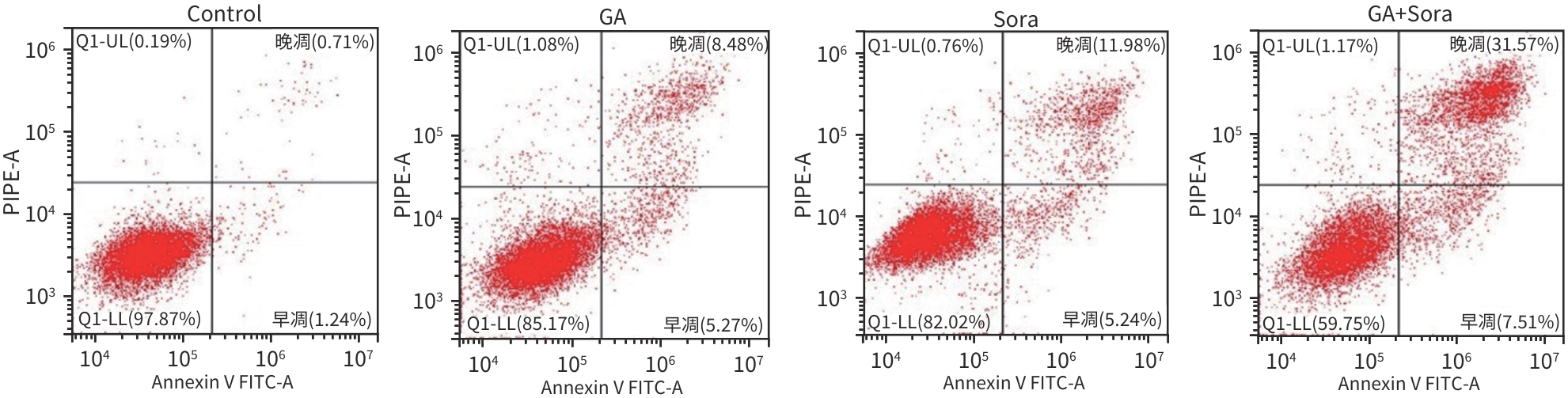
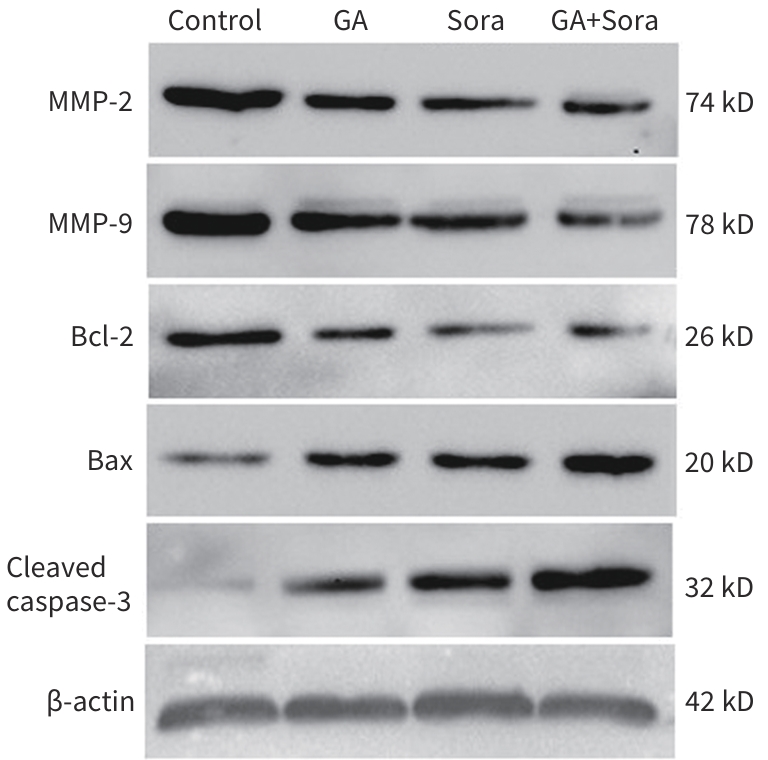
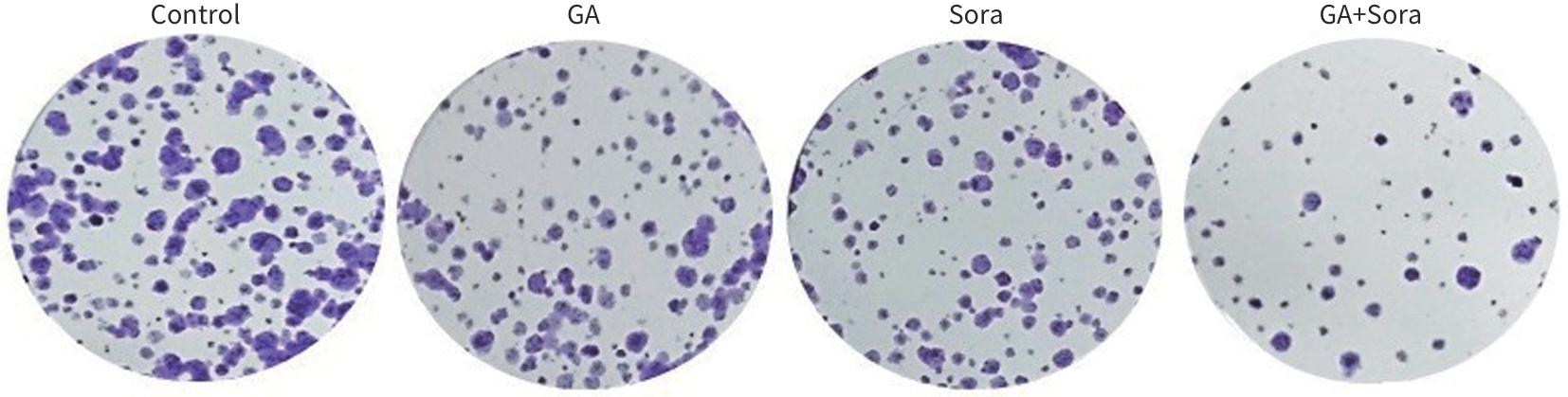
目的 观察五倍子酸(GA)联合索拉非尼(Sora)对HepG2细胞的化疗增敏作用,并探讨其作用机制。 方法 将肝癌HepG2细胞分为对照组、GA组、Sora组和GA+Sora组。CCK8法检测细胞活力,CompuSyn软件分析联合用药指数(CI值);平板克隆形成实验检测细胞克隆形成能力;流式细胞术检测细胞凋亡;细胞划痕和Transwell小室侵袭实验检测细胞迁移和侵袭能力;Western Blot法检测基质金属蛋白酶(MMP)2、MMP-9和凋亡相关蛋白表达。肝癌HepG2细胞接种于裸鼠背部右下方,植瘤6 d后分为4组:对照组(Control)、GA组、Sora组和GA+Sora组,每周测量1次肿瘤大小和质量,药物干预21 d,处死裸鼠,取肿瘤称重。计量资料多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。 结果 GA和Sora作用HepG2细胞48 h的IC50值分别为(123.47±5.16)μmol/L和(9.87±0.98)μmol/L,Sora与70 μmol/L GA(IC30)联用后,IC50降至(2.06±0.35)μmol/L,不同浓度Sora与70 μmol/L GA联合用药CI值均<1;各组细胞克隆形成数分别为234.0±20.4、147.0±12.1、129.3±13.3、73.0±7.6,GA+Sora组细胞克隆数明显低于对照组、GA组和Sora组(P值均<0.05);处理48 h后,各组细胞凋亡率分别为(1.98±0.29)%、(15.17±1.56)%、(18.65±1.48)%和(34.60±5.36)%,GA+Sora组细胞凋亡率明显高于对照组、GA组和Sora组(P值均<0.05);处理24 h后,各组细胞迁移率分别为(55.59±5.08)%、(29.34±4.36)%、(21.80±5.16)%和(6.47±2.75)%,GA+Sora组细胞迁移率明显低于对照组、GA组和Sora组(P值均<0.05);处理48 h后,各组穿膜细胞数分别为223.7±13.0、168.3±10.9、155.3±29.1和62.7±19.7,GA+Sora组穿膜细胞数低于对照组、GA组和Sora组(P值均<0.05);与对照组比较,GA组、Sora组和GA+Sora组细胞中MMP-2、MMP-9、B淋巴细胞瘤2(Bcl-2)蛋白表达水平均明显降低(P值均<0.05),Bcl-2关联X蛋白(Bax)、裂解的半胱氨酸天冬氨酸蛋白酶3(Cleaved caspase-3)蛋白表达水平均明显升高(P值均<0.05)。GA组、Sora组和GA+Sora肿瘤体积和瘤重均比对照组减小(P值均<0.05);与Sora组比较,GA+Sora组裸鼠肿瘤的体积和质量均明显减少(P值均<0.05)。 结论 GA对Sora化疗有增敏作用,其机制可能与GA和Sora联用后促进HepG2细胞凋亡及抑制细胞迁移、侵袭有关。 Abstract:Objective To investigate the chemosensitization effect of gallic acid (GA) combined with sorafenib (Sora) on hepatocellular carcinoma HepG2 cells and related mechanisms. Methods HepG2 cells were randomly divided into control group, GA group, Sora group, and GA+Sora group. CCK8 assay was used to measure cell viability; CompuSyn software was used to analyze combination index (CI); colony formation assay was used to evaluate the colony formation ability of cells; flow cytometry was used to measure cell apoptosis; wound healing assay and Transwell chamber assay were used to observe the migration and invasion abilities of cells; Western Blot was used to measure the expression matrix metalloproteinase 2 (MMP-2), matrix metalloproteinase 9 (MMP-9), and apoptosis-related proteins. HepG2 cells were subcutaneously inoculated into the lower right back of mice, and 6 days later, the mice were divided into control group, GA group, Sora group, and GA+Sora group. Tumor size and body weight were measured once a week, and drug intervention was performed for 21 days. Then the nude mice were sacrificed, and tumor weight was measured. A one-way analysis of variance was used for comparison between multiple groups, and the least significant difference t-test was used for further comparison between two groups. Results The mean IC50 values of GA and Sora for the treatment of HepG2 cells for 48 hours were 123.47±5.16 μmol/L and 9.87±0.98 μmol/L, respectively, and when Sora was combined with 70 μmol/L GA (IC30), IC50 decreased to 2.06±0.35 μmol/L; the CI value was<1 for Sora at different concentrations combined with 70 μmol/L GA. The number of cell colonies was 234.0±20.4, 147.0±12.1, 129.3±13.3, and 73.0±7.6, respectively, in the four groups, and the GA+Sora group had a significantly lower number of cell colonies than the control group, the GA group, and the Sora group (all P<0.05). After 48 hours of treatment, the cell apoptosis rate was 1.98%±0.29%, 15.17%± 1.56%, 18.65%±1.48%, and 34.60%±5.36%, respectively, in the four groups, and the GA+Sora group had a significantly higher cell apoptosis rate than the control group, the GA group, and the Sora group (all P<0.05). After 24 hours of treatment, the cell migration rate was 55.59%±5.08%, 29.34%±4.36%, 21.80%±5.16%, and 6.47%±2.75%, respectively, in the four groups, and the GA+Sora group had a significantly lower cell migration rate than the control group, the GA group, and the Sora group (all P<0.05). After 48 hours of treatment, the number of transmembrane cells was 223.7±13.0, 168.3±10.9, 155.3±29.1, and 62.7±19.7, respectively, in the four groups, and the GA+Sora group had a significantly lower number of transmembrane cells than the control group, the GA group, and the Sora group (all P<0.05). Compared with the control group, the GA group, the Sora group, and the GA+Sora group had significant reductions in the protein expression levels of MMP-2, MMP-9, and Bcl-2 (all P<0.05) and significant increases in the protein expression levels of Bax and cleaved caspase-3 (all P<0.05). Compared with the control group, the GA, Sora, and GA+Sora groups had significant reductions in tumor volume and weight (all P<0.05), and compared with the Sora group, the GA+Sora group had significant reductions in tumor volume and weight in nude mice (both P<0.05). Conclusion GA can increase the sensitivity of HepG2 cells to Sora chemotherapy, possibly by promoting cell apoptosis and inhibiting cell migration and invasion after combination with Sora. -
Key words:
- Carcinoma, Hepatocellular /
- Sorafenib /
- Gallic Acid
-
表 1 GA与Sora联合作用对HepG2细胞增殖抑制作用
Table 1. Combination effect of GA with Sora on the proliferation of HepG2 cells
组别 药物浓度(μmol/L) 抑制率(%) CI 对照组 0 0 - GA组 25 9.46±2.74 - 50 20.80±4.64 - 100 42.77±5.19 - 150 58.32±5.04 - 200 67.88±5.01 - 300 75.46±4.76 - Sora组 1 7.33±3.37 - 2 13.47±3.92 - 5 29.50±4.73 - 10 54.40±6.32 - 20 66.24±5.39 - 40 82.57±2.97 - GA+Sora组 70+1 36.55±5.561) 0.816 70+2 49.14±2.831) 0.549 70+5 64.82±4.601) 0.647 70+10 71.05±4.701) 0.713 70+20 77.55±2.361) 0.856 70+40 85.63±5.371) 0.760 注:与同浓度Sora组比较,1) t=-50.051~-3.131,P<0.05。“-”表示没有结果。
表 2 HepG2细胞MMP-2、MMP-9、Bcl-2、Bax和Cleaved caspase-3蛋白表达水平
Table 2. Expression levels of MMP-2、MMP-9、Bcl-2、Bax and Cleaved caspase-3 proteins of HepG2 cells
组别 MMP-2 MMP-9 Bcl-2 Bax Cleaved caspase-3 对照组 1.07±0.17 1.20±0.17 0.82±0.11 0.41±0.04 0.18±0.04 GA组 0.65±0.081) 0.76±0.051) 0.36±0.061) 0.61±0.051) 0.46±0.071) Sora组 0.60±0.051) 0.69±0.041) 0.37±0.051) 0.60±0.051) 0.61±0.091) GA+Sora组 0.34±0.061)2)3) 0.52±0.041)2)3) 0.28±0.031)2)3) 0.73±0.051)2)3) 0.92±0.131)2)3) F值 25.944 127.208 39.235 25.722 35.535 P值 <0.001 <0.001 <0.001 <0.001 <0.001 注:与对照组比较,1)P<0.05;与GA组比较,2)P<0.05;与Sora组比较,3)P<0.05。
-
[1] ZHOU J, SUN HC, WANG Z, et al. Guidelines for the diagnosis and treatment of primary liver cancer(2022 edition)[J]. Liver Cancer, 2023, 12( 5): 405- 444. DOI: 10.1159/000530495. [2] CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66( 2): 115- 132. DOI: 10.3322/caac.21338. [3] YANG XL, XUE JH, CHEN TY, et al. Effect of atractylone on the viability and apoptosis of hepatoma HepG2 cells and related mechanism[J]. J Clin Hepatol, 2021, 37( 11): 2589- 2594. DOI: 10.3969/j.issn.1001-5256.2021.11.020.杨雪丽, 薛建华, 陈天阳, 等. 苍术酮对肝癌HepG2细胞活性、凋亡的影响及其相关机制[J]. 临床肝胆病杂志, 2021, 37( 11): 2589- 2594. DOI: 10.3969/j.issn.1001-5256.2021.11.020. [4] LI Z, LIU JK. The mechanism of p53 signaling pathway regulating ferroptosis in hepatocellular carcinoma[J]. J Clin Hepatol, 2023, 39( 4): 956- 960. DOI: 10.3969/j.issn.1001-5256.2023.04.032.李震, 刘江凯. p53信号通路调控铁死亡在肝细胞癌中的作用机制[J]. 临床肝胆病杂志, 2023, 39( 4): 956- 960. DOI: 10.3969/j.issn.1001-5256.2023.04.032. [5] General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer(2022 edition)[J]. J Clin Hepatol, 2022, 38( 2): 288- 303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38( 2): 288- 303. DOI: 10.3969/j.issn.1001-5256.2022.02.009. [6] BENSON AB, D’ANGELICA MI, ABBOTT DE, et al. Guidelines insights: Hepatobiliary cancers, version 2.2019[J]. J Natl Compr Canc Netw, 2019, 17( 4): 302- 310. DOI: 10.6004/jnccn.2019.0019. [7] XIAN LF, ZHAO P, CHEN X, et al. Heterogeneity, inherent and acquired drug resistance in patient-derived organoid models of primary liver cancer[J]. Cell Oncol(Dordr), 2022, 45( 5): 1019- 1036. DOI: 10.1007/s13402-022-00707-3. [8] AI XY, HOU XF, FENG NP. Combination of shikonin and gefitinib reverses drug resistance in human non-small cell lung cancer and its mechanism[J]. China J Chin Mater Med, 2024, 49( 1): 175- 184. DOI: 10.19540/j.cnki.cjcmm.20230810.401.艾鑫仪, 侯雪峰, 冯年平. 紫草素与吉非替尼联用逆转人非小细胞肺癌耐药及其机制研究[J]. 中国中药杂志, 2024, 49( 1): 175- 184. DOI: 10.19540/j.cnki.cjcmm.20230810.401. [9] HONG ZC, TANG PL, LIU B, et al. Erratum for ferroptosis-ralated genes for overall survival prediction in patients with colorectal cancer can be inhibited by gallic acid[J]. Int J Biol Sci, 2022, 18( 4): 1398- 1399. DOI: 10.7150/ijbs.69081. [10] KO EB, JANG YG, KIM CW, et al. Gallic acid hindered lung cancer progression by inducing cell cycle arrest and apoptosis in A549 lung cancer cells via PI3K/Akt pathway[J]. Biomol Ther(Seoul), 2022, 30( 2): 151- 161. DOI: 10.4062/biomolther.2021.074. [11] ABOREHAB NM, ELNAGAR MR, WALY NE. Gallic acid potentiates the apoptotic effect of paclitaxel and carboplatin via overexpression of Bax and P53 on the MCF-7 human breast cancer cell line[J]. J Biochem Mol Toxicol, 2021, 35( 2): e22638. DOI: 10.1002/jbt.22638. [12] BULBUL MV, KARABULUT S, KALENDER M, et al. Effects of gallic acid on endometrial cancer cells in two and three dimensional cell culture models[J]. Asian Pac J Cancer Prev, 2021, 22( 6): 1745- 1751. DOI: 10.31557/APJCP.2021.22.6.1745. [13] SUN GJ, ZHANG SQ, XIE YR, et al. Gallic acid as a selective anticancer agent that induces apoptosis in SMMC-7721 human hepatocellular carcinoma cells[J]. Oncol Lett, 2016, 11( 1): 150- 158. DOI: 10.3892/ol.2015.3845. [14] XU WB, XIE SD, CHEN X, et al. Effects of quercetin on the efficacy of various chemotherapeutic drugs in cervical cancer cells[J]. Drug Des Devel Ther, 2021, 15: 577- 588. DOI: 10.2147/DDDT.S291865. [15] SHI CJ, ZHENG YB, PAN FF, et al. Gallic acid suppressed tumorigenesis by an lncRNA MALAT1-Wnt/β-catenin axis in hepatocellular carcinoma[J]. Front Pharmacol, 2021, 12: 708967. DOI: 10.3389/fphar.2021.708967. [16] LI ZJ, DAI HQ, HUANG XW, et al. Artesunate synergizes with sorafenib to induce ferroptosis in hepatocellular carcinoma[J]. Acta Pharmacol Sin, 2021, 42( 2): 301- 310. DOI: 10.1038/s41401-020-0478-3. [17] CHOU TC. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies[J]. Pharmacol Rev, 2006, 58( 3): 621- 681. DOI: 10.1124/pr.58.3.10. [18] CHEN H, NING L, CAI L, et al. Synergistic antitumor effect of evodiamine combined with sorafenib on hepatocellular carcinoma HepG2 cells[J]. J Hubei Univ Sci Technol Med Sci, 2023, 37( 6): 461- 464, 480. DOI: 10.16751/j.cnki.2095-4646.2023.06.0461.陈慧, 宁琳, 蔡丽, 等. 索拉非尼联合吴茱萸碱对肝癌HepG2细胞的协同抗肿瘤作用[J]. 湖北科技学院学报(医学版), 2023, 37( 6): 461- 464, 480. DOI: 10.16751/j.cnki.2095-4646.2023.06.0461. [19] CHEN C, XU HL, WANG P, et al. Inhibition effect of sorafenib combined with the Saponin fraction from Gleditsia sinensis on HepG2 cells[J]. J Clin Exp Med, 2019, 18( 2): 143- 146. DOI: 10.3969/j.issn.1671-4695.2019.02.009.陈成, 许汉林, 王平, 等. 猪牙皂皂苷与索拉非尼联用对肝癌HepG2细胞的抑制作用及其机制[J]. 临床和实验医学杂志, 2019, 18( 2): 143- 146. DOI: 10.3969/j.issn.1671-4695.2019.02.009. [20] TANG MX, YANG MJ, HE KY, et al. Glycyrrhetinic acid remodels the tumor microenvironment and synergizes with doxorubicin for breast cancer treatment in a murine model[J]. Nanotechnology, 2021, 32( 18): 185702. DOI: 10.1088/1361-6528/abe076. [21] WANG XQ, LI QF, CHEN L, et al. Inhibitory effect of curcumin on sorafenib resistance in hepatocellular carcinoma and its regulatory mechanism[J/OL]. Chin J Hepat Surg(Electronic Edition), 2024, 13( 5): 729- 735. DOI: 10.3877/cma.j.issn.2095-3232.2024.05.023.王向前, 李清峰, 陈磊, 等. 姜黄素抑制肝细胞癌索拉非尼耐药作用及其调控机制[J/OL]. 中华肝脏外科手术学电子杂志, 2024, 13( 5): 729- 735. DOI: 10.3877/cma.j.issn.2095-3232.2024.05.023. [22] ZHANG ZW, LI ZG, LI CX. Combination of gallic acid and cisplatin inhibits esophageal cancer by downregulating COX-2[J]. Chin J Surg Integr Tradit West Med, 2024, 30( 4): 562- 567. DOI: 10.3969/j.issn.1007-6948.2024.04.025.张仲卫, 李志刚, 李彩霞. 没食子酸联合顺铂通过下调环氧化酶-2抑制食管癌的实验研究[J]. 中国中西医结合外科杂志, 2024, 30( 4): 562- 567. DOI: 10.3969/j.issn.1007-6948.2024.04.025. [23] YANG QL. Treating advanced malignancies mainly with Dahuang Zhechong pill[J]. Clin J Chin Med, 2013, 5( 19): 16- 17. DOI: 10.3969/j.issn.1674-7860.2013.19.008.杨勤龙. 大黄蛰虫丸为主治疗晚期恶性肿瘤[J]. 中医临床研究, 2013, 5( 19): 16- 17. DOI: 10.3969/j.issn.1674-7860.2013.19.008. [24] YUAN CL, CHEN GP, JING CB, et al. Eriocitrin, a dietary flavonoid suppressed cell proliferation, induced apoptosis through modulation of JAK2/STAT3 and JNK/p38 MAPKs signaling pathway in MCF-7 cells[J]. J Biochem Mol Toxicol, 2022, 36( 1): e22943. DOI: 10.1002/jbt.22943. [25] WANG ZY, ZHANG H, ZHOU JH, et al. Eriocitrin from lemon suppresses the proliferation of human hepatocellular carcinoma cells through inducing apoptosis and arresting cell cycle[J]. Cancer Chemother Pharmacol, 2016, 78( 6): 1143- 1150. DOI: 10.1007/s00280-016-3171-y. [26] HAN QQ, YE MR, JIN QL. Demethylzeylasteral inhibits proliferation, migration and invasion and promotes apoptosis of non-small cell lung cancer cells by inhibiting the AKT/CREB signaling pathway[J]. J South Med Univ, 2024, 44( 2): 280- 288. DOI: 10.12122/j.issn.1673-4254.2024.02.10.韩齐齐, 叶梦然, 金齐力. 去甲泽拉木醛通过抑制AKT/CREB信号通路抑制非小细胞肺癌细胞的增殖、迁移和侵袭[J]. 南方医科大学学报, 2024, 44( 2): 280- 288. DOI: 10.12122/j.issn.1673-4254.2024.02.10. [27] XU GS, JIANG HB, PAN Q, et al. Inhibitory effects of betulinic acid on migration and invasion of gastric cancer MGC-803 cells and their mechanisms[J]. J Jilin Univ Med Ed, 2022, 48( 1): 122- 128. DOI: 10.13481/j.1671-587X.20220115.许广松, 蒋海兵, 盘箐, 等. 桦木酸对胃癌MGC-803细胞迁移和侵袭的抑制作用及其机制[J]. 吉林大学学报(医学版), 2022, 48( 1): 122- 128. DOI: 10.13481/j.1671-587X.20220115. -



 PDF下载 ( 2972 KB)
PDF下载 ( 2972 KB)

 下载:
下载: