中药调控免疫细胞治疗肝细胞癌的研究进展
DOI: 10.12449/JCH250223
Research advances in traditional Chinese medicine for the treatment of hepatocellular carcinoma by regulating immune cells
-
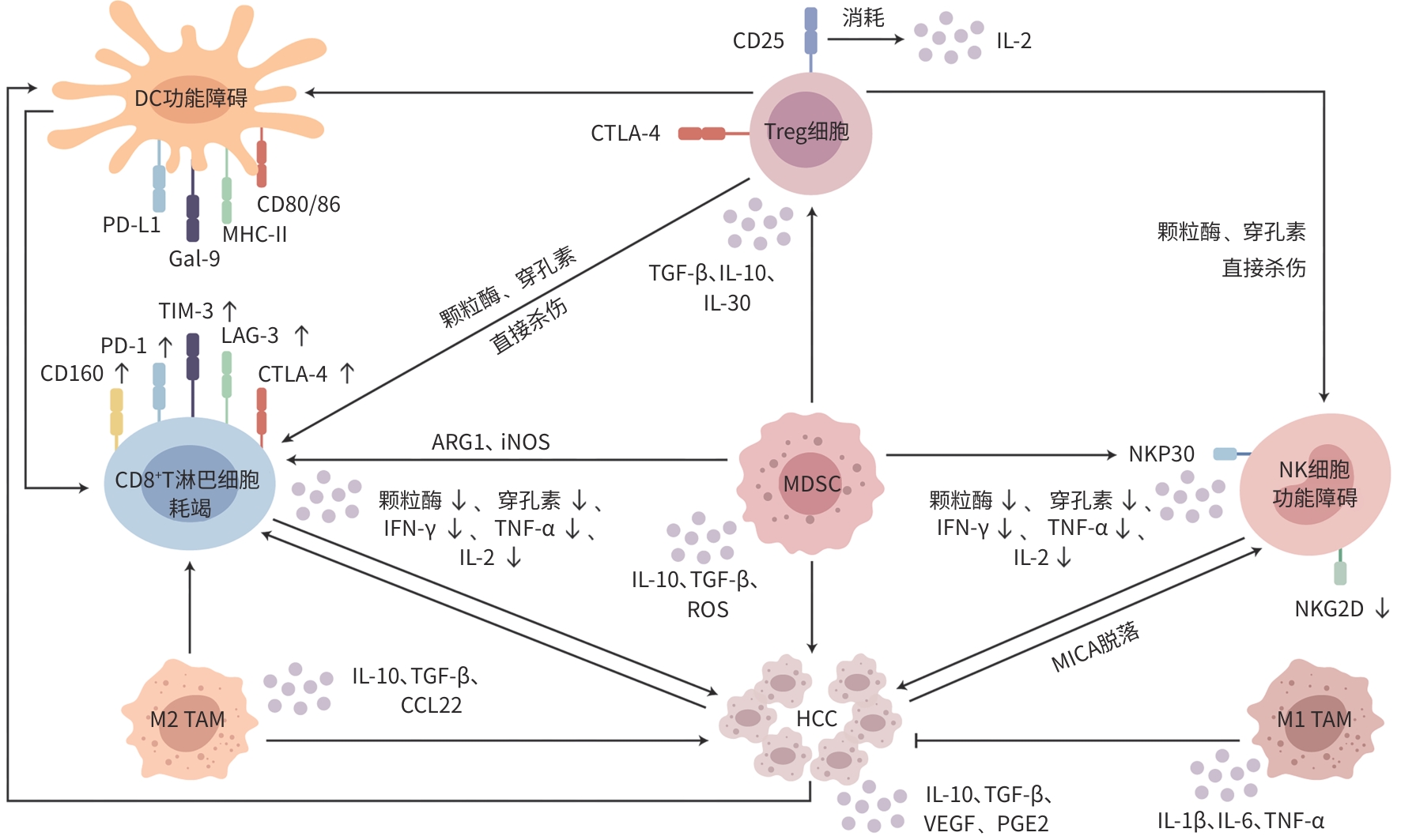
摘要: 肝细胞癌(HCC)是一种常见且死亡率较高的恶性肿瘤,其起病隐匿,病理机制复杂。在肿瘤微环境中,促肿瘤免疫细胞保护肿瘤细胞免受免疫攻击,抗肿瘤免疫细胞发生功能障碍使免疫反应被抑制,最终导致癌症持续恶化。近年来中医药在治疗HCC方面显示出良好的疗效,中药能够调控免疫细胞进而抑制癌细胞增殖与转移。本文通过分析汇总近年来国内外相关文献,总结免疫细胞如何通过免疫抑制途径影响HCC进展以及中药如何调控免疫细胞发挥抗HCC作用,以期为HCC治疗的优化提供理论依据与参考。Abstract: Hepatocellular carcinoma (HCC) is a common malignant tumor with a high mortality rate, an insidious onset, and complex pathological mechanisms. In the tumor microenvironment, tumor-promoting immune cells protect tumor cells from immune attacks, while dysfunction of anti-tumor immune cells causes the inhibition of immune response, thereby leading to the continuous deterioration of cancer. In recent years, traditional Chinese medicine has shown good efficacy in the treatment of HCC, and it can inhibit the proliferation and metastasis of cancer cells by regulating immune cells. By analyzing related articles in China and globally, this article summarizes how immune cells affect the progression of HCC through the immunosuppressive pathway and how traditional Chinese medicine exerts an anti-HCC effect by regulating immune cells, in order to provide theoretical basis and reference for optimizing the treatment of HCC.
-
Key words:
- Carcinoma, Hepatocellular /
- Immune Cells /
- Immunosuppression /
- Traditional Chinese Drugs
-
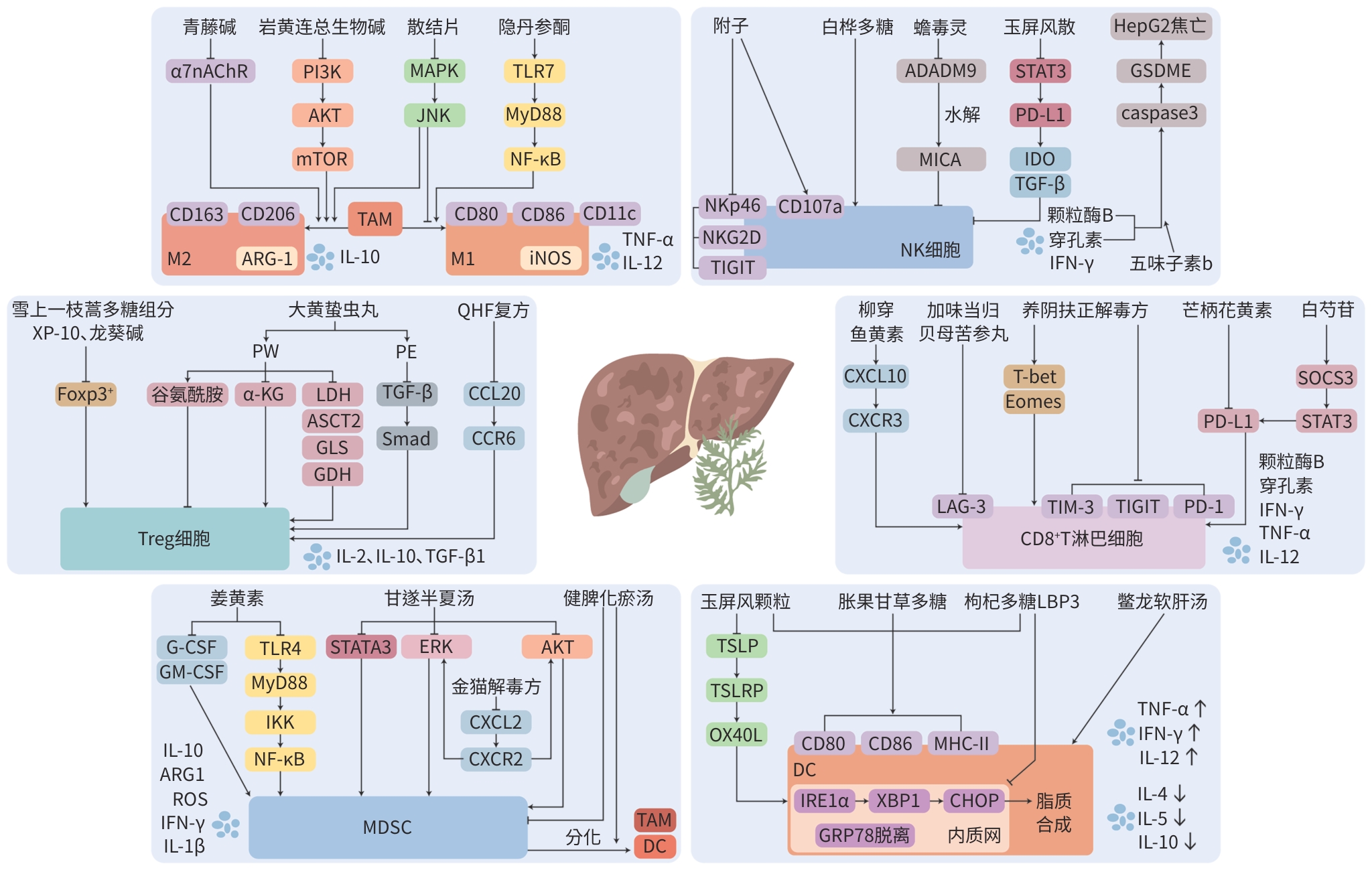
表 1 中药有效成分或单体调控免疫细胞治疗HCC的机制
Table 1. Mechanism of modulating immune cells in HCC treatment by effective components of traditional Chinese medicine
免疫细胞 有效成分或单体 机制 TAM 青藤碱[34] 下调α7nAChR表达,抑制M2极化,促进M1极化 岩黄连总生物碱[35] 负调控PI3K/AKT/mTOR信号通路,抑制巨噬细胞M2型极化 隐丹参酮[36] 调控TLR7/MyD88/NF-κB信号通路,促进巨噬细胞向M1型极化 Treg 雪上一枝蒿多糖组分XP-10[38] 下调Treg比例 龙葵碱[39] 降低Treg含量 MDSC 姜黄素[42] 减少G-CSF、GM-CSF的分泌及抑制TLR4/NF-κB介导的炎症反应,抑制MDSC的作用 NK细胞 白桦多糖[46] 增强NK细胞的细胞毒性,增加NK细胞百分比 五味子素b[47] 调控穿孔素-颗粒酶B-caspase 3-GSDME通路,介导HepG2细胞焦亡 蟾毒灵[48] 降低ADADM9表达,抑制MICA脱落 附子[49] 增加NK细胞百分比和CD107a的表达,下调抑制性受体NKp46、NKG2D和TIGIT的表达 CD8+ T淋巴细胞 芒柄花黄素[51] 阻断PD-1/PD-L1通路,激活CD8+ T淋巴细胞 柳穿鱼黄[52] 增加CD8+ T淋巴细胞数量,提高IFN-γ、颗粒酶B等细胞因子及趋化因子CXCL10及其受体CXCR3表达 芍药苷[53] 通过SOCS3/STAT3信号通路降低PD-L1表达,增强T淋巴细胞介导的抗肿瘤免疫反应 DC 胀果甘草多糖[56] 上调DC的表达水平,增加IL-12和IFN-γ含量,降低IL-10和IL-4含量 枸杞多糖LBP3[57] 抑制IRElα-XBP1通路,改善内质网应激,减少细胞内脂质积累,改善TDC刺激T淋巴细胞的功能 表 2 中药复方调控免疫细胞治疗HCC的机制
Table 2. Mechanism of modulating immune cells in HCC treatment by traditional Chinese medicine compound
免疫细胞 中药复方 组成 机制 TAM 散结片[37] 白鲜皮、海藻、白附子、牛黄等 通过抑制MAPK/JNK信号通路,抑制巨噬细胞向M2型极化,促进M1型极化 Treg 大黄蛰虫丸[40] 大黄、土蝗、水蛭、蝗虫、蛴螬、桃仁、干漆、黄芩、白芍、杏仁、地黄、甘草 通过影响肝癌细胞的代谢、改善肿瘤微环境酸度和谷氨酰胺耗竭或者调控TGF-β/Smad通路来抑制Treg分化 QHF复方[41] 华蟾素、人参皂苷、三七总皂苷、香菇多糖 通过调节CCL20/CCR6信号轴,减少Treg肿瘤浸润 MDSC 金猫解毒方[43] 猫人参、石见穿、山慈菇、鸡内金 阻断CXCL2-CXCR2-ERK和CXCL2-CXCR2-AKT通路,抑制活化的肝星状细胞诱导的MDSC募集和分化 健脾化瘀汤[44] 柑橘、姜黄、苍术、黄槐、狼苜蓿 促进MDSC分化,减少MDSC中ROS的表达,降低对CD4+ T淋巴细胞的抑制作用 甘遂半夏汤[45] 甘遂、半夏、白芍、甘草 通过抑制AKT/STAT3/ERK信号通路,下调IL-1β和IFN-γ的表达,减少MDSC的积累 NK细胞 玉屏风散[50] 黄芪、白术、防风 抑制STAT3/p-STAT3、PD-L1的蛋白表达,以及IDO、TGF-β的分泌,促进颗粒酶B、穿孔素、IFN-γ的表达 CD8+ T淋巴细胞 加味当归贝母苦参丸[54] 当归、贝母、苦参、山慈菇、全蝎、黄芪 促进CD8+T淋巴细胞的增殖,降低LAG-3表达 养阴扶正解毒方[55] 北沙参、麦冬、黄芪、白术、柴胡、苦参、徐长卿、白花蛇舌草 升高CD8+ T淋巴细胞的比例,改善抑制受体的过表达,降低炎症和免疫抑制细胞因子水平,提高效应细胞因子水平,调节T淋巴细胞转录 DC 鳖龙软肝汤[58] 桃仁、莪术、鳖甲、地龙、茯苓、柴胡、白芍、甘草 促进外周血DC的增殖 玉屏风颗粒[59] 黄芪、白术、防风 调控TSLP-OX40L通路促进DC的成熟 -
[1] SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71( 3): 209- 249. DOI: 10.3322/caac.21660. [2] VOGEL A, MEYER T, SAPISOCHIN G, et al. Hepatocellular carcinoma[J]. The Lancet, 2022, 400( 10360): 1345- 1362. DOI: 10.1016/S0140-6736(22)01200-4. [3] ANWANWAN D, SINGH SK, SINGH S, et al. Challenges in liver cancer and possible treatment approaches[J]. Biochim Biophys Acta Rev Cancer, 2020, 1873( 1): 188314. DOI: 10.1016/j.bbcan.2019.188314. [4] QUAN H, SHI L, CHEN J, et al. Research progress of tumor microenvironment in hepatocelluar carcinoma[J]. Anti Tumor Pharm, 2023, 13( 2): 150- 154. DOI: 10.3969/j.issn.2095-1264.2023.02.03.权虎, 石磊, 陈杰, 等. 肿瘤微环境在肝细胞癌中的研究进展[J]. 肿瘤药学, 2023, 13( 2): 150- 154. DOI: 10.3969/j.issn.2095-1264.2023.02.03. [5] WANG WQ, GAO ZH, YIN CJ. A methodological study of traditional Chinese medicine treatment of primary liver cancer[J]. J Clin Hepatol, 2021, 37( 9): 2009- 2015. DOI: 10.3969/j.issn.1001-5256.2021.09.003.王伟芹, 高占华, 尹常健. 中医药治疗原发性肝癌的方法学研究[J]. 临床肝胆病杂志, 2021, 37( 9): 2009- 2015. DOI: 10.3969/j.issn.1001-5256.2021.09.003. [6] WANG ZY, GAO L, HU SP, et al. Discussion on tumor immune microenvironment and the application of traditional Chinese medicine based on the theory of“healthy and evil Qi”[J]. Mod Chin Clin Med, 2023, 30( 6): 71- 75. DOI: 10.3969/j.issn.2095-6606.2023.06.016.王郅宜, 高磊, 胡少朴, 等. 从正邪理论探讨肿瘤免疫微环境及中医辨治思路[J]. 现代中医临床, 2023, 30( 6): 71- 75. DOI: 10.3969/j.issn.2095-6606.2023.06.016. [7] CAI X, YU LH, LIU XL, et al. Standard for diagnosis and treatment of primary liver cancer(2022 edition)[J]. Chin J Integr Tradit West Med Liver Dis, 2024, 34( 4): 351- 354. DOI: 10.3969/j.issn.1005-0264.2024.004.015.蔡雪, 于莉华, 刘晓利, 等. 基于免疫微环境探讨养阴扶正解毒法治疗原发性肝癌[J]. 中西医结合肝病杂志, 2024, 34( 4): 351- 354. DOI: 10.3969/j.issn.1005-0264.2024.004.015. [8] DUNN GP, BRUCE AT, IKEDA H, et al. Cancer immunoediting: From immunosurveillance to tumor escape[J]. Nat Immunol, 2002, 3( 11): 991- 998. DOI: 10.1038/ni1102-991. [9] WANG P, QIU JN, WANG ZX, et al. Research advances in tumor-associated macrophages in hepatocellular carcinoma microenvironment[J]. J Clin Hepatol, 2023, 39( 5): 1212- 1218. DOI: 10.3969/j.issn.1001-5256.2023.05.033.汪鹏, 仇建南, 王忠夏, 等. 肝癌微环境中肿瘤相关巨噬细胞的研究进展[J]. 临床肝胆病杂志, 2023, 39( 5): 1212- 1218. DOI: 10.3969/j.issn.1001-5256.2023.05.033. [10] MIRLEKAR B. Tumor promoting roles of IL-10, TGF-β, IL-4, and IL-35: Its implications in cancer immunotherapy[J]. SAGE Open Med, 2022, 10: 20503121211069012. DOI: 10.1177/20503121211069012. [11] WANG D, YANG L, YUE DL, et al. Macrophage-derived CCL22 promotes an immunosuppressive tumor microenvironment via IL-8 in malignant pleural effusion[J]. Cancer Lett, 2019, 452: 244- 253. DOI: 10.1016/j.canlet.2019.03.040. [12] ZHANG H, LIU L, LIU JB, et al. Roles of tumor-associated macrophages in anti-PD-1/PD-L1 immunotherapy for solid cancers[J]. Mol Cancer, 2023, 22( 1): 58. DOI: 10.1186/s12943-023-01725-x. [13] ZHANG QW, LIU L, GONG CY, et al. Prognostic significance of tumor-associated macrophages in solid tumor: A meta-analysis of the literature[J]. PLoS One, 2012, 7( 12): e50946. DOI: 10.1371/journal.pone.0050946. [14] LAN YT, FAN XP, FAN YC, et al. Change in the Treg/Th17 cell imbalance in hepatocellular carcinoma patients and its clinical value[J]. Medicine, 2017, 96( 32): e7704. DOI: 10.1097/MD.0000000000007704. [15] YU SZ, WANG Y, HOU J, et al. Tumor-infiltrating immune cells in hepatocellular carcinoma: Tregs is correlated with poor overall survival[J]. PLoS One, 2020, 15( 4): e0231003. DOI: 10.1371/journal.pone.0231003. [16] AJITH A, MERIMI M, ARKI MK, et al. Immune regulation and therapeutic application of T regulatory cells in liver diseases[J]. Front Immunol, 2024, 15: 1371089. DOI: 10.3389/fimmu.2024.1371089. [17] CHEN X, DU Y, HU QQ, et al. Tumor-derived CD4+CD25+regulatory T cells inhibit dendritic cells function by CTLA-4[J]. Pathol Res Pract, 2017, 213( 3): 245- 249. DOI: 10.1016/j.prp.2016.12.008. [18] HOECHST B, ORMANDY LA, BALLMAIER M, et al. A new population of myeloid-derived suppressor cells in hepatocellular carcinoma patients induces CD4+CD25+Foxp3(+) T cells[J]. Gastroenterology, 2008, 135( 1): 234- 243. DOI: 10.1053/j.gastro.2008.03.020. [19] ZHANG XY, FU X, LI TY, et al. The prognostic value of myeloid derived suppressor cell level in hepatocellular carcinoma: A systematic review and meta-analysis[J]. PLoS One, 2019, 14( 12): e0225327. DOI: 10.1371/journal.pone.0225327. [20] LU LC, CHANG CJ, HSU CH. Targeting myeloid-derived suppressor cells in the treatment of hepatocellular carcinoma: Current state and future perspectives[J]. J Hepatocell Carcinoma, 2019, 6: 71- 84. DOI: 10.2147/JHC.S159693. [21] HOECHST B, VOIGTLAENDER T, ORMANDY L, et al. Myeloid derived suppressor cells inhibit natural killer cells in patients with hepatocellular carcinoma via the NKp30 receptor[J]. Hepatology, 2009, 50( 3): 799- 807. DOI: 10.1002/hep.23054. [22] WU Y, KUANG DM, PAN WD, et al. Monocyte/macrophage-elicited natural killer cell dysfunction in hepatocellular carcinoma is mediated by CD48/2B4 interactions[J]. Hepatology, 2013, 57( 3): 1107- 1116. DOI: 10.1002/hep.26192. [23] EASOM NJW, STEGMANN KA, SWADLING L, et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction[J]. Front Immunol, 2018, 9: 1009. DOI: 10.3389/fimmu.2018.01009. [24] YU LH, LIU XL, WANG XH, et al. TIGIT+ TIM-3+ NK cells are correlated with NK cell exhaustion and disease progression in patients with hepatitis B virus-related hepatocellular carcinoma[J]. Oncoimmunology, 2021, 10( 1): 1942673. DOI: 10.1080/2162402X.2021.1942673. [25] LUO QZ, LUO WG, ZHU Q, et al. Tumor-derived soluble MICA obstructs the NKG2D pathway to restrain NK cytotoxicity[J]. Aging Dis, 2020, 11( 1): 118- 128. DOI: 10.14336/AD.2019.1017. [26] XU XZ, TAN YL, QIAN Y, et al. Clinicopathologic and prognostic significance of tumor-infiltrating CD8+ T cells in patients with hepatocellular carcinoma: A meta-analysis[J]. Medicine, 2019, 98( 2): e13923. DOI: 10.1097/MD.0000000000013923. [27] JIANG WQ, HE YJ, HE WG, et al. Exhausted CD8+T cells in the tumor immune microenvironment: New pathways to therapy[J]. Front Immunol, 2020, 11: 622509. DOI: 10.3389/fimmu.2020.622509. [28] ZHENG CH, ZHENG LT, YOO JK, et al. Landscape of infiltrating T cells in liver cancer revealed by single-cell sequencing[J]. Cell, 2017, 169( 7): 1342- 1356. e 16. DOI: 10.1016/j.cell.2017.05.035. [29] WANG S, WANG R, XU N, et al. SULT2B1-CS-DOCK2 axis regulates effector T-cell exhaustion in HCC microenvironment[J]. Hepatology, 2023, 78( 4): 1064- 1078. DOI: 10.1097/HEP.0000000000000025. [30] PU J, XU ZM, NIAN JH, et al. M2 macrophage-derived extracellular vesicles facilitate CD8+T cell exhaustion in hepatocellular carcinoma via the miR-21-5p/YOD1/YAP/β-catenin pathway[J]. Cell Death Discov, 2021, 7( 1): 182. DOI: 10.1038/s41420-021-00556-3. [31] ROBERTS EW, BROZ ML, BINNEWIES M, et al. Critical role for CD103+/CD141+ dendritic cells bearing CCR7 for tumor antigen trafficking and priming of T cell immunity in melanoma[J]. Cancer Cell, 2016, 30( 2): 324- 336. DOI: 10.1016/j.ccell.2016.06.003. [32] DU Y, CHEN X, LIN XQ, et al. Tumor-derived CD4+CD25+ Tregs inhibit the maturation and antigen-presenting function of dendritic cells[J]. Asian Pac J Cancer Prev, 2015, 16( 7): 2665- 2669. DOI: 10.7314/apjcp.2015.16.7.2665. [33] ZHOU GY, SPRENGERS D, BOOR PPC, et al. Antibodies against immune checkpoint molecules restore functions of tumor-infiltrating T cells in hepatocellular carcinomas[J]. Gastroenterology, 2017, 153( 4): 1107- 1119. e 10. DOI: 10.1053/j.gastro.2017.06.017. [34] LIU XY, CAO MD, LAN Y, et al. Effects of sinomenine on α7nAChR-involved M2 polarization of macrophages and TAM polarization in hepatoma ascitic tumor mouse model[J]. Tradit Chin Drug Res Clin Pharmacol, 2022, 33( 12): 1645- 1653. DOI: 10.19378/j.issn.1003-9783.2022.12.008.刘新迎, 曹敏蝶, 蓝燕, 等. 青藤碱对α7nAChR参与的巨噬细胞M2极化和小鼠肝癌TAM极化的干预作用[J]. 中药新药与临床药理, 2022, 33( 12): 1645- 1653. DOI: 10.19378/j.issn.1003-9783.2022.12.008. [35] SU Q, CHEN HR, LU J, et al. Experimental study of Corydalis saxicola total alkaloids inhibiting M2-type macrophages against mice liver cancer[J]. J Chin Med Mater, 2023, 46( 7): 1760- 1765. DOI: 10.13863/j.issn1001-4454.2023.07.031.苏倩, 陈好然, 陆洁, 等. 岩黄连总生物碱抑制M2型巨噬细胞抗小鼠肝癌实验研究[J]. 中药材, 2023, 46( 7): 1760- 1765. DOI: 10.13863/j.issn1001-4454.2023.07.031. [36] HAN Z, LIU S, LIN HS, et al. Inhibition of murine hepatoma tumor growth by cryptotanshinone involves TLR7-dependent activation of macrophages and induction of adaptive antitumor immune defenses[J]. Cancer Immunol Immunother, 2019, 68( 7): 1073- 1085. DOI: 10.1007/s00262-019-02338-4. [37] ZHANG Y, DONG J, GUO B, et al. Effect of Sanjie tablet on macrophage polarization and MAPK/JNK signaling pathway in rats with liver cancer[J]. Chin J Anat, 2023, 46( 5): 406- 410, 439. DOI: 10.3969/j.issn.1001-1633.2023.05.008.张远, 董晶, 国滨, 等. 散结片对肝癌大鼠巨噬细胞极化及MAPK/JNK信号通路的作用机制[J]. 解剖学杂志, 2023, 46( 5): 406- 410, 439. DOI: 10.3969/j.issn.1001-1633.2023.05.008. [38] PENG L, ZHANG X, ZUO AX, et al. Polysaccharides from aconiturn brachypodum Diels ameliorate liver metastasis via regulating Treg cells[J]. J Yunnan Univ Chin Med, 2023, 46( 4): 75- 80. DOI: 10.19288/j.cnki.issn.1000-2723.2023.04.015.彭磊, 张霞, 左爱学, 等. 雪上一枝蒿多糖调控调节性T细胞抑制肝癌肺转移机制的研究[J]. 云南中医药大学学报, 2023, 46( 4): 75- 80. DOI: 10.19288/j.cnki.issn.1000-2723.2023.04.015. [39] GAO JW, XU K, RAN R, et al. Impacts of solanine on tumor immune escape mediated by Treg cells in hepatocellular carcinoma[J]. China Mod Dr, 2021, 59( 18): 35- 38, 42, 193.高聚伟, 徐凯, 冉冉, 等. 龙葵碱对肝癌Treg细胞介导的肿瘤免疫逃逸的影响[J]. 中国现代医生, 2021, 59( 18): 35- 38, 42, 193. [40] WU L, YANG FR, XING ML, et al. Multi-material basis and multi-mechanisms of the Dahuang Zhechong pill for regulating Treg/Th1 balance in hepatocellular carcinoma[J]. Phytomedicine, 2022, 100: 154055. DOI: 10.1016/j.phymed.2022.154055. [41] ZHANG LJ. Basic research on QHF compound's application in resisting immune escape of liver cancer by chemotactic Tregs cells[D]. Yichang: China Three Gorges University, 2021.张丽瑾. QHF复方通过趋化Tregs细胞抗肝癌免疫逃逸的应用基础研究[D]. 宜昌: 三峡大学, 2021. [42] TIAN S, LIAO L, ZHOU Q, et al. Curcumin inhibits the growth of liver cancer by impairing myeloid-derived suppressor cells in murine tumor tissues[J]. Oncol Lett, 2021, 21( 4): 286. DOI: 10.3892/ol.2021.12547. [43] NIE SC. Effect and mechanism of Jinmao Jiedu recipe on recruitment and differentiation of marrow-derived inhibitory cells induced by hepatic stellate cells[D]. Shanghai: Naval Medical University, 2023.聂姝常. 金猫解毒方对肝星状细胞诱导的髓源性抑制细胞募集和分化的影响及机制探究[D]. 上海: 中国人民解放军海军军医大学, 2023. [44] XIE YJ, ZHANG Y, WEI XH, et al. Jianpi Huayu Decoction attenuates the immunosuppressive status of H22 hepatocellular carcinoma-bearing mice: By targeting myeloid-derived suppressor cells[J]. Front Pharmacol, 2020, 11: 16. DOI: 10.3389/fphar.2020.00016. [45] FENG XY, CHEN BC, LI JC, et al. Gansui-Banxia Decoction extraction inhibits MDSCs accumulation via AKT/STAT3/ERK signaling pathways to regulate antitumor immunity in C57bl/6 mice[J]. Phytomedicine, 2021, 93: 153779. DOI: 10.1016/j.phymed.2021.153779. [46] XIE X, SHEN W, ZHOU YR, et al. Characterization of a polysaccharide from Eupolyphaga sinensis walker and its effective antitumor activity via lymphocyte activation[J]. Int J Biol Macromol, 2020, 162: 31- 42. DOI: 10.1016/j.ijbiomac.2020.06.120. [47] SONG AP, DING TT, WEI N, et al. Schisandrin B induces HepG2 cells pyroptosis by activating NK cells mediated anti-tumor immunity[J]. Toxicol Appl Pharmacol, 2023, 472: 116574. DOI: 10.1016/j.taap.2023.116574. [48] FU R, YU FJ, WU WQ, et al. Bufalin enhances the killing efficacy of NK cells against hepatocellular carcinoma by inhibiting MICA shedding[J]. Int Immunopharmacol, 2021, 101( Pt B): 108195. DOI: 10.1016/j.intimp.2021.108195. [49] WANG H, QI XZ, JIA WT, et al. The immunoregulatory effect of aconite treatment on H22 tumor-bearing mice via modulating adaptive immunity and natural killer-related immunity[J]. Evid Based Complement Alternat Med, 2023, 2023: 1481114. DOI: 10.1155/2023/1481114. [50] YUAN Q, YAO F, LIU M, et al. Study of the mechanism of improving NK cell activity in the immunosuppressive microenvironment of hepatocellular carcinoma by Yupingfeng powder through STAT3[J]. J Nantong Univ Med Sci, 2023, 43( 3): 211- 215. DOI: 10.16424/j.cnki.cn32-1807/r.2023.03.003.袁琴, 姚霏, 刘敏, 等. 玉屏风散通过STAT3改善肝细胞肝癌免疫抑制微环境中NK细胞活性的机制研究[J]. 南通大学学报(医学版), 2023, 43( 3): 211- 215. DOI: 10.16424/j.cnki.cn32-1807/r.2023.03.003. [51] LI M, JIANG CZ, CHEN JT, et al. Formononetin enhances the antitumor effect of H22 hepatoma transplanted mice[J]. Chin J Cell Mol Immunol, 2023, 39( 12): 1063- 1068. DOI: 10.13423/j.cnki.cjcmi.009768.李汨, 蒋承志, 陈建婷, 等. 芒柄花黄素对小鼠H22肝癌移植瘤的抗肿瘤作用[J]. 细胞与分子免疫学杂志, 2023, 39( 12): 1063- 1068. DOI: 10.13423/j.cnki.cjcmi.009768. [52] GUO DF, ZHANG M, ZHANG XD, et al. Experimental observation of pectolinarigenin in promoting CD8+ T cell infiltration in mice bearing hepatocellular carcinoma[J/CD]. Pract J Organ Transplant Electron Version, 2022, 10( 4): 347- 352. DOI: 10.3969/j.issn.2095-5332.2022.04.011.郭丹风, 张铭, 张笑丹, 等. 柳穿鱼黄素促进肝癌小鼠肿瘤中CD8+ T细胞浸润的实验性观察[J/CD]. 实用器官移植电子杂志, 2022, 10( 4): 347- 352. DOI: 10.3969/j.issn.2095-5332.2022.04.011. [53] GAO M, ZHANG DJ, JIANG CH, et al. Paeoniflorin inhibits hepatocellular carcinoma growth by reducing PD-L1 expression[J]. Biomed Pharmacother, 2023, 166: 115317. DOI: 10.1016/j.biopha.2023.115317. [54] MA XJ, LIU B, WANG L, et al. Modified Danggui Beimu Kushen pills inhibit tumor growth and regulates T cell subsets in H22 hepatocellular carcinoma-bearing mice[J]. Chin J Exp Tradit Med Formulae, 2024, 30( 12): 87- 96. DOI: 10.13422/j.cnki.syfjx.20232224.马晓洁, 刘犇, 王磊, 等. 加味当归贝母苦参丸对H22肝癌荷瘤小鼠抑瘤及T细胞免疫调节作用[J]. 中国实验方剂学杂志, 2024, 30( 12): 87- 96. DOI: 10.13422/j.cnki.syfjx.20232224. [55] YAN FN, WANG XH, XIE YQ, et al. Yangyin Fuzheng Jiedu Prescription exerts anti-tumor immunity in hepatocellular carcinoma by alleviating exhausted T cells[J]. Phytomedicine, 2021, 91: 153722. DOI: 10.1016/j.phymed.2021.153722. [56] YU YT, NADIREMU XKLT, LU YQ, et al. Immunotherapeutic effect of dendritic cell vaccine assisted by Glycyrrhiza in flata polysaccharides in H22 hepatoma-bearing mice[J]. Chin J Hosp Pharm, 2024, 44( 1): 35- 41. DOI: 10.13286/j.1001-5213.2024.01.06.俞永婷, 娜迪热木·肖克拉提, 卢泳强, 等. 胀果甘草多糖佐助的树突状细胞疫苗对H22肝癌荷瘤小鼠的免疫治疗作用[J]. 中国医院药学杂志, 2024, 44( 1): 35- 41. DOI: 10.13286/j.1001-5213.2024.01.06. [57] ZHANG ML, CHEN YP, WANG Q, et al. Lycium barbarum L. polysaccharide LBP3 exerts the anti-tumor effect through enhancing the function of tumor-associated dendritic cells via inhibiting IRE1α-XBP1 pathway of ER stress[J]. J Funct Foods, 2024, 112: 105950. DOI: 10.1016/j.jff.2023.105950. [58] WU YN, LI X, ZHANG D, et al. Influence of beilong Ruangan Decoction on perliferation of peripheral blood dendritic cells from HBV related hepatocellular carcinoma patients[J]. Liaoning J Tradit Chin Med, 2019, 46( 3): 646- 649, 673. DOI: 10.13192/j.issn.1000-1719.2019.03.060.伍玉南, 李秀, 张冬, 等. 鳖龙软肝汤含药血浆对HBV相关性肝癌患者外周血树突状细胞增殖的影响[J]. 辽宁中医杂志, 2019, 46( 3): 646- 649, 673. DOI: 10.13192/j.issn.1000-1719.2019.03.060. [59] YAO F, YUAN Q, SONG XD, et al. Yupingfeng granule improves Th2-biased immune state in microenvironment of hepatocellular carcinoma through TSLP-DC-OX40L pathway[J]. Evid Based Complement Alternat Med, 2020, 2020: 1263053. DOI: 10.1155/2020/1263053. -



 PDF下载 ( 1707 KB)
PDF下载 ( 1707 KB)

 下载:
下载: