自身免疫性胰腺炎合并胰腺外分泌功能不全的研究进展
DOI: 10.12449/JCH250230
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:敖翔负责设计论文框架,起草论文,绘制图表;刘辰晓、张贤达、冉桃菁、周春华、邹多武负责论文修改;敖翔、周春华负责拟定写作思路,指导撰写文章并最后定稿。
Research advances in autoimmune pancreatitis with pancreatic exocrine insufficiency
-
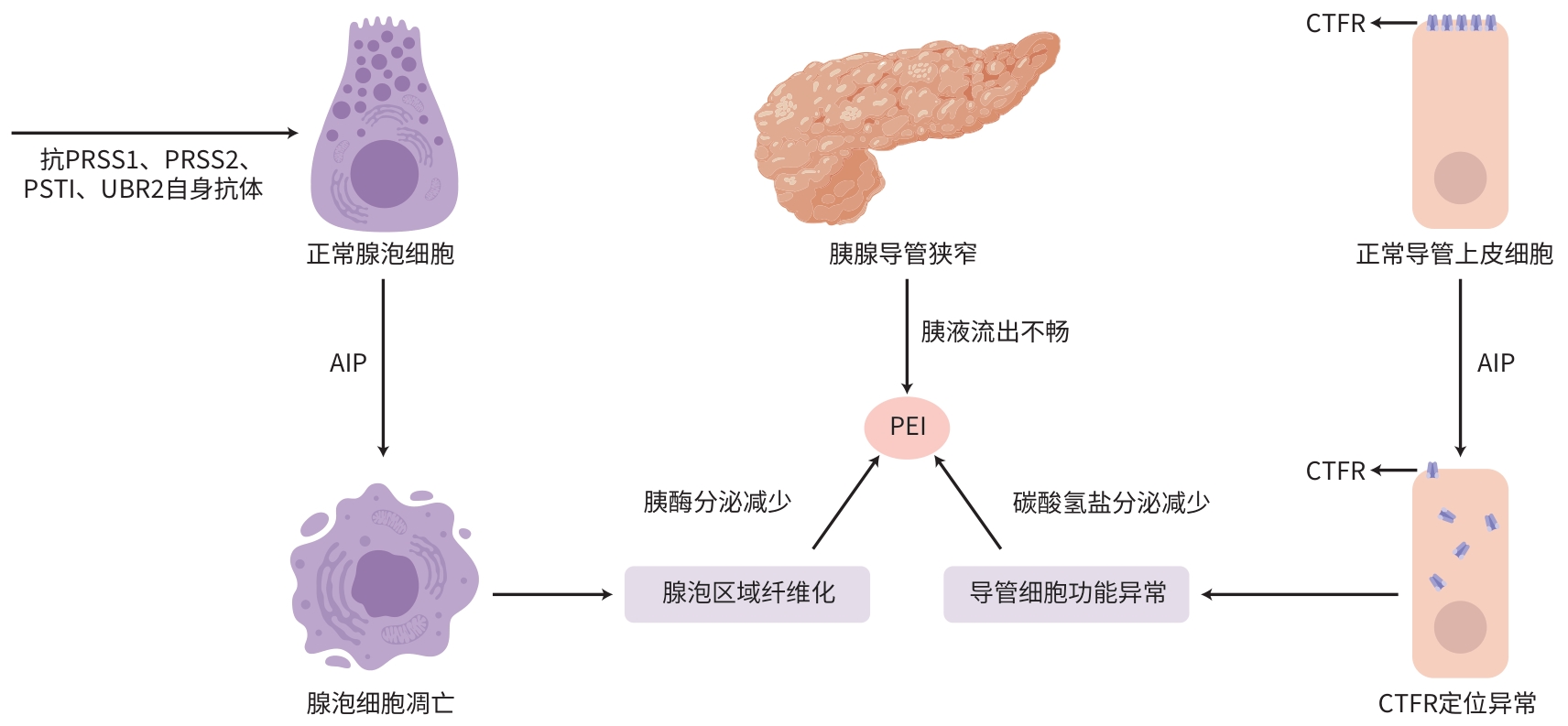
摘要: 自身免疫性胰腺炎(AIP)是一种特殊类型的慢性胰腺炎,会导致患者胰腺外分泌功能出现异常。AIP合并胰腺外分泌功能不全的发病机制复杂,相关研究较少,导致对这类患者的临床认识不足。本文介绍了AIP的流行病学,简单描述了AIP导致胰腺外分泌功能不全的发病机制,归纳总结了胰腺外分泌功能的各种检测方法、营养评估、生活管理及药物治疗等方面的内容。以期加强对AIP合并胰腺外分泌功能不全的认识,并提高胰腺外分泌功能不全的临床诊治水平。Abstract: Autoimmune pancreatitis is a special type of chronic pancreatitis that can lead to abnormal pancreatic exocrine function in patients. Autoimmune pancreatitis comorbid with pancreatic exocrine insufficiency has a complex pathogenesis, and there is limited research on this topic, leading to the lack of understanding of such patients in clinical practice. This article introduces the epidemiology of autoimmune pancreatitis, briefly describes the pathogenesis of pancreatic exocrine insufficiency caused by autoimmune pancreatitis, and summarizes the various detection methods for pancreatic exocrine function, nutritional assessments, lifestyle management, and drug therapy, in order to strengthen the understanding of autoimmune pancreatitis comorbid with pancreatic exocrine insufficiency and improve the clinical diagnosis and treatment of pancreatic exocrine insufficiency.
-
[1] KLEEFF J, WHITCOMB DC, SHIMOSEGAWA T, et al. Chronic pancreatitis[J]. Nat Rev Dis Primers, 2017, 3: 17060. DOI: 10.1038/nrdp.2017.60. [2] ENRIQUE DOMINGUEZ-MUÑOZ J. Diagnosis and treatment of pancreatic exocrine insufficiency[J]. Curr Opin Gastroenterol, 2018, 34( 5): 349- 354. DOI: 10.1097/MOG.0000000000000459. [3] de la IGLESIA-GARCIA D, VALLEJO-SENRA N, IGLESIAS-GARCIA J, et al. Increased risk of mortality associated with pancreatic exocrine insufficiency in patients with chronic pancreatitis[J]. J Clin Gastroenterol, 2018, 52( 8): e63- e72. DOI: 10.1097/MCG.0000000000000917. [4] LAI YM, WU D, YANG H, et al. Epidemiology and clinical characteristics of type 1 autoimmune pancreatitis[J]. Basic Clin Med, 2017, 37( 11): 1607- 1610. DOI: 10.16352/j.issn.1001-6325.2017.11.019.赖雅敏, 吴东, 杨红, 等. 1型自身免疫性胰腺炎的流行病学及临床特点[J]. 基础医学与临床, 2017, 37( 11): 1607- 1610. DOI: 10.16352/j.issn.1001-6325.2017.11.019. [5] KAMISAWA T, CHARI ST, GIDAY SA, et al. Clinical profile of autoimmune pancreatitis and its histological subtypes: An international multicenter survey[J]. Pancreas, 2011, 40( 6): 809- 814. DOI: 10.1097/MPA.0b013e3182258a15. [6] MAIRE F, LE BALEUR Y, REBOURS V, et al. Outcome of patients with type 1 or 2 autoimmune pancreatitis[J]. Am J Gastroenterol, 2011, 106( 1): 151- 156. DOI: 10.1038/ajg.2010.314. [7] HUGGETT MT, CULVER EL, KUMAR M, et al. Type 1 autoimmune pancreatitis and IgG4-related sclerosing cholangitis is associated with extrapancreatic organ failure, malignancy, and mortality in a prospective UK cohort[J]. Am J Gastroenterol, 2014, 109( 10): 1675- 1683. DOI: 10.1038/ajg.2014.223. [8] FRULLONI L, SCATTOLINI C, KATSOTOURCHI AM, et al. Exocrine and endocrine pancreatic function in 21 patients suffering from autoimmune pancreatitis before and after steroid treatment[J]. Pancreatology, 2010, 10( 2-3): 129- 133. DOI: 10.1159/000265945. [9] BUIJS J, CAHEN DL, van HEERDE MJ, et al. The long-term impact of autoimmune pancreatitis on pancreatic function, quality of life, and life expectancy[J]. Pancreas, 2015, 44( 7): 1065- 1071. DOI: 10.1097/MPA.0000000000000451. [10] LANZILLOTTA M, TACELLI M, FALCONI M, et al. Incidence of endocrine and exocrine insufficiency in patients with autoimmune pancreatitis at diagnosis and after treatment: A systematic review and meta-analysis[J]. Eur J Intern Med, 2022, 100: 83- 93. DOI: 10.1016/j.ejim.2022.03.014. [11] LÖHR JM, FAISSNER R, KOCZAN D, et al. Autoantibodies against the exocrine pancreas in autoimmune pancreatitis: Gene and protein expression profiling and immunoassays identify pancreatic enzymes as a major target of the inflammatory process[J]. Am J Gastroenterol, 2010, 105( 9): 2060- 2071. DOI: 10.1038/ajg.2010.141. [12] ITO T, KAWABE K, ARITA Y, et al. Evaluation of pancreatic endocrine and exocrine function in patients with autoimmune pancreatitis[J]. Pancreas, 2007, 34( 2): 254- 259. DOI: 10.1097/01.mpa.0000250127.18908.38. [13] NISTA EC, de LUCIA SS, MANILLA V, et al. Autoimmune pancreatitis: From pathogenesis to treatment[J]. Int J Mol Sci, 2022, 23( 20): 12667. DOI: 10.3390/ijms232012667. [14] DETLEFSEN S, SIPOS B, ZHAO JB, et al. Autoimmune pancreatitis: Expression and cellular source of profibrotic cytokines and their receptors[J]. Am J Surg Pathol, 2008, 32( 7): 986- 995. DOI: 10.1097/PAS.0b013e31815d2583. [15] FRULLONI L, LUNARDI C, SIMONE R, et al. Identification of a novel antibody associated with autoimmune pancreatitis[J]. N Engl J Med, 2009, 361( 22): 2135- 2142. DOI: 10.1056/NEJMoa0903068. [16] SHCHEYNIKOV N, KIM KH, KIM KM, et al. Dynamic control of cystic fibrosis transmembrane conductance regulator Cl(-)/HCO3(-) selectivity by external Cl(-)[J]. J Biol Chem, 2004, 279( 21): 21857- 21865. DOI: 10.1074/jbc.M313323200. [17] ISHIGURO H, STEWARD MC, NARUSE S, et al. CFTR functions as a bicarbonate channel in pancreatic duct cells[J]. J Gen Physiol, 2009, 133( 3): 315- 326. DOI: 10.1085/jgp.200810122. [18] KO SBH, MIZUNO N, YATABE Y, et al. Corticosteroids correct aberrant CFTR localization in the duct and regenerate acinar cells in autoimmune pancreatitis[J]. Gastroenterology, 2010, 138( 5): 1988- 1996. DOI: 10.1053/j.gastro.2010.01.001. [19] de PRETIS N, MARTINELLI L, PALMERI E, et al. The effect of steroid therapy on pancreatic exocrine function in autoimmune pancreatitis[J]. Pancreatology, 2024, 24( 4): 538- 544. DOI: 10.1016/j.pan.2024.04.006. [20] ZHANG BB, JIN EH. MRCP features of pancreatic duct lesions in autoimmune pancreatitis[J]. Chin J Med Imag Technol, 2017, 33( 2): 232- 236. DOI: 10.13929/j.1003-3289.201608151.张斌斌, 靳二虎. 自身免疫性胰腺炎胰管病变的MRCP特征[J]. 中国医学影像技术, 2017, 33( 2): 232- 236. DOI: 10.13929/j.1003-3289.201608151. [21] ZUO L, YANG DJ, LU HM. Clinical application of pancreatic exocrine function tests[J]. J Clin Hepatol, 2022, 38( 4): 956- 960. DOI: 10.3969/j.issn.1001-5256.2022.04.044.左林, 杨都江, 陆慧敏. 胰腺外分泌功能检测方法的临床应用[J]. 临床肝胆病杂志, 2022, 38( 4): 956- 960. DOI: 10.3969/j.issn.1001-5256.2022.04.044. [22] LIN JH, HU LH, LIAO Z, et al. Diagnosis and treatment status and progress of pancreatic exocrine insufficiency in chronic pancreatitis[J]. Chin J Pancreatol, 2015, 15( 6): 420- 422. DOI: 10.3760/cma.j.issn.1674-1935.2015.06.018.林金欢, 胡良皞, 廖专, 等. 慢性胰腺炎胰腺外分泌功能不全的诊治现状与进展[J]. 中华胰腺病杂志, 2015, 15( 6): 420- 422. DOI: 10.3760/cma.j.issn.1674-1935.2015.06.018. [23] CHAMOKOVA B, BASTATI N, POETTER-LANG S, et al. The clinical value of secretin-enhanced MRCP in the functional and morphological assessment of pancreatic diseases[J]. Br J Radiol, 2018, 91( 1084): 20170677. DOI: 10.1259/bjr.20170677. [24] MERKLE EM, BAILLIE J. Exocrine pancreatic function: Evaluation with MR imaging before and after secretin stimulation[J]. Am J Gastroenterol, 2006, 101( 1): 137- 138. DOI: 10.1111/j.1572-0241.2006.00400.x. [25] OCHI K, MIZUSHIMA T, HARADA H, et al. Chronic pancreatitis: Functional testing[J]. Pancreas, 1998, 16( 3): 343- 348. DOI: 10.1097/00006676-199804000-00022. [26] LINDKVIST B. Diagnosis and treatment of pancreatic exocrine insufficiency[J]. World J Gastroenterol, 2013, 19( 42): 7258- 7266. DOI: 10.3748/wjg.v19.i42.7258. [27] WHITCOMB DC, BUCHNER AM, FORSMARK CE. AGA clinical practice update on the epidemiology, evaluation, and management of exocrine pancreatic insufficiency: Expert review[J]. Gastroenterology, 2023, 165( 5): 1292- 1301. DOI: 10.1053/j.gastro.2023.07.007. [28] POWELL-BRETT S, HALL L, EDWARDS M, et al. A systematic review and meta-analysis of the accuracy and methodology of the 13C mixed triglyceride breath test for the evaluation of pancreatic function[J]. Pancreatology, 2023, 23( 3): 283- 293. DOI: 10.1016/j.pan.2023.02.004. [29] ENRIQUE DOMÍNGUEZ-MUÑOZ J, NIETO L, VILARIÑO M, et al. Development and diagnostic accuracy of a breath test for pancreatic exocrine insufficiency in chronic pancreatitis[J]. Pancreas, 2016, 45( 2): 241- 247. DOI: 10.1097/MPA.0000000000000434. [30] SAKAI D, HIROOKA Y, KAWASHIMA H, et al. Increase in breath hydrogen concentration was correlated with the main pancreatic duct stenosis[J]. J Breath Res, 2018, 12( 3): 036004. DOI: 10.1088/1752-7163/aaaf77. [31] VUJASINOVIC M, VALENTE R, DEL CHIARO M, et al. Pancreatic exocrine insufficiency in pancreatic cancer[J]. Nutrients, 2017, 9( 3): 183. DOI: 10.3390/nu9030183. [32] UETSUKI K, KAWASHIMA H, OHNO E, et al. Measurement of fasting breath hydrogen concentration as a simple diagnostic method for pancreatic exocrine insufficiency[J]. BMC Gastroenterol, 2021, 21( 1): 211. DOI: 10.1186/s12876-021-01776-8. [33] VUJASINOVIC M, NIKOLIC S, GORDON ACHOUR A, et al. Autoimmune pancreatitis and micronutrients[J]. Dig Liver Dis, 2023, 55( 10): 1375- 1381. DOI: 10.1016/j.dld.2023.04.009. [34] Special Committee on Chronic Pancreatitis, Pancreatic Disease Specialized Committee, Chinese Medical Doctor Association. Standards for the diagnosis and treatment of pancreatic exocrine insufficiency(2018, Guangzhou)[J]. J Clin Hepatol, 2019, 35( 2): 294- 298. DOI: 10.3969/j.issn.1001-5256.2019.02.010.中国医师协会胰腺病专业委员会慢性胰腺炎专委会. 胰腺外分泌功能不全诊治规范(2018, 广州)[J]. 临床肝胆病杂志, 2019, 35( 2): 294- 298. DOI: 10.3969/j.issn.1001-5256.2019.02.010. [35] LINDKVIST B, PHILLIPS ME, ENRIQUE DOMÍNGUEZ-MUÑOZ J. Clinical, anthropometric and laboratory nutritional markers of pancreatic exocrine insufficiency: Prevalence and diagnostic use[J]. Pancreatology, 2015, 15( 6): 589- 597. DOI: 10.1016/j.pan.2015.07.001. [36] ENRIQUE DOMÍNGUEZ-MUÑOZ J, PHILLIPS M. Nutritional therapy in chronic pancreatitis[J]. Gastroenterol Clin North Am, 2018, 47( 1): 95- 106. DOI: 10.1016/j.gtc.2017.09.004. [37] SHIMIZU K, ITO T, IRISAWA A, et al. Evidence-based clinical practice guidelines for chronic pancreatitis 2021[J]. J Gastroenterol, 2022, 57( 10): 709- 724. DOI: 10.1007/s00535-022-01911-6. [38] de la IGLESIA-GARCÍA D, HUANG W, SZATMARY P, et al. Efficacy of pancreatic enzyme replacement therapy in chronic pancreatitis: Systematic review and meta-analysis[J]. Gut, 2017, 66( 8): 1354- 1355. DOI: 10.1136/gutjnl-2016-312529. [39] ARVANITAKIS M, OCKENGA J, BEZMAREVIC M, et al. ESPEN guideline on clinical nutrition in acute and chronic pancreatitis[J]. Clin Nutr, 2020, 39( 3): 612- 631. DOI: 10.1016/j.clnu.2020.01.004. [40] NIKFARJAM M, WILSON JS, SMITH RC, et al. Diagnosis and management of pancreatic exocrine insufficiency[J]. Med J Aust, 2017, 207( 4): 161- 165. DOI: 10.5694/mja16.00851. [41] DOMÍNGUEZ-MUÑOZ JE, IGLESIAS-GARCÍA J, IGLESIAS-REY M, et al. Effect of the administration schedule on the therapeutic efficacy of oral pancreatic enzyme supplements in patients with exocrine pancreatic insufficiency: A randomized, three-way crossover study[J]. Aliment Pharmacol Ther, 2005, 21( 8): 993- 1000. DOI: 10.1111/j.1365-2036.2005.02390.x. [42] de-MADARIA E, ABAD-GONZÁLEZ A, APARICIO JR, et al. The Spanish Pancreatic Club’s recommendations for the diagnosis and treatment of chronic pancreatitis: Part 2(treatment)[J]. Pancreatology, 2013, 13( 1): 18- 28. DOI: 10.1016/j.pan.2012.11.310. [43] KAMISAWA T, OKAMOTO A, WAKABAYASHI T, et al. Appropriate steroid therapy for autoimmune pancreatitis based on long-term outcome[J]. Scand J Gastroenterol, 2008, 43( 5): 609- 613. DOI: 10.1080/00365520701731263. [44] NISHINO T, TOKI F, OYAMA H, et al. Long-term outcome of autoimmune pancreatitis after oral prednisolone therapy[J]. Intern Med, 2006, 45( 8): 497- 501. DOI: 10.2169/internalmedicine.45.1565. [45] YAMAGUCHI T, NAKAMURA H, KIHARA Y, et al. Long-term overexpression of membrane type-1 matrix metalloproteinase and matrix metalloproteinase-2 in oleic acid-induced pancreatitis in rats[J]. Pancreas, 2002, 24( 4): 348- 356. DOI: 10.1097/00006676-200205000-00005. [46] YAMAGUCHI T, KIHARA Y, TAGUCHI M, et al. Persistent destruction of the basement membrane of the pancreatic duct contributes to progressive acinar atrophy in rats with experimentally induced pancreatitis[J]. Pancreas, 2005, 31( 4): 365- 372. DOI: 10.1097/01.mpa.0000179729.61457.e5. [47] NIKOLIC S, MAISONNEUVE P, DAHLMAN I, et al. Exocrine and endocrine insufficiency in autoimmune pancreatitis: A matter of treatment or time?[J]. J Clin Med, 2022, 11( 13): 3724. DOI: 10.3390/jcm11133724. [48] NAGPAL SJS, SHARMA A, CHARI ST. Autoimmune pancreatitis[J]. Am J Gastroenterol, 2018, 113( 9): 1301. DOI: 10.1038/s41395-018-0146-0. [49] HART PA, TOPAZIAN MD, WITZIG TE, et al. Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab: The Mayo Clinic experience[J]. Gut, 2013, 62( 11): 1607- 1615. DOI: 10.1136/gutjnl-2012-302886. -



 PDF下载 ( 1001 KB)
PDF下载 ( 1001 KB)

 下载:
下载:


