婴儿胆汁淤积的肠道菌群组成及功能变化
DOI: 10.3969/j.issn.1001-5256.2021.01.025
Composition and functional change of intestinal microbiota in infantile cholestasis
-
摘要:
目的 研究胆汁淤积婴儿的肠道菌群组成及功能变化。 方法 纳入2014年9月—2016年2月深圳市儿童医院收治的42例胆汁淤积婴儿(胆汁淤积组)及同期32例正常对照婴儿(对照组),收集以上婴儿的大便标本,采用鸟枪法测序了解入选婴儿肠道菌群特征,应用京都基因与基因组百科全书、eggNOG数据库探索菌群功能改变。计量资料2组间比较采用Wilcoxon秩和检验; 计数资料2组间比较采用χ2检验。得到的菌种和基因功能通路等数据用Shannon系数、Wilcoxon秩和检验和DESeq2进行计算分析,利用Cytoscape将2组的丰富菌种和相关联系直观表现出来。 结果 胆汁淤积组病因包括胆道闭锁11例(26.2%),Citrin蛋白缺乏症4例(9.5%),胆管发育不良4例(9.5%),原因未明23例(54.8%)。2组肠道菌群组成在门水平有显著差异(Z=0.000 046,P<0.05),其中厚壁菌门和拟杆菌门在胆汁淤积组中显著增加; 在种水平上也有差异(Z=0.000 014,P<0.05),胆汁淤积组中有益菌如双歧杆菌明显减少,而潜在致病菌如韦永氏球菌和农研丝杆菌明显增多; 在功能水平上也有差异(Z=0.019 8,P<0.05),胆汁淤积组肠道菌群的功能明显减弱,如氨基酸代谢、糖代谢等。 结论 胆汁淤积婴儿肠道菌群的组成及功能发生改变,胆汁淤积婴儿肠道菌群中有益菌明显减少,潜在致病菌增多,补充双歧杆菌等有益菌可能减少潜在致病菌的产生,从而改变疾病的发展。 Abstract:Objective To investigate the composition and functional change of intestinal microbiota in infantile cholestasis (IC). Methods A total of 42 infants with IC who were admitted to Shenzhen Children's Hospital from September 2014 to February 2016 were enrolled as IC group, and 32 normal infants during the same period of time were enrolled as control group. Fecal samples were collected, and shotgun sequencing was used to investigate the features of intestinal microbiota. The Kyoto Encyclopedia of Genes and Genomes (KEGG) and eggNOG database were used to investigate the functional changes of intestinal microbiota. The Wilcoxon rank-sum test was used for comparison of continuous data between groups, and the chi-square test was used for comparison of categorical data between groups. Shannon coefficient, the Wilcoxon Rank sum test, and DESeq2 were used to calculate and analyze the data of strains and the functional pathways of genes, and Cytoscape was used to give a visual representation of abundant strains and their association. Results As for the etiology of IC in the IC group, 11(26.2%) had biliary atresia, 4(9.5%) had Citrin deficiency, 4(9.5%) had bile duct dysplasia, and 23(54.8%) had unknown cause. There was a significant difference in the composition of intestinal microbiota at the phylum level between the two groups (Z=0.000 046, P < 0.05), and the IC group had significant increases in Firmicutes and Bacteroidetes. There were also significant differences between the two groups at the species level (Z=0.000 014, P < 0.05), and the IC group had significant reductions in the probiotic bacteria including Bifidobacterium and significant increases in the potential pathogens including Veillonella and Niastella koreensis. There was a significant difference in the function of intestinal microbiota between the two groups (Z=0.019 8, P < 0.05), and the IC group had significant reductions in the functions of intestinal microbiota such as amino acid metabolism and carbohydrate metabolism. Conclusion Changes in the composition and function of intestinal microbiota are observed in infants with IC, with a significant reduction in probiotic bacteria and a significant increase in potential pathogens, and supplementation with probiotic bacteria including Bifidobacterium can reduce the production of potential pathogens and change disease progression. -
Key words:
- Infant /
- Cholestasis /
- Gastrointestinal Microbiome
-
婴儿胆汁淤积是由各种原因引起毛细胆管胆汁形成、分泌和/或胆汁排泄异常,使血中胆红素升高,以直接胆红素增高为主[1]。其病因较多,主要包括肝内胆汁淤积和肝外胆汁淤积,而后者主要以胆道闭锁最多见,国外流行病学资料[2]显示,活产婴儿中肝内胆汁淤积发生率为1/2500,欧美国家胆道闭锁发病率为1/9600~1/15 000,我国目前缺乏相关流行病学资料。
胆汁分泌系统作为连接肝脏和肠道的重要桥梁,在调节肠道微生态和肝脏功能中起到非常重要作用[3]。胆汁可以维持肠道菌群功能稳定和保持肠道菌群组成平衡[4-5]。目前,肠道菌群和肝脏疾病的关系是研究热点,如以鸟枪法测序检测成人肝硬化患者的肠道菌群与正常对照具有明显差异[6]。基于前期双胞胎肠道菌群研究经验[7],本研究采用鸟枪法测序检测42例胆汁淤积患儿及32例正常对照婴儿的肠道菌群,在肠道菌群及功能方面进行研究。
1. 资料与方法
1.1 研究对象
收集2014年9月—2016年2月本院收治的42例胆汁淤积婴儿的病例资料,定义为胆汁淤积组。纳入标准:(1)年龄<1岁; (2)均符合胆汁淤积的诊断标准[1]。TBil<85.5 μmol/L,DBil>17.1 μmol/L或TBil≥85.5 μmol/L,DBil占TBil的比例>20%;(3)1周内均未服用抗生素或微生态制剂。对照组选取儿童保健科体检的正常婴儿32例,纳入标准:对照组婴儿均经儿保科体检正常、年龄<1岁、排除胆汁淤积等疾病、1周内均未服用抗生素或微生态制剂。
1.2 临床资料收集
收集胆汁淤积组患儿性别、年龄、是否足月、生产方式、喂养方式、胆红素水平及最终诊断等临床资料。
1.3 标本收集
胆汁淤积组患儿统一在入院2 d内完成大便标本收集,对照组婴儿标本在符合入组标准下尽早收集,留取大便标本20 g,置于-80 ℃冰箱储藏。
1.4 鸟枪法宏基因组学测序
标本收集完毕后进行DNA提取,采用鸟枪法宏基因组学测序,每个标本输出2G原始数据,主要是门纲目科属种各个分类上各个样本的肠道菌群基因组成及比例。
1.5 肠道菌群分类和功能分析
得到的原始数据过滤掉一些质量低劣的序列后,每个样品剩余的序列采用MEGAN5[8]进行分类和功能分析。使用VEGAN[9]对样本多样性进行分析,样品多样性是根据Jaccard指数计算,Jaccard指数(样本A,样本B)=(样本A∩样本B)/(样本A∪样本B)[7],主坐标分析(principal coordinates analysis,PCoA)采用VEGAN的多样性功能。高丰度菌群定义为相对总数超过80%的菌群(超过90%的为门水平)。结果应用京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)[10]和eggNOG数据库[11]进一步功能注释。
1.6 伦理学审查
本研究方案经由深圳市儿童医院伦理委员会审批,批号:2016020,所有纳入婴儿家属均签署知情同意书。
1.7 统计学方法
采用SPSS 17.0统计软件进行数据分析。计量资料用M(P25~P75)表示,2组间比较采用Wilcoxon秩和检验。计数资料组间比较采用χ2检验。得到的菌种和基因功能通路等数据用Shannon系数、Wilcoxon秩和检验和DESeq2[12]进行计算分析,利用Cytoscape[13]将2组的丰富菌种和相关联系直观表现出来。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
胆汁淤积组共42例,对照组共32例。2组间性别、就诊年龄比较差异均有统计学意义(P值均>0.05)(表 1)。
表 1 2组患儿一般资料比较项目 胆汁淤积组(n=42) 对照组(n=32) 统计值 P值 男/女(例) 21/21 25/7 χ2=6.11 0.013 就诊年龄(d) 90.0(29.0~300.0) 60.0(30.0~120.0) Z=4.88 0.019 分娩方式[例(%)] χ2=0.03 0.873 顺产 36(85.7) 27(84.4) 剖腹产 6(14.3) 5(15.6) 喂养方式[例(%)] χ2=2.55 0.111 母乳喂养 34(81.0) 30(93.8) 人工喂养 8(19.0) 2(6.2) TBil(μmol/L) 172.2(41.4~348.9) DBil(μmol/L) 78.3(21.4~153.9) IBil(μmol/L) 80.4(20.0~241.1) 胆道闭锁[例(%)] 11(26.2) Citrin蛋白缺乏症[例(%)] 4(9.5) 胆管发育不良[例(%)] 4(9.5) 原因未明[例(%)] 23(54.8) 2.2 肠道菌群多样性比较
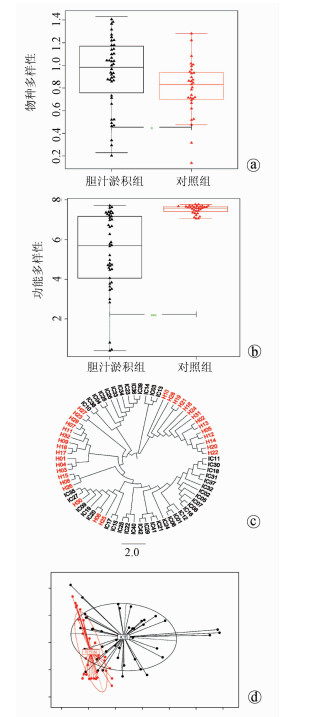
胆汁淤积组和对照组肠道菌群的组成在门水平有显著差异(Z=0.000 046, P<0.05)(图 1a),同时在功能水平上有显著差异(Z=0.019 8, P<0.05)(图 1b); 2组肠道菌群在种水平上亦有差异(Z=0.000 014, P<0.05)(图 1c、d)。
2.3 高丰度菌群和功能通路比较
在门水平上,厚壁菌门和拟杆菌门在胆汁淤积组中显著增加(图 2a)。在功能通路上,两组比较具有显著差异(Z=0.019 8, P<0.05),如氨基酸代谢、糖代谢和其他通路(图 2b),提示胆汁淤积组氨基酸代谢、糖代谢和膜运输通路都明显减弱。
潜在致病菌如农研丝杆菌GR20-10(Niastella koreensis GR20-10)和韦永氏球菌DSM 2008(Veillonella parvula DSM 2008)、加氏乳杆菌ATCC33323(Lactobacillus gasseri ATCC 33323)和沼洋红假单胞菌BisB18(Rho-dopseudomonaspalustris BisB18)在胆汁淤积组中极为丰富; 双歧杆菌(Bifidobacterium)如长双歧杆菌(Bifidobacterium longum)、齿双歧杆菌Bd1(Bifidobacterium dentium Bd1)和短双歧杆菌ACS-071-V-Sch8b(Bifidobacterium breve ACS-071-V-Sch8b)在对照组极为丰富, 狄氏副拟杆菌ATCC 8503(Parabacteroi desdistasonis ATCC 8503)在对照组中也较丰富,但在胆汁淤积组中明显减少(图 3)。
 图 3 胆汁淤积组和对照组中较丰富的菌种交互网络图注:由Cytoscape展示的交互网络图,农研丝杆菌GR20-10(Niastella koreensis GR20-10)、韦永氏球菌DSM 2008(Veillonella parvula DSM 2008)、加氏乳杆菌ATCC33323(Lactobacillus gasseri ATCC 33323)和沼泽红假单胞菌BisB18(Rhodopseudomonas palustris BisB18)在胆汁淤积组中极为丰富。双歧杆菌(Bifidobacterium)如长双歧杆菌(Bifidobacterium longum)、齿双歧杆菌Bd1(Bifidobacterium dentium Bd1)和短双歧杆菌ACS-071-V-Sch8b(Bifidobacterium breve ACS-071-V-Sch8b)在对照组中极为丰富,狄氏副拟杆菌ATCC 8503(Parabacteroides distasonis ATCC 8503)在对照组中也是较丰富的。
图 3 胆汁淤积组和对照组中较丰富的菌种交互网络图注:由Cytoscape展示的交互网络图,农研丝杆菌GR20-10(Niastella koreensis GR20-10)、韦永氏球菌DSM 2008(Veillonella parvula DSM 2008)、加氏乳杆菌ATCC33323(Lactobacillus gasseri ATCC 33323)和沼泽红假单胞菌BisB18(Rhodopseudomonas palustris BisB18)在胆汁淤积组中极为丰富。双歧杆菌(Bifidobacterium)如长双歧杆菌(Bifidobacterium longum)、齿双歧杆菌Bd1(Bifidobacterium dentium Bd1)和短双歧杆菌ACS-071-V-Sch8b(Bifidobacterium breve ACS-071-V-Sch8b)在对照组中极为丰富,狄氏副拟杆菌ATCC 8503(Parabacteroides distasonis ATCC 8503)在对照组中也是较丰富的。3. 讨论
胆汁淤积是婴儿常见疾病,以皮肤、巩膜黄染为主要表现,实验室指标提示胆红素升高,以DBil升高为主,病因多种多样,部分病因尚不清楚,本研究胆汁淤积组以病因未明组居多,胆道闭锁次之,考虑病例数较少,无法根据不同病因进行对照研究,故仅研究胆汁淤积婴儿对肠道菌群的影响。文献[14]报道, 胆汁淤积对肠道菌群的作用机制主要是由于肠道胆汁酸缺乏导致菌群失调,肠道黏膜的机械、化学、免疫及生物屏障均被破坏,细菌代谢产物及内毒素入血,引起器官和组织损伤。肠腔内胆汁分泌减少似乎对肠道微生物调节起着重要作用,这反过来可能影响疾病的发生发展。本研究中,与健康对照相比,胆汁淤积组患者的肠道菌群组成的多样性更显著,胆汁淤积组样本中肠道微生物群组成波动更加剧烈,细菌丰富度增加。研究[15]发现,胆汁流量减少有利于肠道细菌的生长,特别是那些致病和促炎菌。在生命的最初几个月,作为肠道微生物群定植的关键阶段,微生物群组成在肠道内的动态变化易受肠道环境变化的影响[16-18]。胆汁淤积通常发生在出生后1个月内,对干预婴儿肠道微生物群的发展产生影响。尽管患者病程相对较短(平均年龄2.7个月),但他们的肠道微生物群已经显示出过度生长的趋势。本研究结果证实,胆汁淤积是改变这些患者肠道微生物群落的一个重要因素。在这个早期脆弱阶段,肠道微生物群结构的适应性变化可能与长期健康问题有关,如黏膜免疫发育[19]。然而,据报道[20],在成人肝硬化中观察到肠道微生物多样性降低。由于正在生长的婴儿的肠道微生物群仍处于分化和成熟期,因此在胆汁淤积婴儿中保持微生物群体多样性是合理的。尽管胆汁淤积组患者的组成多样性高于对照组,但胆汁淤积组患者肠道微生物群的功能多样性较低。也就是说,组成多样化的肠道微生物群并没有相应地导致微生物群功能多样化,暗示了微生态失调。
为了研究胆汁淤积组患者肠道微生物群的特征,检测不同分类水平的详细组成变化。一般资料显示两组中性别、年龄有差异,但是研究[21]表明不同性别、不同月龄婴儿肠道菌群在门水平上无明显差异,故对研究结果无明显影响,本研究发现胆汁淤积组患者的拟杆菌门和厚壁菌门显著增加。拟杆菌门的增加可能导致农研丝杆菌GR20-10的增加。胆汁淤积组患者中双歧杆菌明显减低,而农研丝杆菌GR20-10和韦永氏球菌则更为丰富。婴儿期微生物组研究[22]表明,双歧杆菌、乳酸杆菌和韦永氏球菌属于4月龄婴儿肠道微生物组的特征性菌群组成。因此,生命的前4个月是这些物种生长的关键时期,它们对环境变化也更敏感。由于两组中的大部分样本都是在4个月前收集的,因此应考虑此阶段肠道微生物组的发育特征。在此期间,由于胆汁分泌减少和肠道双歧杆菌减少,韦永氏球菌和农研丝杆菌很可能疯狂成长。农研丝杆菌在胆汁淤积组患者的肠道菌群中显著增加。作为拟杆菌门中的新物种,农研丝杆菌尚未报道与何种人类疾病相关,目前尚不清楚它们是否与婴儿胆汁淤积有关,或者只是在不稳定的婴儿肠道菌群发育期间发生暂时转变。研究[6, 15, 20, 23]发现, 韦永氏球菌在成人肝硬化中也过度生长。已知韦永氏球菌是口腔起源并富集在小肠中,其富集反映了口腔细菌对肠道的侵入增加和小肠细菌过度生长和易位,这与人类肝硬化的内毒素血症有关[24-25]。胆汁淤积组中长双歧杆菌、齿双歧杆菌Bd1和短双歧杆菌ACS-071-V-Sch8b等有益菌较对照组明显减少,这与近年的研究相符[26],因此,增加双歧杆菌等有益菌摄入可能减少韦永氏球菌、农研丝杆菌和沼泽红假单胞菌BisB18等潜在致病菌的生长,从而改善疾病的发展。
随着肠道微生物组成的改变,胆汁淤积组患者的肠道微生物功能也出现了明显变化。基于KEGG数据库分析,胆汁淤积组患者的肠道微生物功能明显减弱,尤其是氨基酸代谢,碳水化合物代谢和膜转运; 同时,胆汁淤积组患者的未分类功能(无法分类或功能不明)显著升高,然而,肠道微生物群功能并没有与肠道细菌组成的多样性处于同一水平线上。目前尚不清楚这些未分类的功能是否会发展为特征性功能或仍然是未知数。胆汁淤积组患者的微生物功能的这种组内变异可能归因于那些大量未分类的功能,除了未分类的功能外,胆汁淤积组患者中与膜转运相关的标志物,与肝硬化、IBD、肥胖和2型糖尿病一致[6, 27-29]。胆汁淤积组患儿肠道菌群那些大量未分类的功能有待进一步深入研究。
本研究显示, 胆汁淤积患儿的肠道菌群在结构及功能上发生改变,肠道菌群差异主要表现在潜在致病菌的生长和菌群缺乏某些功能。胆汁淤积患儿中有益菌如双歧杆菌明显减少,而潜在致病菌如韦永氏球菌和农研丝杆菌明显增多,有可能导致胆汁流动减少。发现胆汁淤积患儿肠道菌群的功能明显减弱,如氨基酸代谢、糖代谢等,同时一些未分类功能增强,可能与胆汁淤积相关。本研究展示了胆汁淤积患儿在疾病期的肠道菌群组成和功能特点,为进一步深入研究奠定基础。
本研究具有一定局限性,包括样本量偏小,胆汁淤积病因较多,不同病因婴儿的肠道菌群可能有不一样的变化,一般资料中性别和年龄没有严格限制。在未来研究中可以加大样本量,在不同病因的胆汁淤积患儿中进行对照研究,严格设置入组标准,减少对结果的影响,希望未来有更好的研究成果。
-
注:由Cytoscape展示的交互网络图,农研丝杆菌GR20-10(Niastella koreensis GR20-10)、韦永氏球菌DSM 2008(Veillonella parvula DSM 2008)、加氏乳杆菌ATCC33323(Lactobacillus gasseri ATCC 33323)和沼泽红假单胞菌BisB18(Rhodopseudomonas palustris BisB18)在胆汁淤积组中极为丰富。双歧杆菌(Bifidobacterium)如长双歧杆菌(Bifidobacterium longum)、齿双歧杆菌Bd1(Bifidobacterium dentium Bd1)和短双歧杆菌ACS-071-V-Sch8b(Bifidobacterium breve ACS-071-V-Sch8b)在对照组中极为丰富,狄氏副拟杆菌ATCC 8503(Parabacteroides distasonis ATCC 8503)在对照组中也是较丰富的。
图 3 胆汁淤积组和对照组中较丰富的菌种交互网络图
表 1 2组患儿一般资料比较
项目 胆汁淤积组(n=42) 对照组(n=32) 统计值 P值 男/女(例) 21/21 25/7 χ2=6.11 0.013 就诊年龄(d) 90.0(29.0~300.0) 60.0(30.0~120.0) Z=4.88 0.019 分娩方式[例(%)] χ2=0.03 0.873 顺产 36(85.7) 27(84.4) 剖腹产 6(14.3) 5(15.6) 喂养方式[例(%)] χ2=2.55 0.111 母乳喂养 34(81.0) 30(93.8) 人工喂养 8(19.0) 2(6.2) TBil(μmol/L) 172.2(41.4~348.9) DBil(μmol/L) 78.3(21.4~153.9) IBil(μmol/L) 80.4(20.0~241.1) 胆道闭锁[例(%)] 11(26.2) Citrin蛋白缺乏症[例(%)] 4(9.5) 胆管发育不良[例(%)] 4(9.5) 原因未明[例(%)] 23(54.8) -
[1] LIU Y, HUANG ZH. Clinical diagnosis and treatment of cholestatic hepatopathy in infants[J]. J Clin Hepatol, 2015, 31(8): 1218-1220. (in Chinese) DOI: 10.3969/j.issn.1001-5256.2015.08.009刘艳, 黄志华. 婴儿胆汁淤积性肝病的诊断与治疗[J]. 临床肝胆病杂志, 2015, 31(8): 1218-1220. DOI: 10.3969/j.issn.1001-5256.2015.08.009 [2] FISCHLER B, LAMIREAU T. Cholestasis in the newborn and infant[J]. Clin Res Hepatol Gastroenterol, 2014, 38(3): 263-267. DOI: 10.1016/j.clinre.2014.03.010 [3] CESARO C, TISO A, DEL PRETE A, et al. Gut microbiota and probiotics in chronic liver diseases[J]. Dig Liver Dis, 2011, 43(6): 431-438. DOI: 10.1016/j.dld.2010.10.015 [4] TRAUNER M, FICKERT P, TILG H. Bile acids as modulators of gut microbiota linking dietary habits and inflammatory bowel disease: A potentially dangerous liaison[J]. Gastroenterology, 2013, 144(4): 844-846. DOI: 10.1053/j.gastro.2013.02.029 [5] TRAUNER M, HALILBASIC E. Nuclear receptors as new perspective for the management of liver diseases[J]. Gastroenterology, 2011, 140(4): 1120-1125. e1-e12. DOI: 10.1053/j.gastro.2011.02.044 [6] QIN N, YANG F, LI A, et al. Alterations of the human gut microbiome in liver cirrhosis[J]. Nature, 2014, 513(7516): 59-64. DOI: 10.1038/nature13568 [7] ZHOU S, XU R, HE F, et al. Diversity of gut microbiota metabolic pathways in 10 pairs of Chinese infant twins[J]. PLoS One, 2016, 11(9): e0161627. DOI: 10.1371/journal.pone.0161627 [8] HUSON DH, AUCH AF, QI J, et al. MEGAN analysis of metagenomic data[J]. Genome Res, 2007, 17(3): 377-386. DOI: 10.1101/gr.5969107 [9] DIXON P. VEGAN, a package of R functions for community ecology[J]. J Veg Sci, 2003, 14(6): 927-930. DOI: 10.1111/j.1654-1103.2003.tb02228.x [10] MANYAM G, BIRERDINC A, BARANOVA A. KPP: KEGG pathway painter[J]. BMC Syst Biol, 2015, 9(Suppl 2): s3. DOI: 10.1186/1752-0509-9-S2-S3 [11] JENSEN LJ, JULIEN P, KUHN M, et al. Eggnog: Automated construction and annotation of orthologous groups of genes[J]. Nucleic Acids Res, 2008, 36(Suppl 1): d250-d254. http://europepmc.org/abstract/MED/17942413 [12] LOVE MI, HUBER W, ANDERS S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J]. Genome Biol, 2014, 15(12): 550. DOI: 10.1186/s13059-014-0550-8 [13] SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13(11): 2498-2504. DOI: 10.1101/gr.1239303 [14] HUANG Q, ZHANG HB, LI JT, et al. Research advances in the mechanism of action of intestinal microecology in intrahepatic cholestasis[J]. J Clin Hepatol, 2019, 35(10): 2355-2359. (in Chinese) DOI: 10.3969/j.issn.1001-5256.2019.10.050黄倩, 张海博, 李京涛, 等. 肠道微生态在肝内胆汁淤积中的作用机制[J]. 临床肝胆病杂志, 2019, 35(10): 2355-2359. DOI: 10.3969/j.issn.1001-5256.2019.10.050 [15] RIDLON JM, ALVES JM, HYLEMON PB, et al. Cirrhosis, bile acids and gut microbiota: Unraveling a complex relationship[J]. Gut Microbes, 2013, 4(5): 382-387. DOI: 10.4161/gmic.25723 [16] COSTELLO EK, STAGAMAN K, DETHLEFSEN L, et al. The application of ecological theory toward an understanding of the human microbiome[J]. Science, 2012, 336(6086): 1255-1262. DOI: 10.1126/science.1224203 [17] TROSVIK P, STENSETH NC, RUDI K. Convergent temporal dynamics of the human infant gut microbiota[J]. ISME J, 2010, 4(2): 151-158. DOI: 10.1038/ismej.2009.96 [18] KOENIG JE, SPOR A, SCALFONE N, et al. Succession of microbial consortia in the developing infant gut microbiome[J]. Proc Natl Acad Sci U S A, 2011, 108 (Suppl 1): 4578-4585. http://emph.oxfordjournals.org/cgi/ijlink?linkType=ABST&journalCode=pnas&resid=108/Supplement_1/4578 [19] OLSZAK T, AN D, ZEISSIG S, et al. Microbial exposure during early life has persistent effects on natural killer T cell function[J]. Science, 2012, 336(6080): 489-493. DOI: 10.1126/science.1219328 [20] CHEN Y, YANG F, LU H, et al. Characterization of fecal microbial communities in patients with liver cirrhosis[J]. Hepatology, 2011, 54(2): 562-572. DOI: 10.1002/hep.24423 [21] YANG L, GE WP, WANG R, et al. Influence of age, gender and delivery mode on the differential analysis of intestinal flora in infants[J]. Acta Nutrimenta Sinica, 2019, 41(4): 352-357. (in Chinese) https://www.cnki.com.cn/Article/CJFDTOTAL-YYXX201904015.htm杨莉, 葛武鹏, 王瑞, 等. 不同月龄、性别、分娩方式对婴儿肠道菌群差异性分析[J]. 营养学报, 2019, 41(4): 352-357. https://www.cnki.com.cn/Article/CJFDTOTAL-YYXX201904015.htm [22] BÄCKHED F, ROSWALL J, PENG Y, et al. Dynamics and stabilization of the human gut microbiome during the first year of life[J]. Cell Host Microbe, 2015, 17(6): 852. DOI: 10.1016/j.chom.2015.05.012 [23] BAJAJ JS, RIDLON JM, HYLEMON PB, et al. Linkage of gut microbiome with cognition in hepatic encephalopathy[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(1): g168-g175. DOI: 10.1152/ajpgi.00190.2011 [24] FUKUI H. Gut-liver axis in liver cirrhosis: How to manage leaky gut and endotoxemia[J]. World J Hepatol, 2015, 7(3): 425-442. DOI: 10.4254/wjh.v7.i3.425 [25] BAUER TM, SCHWACHA H, STEINBRVCKNER B, et al. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia[J]. Am J Gastroenterol, 2002, 97(9): 2364-2370. DOI: 10.1111/j.1572-0241.2002.05791.x [26] WANG Y, GAO X, ZHANG X, et al. Gut microbiota dysbiosis is associated with altered bile acid metabolism in infantile cholestasis[J]. mSystems, 2019, 4(6): e00463-19. http://www.ncbi.nlm.nih.gov/pubmed/31848302 [27] QIN J, LI Y, CAI Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490(7418): 55-60. DOI: 10.1038/nature11450 [28] GREENBLUM S, TURNBAUGH PJ, BORENSTEIN E. Metagenomic systems biology of the human gut microbiome reveals topological shifts associated with obesity and inflammatory bowel disease[J]. Proc Natl Acad Sci U S A, 2012, 109(2): 594-599. DOI: 10.1073/pnas.1116053109 [29] LEPAGE P, HÄSLER R, SPEHLMANN ME, et al. Twin study indicates loss of interaction between microbiota and mucosa of patients with ulcerative colitis[J]. Gastroenterology, 2011, 141(1): 227-236. DOI: 10.1053/j.gastro.2011.04.011 期刊类型引用(5)
1. 杨秀芳,曾柳钰,郑铠军,邹梅玲,陈康,施尚文,丁俊彩,杨仙姬. 基于16S rDNA序列分析胃肠外营养相关性胆汁淤积症早产儿肠道微生态和肠-肝轴的研究. 标记免疫分析与临床. 2024(03): 482-490 .  百度学术
百度学术2. 陈嘉雯,谢伊玲,杨勇. 新生儿坏死性小肠结肠炎患儿的临床特点及早发型患儿的危险因素分析. 中国妇幼保健. 2024(12): 2248-2251 .  百度学术
百度学术3. 吴晓明,何强,侯林毅,胡艳,甄小芳,郝静,盛燕. 淤胆通方对α-萘异硫氰酸酯诱导的胆汁淤积小鼠肠道菌群和肠道屏障功能的影响. 临床肝胆病杂志. 2023(04): 864-875 .  本站查看
本站查看4. 葛军涛,詹江华. 胆道闭锁Kasai术后辅助治疗研究进展. 天津医药. 2022(01): 30-34 .  百度学术
百度学术5. 叶圣,郑丽珠. 布拉酵母菌在新生儿肠外营养相关性胆汁淤积中的治疗效果. 吉林医学. 2022(05): 1260-1262 .  百度学术
百度学术其他类型引用(3)
-




 PDF下载 ( 4055 KB)
PDF下载 ( 4055 KB)

 下载:
下载:


 下载:
下载:


 百度学术
百度学术




