Establishment and evaluation of a nomogram for predicting post-hepatectomy complications in two types of hepatic echinococcosis
-
摘要:
目的 通过分析两型肝包虫病肝切除术后并发症(PHC)的相关危险因素,建立预测肝包虫病PHC发生风险的列线图,并评价其临床使用价值。 方法 收集青海大学附属医院2015年1月—2020年8月收治的263例两型肝包虫病行肝切除手术患者的临床资料,并进行回顾性分析,263例患者中PHC组93例,对照组170例。非正态分布的计量资料2组间比较采用Mann-Whitney U秩和检验,正态性计量资料2组间比较采用独立样本t检验;计数资料2组间比较采用χ2检验和Fisher确切概率法。通过单因素和多因素logistic回归筛选出两型肝包虫病PHC的独立危险因素。根据独立危险因素所占权重,构建列线图预测风险模型。采用Bootstrap重采样法进行模型的内部验证、构建受试者工作特征曲线对模型的区分度进行评价、使用校准曲线和Hosmer-Lemeshow检验对模型的一致性进行评价、绘制临床决策曲线分析(DCA) 验证模型的临床有效性。 结果 ALBI评分(OR=3.694, 95%CI:1.860~7.336)、手术时间(OR=2.848,95%CI:1.384~5.859)、术中出血量(OR=4.832, 95%CI: 2.384~9.793)、包虫直径(OR=3.073,95%CI: 1.528~6.177)是两型肝包虫发生PHC的独立危险因素(P值均<0.05)。基于上述4个独立危险因素所占权重构建列线图风险预测模型,模型的受试者工作特征曲线下面积为0.877(95%CI:0.831~0.923);Bootstrap重采样法进行内部验证的一致性指数(C-index)为0.871,表明模型的区分度良好。校准曲线观测值和实际值贴合,Hosmer-Lemeshow检验(P=0.905)均显示列线图风险预测模型的预测值与实际观测值一致性良好。当阈概率为35.6%时,DCA显示的临床净获益为22%;在8%~89%阈概率区间内有较好的临床适用性。 结论 ALBI评分、手术时间、术中出血量、包虫直径是两型肝包虫病患者发生PHC的独立危险因素,以此为基础构建的列线图风险预测模型具有较好的准确度、一致性及临床实用性。 Abstract:Objective To establish a nomogram for predicting the risk of post-hepatectomy complications (PHC) in hepatic echinococcosis by analyzing the risk factors for PHC in two types of hepatic echinococcosis, and to investigate its value in clinical practice. Methods A retrospective analysis was performed for the clinical data of 263 patients with two types of hepatic echinococcosis who underwent hepatectomy in Qinghai University Affiliated Hospital from January 2015 to August 2020, and among these patients, 93 were enrolled as PHC group and 170 were enrolled as control group. The Mann-Whitney U test was used for comparison of non-normally distributed continuous data between two groups, and the independent samples t-test was used for comparison of normally distributed continuous data between two groups; the chi-square test and the Fisher's exact test were used for comparison of categorical data between two groups. Univariate and multivariate logistic regression analyses were used to screen out independent risk factors for PHC, and a nomogram risk prediction model was established based on the weight of each independent risk factor. The Bootstrap resampling method was used for internal verification of the model; the receiver operating characteristic (ROC) curve was plotted to evaluate the discriminatory ability of the model; calibration curve and the Hosmer-Lemeshow test were used to evaluate the consistency of the model; decision curve analysis (DCA) was performed to verify the clinical effectiveness of the model. Results Albumin-bilirubin (ALBI) score (odds ratio [OR]=3.694, 95% confidence interval [CI]: 1.860-7.336, P < 0.05), time of operation (OR=2.848, 95%CI: 1.384-5.859, P < 0.05), intraoperative blood loss (OR=4.832, 95%CI: 2.384-9.793, P < 0.05), and hydatid diameter (OR=3.073, 95%CI: 1.528-6.177, P < 0.05) were independent risk factors for PHC in two types of hepatic echinococcosis. A nomogram risk prediction model was established based on the weight of the above four independent risk factors, and the model had an area under the ROC curve of 0.877 (95%CI: 0.831-0.923). The model had a consistency index of 0.871 after internal verification using the Bootstrap resampling method, suggesting that the model had good discriminatory ability. The fitting of the observed value and the actual value of the calibration curve and the Hosmer-Lemeshow test (P=0.905) showed that the predicted value of the nomogram risk prediction model had good consistency with the actual observed value. When the threshold probability was 35.6%, DCA showed a net clinical benefit of 22%, and the model had good clinical applicability within the threshold probability ranging from 8% to 89%. Conclusion ALBI score, time of operation, intraoperative blood loss, and hydatid diameter are independent risk factors for PHC in patients with two types of hepatic echinococcosis, and the nomogram risk prediction model established based on these factors has good accuracy, consistency, and clinical practicability. -
Key words:
- Echinococcosis, Hepatic /
- Hepatectomy /
- Postoperative Complications /
- Risk Factors /
- Nomograms
-
肝包虫病有较高的发病率及死亡率,肝切除是其主要治疗方式。虽然术后死亡率比之前有所降低,但肝切除术后并发症(post-hepatectomy complications,PHC)发生率却未见显著下降[1-2]。目前肝包虫病PHC的临床研究比较局限,所纳入病例混杂且例数相对较少、PHC相关内容欠缺,并且尚无相关列线图风险预测模型的构建及验证[3]。本研究旨在探索两型肝包虫病(囊性和泡型)PHC的独立危险因素,构建列线图风险预测模型,以更好的指导围手术期临床决策,减少PHC的发生。
1. 资料与方法
1.1 研究对象
收集青海大学附属医院2015年1月—2020年8月收治的263例两型肝包虫病行肝切除手术患者的临床资料。入组标准:(1)术前影像学和术后病理学诊断为肝包虫病的患者; (2)行肝切除手术治疗; (3)久居青海。排除标准:(1)影像学及病理学诊断不明确; (2)合并肝囊肿、肝癌、肝血管瘤等其他肝脏良恶性疾病; (3)无术前、术中、术后所需指标; (4)术前已有术后相关PHC; (5)行肝移植、病灶微波消融、病灶穿刺引流、合并其他疾病行化疗等治疗方法; (6)已行多次肝脏手术治疗患者; (7)包虫病灶剔除患者。
1.2 手术方式
取上腹部反“L”字形切口(腹腔镜根据需要采用不同数目的腔镜孔洞),分离韧带、游离肝脏,离断病侧肝短静脉。Pringle法一次性阻断入肝血流不超过15 min,如需继续操作解除阻断5~10 min或精准阻断病侧血流(区域阻断)。标记肝脏离断面,缝针牵引肝脏,CUSA刀切断肝组织,沿断面依次处理管道,5-0 proline线缝扎脉管系统断端,较细的脉管系统用“连发钛夹”夹闭,病灶与肝静脉密切处使用“切割吻合器”处理。胆肠吻合:自肠系膜上血管后方上提空肠,距离盲端15 cm离断,4-0可吸收缝线依次连续缝合。无菌纱布法检查创面有无胆漏,若发现则使用4-0 proline线缝合。肝创面电凝止血并使用“速即纱”覆盖。腹腔注入透明质酸钠、膈下及创面常规放置引流管。
1.3 临床资料搜集
收集患者资料:(1)年龄、身高、体质量等基本信息;(2)术前ALBI、TBil、AST、PLT等实验室指标;(3)包虫直径(病灶最长直径)、数量等影像学资料;(4)是否合并乙型肝炎;(5)手术时间、输血量、切除段数、切除部位、血流阻断方式、有无胆道介入手术等术中资料;(6)术后血红蛋白、INR、TBil、PT、血清肌酐(Scr)、引流液或其他部位体液细菌培养等实验室指标;(7)术后胸部腹部CT及彩超等影像学资料;(8)术后引流液量、颜色、化验结果;(9)术后腹腔穿刺是否引流出胆汁、血液、腹水;(10)PHC的治疗措施。
1.4 相关定义
(1) 中央型肝切除包括肝Ⅳ、Ⅴ、Ⅷ段,并留有两个创面。(2)肝切除术后胆漏(post-hepatectomy bile leakage,PHBL)即术后引流液胆红素浓度为血清浓度的3倍;肝切除术后肝衰竭(post-hepatectomy liver failur, PHLF)即术后第5天或之后INR增高伴随高胆红素血症;肝切除术后出血即血红蛋白水平较术后基线水平下降>3 g/dl或需要介入或重新开腹止血,上述定义遵循国际肝胆胰小组标准[4-6]。(3)胸腔积液:术后经胸部CT证实并采取胸腔闭式引流治疗。(4)肝切除术后感染的诊断符合《医院感染诊断标准》[7],即体液或引流液培养出相关细菌并进行抗感染治疗。(5)急性肾衰竭诊断符合2004年国际专家共识[8],即术后Scr升高3倍或Scr≥354 μmoI/L伴Scr急剧上升>44 μmoI/L。(6)切除3个以上的肝段称为大肝切除。(7)胆道介入是指术中行胆肠吻合、肝肠吻合、胆道重建、T管引流等胆道的有创性操作。(8)死亡定义为住院手术期间死亡病例。(9)PHC包括PHLF、PHBL、出血、胸腔积液、感染、急性肾衰竭、死亡。
1.5 伦理学审查
本研究方案经由青海大学附属医院伦理委员会审批,批号:PSL2018006,患者均签署知情同意书。
1.6 统计学方法
采用SPSS 24.0及R软件3.6.3进行数据分析。非正态分布的计量资料采用M(P25~P75)表示,2组间比较使用Mann-Whitney U秩和检验;正态分布的计量资料使用x±s表示,2组间比较采用独立样本t检验。计数资料2组间比较采用χ2检验和Fisher确切概率法。通过单因素和多因素logistic回归筛选出两型肝包虫病PHC的独立危险因素,使用LR法进行回归分析,同时检验各个因素间有无多重共线性。根据独立危险因素所占权重,构建列线图预测风险模型。采用Bootstrap重采样法进行模型的内部验证、构建受试者工作特征曲线(ROC曲线)对模型的区分度进行评价、使用校准曲线和Hosmer-Lemeshow检验对模型的一致性进行评价、绘制临床决策曲线分析(decision curve analysis,DCA)验证模型的临床有效性。P<0.05为差异有统计学意义。
2. 结果
2.1 PHC发生情况
入组263例患者中PHC组93例,对照组170例。PHC组包括PHLF 78例、PHBL 19例、出血9例;胸腔积液31例、死亡3例、急性肾衰竭4例、切口感染1例、肺部感染3例、腹腔感染17例。
2.2 一般资料
PHC组及对照组间的包虫直径、术中出血量、ALBI、手术时间、切除段数、是否胆道介入差异均有统计学意义(P值均<0.05)(表 1)。
表 1 两型肝包虫病PHC组和对照组资料比较指标 对照组(n=170) PHC组(n=93) 统计值 P值 年龄(岁) 37.04±13.11 38.73±12.98 t=-1.003 0.317 BMI(kg/m2) 21.61±4.31 21.39±3.36 t=0.427 0.670 APRI 0.23(0.19~0.38) 0.27(0.17~0.49) Z=-0.837 0.403 ALBI评分 -2.66(-2.91~-2.39) -2.31(-2.66~-1.87) Z=-5.333 <0.001 手术时间(min) 250(210~286) 330(287~402) Z=-8.120 <0.001 术中出血量(mL) 400(200~800) 1400(900~2100) Z=-9.310 <0.001 包虫直径(cm) 8.50(6.43~11.07) 11.98(10.02~14.24) Z=-7.227 <0.001 切除段数(例) χ2=38.941 <0.001 <3 79 8 ≥3 91 85 切除部位(例) 0.746 非肝中叶切除 164 89 肝中叶切除 6 4 胆道介入(例) χ2=39.866 <0.001 否 167 68 是 3 25 乙型肝炎(例) χ2=0.782 0.377 否 139 80 是 31 13 手术方式(例) 0.103 开腹肝切除 160 92 腹腔镜肝切除 10 1 阻断方式(例) χ2=0.637 0.425 Pringle阻断 79 48 区域阻断 91 45 2.3 单因素及多因素logistic回归分析结果
分析前将APRI、包虫直径、术中出血量、ALBI、手术时间等计量资料取最佳截断值,然后转化成二分类变量并进行赋值:APRI<0.47为0,APRI≥0.47为1;包虫直径<10 cm为0,包虫直径≥10 cm为1;术中出血量<1000 mL为0,术中出血量≥1000 mL为1;ALBI<-2.45分为0,ALBI≥-2.45分为1;手术时间<280 min为0,手术时间≥280 min为1。单因素回归分析筛选出有统计学意义的变量为包虫直径、术中出血量、手术时间、ALBI、切除段数、胆道介入(P值均<0.05)(表 2)。进一步多因素logistic回归结果显示包虫直径、术中出血量、手术时间、ALBI是PHC的独立危险因素(P值均<0.05)(表 3)。
表 2 两型肝包虫病PHC的单因素logistic回归分析结果指标 β值 标准误 Wald值 OR值 95%CI P值 年龄 0.010 0.010 1.006 1.010 0.991~1.030 0.316 BMI -0.014 0.033 0.183 0.986 0.925~1.051 0.669 APRI 0.471 0.257 3.369 1.602 0.969~2.651 0.066 ALBI 2.093 0.292 51.210 8.108 4.571~14.383 <0.001 手术时间 2.087 0.302 47.786 8.058 6.898~23.144 <0.001 术中出血量 2.536 0.309 67.463 12.635 6.898~23.144 <0.001 包虫直径 2.076 0.297 48.839 7.969 4.453~14.264 <0.001 切除段数 2.222 0.401 30.773 9.224 4.207~20.222 <0.001 切除部位 0.206 0.659 0.098 1.228 0.338~4.468 0.755 胆道介入 3.019 0.628 23.127 20.466 5.980~70.039 <0.001 乙型肝炎 -0.317 0.359 0.778 0.729 0.361~1.473 0.378 手术方式 -1.749 1.057 2.739 0.174 0.022~1.380 0.098 阻断方式 -0.206 0.258 0.636 0.814 0.491~1.350 0.425 表 3 两型肝包虫病PHC的多因素logistic回归分析结果指标 β值 标准误 Wald值 OR值 95%CI P值 ALBI 1.307 0.350 13.939 3.694 1.860~7.336 <0.001 手术时间 1.046 0.368 8.082 2.848 1.384~5.859 0.004 术中出血量 1.575 0.360 19.103 4.832 2.384~9.793 <0.001 包虫直径 1.123 0.356 9.928 3.073 1.528~6.177 0.002 常量 -3.122 0.367 72.444 0.044 <0.001 2.4 共线性诊断
将筛选出的危险因素行共线性诊断,方差膨胀因子分别为1.337(包虫直径)、1.402(手术时间)、1.504(术中出血量)、1.284(ALBI)均<10,表明4个独立危险因素间不存在多重共线性。
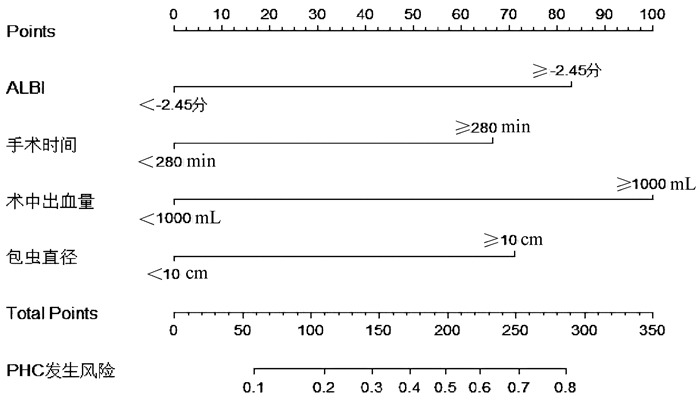
2.5 列线图及验证模型的构建
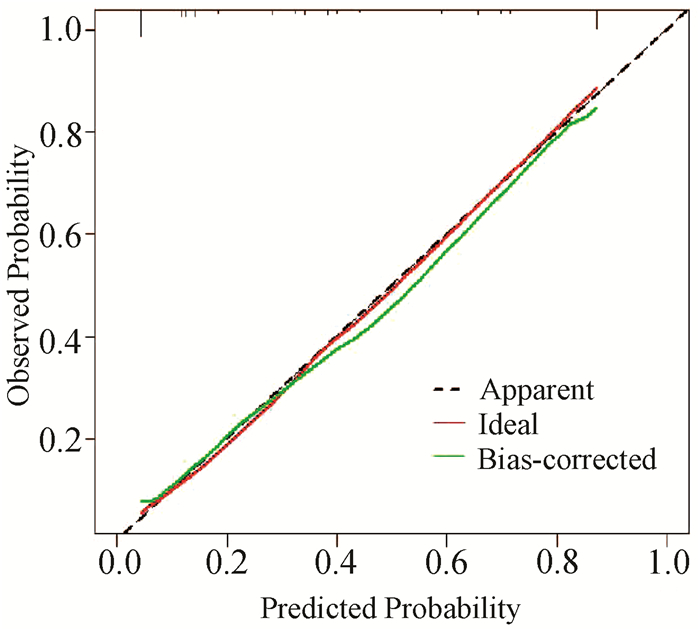
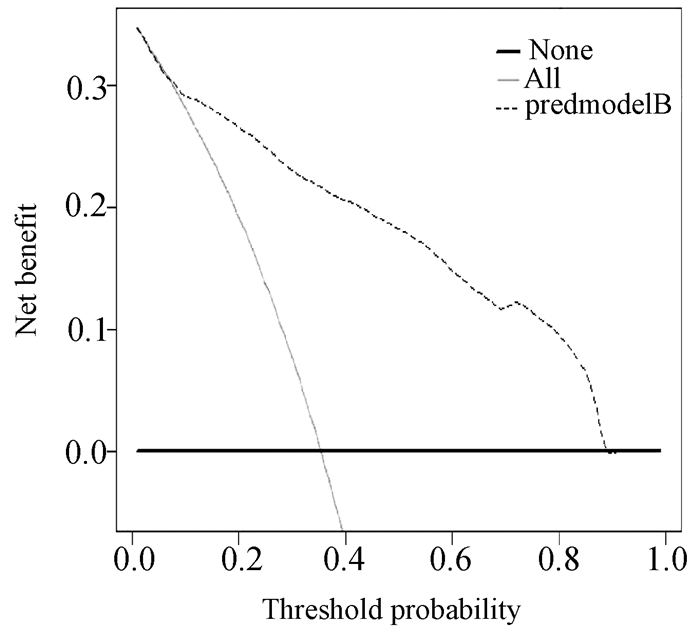
根据独立危险素构建可视化列线图(图 1)。ROC曲线结果显示AUC为0.877(95%CI:0.831~0.923),最佳截断值为0.356(图 2)。设置种子数为300,Bootstrap1000重采样结果显示:C-index为0.871。ROC曲线及重采样法均表明列线图预测模型有较好的区分度。Bootstrap1000重采样构建校准曲线(图 3)显示:拟合直线(Apparent)、校准曲线(Bias-corrected)与实际观测直线(ideal)紧密贴合。Hosmer-Lemeshow检验结果显示:P=0.905。校准曲线和Hosmer-Lemeshow检验均表明模型一致性良好且无过渡拟合情况出现。DCA(图 4)结果显示:阈值在8%~89%区间内,患者受益曲线(黑色虚线)高于两条异常曲线(黑色横线和灰色斜线),并且ROC曲线所得结果的最佳截断值0.356在阈值区间内。假如把35.6%当做诊断PHC且给予治疗的阈概率值,带入DCA,可以发现,100例患者中,在不损伤剩余人利益的情况下有22例患者从DCA中获益。
3. 讨论
包虫病随着流行范围逐渐扩大,越来越受到全世界的广泛关注。肝泡型包虫病的生物学特性决定了其主要治疗方式为肝切除术;而对于肝囊性包虫病,虽然治疗方式多样,但是复发率及并发症较高,严重降低了患者的生活质量。随着外科条件及手术工具的不断进步,肝切除术已经逐渐成为一种常规的手术,也成为其主要的治疗手段[9]。虽然肝切除手术方式多样,但是PHC一直是困扰临床医师的难题,不仅使术后护理难度加大,还延长了住院时限,使住院费用增加。
包虫直径较大引起PHC的主要原因可以归结为以下几点:(1)更容易对周围肝脏造成压迫,形成术中难以发现的隐匿性胆漏; (2)需要离断更多的血管、胆管、淋巴管及其附属组织; (3)切除范围大,剩余肝体积相对较少,严重影响肝功能; (4)手术时间、术中输液量、出血量更多,手术创伤大和大量凝血因子被消耗。既往研究[3, 10]表明肿瘤直径>10.5 cm或>12 cm是PHBL的独立危险因素。以往大多数PHBL的研究[3, 5, 11-13]中均排除了术中胆道介入的因素,只有极少数的研究表明胆道介入与PHBL有关,提示随着医疗科研及手术的进步,胆道介入已经不是影响PHBL的主要因素。同时也有Meta分析表明,病灶直径>10 cm是PHLF的独立危险因素[14]。常磊等[15]Meta分析表明:Pringle法与半肝血流阻断法在PHC发生率方面无差异,但是Pringle法较半肝血流阻断法术后肝功能恢复时间较长。在本研究中Pringle法与半肝血流阻断法的PHC无明显差异。在本研究中病灶直径≥10 cm是最佳截断值,与既往PHBL、PHLF的研究结果一致。
术中出血量多和手术时间较长引起PHC原因有以下几方面:(1)血流重新分布,不重要血管收缩,血流量减少; (2)间接影响术中输血量; (3)消耗大量凝血因子; (4)加重肝功能损伤。相关综述及Meta分析表明,术中出血量≥1000 mL是PHLF的重要影响因素[14, 16-17]。也有研究[12, 18]表明手术时间≥300 min是PHBL、术后感染的独立危险因素。有学者[19]依据Clavien-Dindo分级系统对PHC分析,结果表明术中失血量是PHC的独立危险因素,但是未给出术中出血量的最佳截断值。本研究术中出血量和手术时间的最佳截断值分别为≥1000 mL、≥280 min,与既往相关研究大致相同。
肝功能状态是影响PHC的主要因素。ALBI由于其简单、便捷、无创等优点被广泛用于肝功能的评估。Zou等[20]对行肝切除的229例肝癌患者进行分析,ALBI评分较Child-Pugh评分更适合用于PHC或PHLF预测模型的构建。同时多中心研究[21]表明:ALBI评分比终末期肝病模型更能有效的预测PHBL和PHLF的发生风险,但该研究虽然证实了ALBI在预测PHBL和PHLF的价值,但是没有对其截断值进行确定,仅仅停留在分级系统上。本研究中ALBI的截断值是-2.45分,分属B级范围,与既往研究结果一致[21]。Tian等[22]从细胞因子水平证实了转化生长因子β在肝囊性包虫病患者中表达上调,与肝纤维化密切相关。同时Zhang等[23]在基因水平上阐述了肝囊性包虫病囊液通过抑制miR-19的表达促进囊型包虫病囊周纤维化。有学者[24]认为APRI是肝癌患者PHC发生的关键评估因素。但在本研究中,APRI在PHC组和对照组间无明显差异。目前尚无肝包虫病与纤维化程度、进程、范围的相关研究,其原因可能与包虫所致纤维进程较慢,所致范围较窄,根治性手术期间已经将肝纤维化部分病灶切除有关。
综上所述,以4个独立危险因素为基础构建的预测模型具有良好的临床应用前景,未来可以在多中心验证的基础上寻求进一步的临床应用。
-
表 1 两型肝包虫病PHC组和对照组资料比较
指标 对照组(n=170) PHC组(n=93) 统计值 P值 年龄(岁) 37.04±13.11 38.73±12.98 t=-1.003 0.317 BMI(kg/m2) 21.61±4.31 21.39±3.36 t=0.427 0.670 APRI 0.23(0.19~0.38) 0.27(0.17~0.49) Z=-0.837 0.403 ALBI评分 -2.66(-2.91~-2.39) -2.31(-2.66~-1.87) Z=-5.333 <0.001 手术时间(min) 250(210~286) 330(287~402) Z=-8.120 <0.001 术中出血量(mL) 400(200~800) 1400(900~2100) Z=-9.310 <0.001 包虫直径(cm) 8.50(6.43~11.07) 11.98(10.02~14.24) Z=-7.227 <0.001 切除段数(例) χ2=38.941 <0.001 <3 79 8 ≥3 91 85 切除部位(例) 0.746 非肝中叶切除 164 89 肝中叶切除 6 4 胆道介入(例) χ2=39.866 <0.001 否 167 68 是 3 25 乙型肝炎(例) χ2=0.782 0.377 否 139 80 是 31 13 手术方式(例) 0.103 开腹肝切除 160 92 腹腔镜肝切除 10 1 阻断方式(例) χ2=0.637 0.425 Pringle阻断 79 48 区域阻断 91 45 表 2 两型肝包虫病PHC的单因素logistic回归分析结果
指标 β值 标准误 Wald值 OR值 95%CI P值 年龄 0.010 0.010 1.006 1.010 0.991~1.030 0.316 BMI -0.014 0.033 0.183 0.986 0.925~1.051 0.669 APRI 0.471 0.257 3.369 1.602 0.969~2.651 0.066 ALBI 2.093 0.292 51.210 8.108 4.571~14.383 <0.001 手术时间 2.087 0.302 47.786 8.058 6.898~23.144 <0.001 术中出血量 2.536 0.309 67.463 12.635 6.898~23.144 <0.001 包虫直径 2.076 0.297 48.839 7.969 4.453~14.264 <0.001 切除段数 2.222 0.401 30.773 9.224 4.207~20.222 <0.001 切除部位 0.206 0.659 0.098 1.228 0.338~4.468 0.755 胆道介入 3.019 0.628 23.127 20.466 5.980~70.039 <0.001 乙型肝炎 -0.317 0.359 0.778 0.729 0.361~1.473 0.378 手术方式 -1.749 1.057 2.739 0.174 0.022~1.380 0.098 阻断方式 -0.206 0.258 0.636 0.814 0.491~1.350 0.425 表 3 两型肝包虫病PHC的多因素logistic回归分析结果
指标 β值 标准误 Wald值 OR值 95%CI P值 ALBI 1.307 0.350 13.939 3.694 1.860~7.336 <0.001 手术时间 1.046 0.368 8.082 2.848 1.384~5.859 0.004 术中出血量 1.575 0.360 19.103 4.832 2.384~9.793 <0.001 包虫直径 1.123 0.356 9.928 3.073 1.528~6.177 0.002 常量 -3.122 0.367 72.444 0.044 <0.001 -
[1] MA L, CHEN DC, ZOU SY, et al. Epidemiological characteristics of hepatic echinococcosis, concurrent cerebral echinococcosis, and pulmonary echinococcosis in Ganzi County, Sichuan Province, China[J]. Medicine (Baltimore), 2020, 99(15): e19753. DOI: 10.1097/MD.0000000000019753. [2] MCMANUS DP, GRAY DJ, ZHANG W, et al. Diagnosis, treatment, and management of echinococcosis[J]. BMJ, 2012, 344: e3866. DOI: 10.1136/bmj.e3866. [3] CEHN L, LI Y. The risk factors and prediction systems for posthepatectomy complications[J]. J Clin Hepatol, 2019, 35(1): 217-221. DOI: 10.3969/j.issn.1001-5256.2019.01.048.陈龙, 李钺. 肝切除术后并发症的危险因素及预测评分系统[J]. 临床肝胆病杂志, 2019, 35(1): 217-221. DOI: 10.3969/j.issn.1001-5256.2019.01.048. [4] KOCH M, GARDEN OJ, PADBURY R, et al. Bile leakage after hepatobiliary and pancreatic surgery: A definition and grading of severity by the International Study Group of Liver Surgery[J]. Surgery, 2011, 149(5): 680-688. DOI: 10.1016/j.surg.2010.12.002. [5] RAHBARI NN, GARDEN OJ, PADBURY R, et al. Posthepatectomy liver failure: A definition and grading by the International Study Group of Liver Surgery (ISGLS)[J]. Surgery, 2011, 149(5): 713-724. DOI: 10.1016/j.surg.2010.10.001. [6] RAHBARI NN, GARDEN OJ, PADBURY R, et al. Post-hepatectomy haemorrhage: A definition and grading by the International Study Group of Liver Surgery (ISGLS)[J]. HPB (Oxford), 2011, 13(8): 528-535. DOI: 10.1111/j.1477-2574.2011.00319.x. [7] National Health commission of the People's Republic of China. Diagnostic criteria for nosocomial infections(proposed)[J]. Natl Med J China, 2001, 81(5): 314-320. DOI: 10.3760/j:issn:0376-2491.2001.05.027.中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. DOI: 10.3760/j:issn:0376-2491.2001.05.027. [8] BELLOMO R, RONCO C, KELLUM JA, et al. Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: The Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group[J]. Crit Care, 2004, 8(4): R204-R212. DOI: 10.1186/cc2872. [9] Chinese Doctor Association, Chinese College of Surgeons (CCS), Chinese Committee for Hadytidology (CCH). Expert consensus on diagnosis and treatment of hepatic cystic and alveolar echinococcosis (2019 edition)[J]. Chin J Dig Surg, 2019, 18(8): 711-721. DOI: 10.3760/cma.j.issn.1673-9752.2019.08.002.中国医师协会外科医师分会包虫病外科专业委员会. 肝两型包虫病诊断与治疗专家共识(2019版)[J]. 中华消化外科杂志, 2019, 18(8): 711-721. DOI: 10.3760/cma.j.issn.1673-9752.2019.08.002. [10] YANG X, QIU Y, WANG W, et al. Risk factors and a simple model for predicting bile leakage after radical hepatectomy in patients with hepatic alveolar echinococcosis[J]. Medicine (Baltimore), 2017, 96(46): e8774. DOI: 10.1097/MD.0000000000008774. [11] NAKAGAWA K, TANAKA K, NOJIRI K, et al. Predictive factors for bile leakage after hepatectomy for hepatic tumors: A retrospective multicenter study with 631 cases at Yokohama Clinical Oncology Group (YCOG)[J]. J Hepatobiliary Pancreat Sci, 2017, 24(1): 33-41. DOI: 10.1002/jhbp.411. [12] SADAMORI H, YAGI T, MATSUDA H, et al. Intractable bile leakage after hepatectomy for hepatocellular carcinoma in 359 recent cases[J]. Dig Surg, 2012, 29(2): 149-156. DOI: 10.1159/000337313. [13] ISHII H, OCHIAI T, MURAYAMA Y, et al. Risk factors and management of postoperative bile leakage after hepatectomy without bilioenteric anastomosis[J]. Dig Surg, 2011, 28(3): 198-204. DOI: 10.1159/000324042. [14] YIN TS, YI YY, MAO XX et al. Meta-analysis of risk factors for posthepatectomy liver failure in patients with hepatocellular carcinoma[J]. J Clin Hepatol, 2014, 30(10): 1009-1014. DOI: 10.3969/j.issn.1001-5256.2014.10.009.尹天圣, 易亚阳, 毛熙贤, 等. 肝癌肝切除术后肝衰竭危险因素的Meta分析[J]. 临床肝胆病杂志, 2014, 30(10): 1009-1014. DOI: 10.3969/j.issn.1001-5256.2014.10.009. [15] CHANG L, YU MC, YUAN YF, et al. Safety and effectiveness of hemihepatic blood flow occlusion versus pringle's maneuver during hepatectomy: A Meta-analysis[J]. Chin J Evid-based Med, 2014, 14(6): 743-751. DOI: 10.7507/1672-2531.20140125.常磊, 喻满成, 袁玉峰, 等. 半肝血流阻断法与Pringle法在肝切除术应用中安全性与有效性比较的Meta分析[J]. 中国循证医学杂志, 2014, 14(6): 743-751. DOI: 10.7507/1672-2531.20140125. [16] ZENG YC, DING HD, ZOU RY, et al. Research progress on the risk factors, prevention and therapy in posthepatectomy liver failure[J]. Chin J Hepatobiliary Surg, 2019, 25(9): 711-715. DOI: 10.3760/cma.j.issn.1007-8118.2019.09.020.曾勇超, 丁宏达, 邹若媱, 等. 肝切除术后肝功能衰竭危险因素与防治的研究进展[J]. 中华肝胆外科杂志, 2019, 25(9): 711-715. DOI: 10.3760/cma.j.issn.1007-8118.2019.09.020. [17] XU Y, LI JB, HU XL, et al. Research status of risk predictors and corresponding strategies of posthepatectomy liver failure[J]. Chin J Dig Surg, 2020, 19 (2): 220-224. DOI: 10.3760/cma.j.issn.1673-9752.2020.02.016.徐岩, 李江斌, 胡小玲, 等. 肝切除术后肝衰竭风险预测指标及应对策略的研究现状[J]. 中华消化外科杂志, 2020, 19 (2): 220-224. DOI: 10.3760/cma.j.issn.1673-9752.2020.02.016. [18] CHENG WL, QI YQ, CHEN YJ, et al. A meta-analysis of risk factors of postoperative infectious complications after liver resection for hepatocellular carcinoma[J]. Chin J Hepatobiliary Surg, 2016, 22(1): 5-8. DOI: 10.3760/cma.j.issn.1007-8118.2016.01.002.承文龙, 齐永强, 陈勇军, 等. 肝癌肝切除术后感染并发症相关危险因素的Meta分析[J]. 中华肝胆外科杂志, 2016, 22(1): 5-8. DOI: 10.3760/cma.j.issn.1007-8118.2016.01.002. [19] CHEN L, WANG YB, ZHANG YH, et al. Effective prediction of postoperative complications for patients after open hepatectomy: A simplified scoring system based on perioperative parameters[J]. BMC Surg, 2019, 19(1): 128. DOI: 10.1186/s12893-019-0597-2. [20] ZOU H, WEN Y, YUAN K, et al. Combining albumin-bilirubin score with future liver remnant predicts post-hepatectomy liver failure in HBV-associated HCC patients[J]. Liver Int, 2018, 38(3): 494-502. DOI: 10.1111/liv.13514. [21] ANDREATOS N, AMINI N, GANI F, et al. Albumin-Bilirubin Score: Predicting short-term outcomes including bile leak and post-hepatectomy liver failure following hepatic resection[J]. J Gastrointest Surg, 2017, 21(2): 238-248. DOI: 10.1007/s11605-016-3246-4. [22] TIAN F, LIU Y, GAO J, et al. Study on the association between TGF-β1 and liver fibrosis in patients with hepatic cystic echinococcosis[J]. Exp Ther Med, 2020, 19(2): 1275-1280. DOI: 10.3892/etm.2019.8355. [23] ZHANG C, WANG L, ALI T, et al. Hydatid cyst fluid promotes peri-cystic fibrosis in cystic echinococcosis by suppressing miR-19 expression[J]. Parasit Vectors, 2016, 9(1): 278. DOI: 10.1186/s13071-016-1562-x. [24] WANG Y, LIU XM, WANG B, et al. Preoperative aspartate transaminase and platelet ratio index(APRI)as a predictor of postoperative complications after hepatic resection for primary hepatocellular carcinoma[J]. Chin J Hepatobiliary Surg, 2016, 22(5): 289-293. DOI: 10.3760/cma.j.issn.1007-8118.2016.05.001.王越, 刘学民, 王博, 等. 术前天冬氨酸转氨酶/血小板比值指数对肝细胞癌患者手术切除后并发症的预测价值[J]. 中华肝胆外科杂志, 2016, 22(5): 289-293. DOI: 10.3760/cma.j.issn.1007-8118.2016.05.001. 期刊类型引用(3)
1. 邱逸闻,庞华胜,沈舒,王焘,杨屹,王文涛. 肝泡型棘球蚴病的外科治疗策略. 中国普外基础与临床杂志. 2024(10): 1153-1159 .  百度学术
百度学术2. 何宏材,苏鹏宇,侯立朝,樊海宁. 红细胞分布宽度与血小板计数比值和血小板-白蛋白-胆红素评分预测肝脏多房棘球蚴病术后并发症的列线图构建. 中国普外基础与临床杂志. 2023(07): 795-801 .  百度学术
百度学术3. 智明,庞华胜,王文涛. 肝泡型包虫病解剖风险高低与根治性切除术后并发症的关系. 四川大学学报(医学版). 2022(05): 770-776 .  百度学术
百度学术其他类型引用(3)
-




 PDF下载 ( 2502 KB)
PDF下载 ( 2502 KB)

 下载:
下载:




 下载:
下载:

 百度学术
百度学术





