血清IgG4水平对IgG4相关胰-肝胆疾病与非IgG4相关胰-肝胆疾病的鉴别诊断价值
DOI: 10.3969/j.issn.1001-5256.2022.06.017
Value of serum IgG4 level in differential diagnosis of IgG4-related pancreatic and hepatobiliary diseases and non-IgG4-related pancreatic and hepatobiliary diseases
-
摘要:
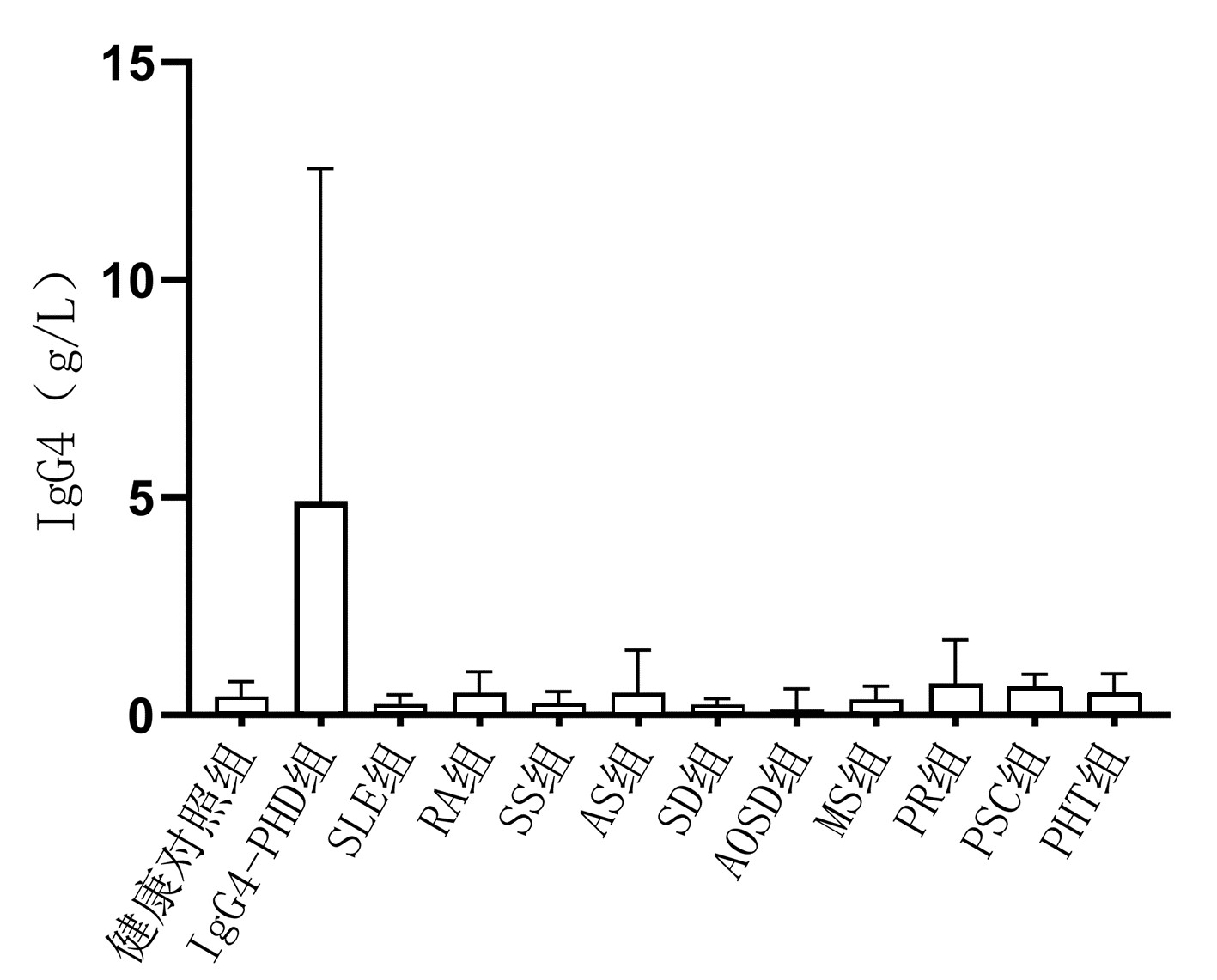
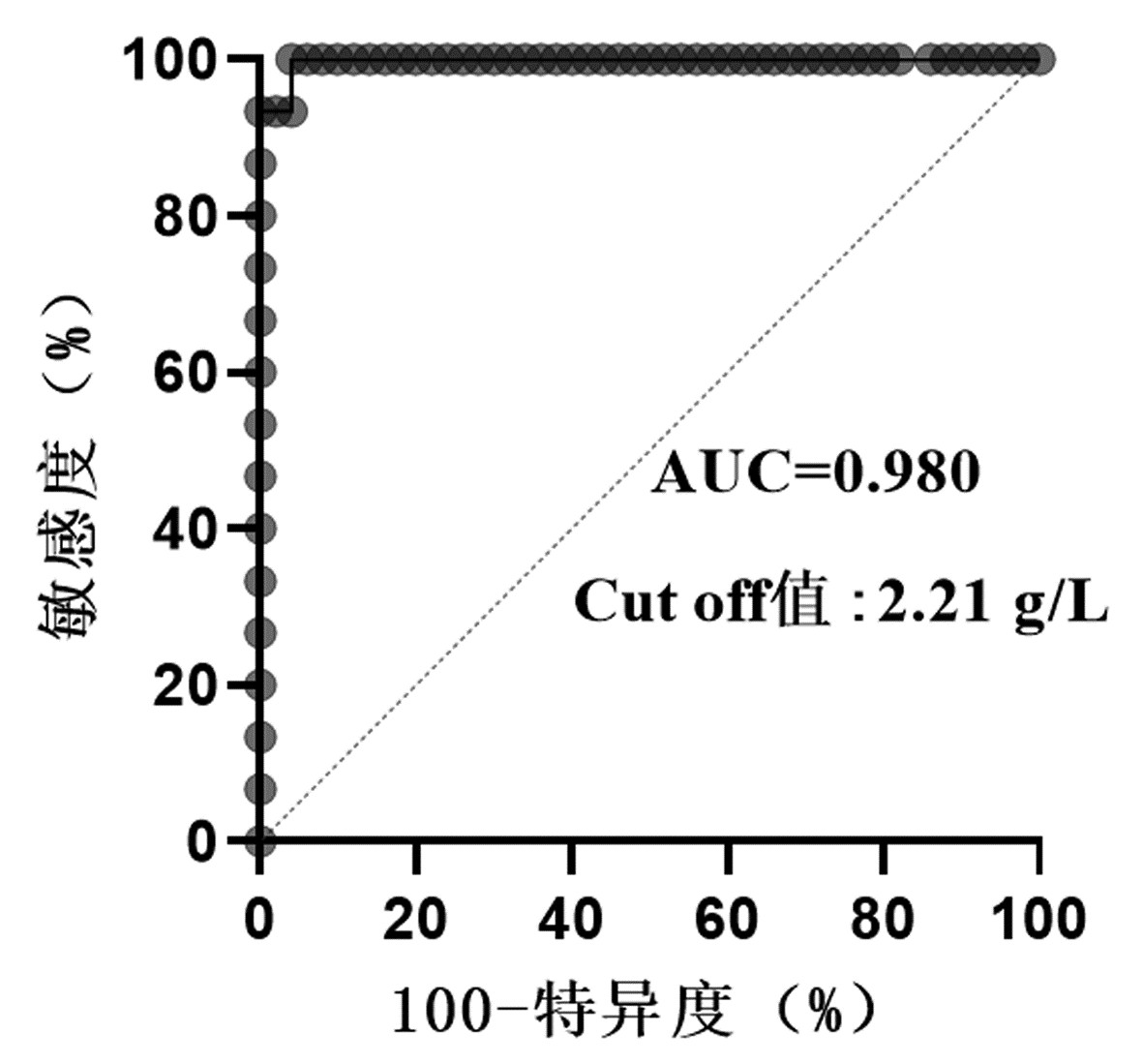
目的 探讨血清IgG4水平在鉴别诊断IgG4相关胰-肝胆疾病(IgG4-PHD)与非IgG4相关性疾病(IgG4-RD)的自身免疫性疾病中的应用价值。 方法 选择2014年8月— 2021年4月于南京医科大学附属淮安第一医院、苏北人民医院及徐州医科大学附属第一医院住院治疗的541例就诊患者和健康体检人群的临床资料,分为4组:IgG4-PHD组(n=20);非IgG4-RD自身免疫性疾病组(n=431),包括系统性红斑狼疮104例,类风湿性关节炎79例,干燥综合征174例,强直性脊柱炎16例,硬皮病11例,成人Still病4例,肌炎30例,银屑病3例,原发性硬化性胆管炎10例;胰腺肝脏胆囊恶性肿瘤组(n=40);健康对照组(n=50)。使用免疫散射比浊法测定各组样本血清IgG4水平。计量资料组间比较使用两样本Mann-Whitney U检验,计数资料组间比较采用Fisher精确检验。绘制受试者工作特征曲线(ROC曲线),确定IgG4诊断IgG4-PHD的最佳临界值。 结果 IgG4-PHD组血清IgG4水平均明显高于非IgG4-RD自身免疫性疾病各组、胰腺肝脏胆囊恶性肿瘤组和健康对照组(P值均<0.05),单独干燥综合征组血清IgG4水平显著低于健康对照组(Z=2.958,P<0.05)。分别以血清IgG4≥1.35 g/L和IgG4≥2.01 g/L作为临界值,IgG4-PHD组的阳性率明显高于非IgG4-RD自身免疫性疾病组和健康对照组,差异均具有统计学意义(P值均<0.05)。ROC曲线显示,以IgG4≥2.21 g/L作为鉴别诊断IgG4-PHD与非IgG4-RD自身免疫性疾病的临界值时,敏感度为100.00%,特异度为94.00%,AUC为0.980。 结论 非IgG4-RD自身免疫性疾病也可出现血清IgG4水平升高,而以2.21 g/L作为诊断临界值,能提升对IgG4-PHD与非IgG4-RD自身免疫性疾病的鉴别诊断效能,但仍需在临床中进一步验证。 Abstract:Objective To investigate the value of serum IgG4 level in the differential diagnosis of IgG4-related pancreatic and hepatobiliary disease (IgG4-PHD) and non-IgG4-related disease (non-IgG4-RD). Methods Clinical data were collected from 491 patients who were hospitalized and 50 individuals who underwent physical examination in Huaian No. 1 People's Hospital Affiliated to Nanjing Medical University, Subei People's Hospital, and The First Affiliated Hospital of Xuzhou Medical University from August 2014 to April 2021. The 491 patients were divided into IgG4-PHD group with 20 patients, non-IgG4-RD autoimmune disease group with 431 patients (104 patients with systemic lupus erythematosus, 79 with rheumatoid arthritis, 174 with Sjogren's syndrome, 16 with ankylosing spondylitis, 11 with scleroderma, 4 with adult-onset Still's disease, 30 with myositis, 3 with psoriasis, and 10 with primary sclerosing cholangitis), and malignant pancreatic/hepatobiliary tumor group with 40 patients, and the 50 individuals undergoing physical examination were enrolled as healthy control group. Scattering immunoturbidimetric assay was used to measure serum IgG4 concentration. The two-sample Mann-Whitney U test was used for comparison of normally distributed continuous data between groups, and the Fisher's exact test was used for comparison of categorical data between groups. The receiver operating characteristic (ROC) curve was plotted to determine the optimal cut-off value of serum IgG4 in the diagnosis of IgG4-PHD. Results The IgG4-PHD group had a significantly higher serum IgG4 level than the non-IgG4-RD autoimmune disease groups, the malignant pancreatic/hepatobiliary tumor group, and the healthy control group (all P < 0.05), and the Sjogren's syndrome group had a significantly lower serum IgG4 level than the healthy control group (Z=2.958, P < 0.05). With serum IgG4 ≥1.35 g/L and IgG4 ≥2.01 g/L as the cut-off values, the IgG4-PHD group had a significantly higher positive rate than the non-IgG4-RD autoimmune disease group and the healthy control group (all P < 0.05). The ROC curve analysis showed that IgG4 had an area under the ROC curve of 0.980 in the differential diagnosis of IgG4-PHD and non-IgG4-RD autoimmune diseases, with a sensitivity of 100.00% and a specificity of 94.00% at the optimal cut-off value of 2.21 g/L. Conclusion Serum IgG4 level may also increase in non-IgG4-RD autoimmune diseases, while the cut-off value of 2.21 g/L can improve the differential diagnosis of IgG4-PHD and non-IgG4-RD autoimmune diseases, which requires further verification in clinical practice. -
Key words:
- Immunoglobulin G /
- Autoimmune Diseases /
- Diagnosis
-
据世界卫生组织报道,2015年全球约有2.57亿慢性HBV感染者,每年约有88.7万人死于HBV感染相关疾病。我国HBsAg阳性率仍高约为6.1%,占全世界病例的1/3,每年因HBV导致的肝硬化和肝癌死亡30万~50万例,每年与乙型肝炎直接相关的医疗负担高达6000亿元[1]。因此,慢性乙型肝炎(CHB)仍是我国亟待解决的严重公共卫生问题。
CHB的治疗目标是延缓或减少肝硬化失代偿、肝衰竭和肝细胞癌的发生,从而改善患者生活质量和延长生存时间,HBsAg阴转与肝功能、组织病理以及长期预后改善相关[2-3]。目前临床常用的治疗CHB的药物主要有核苷(酸)类似物和IFN。核苷(酸)类似物主要通过竞争性抑制HBV DNA多聚酶的活性直接抑制HBV DNA的复制,其优势体现在强效、快速抑制病毒复制,改善肝组织炎症和坏死,但其不足之处在于HBsAg清除率低,HBeAg血清转换率也比较低,需要长期治疗且停药后容易复发,长期应用会发生耐药变异[4]。而IFNα是有限疗程的抗病毒药物,主要通过增强免疫细胞功能和促进细胞因子的表达、诱导IFN刺激基因的产生并经IFN信号通路编码多抗病毒蛋白等环节作用于HBV复制、转录等重要生物学过程,从而发挥免疫调节和抗病毒的双重作用[5-6]。此外,IFN还可通过增强HBV前基因组RNA (pgRNA) 和核心颗粒的降解,或通过对cccDNA的表观遗传修饰来抑制HBV转录并减少病毒蛋白如HBsAg的表达,停药之后可实现持久免疫控制病毒,不易复发[7]。既往研究[8]表明,CHB患者接受IFN治疗后,约8%的患者可产生HBsAg阴转或血清学转换(临床治愈),这是抗HBV治疗的最理想的疗效,核苷类似物治疗难以达到类似效果。
既往循证医学证据证明基于IFN有限疗程的治疗相较于核苷(酸)类似物可获得更好的持续病毒学、生化学、血清学应答,改善肝组织学,减慢向肝硬化、肝癌的进展[9-10],但由于宿主和病毒等因素的差异,IFN治疗的疗效不一。目前临床上已有相关的文献报道[11-13]提出使用聚乙二醇干扰素α (PEG-IFNα) 治疗CHB患者,基线的宿主和病毒因素如:女性、年轻、HBV基因型A或B亚型、低病毒载量及较高ALT水平等均预示着良好的应答。此外,治疗期间HBsAg、HBeAg和HBV DNA的水平有助于临床医生决定是否继续或停止PEG-IFNα治疗[14]。近期有研究[15]认为HBV新型标志物: 乙型肝炎核心相关抗原(HBcrAg)和HBV RNA也是预测PEG-IFNα治疗应答的有效预测因子。
目前有相关的研究认为IFN刺激基因(interferon-stimulated genes, ISG) 与HBV及PEG-IFNα治疗乙型肝炎相关。IFN能诱导的ISG数量极为庞大, 尽管多年来已经鉴定出许多ISG, 但只有部分ISG的抗病毒活性和相关机制得以阐明, 绝大多数ISG的相关生物学和抗病毒作用机制还有待于深入探索,ISG对疗效的预测了解仍较少。因此,本文主要综述ISG与乙型肝炎的关系、其相关的抗病毒作用及对IFN治疗CHB患者的预测作用。
1. ISG的诱导产生
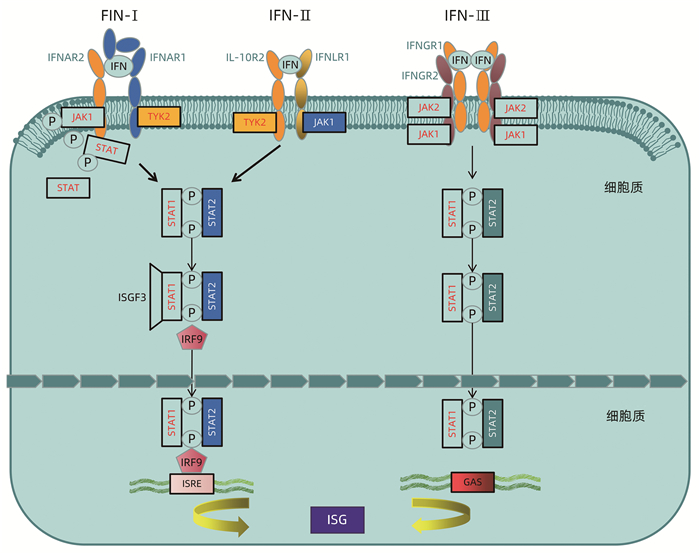
既往研究表明,IFN主要分为3类,分别为IFN-Ⅰ、IFN-Ⅱ和IFN-Ⅲ。其中,IFN-Ⅰ和IFN-Ⅲ与其受体IFNAR1、IFNAR2等结合后,其各自受体上的酪氨酸激2 (tyrosine kinase 2,TyK-2) 与Janus激酶-1(januskinase 1,JAK-1)相互靠近结合发生磷酸化而被激活,随后进一步活化信号转导及转录激活因子(signal transducer and activator of transcription STAT)1、STAT2,被磷酸化的STAT1和STAT2与IFN调节因子9 (IFN regulatory factor 9,IRF-9) 结合形成异源三聚体-IFN调节因子3 (IFN stimulated gene factor 3,ISGF3),ISGF3入细胞核与ISG调节元件(interferon stimulated gene regulatory element,ISRE) 结合,激活ISG转录。而IFN-Ⅱ受体IFNGR-1、IFNGR-2的胞内域分别与Jak1和Jak2激酶结合,激活Jak1、Jak2,并磷酸化STAT1、STAT2,随后活化形成同源二聚体GAF (IFNγ- activated factor),并入核与GAS (IFNγ-activated sequence)结合,诱导ISG的转录[16](图 1)。
 图 1 IFN级联信号通路激活ISG注:3种不同类型的IFN信号通过与细胞表面不同的受体结合激活胞内通路发挥作用。IFN-Ⅰ和IFN-Ⅲ分别与其受体IFNAR1、IFNAR2和IL-10R2、IFNLR1结合后,其各自受体上的TyK-2与JAK-1相互靠近结合发生磷酸化而被激活,随后进一步活化STAT1、STAT2,被磷酸化的STAT1和STAT2与IRF-9结合形成异源三聚体ISGF3,ISGF3入核与ISRE结合,激活ISG转录。IFN-Ⅱ受体IFNGR-1、IFNGR-2的胞内域分别与JAk1和JAk2激酶结合,激活JAk1、JAk2,并磷酸化STAT1、STAT2,随后活化形成同源二聚体GAF,并入核与GAS结合,诱导ISG转录。
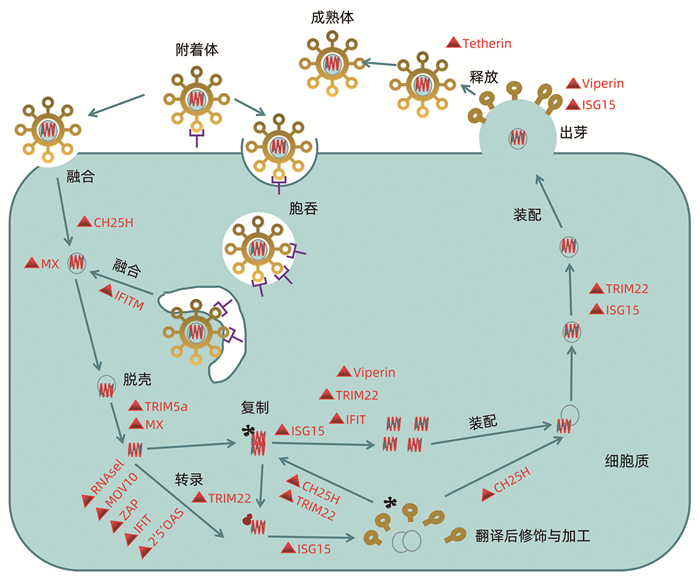
图 1 IFN级联信号通路激活ISG注:3种不同类型的IFN信号通过与细胞表面不同的受体结合激活胞内通路发挥作用。IFN-Ⅰ和IFN-Ⅲ分别与其受体IFNAR1、IFNAR2和IL-10R2、IFNLR1结合后,其各自受体上的TyK-2与JAK-1相互靠近结合发生磷酸化而被激活,随后进一步活化STAT1、STAT2,被磷酸化的STAT1和STAT2与IRF-9结合形成异源三聚体ISGF3,ISGF3入核与ISRE结合,激活ISG转录。IFN-Ⅱ受体IFNGR-1、IFNGR-2的胞内域分别与JAk1和JAk2激酶结合,激活JAk1、JAk2,并磷酸化STAT1、STAT2,随后活化形成同源二聚体GAF,并入核与GAS结合,诱导ISG转录。ISG作为由IFN诱导表达的基因,在宿主抵抗病毒感染的过程中发挥着至关重要的作用。越来越多的研究表明,ISG能够靶向病毒复制的不同阶段(包括病毒入侵、脱壳、基因组复制、病毒粒子装配以及释放等环节),进而抵抗病毒感染,但由于ISG成员众多,且各自的结构及其在细胞中的定位也各不相同,这决定了ISG在宿主体内以不同机制来发挥抗病毒作用(图 2)。
 图 2 ISG在病毒生命周期靶向作用目标注:ISG蛋白干扰病毒生命周期的不同阶段。胆固醇-25-羟化酶(CH25H)可能在宿主膜融合事件期间早期影响病毒入胞; 黏液瘤抗性蛋白1 (MX1)通过阻断传入病毒颗粒的内吞运输和核糖体核衣壳的脱壳而抑制多种病毒; 干扰素诱导跨膜蛋白(IFITM)成员抑制广谱病毒内吞融合事件; TRIM5α参与抑制人类免疫缺陷病毒1 (HIV-1) RNA的脱壳; 一些ISG通过降解病毒RNA和/或阻断病毒mRNA的翻译来抑制病毒,如人体2′-5′寡聚腺苷酸合成酶(2′-5′OAS)家族、蛋白激酶(PKR)、锌指抗病毒蛋白(ZAP)等; TRIM22抑制病毒的转录、复制或病毒蛋白质运输到质膜; ISG15抑制病毒翻译、复制或胞吐,如蝮蛇已被证明能抑制病毒复制或病毒在质膜上出芽。Tetherin将成熟的病毒颗粒诱捕到质膜上,从而抑制病毒的释放,并广泛作用于许多包膜病毒。
图 2 ISG在病毒生命周期靶向作用目标注:ISG蛋白干扰病毒生命周期的不同阶段。胆固醇-25-羟化酶(CH25H)可能在宿主膜融合事件期间早期影响病毒入胞; 黏液瘤抗性蛋白1 (MX1)通过阻断传入病毒颗粒的内吞运输和核糖体核衣壳的脱壳而抑制多种病毒; 干扰素诱导跨膜蛋白(IFITM)成员抑制广谱病毒内吞融合事件; TRIM5α参与抑制人类免疫缺陷病毒1 (HIV-1) RNA的脱壳; 一些ISG通过降解病毒RNA和/或阻断病毒mRNA的翻译来抑制病毒,如人体2′-5′寡聚腺苷酸合成酶(2′-5′OAS)家族、蛋白激酶(PKR)、锌指抗病毒蛋白(ZAP)等; TRIM22抑制病毒的转录、复制或病毒蛋白质运输到质膜; ISG15抑制病毒翻译、复制或胞吐,如蝮蛇已被证明能抑制病毒复制或病毒在质膜上出芽。Tetherin将成熟的病毒颗粒诱捕到质膜上,从而抑制病毒的释放,并广泛作用于许多包膜病毒。2. ISG的抗病毒作用
2.1 抑制病毒入胞
抗黏液病毒蛋白1 (MX1) 是最早发现的抑制病毒入胞的效应分子,主要在早期阻止病毒的复制[16]。CH25H可以将胆固醇转化为羟基胆甾醇(25HC), 25HC可通过阻断病毒和其他寄生体细胞间的膜融合反应进而影响病毒入胞, 也可在病毒感染的早期发挥抗病毒作用,并能同时被Ⅰ型和Ⅱ型IFN上调表达[17]。干扰素诱导跨膜蛋白(interferonrinduced transmembrane proteins, IFITM)[18]是一类小分子同源蛋白家族, 对多种病毒产生抵抗,病毒感染机体后,IFN分泌增加并激活Jak-STAT信号通路诱导其表达上调,随后IFITM蛋白家族通过抑制病毒与寄生虫细胞膜的相互融合,抑制病毒内吞噬进入细胞, 进而可以抑制病毒的复制反应过程, 不同的IFITM家族蛋白对不同的病毒表现出不同的抑制能力,如IFITM1比IFITM3更显著地抑制冠状病毒与线状病毒的复制等[19]。
2.2 抑制病毒复制、转录、翻译、翻译后修饰
(1) 蛋白激酶(protein kinase R,PKR)由IFN-Ⅰ和IFN-Ⅱ诱导表达,是一种双链RNA依赖性蛋白激酶,被病毒dsRNA等激活后发生自我磷酸化,随后PKR磷酸化细胞翻译起始因子2a(eukaryotic initiation factor 2a, EIF2a),不仅能抑制病毒翻译,还能调控细胞自身以及病毒所诱导的自噬发挥抗病毒作用。PKR还可通过磷酸化激活NF-κB, 上调IFN发挥抗病毒作用[20]。(2)锌指抗病毒蛋白(ZAP):ZAP是哺乳动物体内的一种抗病毒蛋白,该蛋白能够有效地抑制多种RNA病毒(如反转录病毒、甲病毒以及线状病毒等)的复制[21]。(3)IFIT家族蛋白:主要包括4个家族成员IFIT1、IFIT2、IFIT3及IFIT5,能够调节转录起始、细胞增殖与细胞迁移等多种生命活动。其中IFIT1与IFIT2能够通过与真核起始因子3 (eukaryotic initiation factor 3,eIF3) 相互作用抑制翻译复合物的形成,从而抑制翻译的起始[22]。IFIT家族蛋白不仅能够通过影响翻译复合体的形成来影响RNA翻译,还可能直接与RNA相结合从而发挥抗病毒作用[23]。此外,除了抑制病毒的转录翻译,ISG还可通过其介导的蛋白翻译后修饰发挥抗病毒功能。如ISG15在被IFN诱导的E1、E2、E3泛素连接酶活化后,可以共价结合病毒和宿主蛋白进行类泛素化修饰,影响病毒的复制与感染[24]。
2.3 抑制病毒出胞
骨髓基质细胞抗原2 (Tetherin) 是IFN-Ⅰ诱导产生的能够与病毒囊膜相结合的跨膜蛋白, 其具有特殊的拓扑结构,使病毒锚定在细胞膜上, 在病毒出芽过程中通过细胞质膜上的两个跨膜区捕获病毒粒子来抑制病毒的有效释放, 也对众多包膜病毒具有抑制作用[25]。蜂蛇毒素(Viperin蛋白)是一种抗病毒蛋白,是极少数自由基sam依赖酶之一,可被Jak-STAT通路诱导和IRF3直接激活表达,对多种包膜病毒具有抑制作用,能够有效抑制病毒释放的抗病毒蛋白[26]。另外,最近的一项研究[27]表明,Viperin还可以直接与IFN基因刺激因子(STING)发挥相互作用和增强TBK1的激活,从而增强Ⅰ型IFN反应,进一步抑制HBV的复制。
3. ISG介导的免疫调控
ISG不仅具有广谱的抗病毒作用,还可调控IFN诱导的免疫应答,包括正向增强机体细胞的病原体识别检测能力和负向调控IFN信号通路。
3.1 正向调控IFN免疫应答
随着对病原体相关分子模式(pathogen-associated molecular patterns, PAMP)和模式识别受体(pattern recognition receptors, PRRS)的认识,发现病毒侵入细胞后,通过Toll样受体(TLR)和RIG-1样受体(IRG like receptor, RLR)对病毒核酸等病原体的特征分子进行识别,进而激活一系列的下游信号转导分子,最终诱导细胞转录因子的激活或IFN等效应蛋白的产生。机体的其他信号传导蛋白如PKR、维甲酸诱导基因1等可被IFN刺激高表达,增强机体对病原识别和检测能力,同时ISG可以增强IFN的免疫应答信号[16]。常见的具有正调控功能的ISG包括OAS,PKR,IRF3、7、9及STAT1/2等。
3.2 负向调控IFN免疫应答
部分ISG可通过抑制IFN介导的下游信号通路负向调控IFN免疫应答。泛素特异性蛋白酶18 (USP18/UBP43)是泛素化特异性蛋白酶家族成员之一,是ISGl5的特异性水解酶,USP18通过竞争性与IFNAR2亚基结合,进而抑制JAK1与IFNAR2结合,进一步抑制IFN-Ⅰ诱导的Jak-STAT信号通路发挥抵抗IFN的抗病毒治疗[28]。细胞因子信号抑制物(suppressor of cytokine signaling,SOCS)可被IFN正向调节表达,但SOCS的过表达又可以抑制IFN通路的Jak的磷酸化及STAT的活化[29]。
4. 与HBV感染相关的ISG及其对IFN治疗CHB的预测作用
IFN基因刺激蛋白是调节肝脏内环境的一种重要先天胞质环状二核苷酸传感器, 可通过特异性T淋巴细胞应答和自噬等激活IFN调节因子(IRF) 3/IRE7,发挥抑制CHB、肝纤维化和肝细胞癌的作用。IFN治疗CHB的疗效在不同个体之间差异很大,目前已有相关研究表明ISG可能与HBV感染后的转归及抗病毒疗效有关,可作为IFN刺激后产生的效应因子直接发挥抗病毒作用。接下来对目前已经报道的与HBV感染相关的ISG及其对IFN治疗CHB的预测作用的相关文献进行综述。
4.1 SAMD家族
Wang等[30]近期进行的一项研究, 将强力霉素(DOX)控制的表达NTCP的质粒稳转到HepG2肝癌细胞系中,挑选出其中一个对HBV病毒株(血清学分型ayw,基因型D)感染高度敏感的克隆HepG2-2B1细胞系,然后向HepG2-2B1细胞转染了285个应答IFN刺激的ISG,加入HBV感染细胞15 d后收集细胞,检测上清中HBeAg水平以反映HBV的感染水平。研究发现,大部分ISG对HBV复制的影响不大,只有SAMD4A、IDO1、PML、ZAP、ISG20、MYD88、DDX3和ZBP1抑制了HBeAg表达,可能是发挥抗HBV功能的ISG,其中SAMD4A对HBV的抑制作用最强。作者又检测了HBV感染后不同时间点的HBeAg与HBsAg水平,证实SAMD4A的确抑制了HepG2-2B1细胞中病毒蛋白的产生,但对NTCP的表达没有影响。在HepG2-2B1细胞中过表达SAMD4A同样抑制了HBV复制。根据上述结果,作者筛选出了一个具有强效抗HBV能力的ISG-SAMD4A。但目前SAMD家族其他相关基因与HBV感染及IFN治疗CHB的相关性的相关研究仍甚少,需要进一步深入挖掘。
4.2 TRIM家族
TRIM蛋白家族,即三结构域(the tripartite motif,TRIM)蛋白家族,既往对人类及小鼠TRIM家族表达模式分析的研究发现,该家族中部分基因如TRIM5、TRIM19、TRIM22和TRIM25等受IFN诱导表达上调。当病毒入侵后,被激活的IFN应答通路将诱导及上调TRIM蛋白的表达。其中TRIM-α入胞后可直接结合在病毒衣壳蛋白,抑制病毒RNA脱壳。TRIM的表达是对IFN刺激的反应,是控制病毒感染所必需的。
研究表明TRIM家族中的一些基因可抑制HBV的复制,如TRIM14招募泛素特异性蛋白酶14切割赖氨酸(Lys)48连接的泛素链,可促进Ⅰ型IFN信号的激活,抑制p62介导的cGAS自噬降解,并在Lys-365处经历Lys-63连接的多泛素化,并向MAVS信号体募集NEMO,激活IRF3和NF-κB通路,从而增强先天免疫应答。Tan等[31]的研究发现TRIM14通过阻断DDB1-HBx-Smc复合物的形成抑制HBV复制。TRIM22被证明能抑制HBV核心启动子的活性,并与体外IFN治疗的良好反应相关[32]。由Ⅰ型IFN以IL-27依赖的方式诱导的TRIM25,则被证明通过促进IFN的产生抑制HBV复制[33]。近期,Tan等[34]进行的一项研究,以高通量双分子荧光互补筛选确定HBx蛋白与145个ISG之间潜在的相互作用,发现7个与HBx相互作用的ISG对HBV复制具有显著的抑制作用,其中TRIM5γ通过促进k48连接的泛素化和HBx蛋白在k95泛素位点上的降解来抑制HBV复制。在过表达条件下,TRIM5γ的B-Box域足以触发HBx降解,并负责与HBx相互作用和招募TRIM31,TRIM31是一种触发HBx泛素化的泛素连接酶。TRIM5γ在IFNa治疗的HBV患者中高表达,可能表明有更好的治疗效果。该研究确定了TRIM5γ和TRIM31在促进HBx降解方面的关键作用。但朱海珍等[35]研究则表明,TRIM28通过抑制JAK-STAT信号通路中ISG的产生促进HBV的复制,在乙型肝炎患者肝组织中TRIM28的高表达可能与HBV的慢性感染有关。综上所述,TRIM家族可能是HBV疗法的潜在目标,但并非所有ISG均有抑制病毒复制。
4.3 腺苷脱氨酶(ADAR)
作用于RNA的腺苷脱氨酶(ADAR)家族通过将腺苷转化为肌苷的作用,可调节多种病毒的复制。ADAR家族有3个成员: ADAR1、ADAR2和ADAR3,其中,作用于RNA-1的ADAR1已知参与了多种病毒的复制。最近的研究发现,在HBV培养模型中,ADAR1的过表达降低了HBV RNA。通过IFNα刺激诱导ADAR1也能降低HBV RNA水平,而敲除内源性ADAR1表达会增加HBV RNA水平。miRNA-122,一种主要的肝细胞特异性microRNA,被发现与ADAR1的表达呈正相关,外源性miRNA-122降低了HBV RNA和DNA,相反,转染miRNA-122抑制剂则使HBV RNA及DNA升高,该研究首次证实ADAR1通过增加肝细胞内miRNA-122的水平,对HBV感染起抗病毒作用[36]。但Yuan等[37]研究表明,ADAR1可通过其脱氨酶结构域促进HBV复制。Li等[38]研究表明,IFNα刺激ADAR1通过RNA编辑下调线粒体抗病毒信号蛋白(mitochondrial antiviral signaling protein, MAVS)的抗病毒作用在HepG2.2.15细胞和2个小鼠模型中得到证实,也证实了CHB患者的MAVS基因多态性与IFNα治疗应答的相关性。ADAR1通过人抗原R (HuR)介导的转录后调控抑制MAVS的表达,在体内外均表现出抗病毒活性,降低HBV标志物水平。以上研究均表明,ADAR1与HBV的感染相关。
4.4 泛素特异性蛋白酶18 (USP18)
USP18是泛素特异性蛋白酶家族成员之一,与IFNAR2亚基结合,抑制JAK1与IFNAR2结合,进而抑制IFN-Ⅰ诱导的Jak-STAT信号通路。Liu等[39]进行了一项研究,该研究共纳入44例接受IFN治疗的HBeAg阳性的CHB患者,结果显示,无论是病毒学应答(VR)还是血清学应答(SR),无应答者的USP18IFN-N基线显著高于应答者。多变量分析显示,基线USP18IFN-N是VR(OR=0.292,P=0.022)或SR(OR=0.173,P=0.031)新的独立预测因子。基线USP18IFN-N水平与病毒学和血清学反应相关,并有可能成为HBeAg阳性的CHB患者使用IFN治疗的疗效预测因子。
4.5 人体2′-5′寡聚腺苷酸合成酶(2′-5′OAS)家族
OAS家族有4个成员OAS1、OAS2、OAS3、OAS-L。既往研究表明,OAS家族的基因多态性与IFN治疗CHB的疗效相关。Domagalski等[40]近期进行了一项研究,共纳入52例接受IFNα治疗48周的HBeAg阴性CHB儿童,对OAS1 (rs1131476)、OAS2 (rs1293747)、OAS3 (rs2072136)、OASL (rs10849829) 中的单核苷酸多态性进行了研究,比较了这些患者在治疗后24周随访中获得部分缓解(PR:HBV DNA<2000 IU/ml或ALT<40 U/L)和完全缓解(CR:HBV DNA<2000 IU/ml和ALT<40 U/L) 的情况,结果显示:OAS-L rs10849829的AA基因型在非CR组中更为常见(P=0.044,OR=0.26,95%CI: 0.07~0.88)。单倍型分析揭示了PR和CR与OAS单倍型之间的显著关联。OAS家族基因多态性也可能是一个新的关于IFN治疗CHB的重要影响因素。
4.6 细胞识别的鳞状细胞癌抗原(SART1)
SART1是一种具有特异性E3泛素化连接酶活性的U4/U6.U5 tri-snRNP特异性因子,可调节细胞增殖,有可能作为肿瘤治疗的靶点[41]。最近的研究[42]发现,SART1通过增强HCV细胞的ISG表达而发挥抗病毒活性,但其在HBV中的作用尚不明确。Li[43]等进行的一项研究共纳入33例初治的HBeAg阳性的CHB患者,给予每周注射PEG-IFNα 180 mg治疗,共48周。所有接受IFNα治疗的患者在基线和治疗12周采集血液样本与PBMC,在IFN治疗前24 h采集肝活检样本。该研究发现,IFN治疗前应答组患者肝脏和PBMC中的SART1基础表达量明显高于无应答者。此外,基线SART1表达水平与IFN治疗后HBV DNA水平和HBeAg水平下降呈正相关。在HepG2细胞中,沉默SART1抑制了IFNα的抗病毒活性,降低ISG(Mx、OAS、和PKR)的表达,并减弱了JAK-STAT信号,提示SART1通过JAK-STAT信号和ISG的表达调节IFN介导的抗病毒活性。因此,SART1可能为IFN治疗CHB提供新的突破点。
4.7 干扰素刺激基因20(ISG20)
ISG20是一种20 kDa的蛋白质,具有3′-5′外切酶活性,能切割单链RNA和DNA,可抑制多种病毒的复制,包括HBV、HCV、HIV和登革热病毒等。Liu等[44]研究表明,ISG20的表达处于基础水平的肝细胞使用IFN处理后,可使ISG20的表达显著上调。而下调ISG20则HBV复制增加,IFN介导的抗病毒作用减弱,并表明ISG20通过直接结合病毒RNA的epsilon茎环结构抑制HBV复制。Imam等[45]表示,ISG20通过选择性降解N6-甲基腺苷修饰的HBV转录物抑制HBV的复制,这种效应受到m6A阅读蛋白YTHDF2的严格调节。同时,Park等[46]在HepG2和HepG2-NTCP细胞中检测ISG20的异位表达来分析HBV的生命周期,发现ISG20显著抑制HBV复制,并降低了HBV基因的表达和转录,这种作用主要通过降低病毒增强子活性来抑制HBV复制,特别是结合增强子Ⅱ和核心启动子(Enh Ⅱ/Cp)区域抑制HBV增强子活性。因此,ISG20与IFN治疗CHB的抑制作用相关,也可以作为一个治疗切入点并可能预测疗效。
5. 总结和展望
目前有较多IFN治疗CHB的预测指标,包括病毒和宿主相关因素,但预测效能不一。以上相关文献研究表明,IFN可以通过诱导ISG产物、调节机体的免疫反应及直接作用于感染病毒的增强子/启动子序列等方式来实现其强大的抗病毒性能。同时,ISG在IFN治疗乙型肝炎时发挥一定的抗病毒作用,ISG表达水平及活性可能用于IFN抗病毒治疗效果的预测,特别是USP18、TRIM家族等研究较多。但IFN能诱导的ISG数量极为庞大,目前只有很少数的ISG已经明确了与乙型肝炎的抗病毒活性相关,绝大多数ISG的相关的生物学和抗病毒作用机制仍有待于深入探索。此外,目前仍未有统一的预测IFN治疗CHB疗效的预测模型,且ISG被证明与IFN治疗乙型肝炎疗效相关的研究尚少且基本为基础研究,需进一步开展相关临床研究验证,以建立更优效的预测系统,识别更多的IFN优势人群达到更好的疗效,为临床工作提供更深入的指导。
-
表 1 各组研究对象资料
Table 1. Basic information of subjects in each group
组别 例数 男/女(例) 年龄(岁) IgG4-PHD组 20 18/2 65(61~69) 非IgG4-RD自身免疫性疾病组 SLE 104 10/94 40±14 RA 79 20/59 56±12 SS 174 20/154 54±13 AS 16 7/9 41±15 SD 11 2/9 47±10 AOSD 4 3/1 42±4 MS 30 17/13 56(43~67) PR 3 2/1 51±13 PSC 10 4/6 59±15 PHT组 40 27/13 56±16 健康对照组 50 24/26 47±15 注:SLE,系统性红斑狼疮;RA,类风湿性关节炎;SS,干燥综合征;AS,强直性脊柱炎;SD,硬皮病;AOSD,成人Still病;MS,肌炎;PR,银屑病;PSC,原发性硬化性胆管炎。 表 2 不同IgG4诊断标准下各组血清IgG4阳性率比较
Table 2. Comparison of the positive rate of serum IgG4 in each group under different diagnostic criteria of IgG4
组别 例数 阳性[例(%)] IgG4≥1.35 g/L IgG4≥2.01 g/L IgG4-PHD组 20 20(100.00) 20(100.00) 非IgG4-RD自身免疫性疾病组 431 48(11.14)1) 27(6.26)1) PHT组 40 6(15.00)1) 01) 健康对照组 50 4(8.00)1) 2(4.00)1) P值 <0.001 <0.001 注:与IgG4-PHD组比较,1)P<0.001。 -
[1] LANZILLOTTA M, MANCUSO G, DELLA-TORRE E. Advances in the diagnosis and management of IgG4 related disease[J]. BMJ, 2020, 369: m1067. DOI: 10.1136/bmj.m1067. [2] YANG C, LI J, ZHANG YY, et al. Imaging findings of IgG4-related sclerosing mass pancreatitis and analysis of misdiagnosis[J]. Clin Misdiagn Misther, 2021, 305(1): 13-16. DOI: 10.3969/j.issn.1002-3429.2021.01.004.杨超, 李进, 张优仪, 等. IgG4相关硬化性肿块型胰腺炎影像学表现及误诊分析[J]. 临床误诊误治, 2021, 305(1): 13-16. DOI: 10.3969/j.issn.1002-3429.2021.01.004. [3] DELLA-TORRE E, LANZILLOTTA M, DOGLIONI C. Immunology of IgG4-related disease[J]. Clin Exp Immunol, 2015, 181(2): 191-206. DOI: 10.1111/cei.12641. [4] WALLACE ZS, ZHANG Y, PERUGINO CA, et al. Clinical phenotypes of IgG4-related disease: an analysis of two international cross- sectional cohorts[J]. Ann Rheum Dis, 2019, 78(3): 406-412. DOI: 10.1136/annrheumdis-2018-214603. [5] LANZILLOTTA M, CAMPOCHIARO C, MANCUSO G, et al. Clinical phenotypes of IgG4-related disease reflect different prognostic outcomes[J]. Rheumatology (Oxford), 2020, 59(9): 2435-2442. DOI: 10.1093/rheumatology/keaa221. [6] MILOSLAVSKY EM, NADEN RP, BIJLSMA JW, et al. Development of a Glucocorticoid Toxicity Index (GTI) using multicriteria decision analysis[J]. Ann Rheum Dis, 2017, 76(3): 543-546. DOI: 10.1136/annrheumdis-2016-210002. [7] GHAZALE A, CHARI ST, ZHANG L, et al. Immunoglobulin G4-associated cholangitis: clinical profile and response to therapy[J]. Gastroenterology, 2008, 134(3): 706-715. DOI: 10.1053/j.gastro.2007.12.009. [8] OTSUKI M, CHUNG JB, OKAZAKI K, et al. Asian diagnostic criteria for autoimmune pancreatitis: consensus of the Japan-Korea Symposium on Autoimmune Pancreatitis[J]. J Gastroenterol, 2008, 43(6): 403-408. DOI: 10.1007/s00535-008-2205-6. [9] WALLACE ZS, NADEN RP, CHARI S, et al. The 2019 American College of Rheumatology/European League Against Rheumatism classification criteria for IgG4-related disease[J]. Ann Rheum Dis, 2020, 79(1): 77-87. DOI: 10.1136/annrheumdis-2019-216561. [10] ZHANG DH, ZHAO J. Pathogenesis of immunoglobulin G4-related hepatobiliary and pancreatic diseases[J]. J Clin Hepatol, 2019, 35(6): 1401-1405. DOI: 10.3969/j.issn.1001-5256.2019.06.050.张德华, 赵婕. IgG4相关性肝胆胰疾病的发病机制[J]. 临床肝胆病杂志, 2019, 35(6): 1401-1405. DOI: 10.3969/j.issn.1001-5256.2019.06.050. [11] OKAZAKI K, UCHIDA K, IKEURA T, et al. Current concept and diagnosis of IgG4-related disease in the hepato-bilio-pancreatic system[J]. J Gastroenterol, 2013, 48(3): 303-314. DOI: 10.1007/s00535-012-0744-3. [12] TANAKA A. IgG4-related sclerosing cholangitis and primary sclerosing cholangitis[J]. Gut Liver, 2019, 13(3): 300-307. DOI: 10.5009/gnl18085. [13] XU WL, LING YC, WANG ZK, et al. Diagnostic performance of serum IgG4 level for IgG4-related disease: A meta-analysis[J]. Sci Rep, 2016, 6(2): 32035. DOI: 10.1038/srep32035. [14] KHOSROSHAHI A, WALLACE ZS, CROWE JL, et al. International consensus guidance statement on the management and treatment of IgG4-related disease[J]. Arthritis Rheumatol, 2015, 67(7): 1688-1699. DOI: 10.1002/art.39132. [15] BERNASCONI L, MUNDWILER E, REGENASS S, et al. Variable and inaccurate serum IgG4 levels resulting from lack of standardization in IgG subclass assay calibration[J]. Clin Chem Lab Med, 2019, 57(11): 1777-1783. DOI: 10.1515/cclm-2019-0261. [16] TANG J, CAI S, YE C, et al. Biomarkers in IgG4-related disease: A systematic review[J]. Semin Arthritis Rheum, 2020, 50(2): 354-359. DOI: 10.1016/j.semarthrit.2019.06.018. [17] VALENZUELA NM, SCHAUB S. The biology of IgG subclasses and their clinical relevance to transplantation[J]. Transplantation, 2018, 102(1S Suppl 1): S7-S13. DOI: 10.1097/TP.0000000000001816. [18] USAMI Y, SUGANO M, UEHARA T, et al. Cut-off values of serum IgG4 among three reagents, including a novel IgG4 reagent: A multicenter study[J]. Sci Rep, 2021, 11(1): 7280. DOI: 10.1038/s41598-021-86024-5. [19] ZEGERS I, KELLER T, SCHREIBER W, et al. Characterization of the new serum protein reference material ERM-DA470k/IFCC: Value assignment by immunoassay[J]. Clin Chem, 2010, 56(12): 1880-1888. DOI: 10.1373/clinchem.2010.148809. 期刊类型引用(1)
1. 刘雅光,胡连智,董一侠. 达卡他韦和索非布韦治疗初治慢性丙型肝炎患者单核细胞亚群和表型的变化. 肝脏. 2024(04): 440-443 .  百度学术
百度学术其他类型引用(7)
-




 PDF下载 ( 1986 KB)
PDF下载 ( 1986 KB)

 下载:
下载:
 下载:
下载:
 百度学术
百度学术