能量代谢指标与失代偿期乙型肝炎肝硬化患者短期内自发性细菌性腹膜炎发生风险的相关性
DOI: 10.3969/j.issn.1001-5256.2022.06.018
Association of energy metabolic markers with the short-term risk of spontaneous bacterial peritonitis in patients with decompensated hepatitis B virus-related liver cirrhosis
-
摘要:
目的 探讨失代偿期乙型肝炎肝硬化(HBV-LC)患者的间接能量代谢指标与自发性细菌性腹膜炎(SBP)发生风险的相关性。 方法 回顾性分析2017年11月—2019年11月福建医科大学孟超肝胆医院收治住院的失代偿期HBV-LC患者的临床资料,比较住院后2周内发生SBP和无SBP患者的基线临床参数和能量代谢指标的差异,采用logistic多因素回归分析患者发生SBP的相关风险因素。符合正态分布的计量资料两组间比较采用t检验;非正态分布的计量资料两组间比较采用Kruskal-Wallis H秩和检验。计数资料两组间比较采用χ2检验或Fisher精确检验。绘制受试者工作特征曲线(ROC曲线)分析新建立logistic回归模型的诊断效应,以最大Youden指数对应的点为模型的截断值,采用DeLong检验比较ROC曲线下面积(AUC)。 结果 纳入失代偿期HBV-LC患者50例,住院后2周内发生SBP患者23例(46%),无SBP患者27例(54%)。SBP患者的甘油三酯、前白蛋白以及凝血酶原活动度(PTA)均显著低于无SBP患者(P值均<0.05);而SBP患者的国际标准化比值、C反应蛋白(CRP)和终末期肝病模型评分则显著高于无SBP患者(P值均<0.05)。比较两组患者的基线能量代谢指标:SBP患者的呼吸熵(RQ)和碳水化合物氧化率(CHO)均较无SBP患者低[RQ: 0.79(0.76~0.86) vs 0.85(0.79~0.91), P=0.041; CHO: 20.50%(15.25%~41.05%) vs 41.6%(22.25%~68.05%), P=0.041]。logistic多因素回归分析提示PTA为失代偿期HBV-LC患者住院期间发生SBP的独立危险因素(比值比=0.004,P=0.008),并以PTA、CRP、RQ和CHO等变量构建回归模型,模型AUC为85.0%,当曲线的Youden指数为最大值时,模型截断值为0.60,特异度为85.19%,敏感度为73.91%,模型的区分度优于CRP(AUC=74.5%, P=0.049)和PCT(AUC=56.4%, P<0.01)。 结论 失代偿期HBV-LC患者短期内发生SBP的患者能量代谢指标RQ和CHO明显降低,结合PTA、CRP和CHO/RQ比值等指标,有助于临床医师早期判断SBP的高风险患者,并加强对高风险患者的营养支持。 Abstract:Objective To investigate the association of energy metabolic markers with the risk of spontaneous bacterial peritonitis (SBP) in patients with decompensated hepatitis B virus-related liver cirrhosis (HBV-LC). Methods A retrospective analysis was performed for the clinical data of the patients with decompensated HBV-LC who were admitted to Mengchao Hepatobiliary Hospital of Fujian Medical University from November 2017 to November 2019, and baseline clinical parameters and energy metabolic markers were compared between the patients with SBP and those without SBP within 2 weeks after admission. A multivariate logistic regression analysis was performed to investigate the risk factors for SBP. The t-test was used for comparison of normally distributed continuous data between two groups, and the Kruskal-Wallis H test was used for comparison of non-normally distributed continuous data between two groups; the Fisher's exact test was used for comparison of categorical data between two groups. The receiver operating characteristic (ROC) curve was plotted to evaluate the diagnostic efficiency of the newly established logistic regression model, and with the corresponding point of Youden index as the cut-off value, the DeLong test was used to compare the area under the ROC curve (AUC). Results A total of 50 patients with decompensated HBV-LC were included, among whom 23 (46%) developed SBP within 2 weeks after admission and 27 (54%) had no SBP during hospitalization. Compared with the non-SBP patients, the SBP patients had significantly lower triglyceride, prealbumin, and prothrombin time activity (PTA) and significantly higher international normalization ratio, C-reactive protein (CRP), and Model for End-Stage Liver Disease score (all P < 0.05). Comparison of baseline energy metabolic markers showed that compared with the non-SBP patients, the SBP patients had significantly lower respiratory quotient (RQ) [0.79(0.76-0.86) vs 0.85(0.79-0.91), P=0.041] and carbohydrate oxidation (CHO) rate [20.50%(15.25%-41.05%) vs 41.6%(22.25%-68.05%), P=0.041]. The multivariate logistic regression analysis showed that PTA was an independent risk factor for SBP in the patients with decompensated HBV-LC during hospitalization (odd ratio=0.004, P=0.008), and the regression model established based on the variables including PTA, CRP, RQ, and CHO had an AUC of 85.0% and a cut-off value of 0.60 at the maximum Youden index, with a specificity of 85.19% and a sensitivity of 73.91%, suggesting that this model had a better discriminatory ability than CRP (AUC=74.5%, P=0.049) and procalcitonin (AUC=56.4%, P < 0.01). Conclusion There are significant reductions in the energy metabolic markers RQ and CHO in the patients with decompensated HBV-LC who develop SBP within a short term, and their combination with PTA, CRP, and CHO/RQ ratio can help clinicians identify the patients at a high risk of SBP in the early stage and enhance nutrition support for such patients. -
Key words:
- Hepatitis B virus /
- Liver Cirrhosis /
- Peritonitis /
- Energy Metabolism
-
自发性细菌性腹膜炎(SBP)是在肝硬化基础上发生的无明确腹腔内病变来源的腹腔感染[1]。在门诊肝硬化患者中,SBP的发生率为1.5%~3.5%,而在住院肝硬化患者中的发生率为10%~30%,是失代偿期肝硬化患者最常见的严重并发症之一。肝硬化患者并发SBP,可迅速进展为肝肾功能衰竭,致使病情进一步恶化,为肝硬化患者死亡的主要原因[1]。既往的临床研究[1-3]表明,肝硬化合并SBP患者发生急性肾损伤的概率为54%,而发生慢加亚急性肝衰竭的概率为35%~36%,未经治疗的SBP患者或院内感染SBP患者病死率高达60%。然而,约有1/3的肝硬化合并SBP患者未表现典型的临床症状[4],经常导致诊治的延误。因此,对肝硬化合并SBP的及时诊断和防治,是临床工作中的关键,关于并发SBP相关危险因素的研究,一直备受关注[3]。
肝硬化患者普遍存在营养不良,其中包括营养缺乏(肌减少、脂减少)和营养过剩(肥胖)[5]。严重的营养不良可能影响肝硬化患者的免疫调节和肠道菌群功能,是肝硬化患者并发SBP的发病机制之一[6]。肝硬化患者发生营养不良与细菌感染关系密切。一项前瞻性研究[7]表明,肝硬化合并肌减少患者的感染相关病死率,显著高于无合并肌减少患者(22%vs 8%, P=0.02)。此外,肝硬化合并皮下脂肪与内脏脂肪减少与肝静脉压力梯度呈负相关[8],而静脉压力升高是肝硬化患者产生腹水的病因之一,提示肝硬化的脂肪代谢异常与SBP可能存在关联。
通过床旁间接能量检测仪检测患者的能量代谢指标,包括呼吸熵(respiratory quotient, RQ)、静息能量消耗(rest energy expenditure, REE)和三大营养底物(碳水化合物、脂肪和蛋白质)的氧化率等,是目前推荐的营养评估方法[5, 9]。本研究旨在探讨乙型肝炎肝硬化(HBV-LC)患者的能量代谢指标与短期内发生SBP风险的相关性。
1. 资料与方法
1.1 研究对象
回顾性分析2017年11月—2019年11月在本院住院的HBV-LC患者资料。诊断标准:HBV-LC符合《慢性乙型肝炎防治指南(2019年版)》[10]中的临床诊断标准,其中合并腹水、食管静脉曲张破裂出血或肝性脑病等严重并发症者,为失代偿期肝硬化。肝衰竭患者的诊断符合《肝衰竭诊治指南(2018年版)》[11]中的诊断标准。SBP符合《肝硬化腹水及相关并发症的诊疗指南》[1]中的诊断标准。排除标准:(1)其他病因所致肝硬化,如慢性丙型肝炎、酒精性肝病、自身免疫性肝病和药物性肝损伤;(2)入院前即合并感染;(3)恶性肿瘤;(4)就诊前有肾上腺皮质激素药物服用史;(5)合并慢性呼吸系统疾病,如哮喘、支气管肺炎等。本研究筛选出100例HBV-LC患者,其中失代偿期HBV-LC患者93例,排除合并恶性肿瘤、酒精性肝病、2型糖尿病患者(n=38),排除未进行能量代谢检测患者(n=5),最终纳入50例患者进行后续分析。
1.2 资料收集
收集患者的一般特征资料(年龄、身高和体质量等)、相关实验室检查指标、能量代谢检测结果等,记录患者住院2周内发生SBP的情况。
1.3 能量代谢检测
使用Quark RMR间接能量代谢检测仪(意大利COSMED公司),检测患者的能量代谢情况(住院后3天内完成),并严格遵守标准流程:(1)要求患者检测前一天22∶ 00后开始禁食,并尽量保持静卧状态至检测结束,期间确保睡眠质量同平常,且无肠外营养;检测时间安排在6∶ 00-7∶ 00,于患者床边进行。(2)能量代谢检测仪按照说明书操作,并使用厂家提供的标准气体(11.5%O2、4.81%CO2、83.69% N2)进行矫正,每次检测时间持续20~25 min。(3)收集检测前一日24 h尿液,记录尿量和测定尿氮浓度,计算24 h尿氮(尿氮浓度×24 h尿量),用于计算蛋白质氧化率(protein oxidation rate, PRO) 和非蛋白呼吸熵(non protein RQ, npRQ)。npRQ的计算公式为:npRQ=(1.44×每分钟CO2产生量-4.89×24 h尿氮)÷(1.44×每分钟O2消耗量-6.04×24 h尿氮)[12]。
1.4 统计学方法
采用开源统计软件R语言(版本:4.0.3)进行数据分析。符合正态分布的计量资料采用x±s表示,两组间比较采用t检验;非正态分布的计量资料采用M(P25~P75)表示,两组间比较采用Kruskal-Wallis H秩和检验。计数资料组间比较采用χ2检验或Fisher精确检验。将单因素分析中有显著差异的变量(P<0.05) 纳入多因素logistic回归分析,采用逐步回归法筛选变量,方差膨胀因子(variance inflation factor, VIF)评估变量间的共线性,并最终构建模型;绘制受试者工作特征曲线(ROC曲线)分析模型的诊断效应,以最大Youden指数对应的点为模型的截断值,采用DeLong检验比较ROC曲线下面积(AUC)。P<0.05为差异有统计学意义。
2. 结果
2.1 基线特征的比较
研究最终纳入失代偿期HBV-LC患者50例,住院后2周发生SBP患者23例(46%),其中诊断为肝衰竭患者13例(57%);无SBP患者27例(54%),其中诊断为肝衰竭患者8例(30%);女性7例(14%),男性43例(86%),平均年龄49.98岁,平均体质量62.10 kg。依据BMI将患者划分为体质量减少(BMI<18.50 kg/m2),正常体质量(18.50 kg/m2≤BMI<25 kg/m2),超重(25 kg/m2≤BMI<30 kg/m2)和肥胖(BMI≥30 kg/m2)。并发SBP与无SBP两组患者基线的性别、年龄、身高、体质量、体表面积及BMI均无统计学差异(P值均>0.05)(表 1)。
表 1 基线特征比较Table 1. Comparison of baseline characteristics指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 性别[例(%)] 0.689 女 7(14) 4(17) 3(11) 男 43(86) 19(83) 24(89) 肝衰竭[例(%)] χ2=2.7 0.103 是 21(42) 13(57) 8(30) 否 29(58) 10(43) 19(70) 年龄(岁) 49.98±11.61 53.13±11.62 47.30±11.11 t=1.8 0.078 身高(cm) 168(165~170) 165(163~170) 168(165~170) H=230.5 0.117 体质量(kg) 62.1(55.2~72.0) 63.0(53.7~71.0) 61.0(55.9~71.9) H=304.5 0.915 体表面积(m2) 1.73±0.17 1.71±0.16 1.74±0.18 H=-0.7 0.517 BMI[例(%)] 0.793 下降 5(10) 2(9) 3(11) 正常 32(64) 14(61) 18(67) 超重 10(20) 6(26) 4(15) 肥胖 3(6) 1(4) 2(7) 2.2 实验室指标的比较
失代偿期HBV-LC合并SBP患者的甘油三酯、前白蛋白以及凝血酶原活动度(PTA)均显著低于无SBP患者(P值均<0.05);而SBP患者的国际标准化比值(INR)、C反应蛋白(CRP)和终末期肝病模型(MELD)评分则显著高于无SBP患者(P值均<0.05)(表 2)。
表 2 实验室指标比较Table 2. Comparison of laboratory parameters指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 总胆红素(μmol/L) 124.95(43.75~274.40) 185.80(83.40~280.60) 77.70(29.30~245.45) H=403.0 0.073 白蛋白(g/L) 33.2±5.8 31.6±5.4 34.6±5.9 t=-1.8 0.071 前白蛋白(g/L) 55(45~88) 50(38~65) 78(51~126) H=177.5 0.010 胆碱酯酶(U/L) 3401(2230~5029) 3120(2094~4299) 4111(2367~5396) H=256.5 0.298 血糖(mmol/L) 5.27(4.74~7.18) 5.50(4.68~6.58) 5.22(4.84~7.28) H=311.0 0.992 甘油三酯(mmol/L) 0.88(0.71~1.20) 0.81(0.69~0.94) 1.09(0.76~1.27) H=208.5 0.048 总胆固醇(mmol/L) 2.94±1.19 2.69±1.15 3.15±1.20 t=-1.4 0.179 低密度脂蛋白(mmol/L) 1.57±0.70 1.52±0.73 1.62±0.68 t=-0.5 0.600 高密度脂蛋白(mmol/L) 0.56(0.21~0.90) 0.46(0.17~0.65) 0.74(0.29~1.04) H=216.5 0.069 血肌酐(μmol/L) 73(63~87) 70(65~85) 73(61~88) H=306.5 0.946 PTA(%) 0.56±0.22 0.45±0.16 0.66±0.21 t= -4.0 <0.001 INR 1.55(1.20~2.04) 1.99(1.50~2.46) 1.25(1.12~1.67) H= 482.0 <0.001 血红蛋白(g/L) 124.12±21.03 118.78±17.31 128.67±23.10 t=-1.7 0.091 血小板(×109/L) 81.0(53.5~110.3) 74.0(51.5~95.0) 92.0(57.5~124.5) H=234.5 0.142 MELD评分 16.81±6.84 19.83±6.22 14.25±6.37 t=3.1 0.003 CRP(mg/L) 8.37(3.32~14.79) 13.42(6.82~21.44) 6.79(2.05~9.42) H=462.5 0.003 PCT(ng/mL) 0.36(0.11~0.71) 0.55(0.08~0.76) 0.35(0.15~0.60) H=350.5 0.442 注:PCT,降钙素原。 2.3 能量代谢指标的比较
失代偿期HBV-LC合并SBP患者的RQ值、碳水化合物氧化率(carbohydrate oxidation, CHO)及CHO/RQ均显著低于无SBP患者(P值均<0.05)(表 3)。
表 3 能量代谢指标比较Table 3. Comparison of energy metabolism indices指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 REE(kcal) 1 513.30±323.65 1 493.78±266.95 1 529.93±369.44 t=-0.4 0.691 pREE((kcal) 1396(1312~1565) 1383(1259~1504) 1401(1327~1594) H=266.0 0.392 RQ 0.82(0.78~0.89) 0.79(0.76~0.86) 0.85(0.79~0.91) H=205.0 0.041 npRQ 0.82(0.78~0.90) 0.79(0.76~0.86) 0.85(0.79~0.91) H=210.0 0.051 FAT(%) 49.70(28.15~65.33) 55.80(40.85~69.30) 43.80(15.35~61.40) H=385.0 0.149 CHO(%) 31.55(18.15~52.83) 20.50(15.25~41.05) 41.60(22.25~68.05) H=205.0 0.041 PRO(%) 15.2(8.0~22.1) 15.1(5.1~24.4) 15.5(8.4~19.3) H=302.5 0.884 CHO/RQ 0.38(0.23~0.59) 0.26(0.20~0.48) 0.49(0.28~0.62) H=202.5 0.036 注:pREE,预测静息能量消耗;FAT,脂肪氧化率。 2.4 logistic回归分析与模型构建
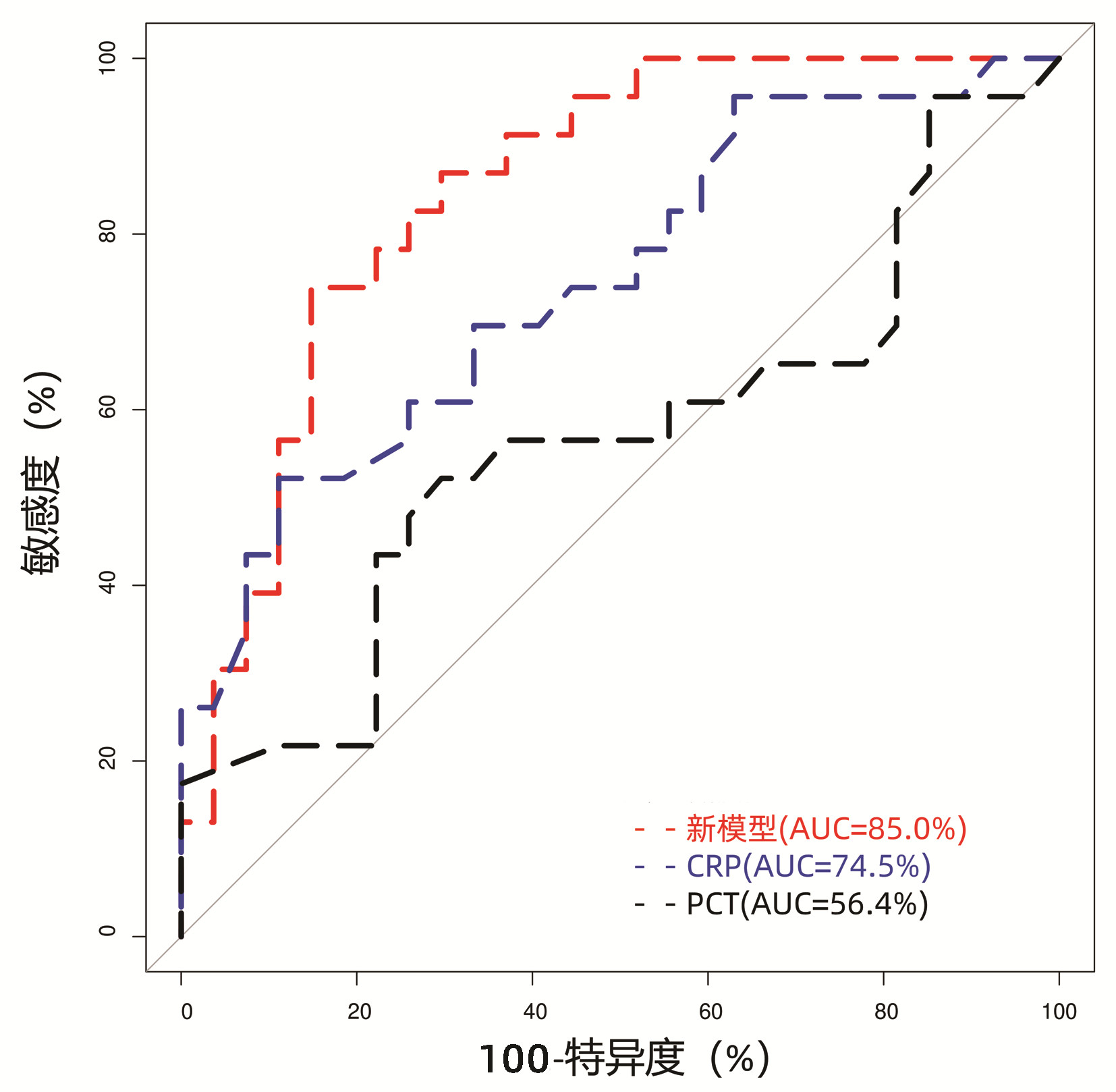
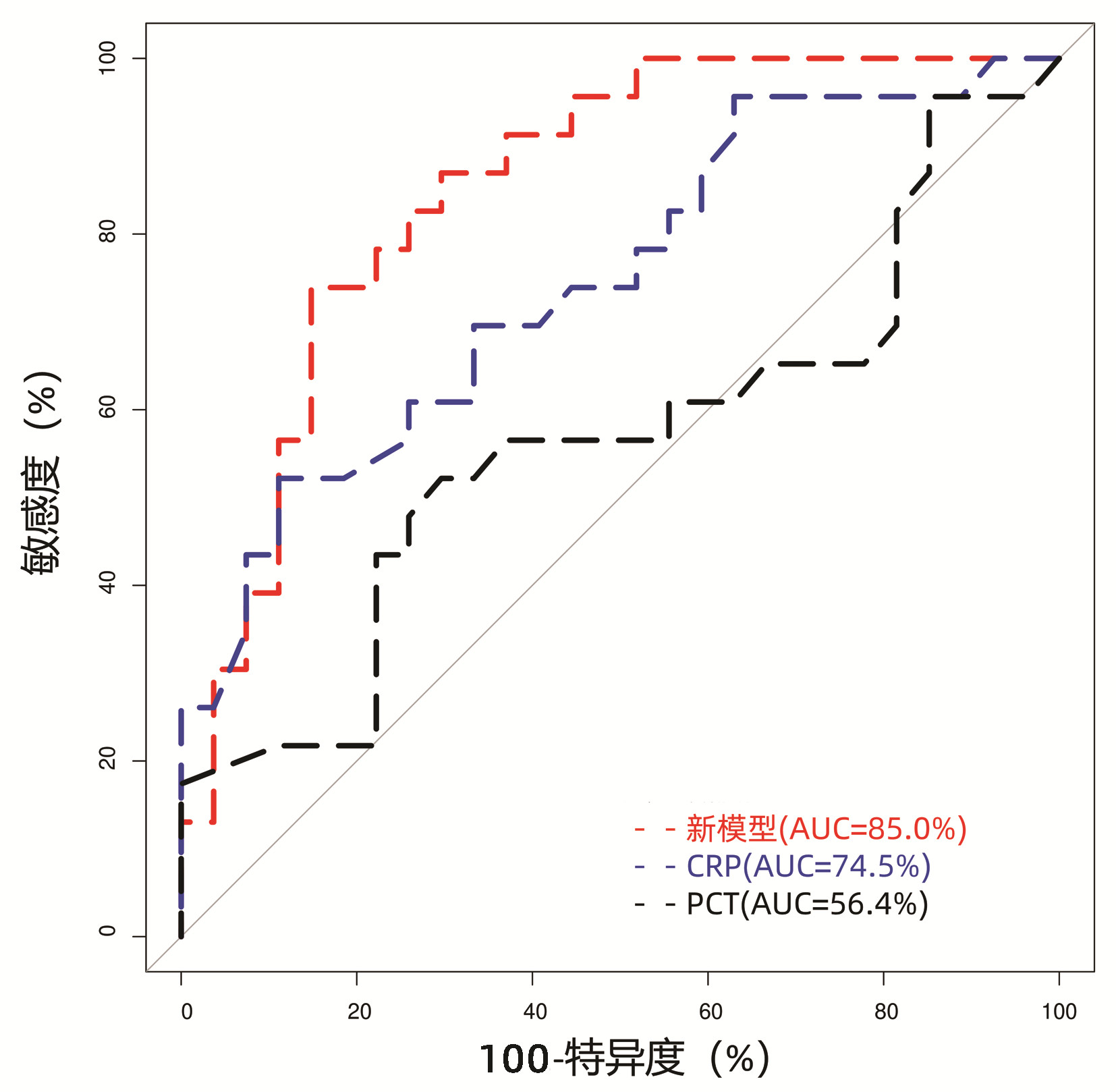
将两组患者上述指标比较中的差异变量(P<0.05),包括前白蛋白、甘油三酯、PTA、INR、CRP、MELD评分、RQ及CHO等,纳入多因素logistic回归分析中。由于PTA(VIF=10.61)和INR(VIF=8.06)存在变量间共线性,且均为反映凝血酶原时间的指标,而RQ(VIF=12.77)和CHO(VIF=11.07)也存在变量间共线性,且均为反应碳水化合物代谢的指标,故将PTA和CHO/RQ比值纳入模型构建。最终构建回归模型参数见表 4,其中PTA为独立危险因素(比值比=0.004, P=0.008),所构建回归模型:Logit(P)=2.18-5.43×PTA-0.93(CHO/RQ)+0.08×CRP。模型的AUC为85.0%,当曲线的Youden指数为最大值时,模型截断值为0.60,特异度为85.19%,敏感度为73.91%,模型的区分度优于CRP(AUC=74.5%, P=0.049)和PCT(AUC=56.4%, P<0.01)(图 1)。
表 4 logistic回归模型参数Table 4. The parameters of logistic regression model参数 系数 比值比 95%置信区间 Z值 P值 截距 2.18 0.611~163.911 1.559 0.119 PTA -5.43 0.004 0.000~0.179 -2.634 0.008 CHO/RQ -0.93 0.396 0.011~13.843 -0.517 0.605 CRP 0.08 1.086 1.012~1.204 1.899 0.058 3. 讨论
肝脏是代谢的重要器官,肝硬化患者的肝功能受损,可直接影响机体的能量代谢,导致糖异生增加、肌肉减少、脂肪氧化增加及脂肪减少,最终导致患者营养状况的恶化;此外,肝硬化患者由于饮食摄入不足,致使营养不良也成为一种常见并发症[9]。
REE、RQ和三大营养物质的氧化率是反应能量代谢的主要指标。既往研究表明与健康对照组相比,肝硬化患者的REE值升高,提示能量消耗升高[13-14],但高REE的肝硬化患者生存预后较好,这可能与REE水平随Child-Pugh分级升高而下降有关,而Child-Pugh C级的肝硬化患者往往预后不良[15]。REE还与感染相关,研究发现脓毒症患者REE较入院时基线值逐渐升高,并于入院2周后达到最高值(约1.7倍)[16]。但在本研究中失代偿期HBV-LC患者入院2周内发生SBP与未发生SBP患者的基线REE和pREE均无统计学差异,可能与并发感染的患者同时存在高代谢与低代谢有关[17]。RQ值反映了三大营养物质代谢的情况,而npRQ则仅体现碳水化合物和脂肪的代谢情况。肝硬化患者的RQ值、npRQ值较健康对照组均显著下降,并与疾病的严重程度和生存预后相关[15, 18-20]。肝硬化患者的npRQ下降,机体供能底物从碳水化合物转化为脂肪酸氧化和氨基酸糖异生,蛋白质合成下降,导致患者的肌肉含量减少[18]。具体到三大营养物质的氧化率,肝硬化患者表现为CHO显著下降,FAT则显著升高,而PRO在肝硬化患者与健康人之间并未体现出差异[19]。在脓毒症患者的早期,能量代谢表现RQ值下降(<0.8),营养底物消耗从碳水化合物转化为脂肪,存活患者的RQ值升高(>0.8),而死亡患者的RQ值仍维持低水平[21]。本研究中,失代偿期HBV-LC患者并发SBP与未发生SBP患者相比较,RQ和CHO均显著下降,提示两者与并发SBP风险相关。
CRP和PCT是目前临床上常用的反映急性炎症状态的指标,作为诊断感染的重要参考依据[22-23]。既往对肝硬化患者的相关研究中,Metwally等[24]通过回顾性分析300例肝硬化患者的临床资料,认为CRP水平是患者发生SBP的独立危险因素(比值比=1.228, P<0.001);Abdel-Razik等[25]通过比较肝硬化合并SBP(n=52)和无合并SBP(n=27)的PCT水平,结果显示PCT水平为0.94 ng/mL时,对SBP具有较高的敏感度(94.3%)和特异度(91.8%)。而Mikuła等[26]回顾性分析63例肝硬化合并腹水患者的临床资料,结果则显示CRP和PCT与患者腹水多核细胞数呈弱相关,认为两者对于肝硬化并发SBP的预测作用低。CRP和PCT的研究结果出现上述矛盾的原因可能是CRP和PCT主要在肝细胞中表达,而肝脏疾病的严重程度影响了二者的表达水平[22]。结合本研究结果,CRP和PCT预测失代偿期HBV-LC并发SBP的AUC值分别为74.5%和56.4%,提示CRP与失代偿期HBV-LC短期发生SBP的风险相关,而由CRP、PTA和CHO/RQ构建的模型,其AUC值为85.0%,区分度优于CRP和PCT。
PTA是反映凝血酶原时间的指标之一,PTA下降提示肝细胞合成功能下降,患者病情严重。一项荟萃分析[27]显示,凝血酶原时间延长是肝硬化患者合并SBP的危险因素。本研究中,PTA是失代偿期肝硬化患者合并SBP的独立危险因素(比值比=0.004,P=0.008),与既往研究结论一致。
本研究存在以下不足:(1)本研究为回顾性单中心的研究,且样本量相对较少,可能导致样本选择偏倚;(2)本研究中失代偿期肝硬化患者的SBP发生率较高(46%),这与笔者将肝衰竭患者纳入分析有关,但两组患者的肝衰竭比例无显著差异;(3)RQ和CHO作为失代偿期HBV-LC患者合并SBP的特征性指标,其临床诊断价值还需后续通过严格筛选患者,设计前瞻性、多中心、大样本的临床研究一步明确。
总之,本研究初步对失代偿期HBV-LC患者的能量代谢指标与住院后2周内发生SBP的相关性进行探讨,结果提示失代期HBV-LC患者RQ和CHO水平下降与SBP风险相关,结合PTA、CRP和CHO/RQ比值,有助于对失代期HBV-LC短期发生SBP高风险患者进行筛查,并及时采取措施,加强营养支持,改善患者临床预后。
-
表 1 基线特征比较
Table 1. Comparison of baseline characteristics
指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 性别[例(%)] 0.689 女 7(14) 4(17) 3(11) 男 43(86) 19(83) 24(89) 肝衰竭[例(%)] χ2=2.7 0.103 是 21(42) 13(57) 8(30) 否 29(58) 10(43) 19(70) 年龄(岁) 49.98±11.61 53.13±11.62 47.30±11.11 t=1.8 0.078 身高(cm) 168(165~170) 165(163~170) 168(165~170) H=230.5 0.117 体质量(kg) 62.1(55.2~72.0) 63.0(53.7~71.0) 61.0(55.9~71.9) H=304.5 0.915 体表面积(m2) 1.73±0.17 1.71±0.16 1.74±0.18 H=-0.7 0.517 BMI[例(%)] 0.793 下降 5(10) 2(9) 3(11) 正常 32(64) 14(61) 18(67) 超重 10(20) 6(26) 4(15) 肥胖 3(6) 1(4) 2(7) 表 2 实验室指标比较
Table 2. Comparison of laboratory parameters
指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 总胆红素(μmol/L) 124.95(43.75~274.40) 185.80(83.40~280.60) 77.70(29.30~245.45) H=403.0 0.073 白蛋白(g/L) 33.2±5.8 31.6±5.4 34.6±5.9 t=-1.8 0.071 前白蛋白(g/L) 55(45~88) 50(38~65) 78(51~126) H=177.5 0.010 胆碱酯酶(U/L) 3401(2230~5029) 3120(2094~4299) 4111(2367~5396) H=256.5 0.298 血糖(mmol/L) 5.27(4.74~7.18) 5.50(4.68~6.58) 5.22(4.84~7.28) H=311.0 0.992 甘油三酯(mmol/L) 0.88(0.71~1.20) 0.81(0.69~0.94) 1.09(0.76~1.27) H=208.5 0.048 总胆固醇(mmol/L) 2.94±1.19 2.69±1.15 3.15±1.20 t=-1.4 0.179 低密度脂蛋白(mmol/L) 1.57±0.70 1.52±0.73 1.62±0.68 t=-0.5 0.600 高密度脂蛋白(mmol/L) 0.56(0.21~0.90) 0.46(0.17~0.65) 0.74(0.29~1.04) H=216.5 0.069 血肌酐(μmol/L) 73(63~87) 70(65~85) 73(61~88) H=306.5 0.946 PTA(%) 0.56±0.22 0.45±0.16 0.66±0.21 t= -4.0 <0.001 INR 1.55(1.20~2.04) 1.99(1.50~2.46) 1.25(1.12~1.67) H= 482.0 <0.001 血红蛋白(g/L) 124.12±21.03 118.78±17.31 128.67±23.10 t=-1.7 0.091 血小板(×109/L) 81.0(53.5~110.3) 74.0(51.5~95.0) 92.0(57.5~124.5) H=234.5 0.142 MELD评分 16.81±6.84 19.83±6.22 14.25±6.37 t=3.1 0.003 CRP(mg/L) 8.37(3.32~14.79) 13.42(6.82~21.44) 6.79(2.05~9.42) H=462.5 0.003 PCT(ng/mL) 0.36(0.11~0.71) 0.55(0.08~0.76) 0.35(0.15~0.60) H=350.5 0.442 注:PCT,降钙素原。 表 3 能量代谢指标比较
Table 3. Comparison of energy metabolism indices
指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 REE(kcal) 1 513.30±323.65 1 493.78±266.95 1 529.93±369.44 t=-0.4 0.691 pREE((kcal) 1396(1312~1565) 1383(1259~1504) 1401(1327~1594) H=266.0 0.392 RQ 0.82(0.78~0.89) 0.79(0.76~0.86) 0.85(0.79~0.91) H=205.0 0.041 npRQ 0.82(0.78~0.90) 0.79(0.76~0.86) 0.85(0.79~0.91) H=210.0 0.051 FAT(%) 49.70(28.15~65.33) 55.80(40.85~69.30) 43.80(15.35~61.40) H=385.0 0.149 CHO(%) 31.55(18.15~52.83) 20.50(15.25~41.05) 41.60(22.25~68.05) H=205.0 0.041 PRO(%) 15.2(8.0~22.1) 15.1(5.1~24.4) 15.5(8.4~19.3) H=302.5 0.884 CHO/RQ 0.38(0.23~0.59) 0.26(0.20~0.48) 0.49(0.28~0.62) H=202.5 0.036 注:pREE,预测静息能量消耗;FAT,脂肪氧化率。 表 4 logistic回归模型参数
Table 4. The parameters of logistic regression model
参数 系数 比值比 95%置信区间 Z值 P值 截距 2.18 0.611~163.911 1.559 0.119 PTA -5.43 0.004 0.000~0.179 -2.634 0.008 CHO/RQ -0.93 0.396 0.011~13.843 -0.517 0.605 CRP 0.08 1.086 1.012~1.204 1.899 0.058 -
[1] Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the management of ascites and complications in cirrhosis[J]. J Clin Hepatol, 2017, 33(10): 1847-1863. DOI: 10.3969/j.issn.1001-5256.2017.10.003.中华医学会肝病学分会. 肝硬化腹水及相关并发症的诊疗指南[J]. 临床肝胆病杂志, 2017, 33(10): 1847-1863. DOI: 10.3969/j.issn.1001-5256.2017.10.003. [2] European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis[J]. J Hepatol, 2018, 69(2): 406-460. DOI: 10.1016/j.jhep.2018.03.024. [3] MARCIANO S, DÍAZ JM, DIRCHWOLF M, et al. Spontaneous bacterial peritonitis in patients with cirrhosis: incidence, outcomes, and treatment strategies[J]. Hepat Med, 2019, 11: 13-22. DOI: 10.2147/HMER.S164250. [4] CHINNOCK B, AFARIAN H, MINNIGAN H, et al. Physician clinical impression does not rule out spontaneous bacterial peritonitis in patients undergoing emergency department paracentesis[J]. Ann Emerg Med, 2008, 52(3): 268-273. DOI: 10.1016/j.annemergmed.2008.02.016. [5] TANDON P, RAMAN M, MOURTZAKIS M, et al. A practical approach to nutritional screening and assessment in cirrhosis[J]. Hepatology, 2017, 65(3): 1044-1057. DOI: 10.1002/hep.29003. [6] LI YT, HUANG JR, PENG ML. Current status and prospects of spontaneous peritonitis in patients with cirrhosis[J]. Biomed Res Int, 2020, 2020: 3743962. DOI: 10.1155/2020/3743962. [7] MONTANO-LOZA AJ, MEZA-JUNCO J, PRADO CM, et al. Muscle wasting is associated with mortality in patients with cirrhosis[J]. Clin Gastroenterol Hepatol, 2012, 10(2): 166-173, 173. e1. DOI: 10.1016/j.cgh.2011.08.028. [8] RODRIGUES SG, BRABANDT B, STIRNIMANN G, et al. Adipopenia correlates with higher portal pressure in patients with cirrhosis[J]. Liver Int, 2019, 39(9): 1672-1681. DOI: 10.1111/liv.14175. [9] Chinese Society of Hepatology, Chinese Medical Association, Chinese Society of Gastroenterology, Chinese Medical Association. Clinical guidelines on nutrition in end-stage liver disease[J]. J Clin Hepatol, 2019, 35(6): 1222-1230. DOI: 10.3969/j.issn.1001-5256.2019.06.010.中华医学会肝病学分会, 中华医学会消化病学分会. 终末期肝病临床营养指南[J]. 临床肝胆病杂志, 2019, 35(6): 1222-1230. DOI: 10.3969/j.issn.1001-5256.2019.06.010. [10] Chinese Society of Infectious Diseases, Chinese Medical Association, Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B (version 2019)[J]. J Clin Hepatol, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007. [11] Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, Chinese Medical Association; Severe Liver Disease and Artificial Liver Group, Chinese Society of Hepatology, Chinese Medical Association. Guideline for diagnosis and treatment of liver failure(2018)[J]. J Clin Hepatol, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007.中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2018年版)[J]. 临床肝胆病杂志, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007. [12] TERAKURA Y, SHIRAKI M, NISHIMURA K, et al. Indirect calorimetry and anthropometry to estimate energy metabolism in patients with liver cirrhosis[J]. J Nutr Sci Vitaminol (Tokyo), 2010, 56(6): 372-379. DOI: 10.3177/jnsv.56.372. [13] PENG S, PLANK LD, MCCALL JL, et al. Body composition, muscle function, and energy expenditure in patients with liver cirrhosis: a comprehensive study[J]. Am J Clin Nutr, 2007, 85(5): 1257-1266. DOI: 10.1093/ajcn/85.5.1257. [14] PRIETO-FRÍAS C, CONCHILLO M, PAYERAS M, et al. Factors related to increased resting energy expenditure in men with liver cirrhosis[J]. Eur J Gastroenterol Hepatol, 2016, 28(2): 139-145. DOI: 10.1097/MEG.0000000000000516. [15] BELARMINO G, SINGER P, GONZALEZ MC, et al. Prognostic value of energy expenditure and respiratory quotient measuring in patients with liver cirrhosis[J]. Clin Nutr, 2019, 38(4): 1899-1904. DOI: 10.1016/j.clnu.2018.07.001. [16] de WAELE E, MALBRAIN M, SPAPEN H. Nutrition in Sepsis: A bench-to-bedside review[J]. Nutrients, 2020, 12(2): 395. DOI: 10.3390/nu12020395. [17] KAO CC, GUNTUPALLI KK, BANDI V, et al. Whole-body CO2 production as an index of the metabolic response to sepsis[J]. Shock, 2009, 32(1): 23-28. DOI: 10.1097/SHK.0b013e3181970f32. [18] GLASS C, HIPSKIND P, TSIEN C, et al. Sarcopenia and a physiologically low respiratory quotient in patients with cirrhosis: a prospective controlled study[J]. J Appl Physiol (1985), 2013, 114(5): 559-565. DOI: 10.1152/japplphysiol.01042.2012. [19] TAJIKA M, KATO M, MOHRI H, et al. Prognostic value of energy metabolism in patients with viral liver cirrhosis[J]. Nutrition, 2002, 18(3): 229-234. DOI: 10.1016/s0899-9007(01)00754-7. [20] NISHIKAWA H, ENOMOTO H, IWATA Y, et al. Prognostic significance of nonprotein respiratory quotient in patients with liver cirrhosis[J]. Medicine (Baltimore), 2017, 96(3): e5800. DOI: 10.1097/MD.0000000000005800. [21] LI A, MUKHOPADHYAY A. Correction to: Substrate utilization and energy expenditure pattern in sepsis by indirect calorimetry[J]. Crit Care, 2020, 24(1): 660. DOI: 10.1186/s13054-020-03391-7. [22] TANG L, YIN X. Diagnostic value of serum procalcitonin, C-reactive protein and neutrophil CD64 index in early diagnosis of neonatal infection with umbilical vein catheterization[J/CD]. Chin J Exp Clin Infect Dis(Electronic Edition), 2020, 14(4): 336-339. DOI: 10.3877/cma.j.issn.1674-1358.2020.04.013.唐磊, 尹旭. 血清降钙素原、C反应蛋白和中性粒细胞CD64指数对脐静脉置管新生儿感染早期诊断价值[J/CD]. 中华实验和临床感染病杂志(电子版), 2020, 14(4): 336-339. DOI: 10.3877/cma.j.issn.1674-1358.2020.04.013. [23] LI T, CHEN YY, SUN HS, et al. Application of hematology-related indexes in early diagnosis of bacterial infection of tumor patients in ICU[J]. J Jilin Univ(Med Edit), 2020, 46(4): 816-821. DOI: 10.13481/j.1671-587x.20200424.李铤, 陈媛媛, 孙洪帅, 等. 血液学相关指标在ICU肿瘤患者细菌感染早期诊断中的应用[J]. 吉林大学学报(医学版), 2020, 46(4): 816-821. DOI: 10.13481/j.1671-587x.20200424. [24] METWALLY K, FOUAD T, ASSEM M, et al. Predictors of spontaneous bacterial peritonitis in patients with cirrhotic ascites[J]. J Clin Transl Hepatol, 2018, 6(4): 372-376. DOI: 10.14218/JCTH.2018.00001. [25] ABDEL-RAZIK A, MOUSA N, ELHAMMADY D, et al. Ascitic fluid calprotectin and serum procalcitonin as accurate diagnostic markers for spontaneous bacterial peritonitis[J]. Gut Liver, 2016, 10(4): 624-631. DOI: 10.5009/gnl15120. [26] MIKUŁA T, SAPUŁA M, JABŁOŃSKA J, et al. Significance of heparin-binding protein and D-dimers in the early diagnosis of spontaneous bacterial peritonitis[J]. Mediators Inflamm, 2018, 2018: 1969108. DOI: 10.1155/2018/1969108. [27] SHEN HX, LOU XP, CHANG XW, et al. Risk factors for spontaneous bacterial peritonitis in cirrhotic patients: A meta analysis[J]. World Chin J Dig, 2016, 24(12): 1903-1909. DOI: 10.11569/wcjd.v24.i12.1903.申红霞, 娄小平, 苌新伟, 等. 肝硬化患者自发性细菌性腹膜炎危险因素的Meta分析[J]. 世界华人消化杂志, 2016, 24(12): 1903-1909. DOI: 10.11569/wcjd.v24.i12.1903. 期刊类型引用(4)
1. 谭梅傲,黄祎,刘姝婉,王雅楠,刘华宝. 基于“肝为气之治”理论探讨肝硬化全病程中医防治机理及实践. 中西医结合肝病杂志. 2024(04): 292-295+300 .  百度学术
百度学术2. 林占崇,彭云娟,蒋小艳. 甲型肝炎并发自发性腹膜炎的病原菌及耐药性特征分析. 医疗装备. 2024(15): 105-107+109 .  百度学术
百度学术3. 赵娟,苏璇,徐斌. 合并自发性细菌性腹膜炎对男性酒精性肝硬化患者能量代谢的影响. 北京医学. 2024(10): 815-819 .  百度学术
百度学术4. 施静,陈佩,万楚楚,赵疃. COX健康行为互动模式在乙型肝炎肝硬化患者护理中的应用. 国际护理学杂志. 2023(10): 1792-1795 .  百度学术
百度学术其他类型引用(0)
-




 PDF下载 ( 2128 KB)
PDF下载 ( 2128 KB)

 下载:
下载:

 下载:
下载:
 百度学术
百度学术