程序性细胞死亡受体-1及其配体与肝细胞癌患者预后和临床特征相关性的Meta分析
DOI: 10.3969/j.issn.1001-5256.2022.07.022
Association of programmed death-1 and programmed death-ligand 1 with the prognosis and clinical features of patients with hepatocellular carcinoma: A meta-analysis
-
摘要:
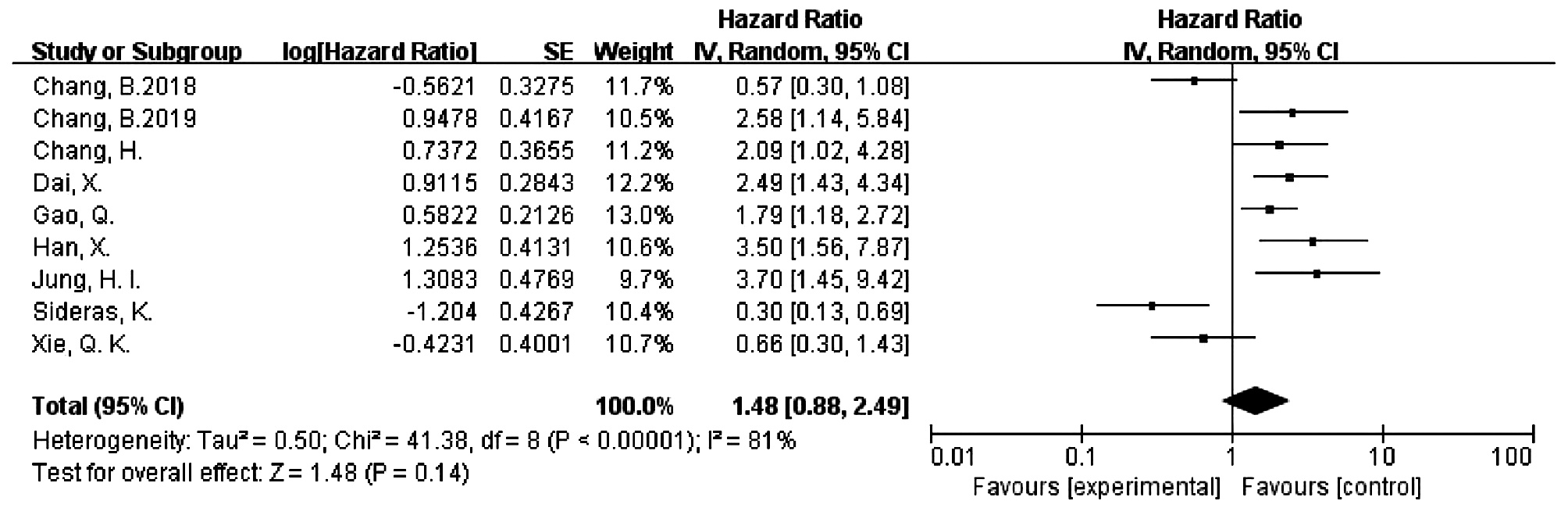
目的 系统评价程序性细胞死亡-1(PD-1)和程序性细胞死亡配体-1(PD-L1)的表达对肝细胞癌患者预后的影响。 方法 检索PubMed、Cochrane Library、Embase、中国生物医学数据库、中国知网、万方等数据库收集相关文献。纳入调查PD-1/PD-L1表达与肝细胞癌患者预后关系的队列研究或病例对照研究。采用RevMan 5.3软件对总生存期(OS)、无瘤生存期(DFS)进行Meta分析。 结果 共纳入20项符合条件的队列研究或病例对照研究。PD-1的表达与HCC患者的OS无关(HR=0.78, 95%CI: 0.31~1.97, P<0.05),但与DFS显著相关(HR=0.38, 95%CI: 0.24~0.58, P<0.01);PD-L1的表达与HCC患者的OS显著相关(HR=1.64, 95%CI: 1.26~2.15, P<0.05),但与DFS无关(HR=1.48, 95%CI: 0.88~2.49, P>0.05)。PD-1/PD-L1的表达与肝细胞癌患者临床特征无明显相关性(P>0.05)。 结论 PD-1/PD-L1表达与肝细胞癌患者预后具有相关性,但与临床特征无明显相关性。 -
关键词:
- 癌, 肝细胞 /
- 程序性细胞死亡受体-1 /
- 程序性细胞死亡配体-1 /
- Meta分析(主题)
Abstract:Objective To systematically evaluate the influence of the expression of programmed death-1 (PD-1) and programmed death-ligand 1 (PD-L1) on the prognosis of patients with hepatocellular carcinoma (HCC). Methods Related databases, such as PubMed, The Cochrane Library, Embase, CBM, CNKI, and Wanfang Data, were searched to collect related articles, and the cohort studies or case-control studies on the association of the expression of PD-1 and PD-L1 with the prognosis of HCC patients were included. RevMan 5.3 software was used to perform a meta-analysis of overall survival (OS) and disease-free survival (DFS). Results A total of 20 eligible cohort studies or case-control studies were included. The expression of PD-1 was not associated with the OS of HCC patients (hazard ratio [HR]=0.78, 95% confidence interval [CI]: 0.31-1.97, P < 0.05), while it was significantly associated with DFS (HR=0.38, 95%CI: 0.24-0.58, P < 0.01). The expression of PD-L1 was significantly associated with the OS of HCC patients (HR=1.64, 95%CI: 1.26-2.15, P < 0.05), but it was not associated with DFS (HR=1.48, 95%CI: 0.88-2.49, P > 0.05). In addition, the expression of PD-1 and PD-L1 was not significantly associated with the clinical features of HCC patients (P > 0.05). Conclusion The expression of PD-1 and PD-L1 is associated with the prognosis of HCC patients, with no significant association with clinical features. -
表 1 纳入文献基本特征
Table 1. Basic characteristics of included literature
作者 时间 国家 样本量 方法 表达位置 结局 治疗 研究类型 Chang[9] 2019 中国 120 抗体阵列分析 血清 OS、DFS 手术 回顾性病例对照研究 Chang[10] 2018 中国 145 免疫组化 肿瘤浸润性淋巴细胞 OS、DFS 综合 回顾性病例对照研究 Chang[11] 2017 韩国 146 免疫组化 肿瘤组织 DFS 手术 回顾性病例对照研究 Dai[12] 2018 中国 90 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 Finkelmeier[13] 2016 德国 215 酶联免疫吸附试验 血清 OS - 回顾性病例对照研究 Gao[14] 2009 中国 240 免疫组化 肿瘤组织 OS、DFS 手术 队列研究 Han[15] 2019 中国 81 酶联免疫吸附试验 血清 OS、DFS - 回顾性病例对照研究 Hu[16] 2018 中国 136 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 Huang[17] 2017 中国 411 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 Jung[18] 2017 韩国 85 免疫组化 肿瘤组织 OS、DFS 手术 回顾性病例对照研究 Kan[19] 2015 中国 128 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 Li[20] 2017 中国 83 酶联免疫吸附试验 血清 OS - 队列研究 Liu[21] 2018 中国 453 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 Pei[22] 2019 中国 143 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 Semaan[23] 2017 德国 176 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 Sideras[24] 2017 荷兰 146 免疫组化 肿瘤组织 DFS 手术 回顾性病例对照研究 Umemoto[25] 2015 日本 80 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 Xie[26] 2016 中国 90 免疫组化 肿瘤组织 OS、DFS 手术 队列研究 Zeng[27] 2011 中国 109 流式细胞检测分析 血清 OS - 回顾性病例对照研究 Zhang[28] 2018 中国 46 免疫组化 肿瘤组织 OS 手术 回顾性病例对照研究 表 2 纳入文献质量评价
Table 2. Including literature quality evaluation
作者 时间 国家 对象的选择(分) 可比性(分) 结局评估(分) 得分(分) a b c d e f g h Chang[9] 2019 中国 1 1 1 1 1 1 1 - 7 Chang[10] 2018 中国 1 1 1 1 1 1 1 1 8 Chang[11] 2017 韩国 1 1 1 1 1 1 1 1 8 Dai[12] 2018 中国 1 1 1 1 1 1 1 1 8 Finkelmeier[13] 2016 德国 1 1 1 1 1 1 1 1 8 Gao[14] 2009 中国 1 1 1 1 1 1 - - 6 Han[15] 2019 中国 1 1 1 1 1 1 1 - 7 Hu[16] 2018 中国 1 1 1 1 1 1 1 - 6 Huang[17] 2017 中国 1 1 1 1 1 1 1 1 8 Jung[18] 2017 韩国 1 1 1 1 1 1 1 - 7 Kan[19] 2015 中国 1 1 1 1 1 1 1 - 7 Li[20] 2017 中国 1 1 1 1 1 1 1 1 8 Liu[21] 2018 中国 1 1 1 1 1 1 1 1 8 Pei[22] 2019 中国 1 1 1 1 1 1 - - 6 Semaan[23] 2017 德国 1 1 1 1 1 1 1 1 8 Sideras[24] 2017 荷兰 1 1 1 1 1 1 1 1 8 Umemoto[25] 2015 日本 1 1 1 1 1 1 - - 6 Xie[26] 2016 中国 1 1 1 1 1 1 - - 6 Zeng[27] 2011 中国 1 1 1 1 1 1 1 - 7 Zhang[28] 2018 中国 1 1 1 1 1 1 1 1 8 注:a为暴露队列的代表性;b为非暴露队列的选择;c为暴露因素确定;d为研究起始前尚无要观察的结局事件;e为基于设计或分析所得的队列的可比性;f为结局事件的评价;g为随访时间足够长;h为随访的完整性。 表 3 PD-1表达与HCC临床特征的Meta分析
Table 3. Meta-analysis of PD-1 expression and clinical characteristics of HCC
临床特征 研究数量 例数 OR(95%CI) P值 异质性检验 I2值 P值 模型 年龄(>50岁/<50岁) 3 406 1.39(0.92~2.12) 0.12 0% 0.46 混合 性别(男/女) 3 406 1.32(0.76~2.28) 0.33 0% 0.41 混合 AFP(高/低) 3 406 1.01(0.30~3.36) 0.99 87% 0.000 4 随机 肿瘤大小(<5 cm/>5 cm) 3 406 0.52(0.10~2.83) 0.45 92% <0.000 01 随机 肝炎(是/否) 2 265 0.63(0.29~1.37) 0.24 0% 0.70 混合 肿瘤数量(单发/多发) 3 410 0.78(0.46~1.31) 0.34 46% 0.16 混合 BCLC分期(A/B) 3 265 1.03(0.47~2.24) 0.94 50% 0.16 混合 表 4 PD-L1表达与HCC临床特征的Meta分析
Table 4. Meta-analysis of PD-1 expression and clinical characteristics of HCC
临床特征 研究数量 例数 OR(95%CI) P值 异质性检验 I2值 P值 模型 年龄(>50岁/<50岁) 11 1541 0.96(0.76~1.21) 0.74 0 0.53 混合 性别(男/女) 14 2208 1.25(0.95~1.65) 0.11 0 0.82 混合 AFP (高/低) 10 1354 1.30(0.88~1.94) 0.19 56% 0.01 随机 肿瘤大小(<5 cm/>5 cm) 11 1774 1.13(0.69~1.84) 0.62 76% <0.000 1 随机 肝炎(是/否) 12 1972 1.18(0.88~1.58) 0.28 26% 0.19 混合 肿瘤数量(单发/多发) 9 1595 1.07(0.81~1.41) 0.26 20% 0.64 混合 TNM分期(晚期/早期) 6 1115 1.10(0.78~1.53) 0.59 27% 0.23 混合 分化程度(高/低) 7 1224 0.82(0.61~1.12) 0.21 47% 0.08 混合 肝炎(是/否) 6 926 1.24(0.69~2.22) 0.48 59% 0.03 随机 血管侵犯(是/否) 10 1665 1.17(0.67~2.06) 0.58 77% <0.000 1 随机 -
[1] CAO M, DING C, XIA C, et al. Attributable deaths of liver cancer in China[J]. Chin J Cancer Res, 2021, 33(4): 480-489. DOI: 10.21147/j.issn.1000-9604.2021.04.05. [2] ARAVALLI RN, STEER CJ. Immune-mediated therapies for liver cancer[J]. Genes (Basel), 2017, 8(2): 76. DOI: 10.3390/genes8020076. [3] MACEK JILKOVA Z, ASPORD C, DECAENS T, et al. Predictive factors for response to PD-1/PD-L1 checkpoint inhibition in the field of hepatocellular carcinoma: Current status and challenges[J]. Cancers (Basel), 2019, 11(10): 1554. DOI: 10.3390/cancers11101554.10.3390/cancers11101554. [4] SUNSHINE J, TAUBE JM. PD-1/PD-L1 inhibitors[J]. Curr Opin Pharmacol, 2015, 23: 32-38.10.1016/j.coph.2015.05.011. DOI: 10.1016/j.coph.2015.05.011 [5] ZHU YP, YUE F, HE Y, et al. Prokaryotic expression of the extracellular domain of porcine programmed death 1 (PD-1) and its ligand PD-L1 and identification of the binding with peripheral blood mononuclear cells in vitro[J]. Can J Vet Res, 2017, 81(2): 147-154. [6] BAŞ Y, KOÇ N, HELVACI K, et al. Clinical and pathological significance of programmed cell death 1 (PD-1)/programmed cell death ligand 1 (PD-L1) expression in high grade serous ovarian cancer[J]. Transl Oncol, 2021, 14(2): 100994. DOI: 10.1016/j.tranon.2020.100994. [7] TIAN L, MA J, MA L, et al. PD-1/PD-L1 expression profiles within intrahepatic cholangiocarcinoma predict clinical outcome[J]. World J Surg Oncol, 2020, 18(1): 303. DOI: 10.1186/s12957-020-02082-5. [8] WU Y, CAO D, QU L, et al. PD-1 and PD-L1 co-expression predicts favorable prognosis in gastric cancer[J]. Oncotarget, 2017, 8(38): 64066-64082. DOI: 10.18632/oncotarget.19318. [9] CHANG B, HUANG T, WEI H, et al. The correlation and prognostic value of serum levels of soluble programmed death protein 1 (sPD-1) and soluble programmed death-ligand 1 (sPD-L1) in patients with hepatocellular carcinoma[J]. Cancer Immunol Immunother, 2019, 68(3): 353-363. DOI: 10.1007/s00262-018-2271-4. [10] CHANG B, SHEN L, WANG K, et al. High number of PD-1 positive intratumoural lymphocytes predicts survival benefit of cytokine-induced killer cells for hepatocellular carcinoma patients[J]. Liver Int, 2018, 38(8): 1449-1458. DOI: 10.1111/liv.13697. [11] CHANG H, JUNG W, KIM A, et al. Expression and prognostic significance of programmed death protein 1 and programmed death ligand-1, and cytotoxic T lymphocyte-associated molecule-4 in hepatocellular carcinoma[J]. APMIS, 2017, 125(8): 690-698. DOI: 10.1111/apm.12703. [12] DAI X, PI G, YANG SL, et al. Association of PD-L1 and HIF-1α coexpression with poor prognosis in hepatocellular carcinoma[J]. Transl Oncol, 2018, 11(2): 559-566. DOI: 10.1016/j.tranon.2018.02.014. [13] FINKELMEIER F, CANLI Ö, TAL A, et al. High levels of the soluble programmed death-ligand (sPD-L1) identify hepatocellular carcinoma patients with a poor prognosis[J]. Eur J Cancer, 2016, 59: 152-159. DOI: 10.1016/j.ejca.2016.03.002. [14] GAO Q, WANG XY, QIU SJ, et al. Overexpression of PD-L1 significantly associates with tumor aggressiveness and postoperative recurrence in human hepatocellular carcinoma[J]. Clin Cancer Res, 2009, 15(3): 971-979. DOI: 10.1158/1078-0432.CCR-08-1608. [15] HAN X, GU YK, LI SL, et al. Pre-treatment serum levels of soluble programmed cell death-ligand 1 predict prognosis in patients with hepatitis B-related hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2019, 145(2): 303-312. DOI: 10.1007/s00432-018-2758-6. [16] HU K, WANG ZM, LI JN, et al. CLEC1B Expression and PD-L1 expression predict clinical outcome in hepatocellular carcinoma with tumor hemorrhage[J]. Transl Oncol, 2018, 11(2): 552-558. DOI: 10.1016/j.tranon.2018.02.010. [17] HUANG CY, WANG Y, LUO GY, et al. Relationship between PD-L1 expression and CD8+ T-cell immune responses in hepatocellular carcinoma[J]. J Immunother, 2017, 40(9): 323-333. DOI: 10.1097/CJI.0000000000000187. [18] JUNG HI, JEONG D, JI S, et al. Overexpression of PD-L1 and PD-L2 is associated with poor prognosis in patients with hepatocellular carcinoma[J]. Cancer Res Treat, 2017, 49(1): 246-254. DOI: 10.4143/crt.2016.066. [19] KAN G, DONG W. The expression of PD-L1 APE1 and P53 in hepatocellular carcinoma and its relationship to clinical pathology[J]. Eur Rev Med Pharmacol Sci, 2015, 19(16): 3063-3071. [20] LI N, ZHOU Z, LI F, et al. Circulating soluble programmed death-1 levels may differentiate immune-tolerant phase from other phases and hepatocellular carcinoma from other clinical diseases in chronic hepatitis B virus infection[J]. Oncotarget, 2017, 8(28): 46020-46033. DOI: 10.18632/oncotarget.17546. [21] LIU CQ, XU J, ZHOU ZG, et al. Expression patterns of programmed death ligand 1 correlate with different microenvironments and patient prognosis in hepatocellular carcinoma[J]. Br J Cancer, 2018, 119(1): 80-88. DOI: 10.1038/s41416-018-0144-4. [22] PEI R, ZHANG W, WANG S, et al. Prognostic value of PD-L1 in patients with hepatocellular carcinoma[J]. Clin Lab, 2019, 65(5). DOI: 10.7754/Clin.Lab.2018.180839. [23] SEMAAN A, DIETRICH D, BERGHEIM D, et al. CXCL12 expression and PD-L1 expression serve as prognostic biomarkers in HCC and are induced by hypoxia[J]. Virchows Arch, 2017, 470(2): 185-196. DOI: 10.1007/s00428-016-2051-5. [24] SIDERAS K, BIERMANN K, VERHEIJ J, et al. PD-L1, Galectin-9 and CD8+ tumor-infiltrating lymphocytes are associated with survival in hepatocellular carcinoma[J]. Oncoimmunology, 2017, 6(2): e1273309. DOI: 10.1080/2162402X.2016.1273309. [25] UMEMOTO Y, OKANO S, MATSUMOTO Y, et al. Prognostic impact of programmed cell death 1 ligand 1 expression in human leukocyte antigen class I-positive hepatocellular carcinoma after curative hepatectomy[J]. J Gastroenterol, 2015, 50(1): 65-75. DOI: 10.1007/s00535-014-0933-3. [26] XIE QK, ZHAO YJ, PAN T, et al. Programmed death ligand 1 as an indicator of pre-existing adaptive immune responses in human hepatocellular carcinoma[J]. Oncoimmunology, 2016, 5(7): e1181252. DOI: 10.1080/2162402X.2016.1181252. [27] ZENG Z, SHI F, ZHOU L, et al. Upregulation of circulating PD-L1/PD-1 is associated with poor post-cryoablation prognosis in patients with HBV-related hepatocellular carcinoma[J]. PLoS One, 2011, 6(9): e23621. DOI: 10.1371/journal.pone.0023621. [28] ZHANG J, LI H, GAO D, et al. A prognosis and impact factor analysis of DC-CIK cell therapy for patients with hepatocellular carcinoma undergoing postoperative TACE[J]. Cancer Biol Ther, 2018, 19(6): 475-483. DOI: 10.1080/15384047.2018.1433501. [29] STANG A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603-605. DOI: 10.1007/s10654-010-9491-z. -



 PDF下载 ( 3057 KB)
PDF下载 ( 3057 KB)


 下载:
下载: