Clinical application of fiber choledochoscope in treatment of retained biliary tract stones: An analysis of 573 cases
-
摘要:
目的探讨纤维胆道镜治疗胆道术后残余结石的方法及价值。方法回顾分析2003年1月-2012年12月应用纤维胆道镜治疗术后胆管残余结石573例患者的临床资料。结果 573例患者中536例取净结石,取净率93.5%。取石次数1~7次,平均为(2.36±1.45)次。治疗期间一过性发热23例(4.0%),腹泻42例(7.3%),并发胆道出血7例(1.2%),胰腺炎3例(0.5%),窦道穿孔5例(0.9%),均经保守治疗痊愈。结论纤维胆道镜技术是治疗术后胆管残余结石的安全、有效方法,应作为常规技术推广普及。
Abstract:Objective To investigate the clinical application and value of fiber choledochoscope in the treatment of postoperative retained biliary tract stones.Methods A retrospective analysis was performed on the clinical data of 573 patients with postoperative retained biliary tract stones who were treated by the fiber choledochoscope from January 2003 to December 2012.Results Among the 573 patients, 536 (93.5%) had stones removed completely.Stone removal was performed 1-7 times (2.36±1.45 times) in each case.The complications during treatment included transient fever (23 cases, 4.0%) , diarrhea (42 cases, 7.3%) , hemobilia (7 cases, 1.2%) , pancreatitis (3 cases, 0.5%) , and sinus perforation (5 cases, 0.9%) ;all the complications were cured by conservative therapy.Conclusion The stone-removing technique using fiber choledochoscope is a safe and effective method for treating postoperative retained biliary tract stones and deserves wide application.
-
Key words:
- fibercholedochoscopy /
- T-tube /
- cholelithiasis
-
肝棘球蚴病是棘球蚴绦虫幼虫寄生于人体和某些动物体内,侵犯其肝脏所致的一种严重肝脏疾病[1]。由细粒棘球蚴绦虫幼虫引起的肝细粒棘球蚴病,又称肝囊型包虫病;由多房棘球蚴绦虫幼虫引起的肝多房棘球蚴病,又称肝泡性型包虫病。肝棘球蚴病广泛分布于地中海地区、美国西南部、亚洲和非洲等农业和畜牧业常见地区,在我国主要分布于西北地区,如内蒙古、新疆、西藏和青海等[2]。当宿主感染棘球蚴时,棘球蚴可通过某些信号通路进行自身与宿主间的信息传递,调控自身生长发育与宿主的免疫系统。在棘球蚴感染过程中,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路发挥着重要作用。现就MAPK信号通路在肝棘球蚴病中涉及的相关免疫调节情况作一综述。
1. MAPK信号通路与相关肝脏疾病的研究概述
MAPK信号通路是介导细胞氧化应激、增殖与凋亡等生命活动的重要信号传导系统,其可将细胞外的相关生物信号进行逐级放大,传导到细胞内部,从而刺激细胞中的效应分子来完成细胞的各项生命活动。
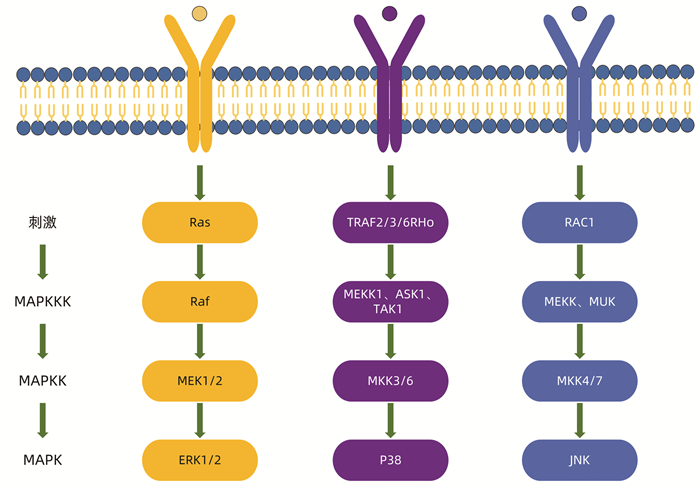
目前至少存在3种不同的MAPK信号通路,并且3种途径之间具有相互交叉、影响的关系,包括ERK激酶家族通路、JNK激酶家族通路和p38激酶家族通路[3]。ERK激酶家族由ERK1、2组成,JNK激酶家族由JNK1~3组成,p38激酶家族分为p38α、β、γ和δ。ERK信号的激活主要与生长因子的启动密切相关,JNK和p38信号由多种因素激活,如细胞因子、生长因子、环境应激和其他刺激[4]。激活的信号通路以三级激酶级联反应方式进行,其关键酶为MAPKKK、MAPKK、MAPK 3个丝氨酸/苏氨酸蛋白激酶,进行方向为MAPKKK-MAPKK-MAPK[5](图 1)。ERK激酶家族通路是MAPK信号通路的经典通路,其MAPKKK-MAPKK-MAPK三级激酶级联反应为Ras-Raf-MEK-ERK通路。细胞外的相关信号通过逐级活化激活ERK信号通路,磷酸化的ERK进入细胞核,激活多种转录因子,如Elk-1、ATF、NF-κB、Ap-1、c-fos和c-Jun等, 这些转录因子进一步调节各蛋白的表达,参与细胞增殖与分化、细胞形态维持等多种生物学反应。而活化的JNK调节细胞分化、凋亡和癌基因转化等多种生命过程[6],P38可调控氧化应激条件下炎症相关因子的表达、细胞骨架重构、能量代谢和增殖凋亡等[7]。
作为一种广泛存在真核生物中且高度保守的经典信号通路,MAPK通路在肝脏疾病中的作用逐渐被人们认识。其可在转录前、转录后及翻译等过程中调节相关基因的表达,与肝脏相关炎症反应、肝纤维化、肝癌等病理活动密切相关[8]。如马佳敏等[9]研究证实MAPK途径在非酒精性脂肪性肝炎进展中发挥关键作用。次旦旺久等[10]研究证实MAPK信号通路在肝癌的发生发展及治疗中发挥重要作用,是肝癌治疗及预后评价的潜在分子靶点。
而在肝棘球蚴病中,通过对感染细粒棘球蚴与多房棘球蚴的小鼠进行研究发现,其miRNA与正常小鼠的miRNA存在差异性表达,且差异性表达的miRNA主要集中在Wnt、MAPK、IL-17和TNF等信号通路中[11-12]。目前已在棘球绦虫体内成功鉴定出MAPK的几个组成部分[13],表明MAPK信号通路是一种棘球蚴和人体共有的信号传导系统,可作为连接棘球蚴与宿主的桥梁,影响棘球蚴的发育存活以及人体肝脏病变的病理过程,是打开肝棘球蚴病疾病密码的重要研究方向。研究棘球蚴病中与MAPK信号通路相关的基因、蛋白质的表达和功能鉴定等,有助于从细胞分子水平上了解疾病的进展过程,揭示棘球蚴和人体在各类病理性过程中的关系,为肝棘球蚴病的防治、预后等方面提供相关科学依据[14-16]。以下将重点介绍MAPK通路在肝棘球蚴病相关研究中的进展。
2. 棘球蚴感染宿主肝脏中的MAPK信号通路
在棘球蚴感染宿主的过程中,肝脏是最易受到其侵袭和累及的器官。而MAPK信号通路可接收多种细胞外刺激,参与多种信号传导,调节着几乎所有肝细胞的生理过程,包括基因表达、周期调控、细胞存活与死亡等[17]。研究MAPK信号通路的各个途径在肝细胞代谢过程中起到的作用,对肝棘球蚴病的进展过程尤为重要。
当受氧化应激、生长因子、细胞因子等刺激时,MAPK信号通路被激活,引起相应的级联反应,造成相应的生物学改变[18]。在MAPK信号通路中,ERK通路可调控细胞的发育、活化、凋亡等,是细胞内多种信号交汇点,ERK的激活更是导致细胞有丝分裂的早期关键因素。研究[19]显示,肝星状细胞分泌胶原以及肝细胞外基质的产生和降解等均受到了ERK途径的调控,而JNK可在一定程度上参与上述活动,并与ERK通路共同促进了肝纤维化。有证据[20]表明,ERK抑制剂PD98059和JNK抑制剂SP600125能够逆转TGF-β1诱导的肝星状细胞的自噬和纤维化。与正常生理状态相比,P38通路在肝脏疾病中存在差异表达,可参与到多种肝脏病理生理过程中,P38阻断剂SB203580可使肝星形细胞活化程度显著降低,表明在肝星状细胞的增殖与凋亡中,甚至在胶原、胞外基质的合成与降解等过程中,P38通路均发挥了重要作用[21]。
在肝多房棘球蚴病中,多房棘球绦虫原头蚴能够激活大鼠肝细胞ERK激酶,并且对JNK激酶和P38激酶也有不同程度的激活作用,同时多房棘球绦虫原头蚴也能够激活肝癌细胞的ERK激酶,表明多房棘球绦虫原头蚴自身分泌的一些细胞因子,如EmIns、EmBMP1/2等,可与宿主表面受体结合,从而激活宿主肝细胞的MAPK信号通路[22]。采用大鼠肝星状细胞株HSC-T6与不同蛋白浓度的多房棘球绦虫囊液进行共培养,结果显示,泡球蚴囊液对大鼠肝星状细胞ERK1/2、JNK1/2和P38的mRNA水平存在显著影响[19]。在肝细粒棘球蚴病中,Lin等[23]通过蛋白质印迹和免疫荧光测定表明,细粒棘球绦虫囊液可通过脂多糖刺激小鼠巨噬细胞中的P38和ERK1/2信号通路。Liu等[24]用细粒棘球绦虫囊液刺激小鼠腹腔巨噬细胞后,磷酸化的细胞外调节蛋白激酶、磷酸化的P38丝裂原活化蛋白激酶、磷酸化的丝氨酸/苏氨酸蛋白激酶表达水平均有所升高。
由此可见,利用多房棘球绦虫原头蚴、囊液及细粒棘球绦虫囊液刺激相关动物模型后,实验动物体内的MAPK信号通路均有不同程度的激活,激活后的MAPK信号通路将进一步调控机体内相关蛋白的表达,推动病情的进展,尤其在肝脏病理进展过程中发挥重要作用。而宿主肝细胞中MAPK信号通路对于棘球蚴绦虫刺激表现的高敏感性,或许为棘球蚴病常见的受累器官为什么是肝脏提供了相关合理解释。
3. 棘球蚴体内的MAPK信号通路
3.1 MAPK信号通路相关基因的鉴定和克隆
在肝多房棘球蚴病中,Spiliotis等[25]在体外培养中间宿主感染期间,在幼虫期囊蚴和原头蚴的裂解物中检测到EmRaf与EmRas基因的表达,并证实EmRas与编码Raf-1的人类基因共享4个高度保守的外显子-内含子边界。使用酵母双杂交系统表明EmRaf与EmRas相互作用,但不与EmRal相互作用。其团队后又成功分离了多房棘球蚴EmMPK1基因,并对其进行了全序列测定,结果显示该序列与已知物种的MAP激酶基因有显著的同源性,并在体外培养和感染中间宿主的幼虫阶段检测了EmMPK1及其磷酸化形式[26]。Gelmedin等[27]采用兼并PCR方法鉴定和成功克隆了多房棘球蚴的EmMKK1和EmMKK1基因。在结构上,EmMKK1和EmMKK2与来自其他物种的MKK3/6-和MEK1/2-MAPKK亚家族成员也表现出显著同源性。在酵母双杂交分析中,EmMKK2不仅与EmRaf相互作用,与EmMPK1也存在相互作用。而对EmMKK1来说,其与EmRaf也有着强烈相互作用,但与EmMPK1或EmMPK2不存在相互作用。Gelmedin等[28]发现,多房棘球绦虫P38 MAPK家族中的EmMPK2与其他种族的P38 MAPK具有相当大的同源性,但也存在几个明显的差异,如与人类P38-alpha相比,EmMPK2显示出显著的自身磷酸化活性和对MAPK底物强烈升高的基础活性。
在肝细粒棘球蚴病中,吕国栋等[29]应用逆转录聚合酶链式反应法从新疆株细粒棘球绦虫原头蚴和成虫中克隆出EgRas基因, 其与多房棘球绦虫基因EmRas以及线虫、人类等物种来源的Ras基因都表现出了较高的同源性。虽然EgRas的具体功能有待进一步研究,但推测其可能参与了细粒棘球绦虫向成囊与成虫两种不同发育模式的转变过程。其团队后又从细粒棘球绦虫原头蚴cDNA中克隆出Ral基因,检测到其与EmRal的同源性高达99%,但与线虫、人类等物种来源的Ral基因同源性则较低[30]。细粒棘球绦虫和多房棘球绦虫在不同的发育时期具有较相似的形态结构,但二者在中间宿主体内生长发育模式和致病过程却表现出了较大的差异,推测Ral基因可能在这2种寄生虫不同的发育过程中发挥一定作用。对新疆株细粒棘球蚴EgERK1基因进行相关测定发现,EgERK1与多房棘球绦虫ERK基因EmMPK1同源性为95.45%,与线虫、人类等ERK基因的同源性为43.04% ~61.88%。功能分析预测EgERK1具有ERK类激酶T-X-Y结构保守区和酶激活功能域。Western印迹显示,原核诱导表达的EgERK1重组蛋白能与抗人ERK1/2抗体发生特异性免疫反应[31]。Zhang等[32]检出细粒棘球绦虫EgMKK1和EgMKK2均在幼虫阶段表达。酵母双杂交和共免疫沉淀分析所示,EgMKK1与先前鉴定的EgP38蛋白相互作用,但不与EgERK相互作用。另一方面,EgMKK2与EgERK相互作用。此外,EgMKK1和EgMKK2显示出针对底物髓鞘碱性蛋白的激酶活性。Lv等[33]在细粒棘球蚴中鉴定了一个1107 bp的cDNA,该cDNA编码了368个氨基酸的组成的EgP38蛋白。EgP38具有P38样激酶的2个显著特征:高度保守的TXY基序和激活环片段。结构同源性建模表明EgP38、EmMPK2和智人P38α之间存在保守结构,EgP38的活性形式在囊泡和原头蚴中表达,但不在伴随的囊液中表达(表 1)。
3.2 MAPK信号通路的抑制剂与相关治疗效果
在ERK途径中,人EGF介导的EGFR/ERK信号促进了多房棘球蚴生发细胞的增殖,使用EGFR抑制剂CI-1033和BIBW2992、MEK/ERK抑制剂U0126,抑制信号传导会损害生发细胞增殖和幼虫生长[32, 36-37]。Raf抑制剂甲苯磺酸索拉非尼(25 μmol/L)、MEK选择性抑制剂PD184352(100 μmol/L)、MEK抑制剂U0126-EtOH(100 μmol/L)可诱导细粒棘球蚴中EgMKK和EgERK去磷酸化,引起形态和超微结构的改变,包括生发层中的细胞死亡、部分起皱和分离,同时降低原头蚴活力。且甲苯磺酸索拉非尼比PD184352和U0126更可有效地降低原头蚴活力[32]。ERK途径中Tau蛋白的阻滞剂TRx0237(LMTX)mesylate可以抑制棘球蚴原头蚴活性,阻碍生发层细胞与多房棘球蚴包囊的增殖。ERK蛋白的阻滞剂GDC-0994可以达到抑制原头蚴活性与抑制多房棘球蚴包囊增殖的作用,但与多房棘球蚴生发层细胞的增殖关系不密切[8]。
在P38途径与JNK途径中,EmMPK2活性被抑制剂ML3403和SB202190有效抑制。当将SB202190尤其是ML3403添加到体外培养的多房棘球蚴囊泡时,会导致寄生虫中EmMPK2的去磷酸化,损害棘球蚴细胞生发细胞增殖和幼虫生长,并在不影响培养的哺乳动物细胞的浓度下有效杀死寄生虫囊泡[28, 32]。用P38抑制剂ML3403处理细粒棘球蚴体外培养的原头蚴可有效抑制EgP38活性,并在5 d内导致显著的原头蚴死亡[33]。而P38途径中靶点蛋白ASK1阻滞剂Selonsertib在体内及体外均无明显的抗多房棘球蚴作用[38]。ERK抑制剂PD98059、JNK抑制剂SP600125、P38抑制剂SB202190均对细粒棘球蚴原头蚴的生长有不同程度的抑制作用, 且抑制P38及JNK信号通路对HO-1酶活性影响更大[39]。
在其他相关途径中,P53蛋白的阻滞剂Pifithrin-β hydrobromide在小鼠体内抗多房棘球蚴效果较好,而在体外实验中,对原头蚴及生发层细胞均无明显抑制作用,推测其可能在棘球蚴与宿主之间的交互作用中发挥了重要生物效应[8]。BMP抑制剂LDN-193189能够对BMP分子诱导的Smad、P38、AKT、ERK等信号通路产生抑制作用,阻碍寄生虫获取能量,并破坏其虫体结构。在体外培养体系中,予以不同浓度LDN-193189,阻断其信号转导,会使原头蚴生存能力显著减弱,且随着浓度的增大和作用时间的延长,这种效果更为显著[40]。
表 1 目前已在棘球蚴中鉴定的相关MAPK基因、蛋白质及其功能棘球蚴类别 基因 蛋白质 功能 参考文献 多房棘球蚴 EmRas EmRas 小GTP家族;Ras家族 [25] EmRal EmRal 小GTP家族;Ras家族 [34] EmRaf EmRaf MAPKKK,Raf家族 [25] EmMKK2 EmMKK2 MAPKK,MEK1/2家族 [27] EmMPK1 EmMPK1 MAPK,ERK家族 [26] EmMKK1 EmMKK1 MAPKK,MEK3/6家族 [27] EmMPK2 EmMPK2 MAPK,P38家族 [28] EmMPK3 EmMPK3 MAPK,JUK家族 [35] 细粒棘球蚴 EgRas EgRas 小GTP家族;Ras家族 [29] EgRal EgRal 小GTP家族;Ras家族 [30] EgRaf EgRaf MAPKKK,Raf家族 [32] EgMKK2 EgMKK2 MAPKK,MEK1/2家族 [32] EgERK1 EgERK1 MAPK,ERK家族 [31] EgMKK 1 EgMKK1 MAPKK,MEK3/6家族 [32] EgP38 EgP38 MAPK,P38家族 [33] 4. 小结和展望
综上所述,棘球蚴绦虫的生长和发育依赖于人体分子信号,而人体肝脏内一系列病理过程的变化和棘球蚴的分子信号也有千丝万缕的联系。近年来,以肝棘球蚴病信号转导通路中的关键激酶为药物的筛选靶点,探索具有高特异性且毒副作用小的新型靶向药物已成为当前肝棘球蚴病研究的热点。而MAPK信号通路在肝棘球蚴病中存在虫体与宿主的双重激活,参与肝棘球蚴病发生、发展的各个方面,对进一步研发更有效的治疗方案有着重要意义。未来,以MAPK信号通路为靶点的药物治疗有望成为肝棘球蚴病治疗新的选择。
-
[1]Feng QS, Zhang BS, Wei JJ.choledochoscopic treatment of intrac-table hepatolithiasis[J].Chin J Hepatobiliary Surg, 2000, 6 (3) :168-169. (in Chinese) 冯秋实, 张宝善, 魏久九.疑难肝内结石的胆镜治疗[J].中华肝胆外科杂志, 2000, 6 (3) :168-169. [2]Du RF, Zhang B, He HC, et al.Treatment of residual bile ductstones with choledochofiberscope via T-tube sinus[J].Chin J En-doscopy, 2007, 13 (8) :352-353. (in Chinese) 杜锐锋, 张冰, 和红春, 等.纤维胆道镜经T管窦道治疗术后胆道残石[J].中国内镜杂志, 2007, 13 (8) :352-353. [3]Xian GZ, Wu SD, Kong J, et al.Clinical experience with choledo-chofiberscope in the treatment of 787 patients with residual bile ductstones[J].J China Med Univ, 2008, 10 (5) :714-715. (in Chi-nese) 咸国哲, 吴硕东, 孔静, 等.787例纤维胆道镜治疗胆管残石的体会[J].中国医科大学学报, 2008, 10 (5) :714-715. [4]Liu SL.Application of choledochofiberscopy to treatment of postop-erative residual calculi in biliary tract (a report of 105 cases) [J].Chin J Endoscopy, 2009, 7 (7) :765-767. (in Chinese) 刘森林.纤维胆道镜在胆道术后残石治疗中的应用 (附105例报告) [J].中国内镜杂志, 2009, 7 (7) :765-767. [5]Gong LS, Zhang YD, He JT.Analysis of diagnostic reliability of re-tained stones after biliary operation[J].Chin J Modern Med, 2006, 16 (10) :1511-1513. (in Chinese) 龚连生, 张阳德, 何剪太.胆道术后残石诊断方法的可靠性分析[J].中国现代医学杂志, 2006, 16 (10) :1511-1513. [6]Chen JS, Shang CZ.Diagnostic imaging methods for hepatolithiasisand their rational selection[J].J Abdominal Surg, 2007, 20 (6) :331-332. (in Chinese) 陈积圣, 商昌珍.肝胆管结石的影像学诊断方法及其合理选择[J].腹部外科, 2007, 20 (6) :331-332. [7]Li LC, Zhu H, Li YH, et al.Surgical treatment by using cholangiosco-py for hepatolithiasis[J].Dig Surg, 2003, 2 (1) :48-50. (in Chi-nese) 李立春, 朱红, 李越华, 等.纤维胆道镜在肝内胆管结石外科治疗中的价值[J].消化外科, 2003, 2 (1) :48-50. [8] Huang ZQ, Gu ZY, Zhang XW, et al.Current situation of surgicaltreatment of hepatolithiasis in China[J].Chin J Surg, 1988, 26 (9) :513-522. (in Chinese) 黄志强, 顾倬云, 张晓卫, 等.我国肝内胆管结石外科治疗现状[J].中华外科杂志, 1988, 26 (9) :513-522. [9]Zhang BS.Clinical evaluation of“comet sign”in intrahepatic bileduct[J].Chin J Pract Surg, 1997, 17 (3) :182-183. (in Chi-nese) 张宝善.肝内胆管“彗星征”的临床评价[J].中国实用外科杂志, 1997, 17 (3) :182-183. [10]Chen J, Wang ZT, Tan SP.Intraoperative fibrocholangioscopy:itssignificance&approach[J].Chin J Dig Endoscopy, 2000, 17 (5) :280-282. (in Chinese) 陈剑, 王在同, 谭树平.术中胆道镜检的价值及入路选择[J].中华消化内镜杂志, 2000, 17 (5) :280-282. [11]Feng QS, Zhang BS, Wei JJ.The processing methods of T pipe o-verhang after choledochoscope operation[J].Chin J Endoscopy, 2000, 6 (2) :22-23. (in Chinese) 冯秋实, 张宝善, 魏久久.胆道镜术后T管脱出的处理方法[J].中国内镜杂志, 2000, 6 (2) :22-23. 期刊类型引用(2)
1. 米传靓,付彬,李思迪,陈志达,郭中坤,王可洲. Adra1a调节LPS诱导的Lbp~(-/-)小鼠原代肝细胞炎症反应. 中国比较医学杂志. 2024(05): 84-91 .  百度学术
百度学术2. 甘琴,王鑫,杨换花,董六一. 牡荆素调控Epac1/Rap1通路介导H9c2心肌细胞缺氧复氧损伤的保护作用机制. 中国临床药理学与治疗学. 2024(10): 1091-1099 .  百度学术
百度学术其他类型引用(2)
-




 PDF下载 ( 1169 KB)
PDF下载 ( 1169 KB)


 下载:
下载:
 百度学术
百度学术
 下载:
下载: