肝纤维化-4指数(FIB-4)联合预后营养指数(PNI)对早期肝癌射频消融术后复发及生存期的预测价值
DOI: 10.3969/j.issn.1001-5256.2023.11.015
Value of fibrosis-4 combined with prognostic nutritional index in predicting recurrence and survival time after radiofrequency ablation for early-stage hepatocellular carcinoma
-
摘要:
目的 探讨术前肝纤维化-4指数(FIB-4)联合预后营养指数(PNI)对于早期肝癌射频治疗(RFA)术后复发的预测价值。 方法 回顾性分析2013年1月—2017年12月于天津市第三中心医院行RFA的365例初诊为早期肝癌患者的临床资料,统计患者的复发及生存情况。以术后肿瘤复发为阳性事件绘制FIB-4、PNI的ROC曲线,选取最佳cut-off值,进行FIB-4和PNI的分级,组合为FIB-4-PNI评分,据此分为FIB-4-PNI 0分组(n=207)、1分组(n=93)和2分组(n=65)。计数资料组间比较采用χ2检验。采用Kaplan-Meier生存分析及Log-rank检验分析不同FIB-4-PNI等级组无复发生存率(RFS)及总生存率(OS)的差异。采用Cox回归模型筛选影响患者RFS、OS的相关因素。 结果 所有患者的1、3和5年RFS率分别为79.2%、49.8%和34.3%,中位RFS为35个月,1、3和5年OS率分别为98.9%、86.9%和77.3%。不同FIB-4、PNI、FIB-4-PNI水平患者累积RFS率(χ2值分别为17.890、29.826、32.397,P值均<0.001)、OS率(χ2值分别为16.896、21.070、26.121,P值均<0.001)差异均有统计学意义。多因素Cox回归分析显示,糖尿病史(HR=1.418,95%CI:1.046~1.922,P=0.024),肿瘤数目2个(HR=1.516,95%CI:1.094~2.101,P=0.012)、3个(HR=2.146,95%CI:1.278~3.604,P=0.004),FIB-4-PNI 1分(HR=1.875,95%CI:1.385~2.539,P<0.001)、2分(HR=2.350,95%CI:1.706~3.236,P<0.001)是RFS的独立危险因素;肿瘤数目2个(HR=1.732,95%CI:1.005~2.983,P=0.048)、3个(HR=3.511,95%CI:1.658~7.433,P=0.001),FIB-4-PNI 1分(HR=2.094,95%CI:1.230~3.565,P=0.006)、2分(HR=3.908,95%CI:2.306~6.624,P<0.001)是影响OS的独立危险因素。 结论 FIB-4-PNI评分可作为早期肝癌RFA术后复发及总生存期的独立预测因素,可联合肿瘤特征预测患者术后的复发及生存情况。 Abstract:Objective To investigate the value of preoperative fibrosis 4 score (FIB-4) combined with prognostic nutritional index (PNI) in predicting recurrence after radiofrequency ablation (RFA) for early-stage hepatocellular carcinoma (HCC). Methods A retrospective analysis was performed for the clinical data of 365 patients with the initial diagnosis of early-stage HCC who underwent RFA at Tianjin Third Central Hospital from January 2013 to December 2017, and a statistical analysis was performed for recurrence and survival. The receiver operating characteristic (ROC) curve was plotted for FIB-4 and PNI with postoperative tumor recurrence as the positive event, and their optimal cut-off values were selected. FIB-4 and PNI were graded and combined as FIB-4-PNI score, based on which the patients were divided into 0-point group with 207 patients, 1-point group with 93 patients, and 2-point group with 65 patients. The chi-square test was used for comparison of categorical data between groups. The Kaplan-Meier survival analysis and the log-rank test were used to compare the recurrence-free survival (RFS) and overall survival (OS) between groups, and the Cox regression model was used to investigate the influencing factors for RFS and OS. Results The 1-, 3-, and 5-year RFS rates of all patients were 79.2%, 49.8%, and 34.3%, respectively, with a median RFS of 35 months, while the 1-, 3-, and 5-year OS rates of all patients were 98.9%, 86.9%, and 77.3%, respectively. There were significant differences in cumulative RFS and OS rates between the patients with different levels of FIB-4, PNI, and FIB-4-PNI (RFS rate: χ2=17.890, 29.826, and 32.397, all P<0.001; OS rate: χ2=16.896, 21.070, and 26.121, all P<0.001). The multivariate Cox regression analysis showed that history of diabetes (hazard ratio [HR]=1.418, 95% confidence interval [CI]: 1.046 — 1.922, P=0.024), two tumors (HR=1.516, 95%CI: 1.094 — 2.101, P=0.012), three tumors (HR=2.146, 95%CI: 1.278 — 3.604, P=0.004), FIB-4-PNI 1 point (HR=1.875, 95%CI: 1.385 — 2.539, P<0.001), and FIB-4-PNI 2 points (HR=2.35, 95%CI: 1.706 — 3.236, P<0.001) were independent risk factors for RFS, while two tumors (HR=1.732, 95%CI: 1.005 — 2.983, P=0.048), three tumors (HR=3.511, 95%CI: 1.658 — 7.433, P=0.001), FIB-4-PNI 1 point (HR=2.094, 95%CI: 1.230 — 3.565, P=0.006), and FIB-4-PNI 2 points (HR=3.908, 95%CI: 2.306 — 6.624, P<0.001) were independent risk factors for OS. Conclusion FIB-4-PNI score can be used as an independent predictive factor for recurrence and overall survival time after RFA for early-stage HCC, and it can be combined with tumor features to predict postoperative recurrence and survival. -
Key words:
- Carcinoma, Hepatocellular /
- Radiofrequency Ablation /
- Nutrition Assessment /
- Prognosis
-
肝细胞癌(HCC)是全球第五大常见肿瘤,也是第二大癌症相关死亡原因[1]。对于巴塞罗那分期(BCLC)0期或A期的HCC患者,通常建议手术切除或射频消融(radiofrequency ablation,RFA)治疗[2]。尽管治疗后5年的中位生存率可以达到50%~70%,但复发率仍高达70%[3]。肿瘤复发是影响HCC患者预后的主要原因[4],因此探索复发的预测因素至关重要。近年研究发现,肿瘤分期、肝纤维化程度及营养状态是影响肿瘤患者复发及预后的重要因素。FIB-4是评估慢性肝病患者肝纤维化的一种有效的、无创性方法,可用于预测肝癌手术切除后复发的风险[5],但尚缺少预测肝癌RFA术后复发的相关研究。预后营养指数(prognostic nutritional index,PNI)是用于评估机体的免疫、营养状态以及肝脏的合成功能的指标。研究[6-7]显示,PNI是肝癌RFA和手术切除术后生存期的有效预测因子,但对于术后复发的预测价值评价不一。本研究旨在探讨FIB-4联合PNI对早期肝癌RFA治疗术后复发及生存期的预测价值。
1. 资料与方法
1.1 研究对象
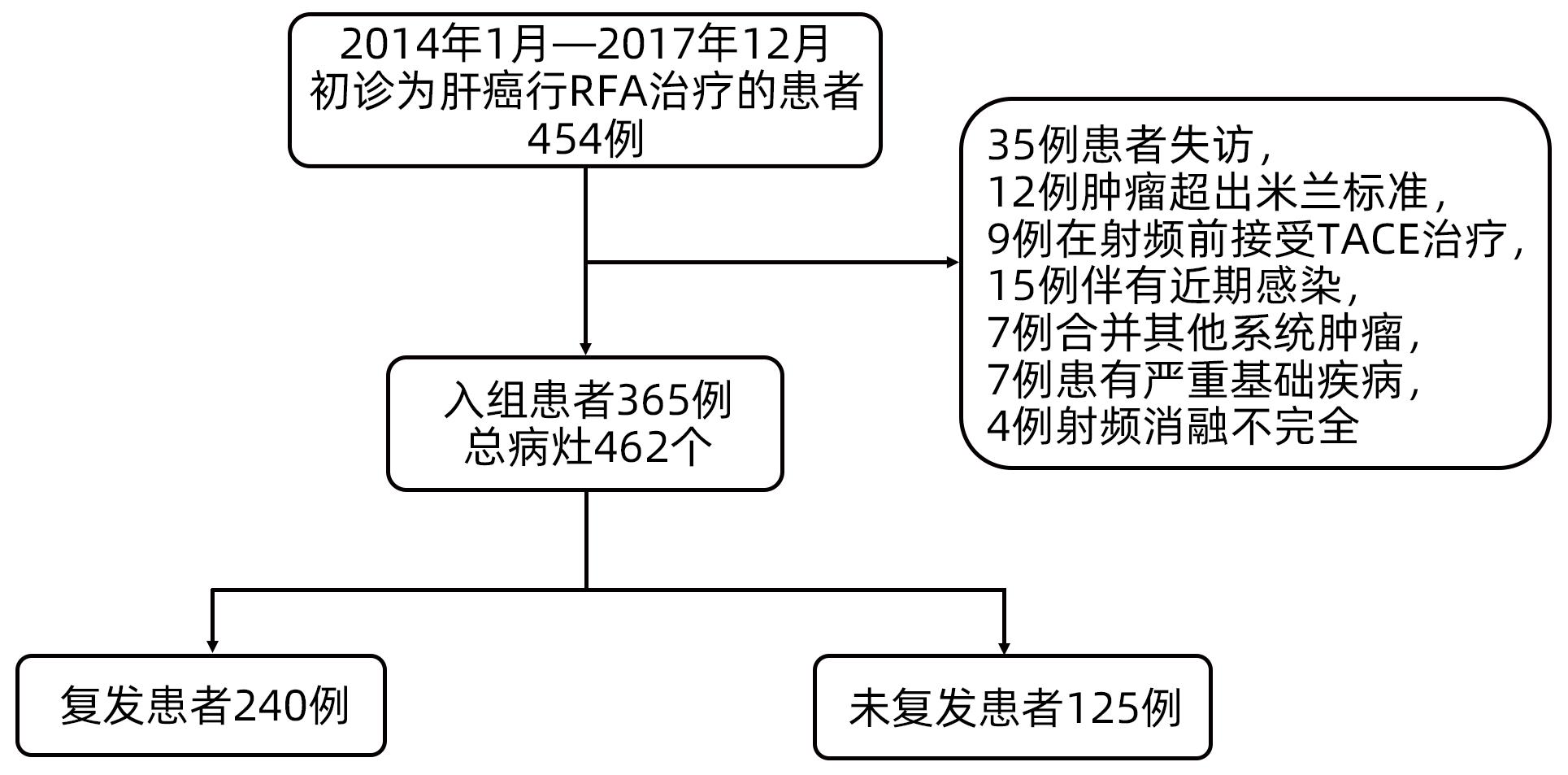
回顾性选取2014年1月—2017年12月于天津市第三中心医院首诊并初始治疗为RFA的HCC患者365例。根据《原发性肝癌诊疗规范(2019年版)》[8],所有患者均符合基于放射学或组织学基础的HCC诊断标准。纳入标准:(1)符合米兰标准(单个肿瘤直径≤5 m,或肿瘤数量≤3个,每个肿瘤的最大直径≤3 cm);(2)无肝外转移或主要血管侵犯;(3)患者术前未接受过其他抗肿瘤治疗。排除标准:(1)患者在2周内发生急性感染,(2)存在其他系统肿瘤或严重基础疾病;(3)消融不完全;(4)数据不完整(图1)。
1.2 研究方法
收集患者RFA术前基本资料,包括性别、年龄、病因学资料、病史;实验室资料:血常规、肝功能、肾功能及AFP等;影像学资料:腹部超声、超声造影、强化CT及强化MRI等。
PNI和FIB-4采用以下公式:PNI=血清Alb(g/L)+ 0.005×绝对淋巴细胞计数/mm3 [9];FIB-4=[年龄×AST(U/L)]/[血小板(×109/L)×ALT(U/L)1/2] [10]。
采用ROC曲线分析FIB-4、PNI对复发的最佳截断值,并计算FIB-4-PNI分值(表1),将患者分为3组。
表 1 FIB-4和PNI联合作为预后指标分组标准Table 1. Combination of FIB-4 and PNI as recurrence indices变量 评分(分) FIB-4 ≤6.25 0 >6.25 1 PNI ≤46.20 1 >46.20 0 FIB-4-PNI FIB-4=0和PNI=0 0 FIB-4=1和PNI=1 1 FIB-4=2和PNI=2 2 1.3 RFA治疗
术前准备及治疗程序均参照2011年《肝癌RFA治疗规范的专家共识》[11]开展。治疗采用Radionics冷循环RFA系统,频率480 kHz,射频电极长15~20 cm,裸露端长2 cm或3 cm,为带有冷循环系统的单电极。超声引导下,穿刺进入肿瘤组织,逐点进行消融治疗,消融范围应力求达到0.5 cm的安全边界。RFA治疗均由2位相同年资的主任医师共同操作完成。
1.4 术后随访
术后前2个月,每月复查腹部强化CT/MRI或超声造影,以及肝功能、肿瘤标志物等,观察肿瘤是否消融完全。2年内,每3个月复查,2年后,每半年复查。本研究的主要观察终点为肿瘤复发,次要终点为患者死亡。无复发生存期(recurrence free survival,RFS)时间定义为从RFA到首次复发或随访结束的时间。总生存期(overall survival,OS)定义为从RFA后到患者死亡或随访截止的时间。
1.5 统计学方法
采用SPSS 26.0软件进行统计学分析。采用受试者工作特征曲线(ROC曲线)分析FIB-4、PNI对复发的最佳诊断切点。计数资料组间比较采用χ2检验。采用Kaplan-Meier生存分析及Log-rank检验分析不同FIB-4-PNI等级组RFS及OS率的差异。采用Cox回归模型筛选影响患者RFS、OS的相关因素。P<0.05为差异有统计学意义。
2. 结果
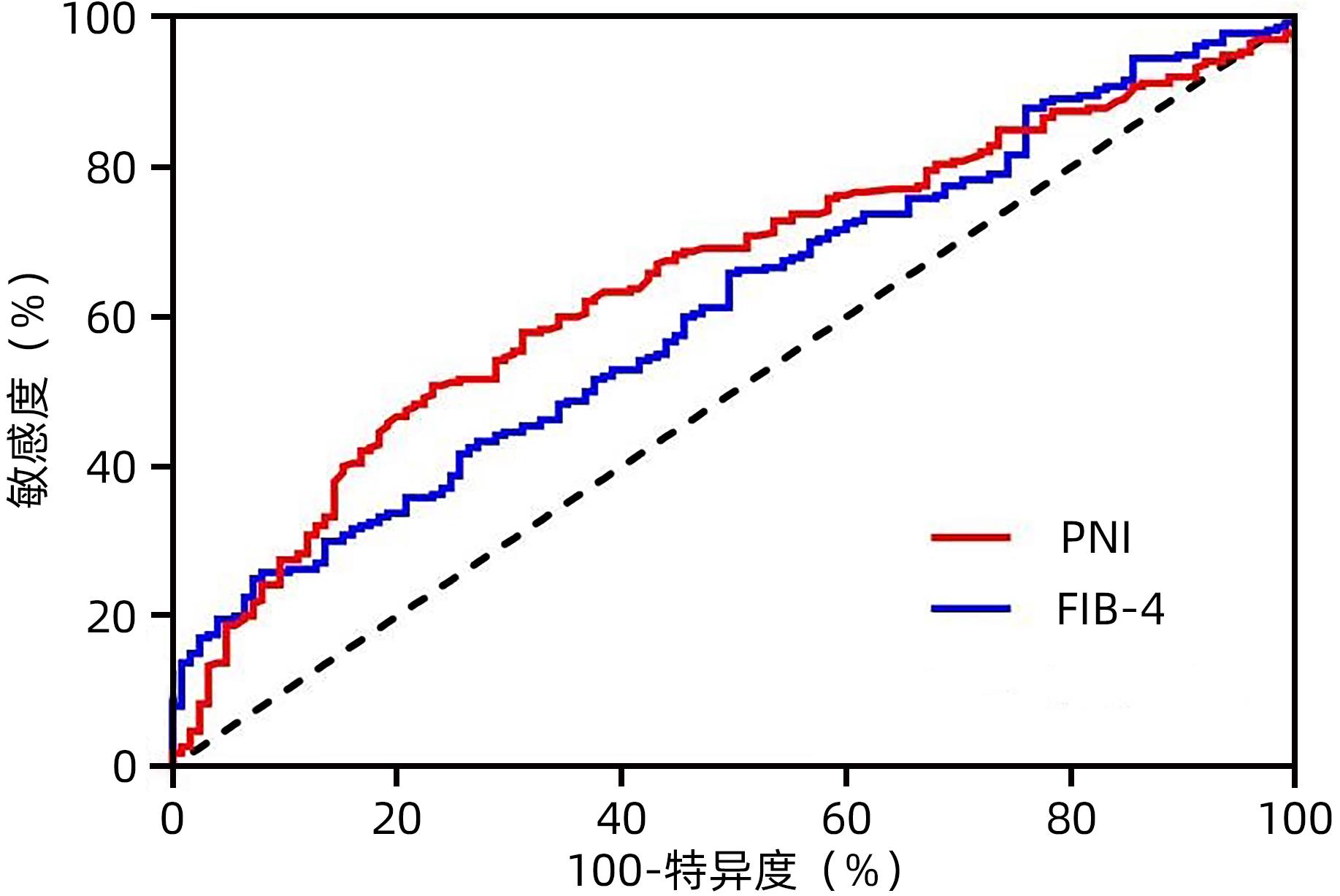
2.1 FIB-4、PNI诊断患者RFS的ROC曲线
绘制FIB-4、PNI诊断患者RFS的ROC曲线(图2),曲线下面积分别为0.610(0.551~0.669)、0.649(0.592~0.707),P值均<0.05。两者诊断RFS的cut-off值分别为6.25和46.2,由此对患者进行分级(表1)。
2.2 不同FIB-4-PNI水平组临床资料比较
不同FIB-4-PNI水平组ALT、AST、Alb、TBil、PLT、淋巴细胞计数、AFP、ALBI分级、肿瘤直径等指标差异均有统计学意义(P值均<0.05)(表2)。
表 2 不同FIB-4-PNI水平组临床资料比较Table 2. Comparison of clinical data between different FIB-4-PNI grades指标 FIB-4-PNI 0分组 (n=207) FIB-4-PNI 1分组 (n=93) FIB-4-PNI 2分组 (n=65) χ2值 P值 年龄[例(%)] 2.771 0.250 <55岁 46(22.2) 29(31.2) 17(26.2) ≥55岁 161(77.8) 64(68.8) 48(73.8) 性别[例(%)] 1.352 0.509 女 46(22.2) 26(28.0) 14(21.5) 男 161(77.8) 67(72.0) 51(78.5) 肝硬化[例(%)] 174(84.1) 91(97.8) 60(92.3) 13.373 0.001 肝癌家族史[例(%)] 28(13.5) 7(7.5) 11(16.9) 3.437 0.179 糖尿病病史[例(%)] 46(22.2) 19(20.4) 11(16.9) 0.854 0.652 肝病原因[例(%)] 6.968 0.314 乙型肝炎 170(82.1) 76(81.7) 47(72.3) 丙型肝炎 14(6.8) 10(10.8) 9(13.8) 酒精肝 13(6.3) 3(3.2) 3(4.6) 其他 10(4.8) 4(4.3) 6(9.2) ALT[例(%)] 6.708 0.035 ≤45 U/L 176(85.0) 76(81.7) 46(70.8) >45 U/L 31(15.0) 17(18.3) 19(29.2) AST[例(%)] 89.514 <0.001 ≤45 U/L 188(90.8) 78(83.9) 24(36.9) >45 U/L 19(9.2) 15(16.1) 41(63.1) Alb[例(%)] 111.260 <0.001 ≥35 g/L 207(100.0) 72(77.4) 31(47.7) <35 g/L 0(0) 21(22.6) 34(52.3) TBil[例(%)] 48.447 <0.001 ≤20 μmol/L 165(79.7) 64(68.8) 22(33.8) >20 μmol/L 42(20.3) 29(31.2) 43(66.2) PLT[例(%)] 100.611 <0.001 ≥100×109/L 160(77.3) 42(45.2) 6(9.2) <100×109/L 47(22.7) 51(54.8) 59(90.8) 淋巴细胞计数[例(%)] 76.494 <0.001 ≤1.18×109/L 63(30.4) 66(71.0) 54(83.1) >1.18×109/L 144(69.6) 27(29.0) 11(16.9) AFP[例(%)] 8.285 0.016 ≤15 ng/mL 123(59.4) 46(49.5) 26(40.0) >15 ng/mL 84(40.6) 47(50.5) 39(60.0) ALBI分级[例(%)] 229.489 <0.001 1级 191(92.3) 31(33.3) 4(6.2) 2级 16(7.7) 62(66.7) 54(83.1) 3级 0(0) 0(0) 7(10.8) 肿瘤数目[例(%)] 0.765 0.954 1个 164(79.2) 72(77.4) 51(78.5) 2个 32(15.5) 17(18.3) 10(15.4) 3个 11(5.3) 4(4.3) 4(6.2) 肿瘤直径[例(%)] 8.699 0.013 ≤2.5 cm 102(49.3) 55(59.1) 45(69.2) >2.5 cm 105(50.7) 38(40.9) 20(30.8) BCLC分期[例(%)] 2.609 0.271 0期 52(25.1) 26(28.0) 23(35.4) A期 155(74.9) 67(72.0) 42(64.6) 2.3 不同FIB-4-PNI水平患者RFS率比较
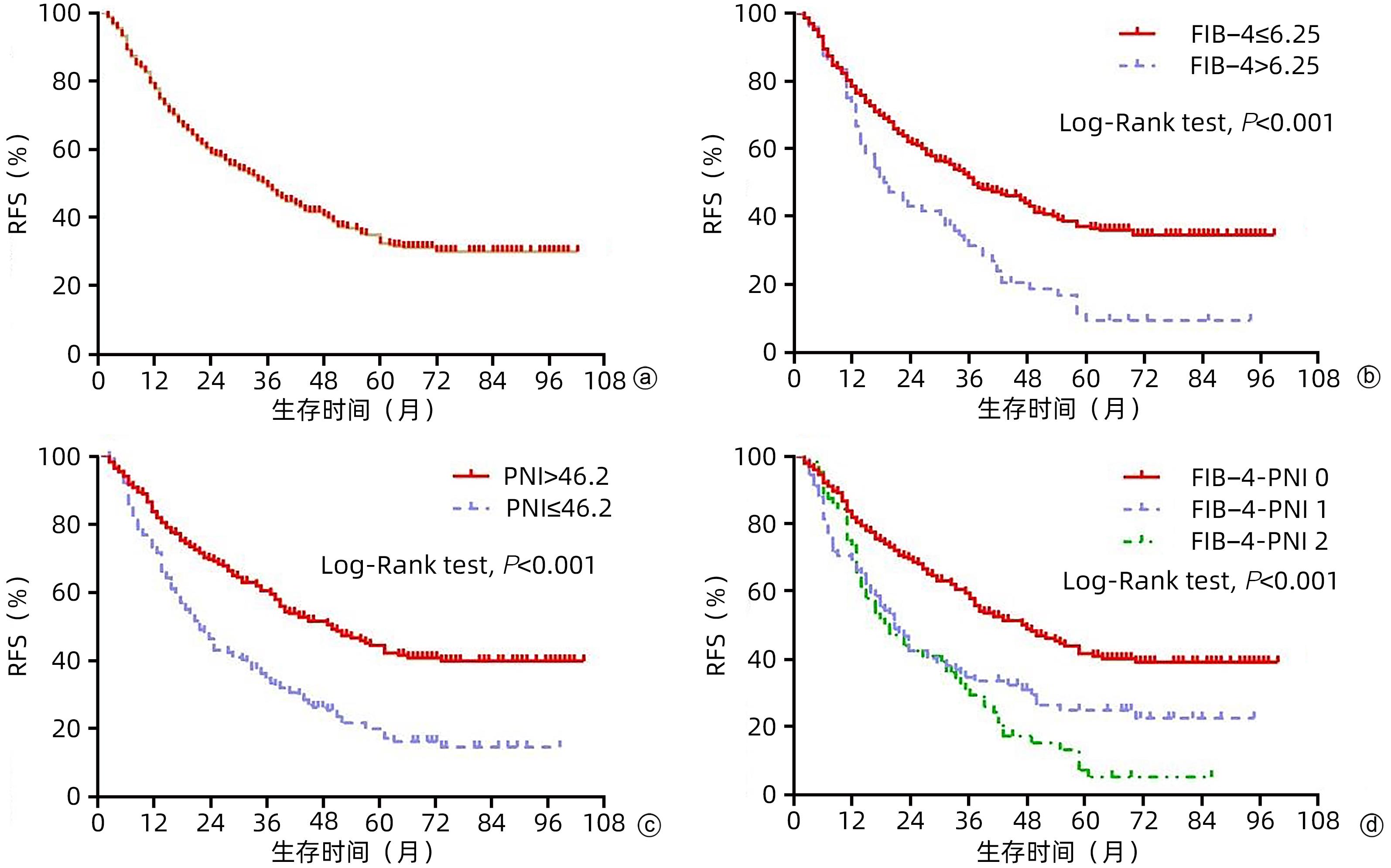
365例患者随访过程中,共240例发生肿瘤复发,中位随访时间为33(2~102)个月,所有患者的1、3和5年RFS率分别为79.2% 、49.8%和34.3%,中位RFS为35个月。低FIB-4组和高FIB-4组患者1、3、5年的RFS率分别为80.2%、53.6%、37%和73.6%、32.8%、11.2%,组间比较均有统计学差异(P值均<0.05);低PNI组和高PNI组患者1、3、5年的RFS率分别为72.8%、34.8%、17.3%和83.6%、59.4%、44.4%,组间比较均有统计学差异(P值均<0.05);FIB-4-PNI 0分组、1分组及2分组患者1、3、5年的RFS率分别为84.1%、61%、44.5%;69.9%、35.3%、25.6%和73.8%、31.7%、8%,3组患者累积RFS率组间比较均有统计学差异(P值均<0.05)(图3)。
2.4 不同FIB-4-PNI水平患者OS率比较
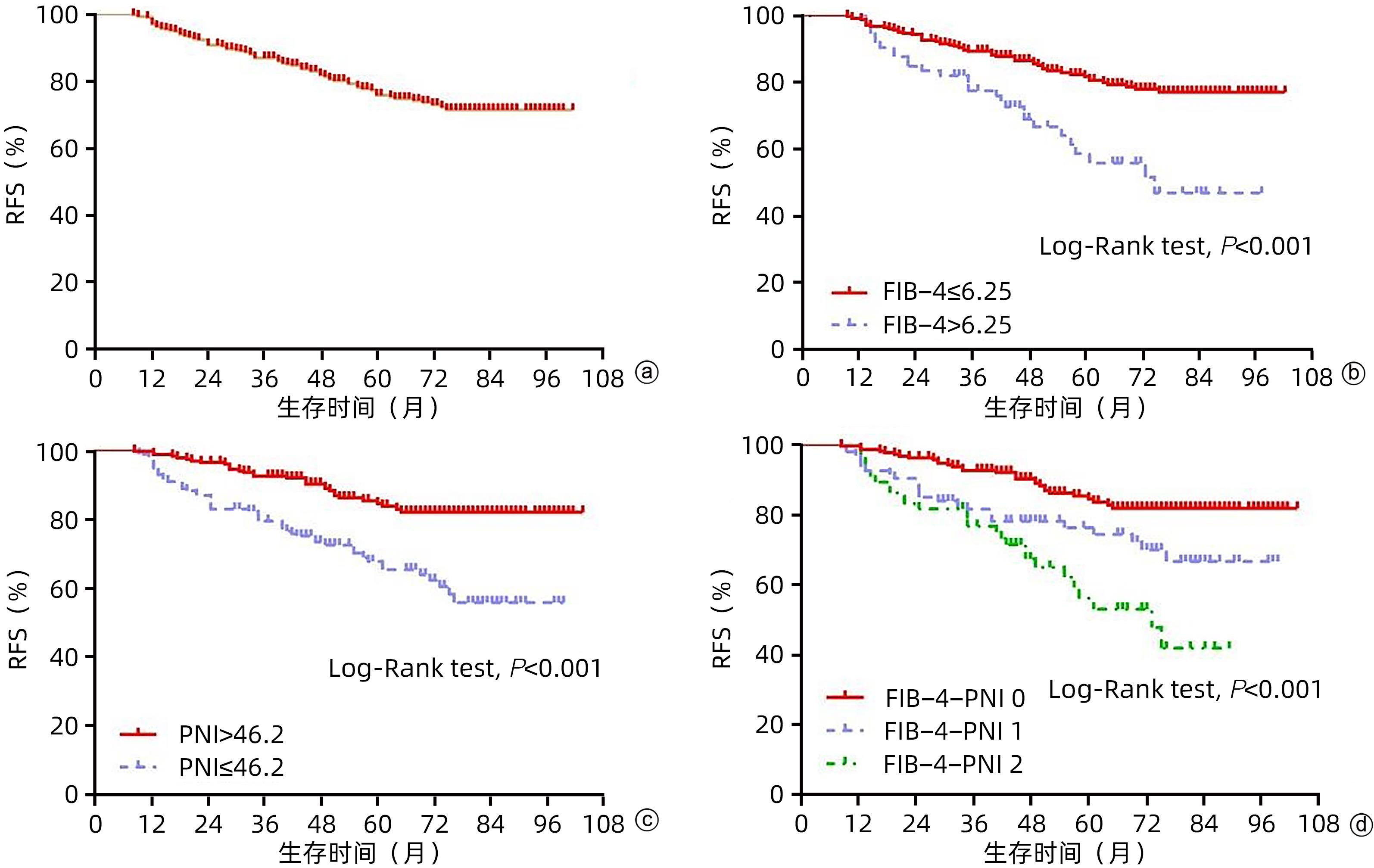
365例患者随访过程中,共82例死亡,所有患者的1、3和5年OS率分别为98.9%、86.9%和77.3%。低FIB-4组和高FIB-4组患者1、3、5年OS率分别为98.6%、89.2%、80.5%和97.2%、77.3%、55.8%,组间比较均有统计学差异(P值均<0.05);低PNI组和高PNI组患者1、3、5年OS率分别为98%、79.2%、67.5%和99.5%、92.3%、83.5%,组间比较均有统计学差异(P值均<0.05);FIB-4-PNI 0分组、1分组、2分组患者1、3、5年的OS率分别为99.5%、92.5%、83.5%;93.5%、81.4%、74.2%和96.9%、76.5%、52.8%,3组患者累积OS率组间比较均有统计学差异(P值均<0.05)(图4)。
2.5 影响患者RFS的因素分析
构建影响患者RFS的Cox回归模型(表3)。单因素分析显示,糖尿病史、ALBI分级、肿瘤数目、FIB-4-PNI分级与患者复发之间均存在明显的相关性(P值均<0.05);多因素分析结果显示,糖尿病史、肿瘤数目、FIB-4-PNI分级是RFS的独立危险因素(P值均<0.05)。即有糖尿病史患者HCC复发的风险是无糖尿病史患者的1.418倍;肿瘤数目为2、3个的患者HCC复发的风险分别是肿瘤数目为1个患者的1.516和2.146倍;FIB-4-PNI 1、2分患者发生复发的风险分别是0分患者的1.875、2.350倍。
表 3 影响患者RFS的Cox回归模型分析Table 3. Analysis of Cox proportional hazards model affecting RFS因素 单因素分析 多因素分析 HR(95%CI) χ2值 P值 HR(95%CI) χ2值 P值 年龄(<55岁/≥55岁) 1.123(0.834~1.511) 0.580 0.446 性别(女/男) 1.107(0.816~1.502) 0.426 0.514 肝硬化(无/有) 1.468(0.929~2.321) 2.704 0.100 肝病原因 1.294 0.730 乙型肝炎 1.000 丙型肝炎 0.790(0.499~1.252) 1.008 0.315 酒精肝 0.981(0.547~1.758) 0.004 0.949 其他 0.835(0.466~1.496) 0.368 0.544 肝癌家族史(无/有) 1.128(0.777~1.637) 0.401 0.527 糖尿病史(无/有) 1.392(1.029~1.882) 4.614 0.032 1.418(1.046~1.922) 5.068 0.024 AFP(≤15 ng/mL/>15 ng/mL) 1.255(0.974~1.616) 3.089 0.079 ALBI分级 22.179 <0.001 1级 1.000 2级 1.856(1.434~2.402) 22.105 <0.001 3级 1.500(0.613~3.667) 0.790 0.374 肿瘤数目 12.565 0.002 12.856 0.002 1个 1.000 1.000 2个 1.515(1.095~2.096) 6.291 0.012 1.516(1.094~2.101) 6.245 0.012 3个 2.088(1.251~3.487) 7.925 0.005 2.146(1.278~3.604) 8.340 0.004 肿瘤直径(≤2.5 cm/>2.5 cm) 1.055(0.817~1.361) 0.167 0.683 BCLC分期(0期/A期) 1.245(0.933~1.663) 2.210 0.137 FIB-4-PNI 30.337 <0.001 32.828 <0.001 0分 1.000 1.000 1分 1.764(1.306~2.384) 13.668 <0.001 1.875(1.385~2.539) 16.530 <0.001 2分 2.308(1.678~3.176) 26.395 <0.001 2.350(1.706~3.236) 27.339 <0.001 2.6 影响患者OS的风险因素分析
建立影响患者OS的Cox回归模型。单因素分析结果显示,肝硬化、AFP、ALBI分级、肿瘤数目、FIB-4-PNI分级与患者死亡呈明显相关性(P值均<0.05);多因素分析结果显示,肿瘤数目、FIB-4-PNI分级是患者死亡的独立危险因素(P值均<0.05),即肿瘤数目为2、3个的患者发生死亡的风险分别是肿瘤数目1个患者的1.732、3.511倍,FIB-4-PNI 1、2分患者发生死亡的风险分别是FIB-4-PNI 0分患者的2.094、3.908倍(表4)。
表 4 影响患者OS的Cox回归模型分析Table 4. Analysis of Cox proportional hazards model affecting OS因素 单因素分析 多因素分析 HR(95%CI) χ2值 P值 HR(95%CI) χ2值 P值 年龄(<55岁/≥55岁) 0.688(0.432~1.096) 2.481 0.115 性别(女/男) 0.884(0.538~1.452) 0.236 0.627 肝硬化(无/有) 3.188(1.006~10.099) 3.883 0.049 肝病原因 0.335 0.953 乙型肝炎 1.000 丙型肝炎 1.207(0.601~2.424) 0.281 0.596 酒精肝 1.150(0.418~3.163) 0.074 0.786 其他 1.005(0.366~2.760) 0.000 0.993 肝癌家族史(无/有) 1.247(0.689~2.255) 0.531 0.466 糖尿病史(无/有) 1.065(0.624~1.817) 0.053 0.817 AFP(≤15 ng/mL/>15 ng/mL) 1.577(1.018~2.443) 4.166 0.041 ALBI分级 18.443 <0.001 1级 1.000 2级 2.522(1.617~3.936) 16.609 <0.001 3级 3.762(1.152~12.286) 4.813 0.028 肿瘤数目 9.839 0.007 12.787 0.002 1个 1.000 1.000 2个 1.647(0.958~2.833) 3.258 0.071 1.732(1.005~2.983) 3.913 0.048 3个 2.922(1.392~6.132) 8.033 0.005 3.511(1.658~7.433) 10.768 0.001 肿瘤直径(≤2.5 cm/>2.5 cm) 1.323(0.858~2.040) 1.602 0.206 BCLC分期(0期/A期) 1.703(0.986~2.940) 3.645 0.056 FIB-4-PNI 23.400 <0.001 25.812 <0.001 0分 1.000 1.000 1分 2.060(1.211~3.504) 7.118 0.008 2.094(1.230~3.565) 7.411 0.006 2分 3.606(2.139~6.081) 23.159 <0.001 3.908(2.306~6.624) 25.640 <0.001 3. 讨论
HCC是全球最常见的恶性肿瘤之一,预后极差。对于BCLC 0期或A期的HCC患者,当前指南推荐的治疗方式为肝移植、手术切除和局部消融治疗[12]。RFA是早期HCC最常用的热消融方法之一,与肝切除术相比可以取得良好的预后[13-14]。然而,消融后的复发率很高,限制了HCC患者的长期生存。因此,明确RFA术后复发的危险因素对于制订个体化术后辅助治疗至关重要。近年来,国内外学者致力于RFA术后复发风险预测模型的研究,发现Alb/ALP比值、炎症标志物等指标对RFA术后复发均有一定的预测价值[15-16]。但考虑到ALP及由血细胞计数计算得来炎症指标临床波动较大,容易受骨骼疾病、感染等多重因素影响,稳定性欠佳。本研究主要探索无创纤维预测模型FIB-4与PNI联合对于RFA术后HCC复发及预后的预测价值。
严重肝纤维化和肝硬化是HCC的主要危险因素,高达90%的HCC病例发生在肝硬化背景下[17]。肝纤维化的严重程度与HCC复发有关。尽管肝活检仍然是评估肝纤维化程度的金标准,但由于其侵袭性和并发症风险,活检的临床应用受到限制。近期,一些基于实验室检测指标的纤维化评分也被用于评估肝纤维化或肝硬化,这些评分系统已被证明具有高重复性和可靠性。其中,FIB-4指数由ALT、AST及PLT计算得来,随着纤维化程度的进展,数值稳定升高,相较于其他指标显示出更高的准确性[18],同时,研究[19]发现FIB-4对病毒性肝炎、酒精性肝病人群发生肝癌有较好的预测价值。此外,FIB-4也与肝癌根治术后复发率及总体生存期密切相关[5, 20]。本研究中,依据cut-off值6.25将FIB-4分为高、低2个级别,FIB-4≤6.25组与FIB-4>6.25组的累积RFS及OS均存在显著差异,证实了FIB-4对于RFA术后RFS及OS的预测价值。
PNI最初被用于评估胃肠道手术患者的营养状况和预测手术风险,在1984年Onodera等[9]的研究中被证实其临床价值。此后,针对PNI进一步研究发现,该指数与不同类型实体瘤患者的预后相关。一项包含3 165例肝癌患者的荟萃分析[21]显示,低PNI者DFS和OS较差,且与更高的AFP和TNM分期相关。在早期HCC患者中,越来越多的证据表明PNI是RFA后OS的有效独立预测因素[7],但对于肿瘤复发影响的相关研究较少。PNI由Alb和淋巴细胞计数构成,Alb能够反映机体的营养状态及肝功能情况,淋巴细胞是机体免疫监视和免疫应答的重要组成成分,参与肿瘤的免疫反应,特别是在抗肿瘤增殖和转移的过程[22]。淋巴细胞浸润增加与癌症患者预后良好相关,而淋巴细胞数量减少和功能抑制可能会削弱肿瘤特异性免疫,造成利于肿瘤侵袭和转移的环境,进而影响患者预后[23]。PNI降低表示营养状态的下降或免疫功能下降,增加RFA术后复发及死亡风险。本研究中,依据cut-off值46.2将PNI分为高、低2个级别,高PNI组的HCC患者RFS与OS均明显优于低PNI组,提示营养指标是肝癌射频患者术后进展及死亡的重要风险因素。
本研究将纤维化指标及营养指标相结合对纳入人群进行分组,Kaplan-Meier生存分析显示,不同FIB-4-PNI组间的RFS及OS均存在明显差异。Cox风险模型分析显示,FIB-4-PNI评分为RFS及OS的独立预测因素,随着分值的增高,患者复发及死亡风险增高。
2型糖尿病是NAFLD和HCC的一个公认的独立危险因素[24]。研究[25]显示,2型糖尿病患者发生HCC的风险较一般人群高出2.5~4倍。本研究结果显示,合并糖尿病是RFS的独立危险因素,即有糖尿病史的患者更容易出现肿瘤复发,但对于患者OS的影响未显示有统计学差异。
此外,肿瘤数目也是影响患者RFS及OS的独立危险因素,肿瘤数目增加将增加RFA术后复发及死亡风险,研究结果与既往报道[26-27]一致,考虑可能与多发肿瘤存在肝内卫星灶的概率较大,术后更易复发。本研究未发现肿瘤大小对RFS及OS的影响,考虑本研究入组患者瘤体偏小,最大肿瘤直径仅为4.5 cm,且365例患者中存在>4 cm的肿瘤仅有12例患者,瘤体消融充分,因此术后出现原位复发及消融不完全造成肝内转移的概率较小。
本研究也存在一定的局限性。在危险因素的分析中,未将人群按术后肿瘤复发时间进行分组。有研究[26]显示,术后早期(2年内)复发与晚期(2年后)复发的复发模式不同,因此危险因素可能不同。此外,本研究对列来源为国内单中心,大多数为乙型肝炎肝硬化背景,与欧美地区肝炎被多为丙型肝炎、酒精肝、非酒精性脂肪肝等情况不同。因此,本研究仍需进一步扩大样本量,在多种肝病基础上发生的肝癌人群中进一步验证。
综上所述,本研究证实FIB-4-PNI评分作为一项简单、无创、易获取的指标,与早期肝癌RFS术后复发及预后有较好的相关性,可用于筛选及评估高危复发人群,制订早期术后管理方案。
-
表 1 FIB-4和PNI联合作为预后指标分组标准
Table 1. Combination of FIB-4 and PNI as recurrence indices
变量 评分(分) FIB-4 ≤6.25 0 >6.25 1 PNI ≤46.20 1 >46.20 0 FIB-4-PNI FIB-4=0和PNI=0 0 FIB-4=1和PNI=1 1 FIB-4=2和PNI=2 2 表 2 不同FIB-4-PNI水平组临床资料比较
Table 2. Comparison of clinical data between different FIB-4-PNI grades
指标 FIB-4-PNI 0分组 (n=207) FIB-4-PNI 1分组 (n=93) FIB-4-PNI 2分组 (n=65) χ2值 P值 年龄[例(%)] 2.771 0.250 <55岁 46(22.2) 29(31.2) 17(26.2) ≥55岁 161(77.8) 64(68.8) 48(73.8) 性别[例(%)] 1.352 0.509 女 46(22.2) 26(28.0) 14(21.5) 男 161(77.8) 67(72.0) 51(78.5) 肝硬化[例(%)] 174(84.1) 91(97.8) 60(92.3) 13.373 0.001 肝癌家族史[例(%)] 28(13.5) 7(7.5) 11(16.9) 3.437 0.179 糖尿病病史[例(%)] 46(22.2) 19(20.4) 11(16.9) 0.854 0.652 肝病原因[例(%)] 6.968 0.314 乙型肝炎 170(82.1) 76(81.7) 47(72.3) 丙型肝炎 14(6.8) 10(10.8) 9(13.8) 酒精肝 13(6.3) 3(3.2) 3(4.6) 其他 10(4.8) 4(4.3) 6(9.2) ALT[例(%)] 6.708 0.035 ≤45 U/L 176(85.0) 76(81.7) 46(70.8) >45 U/L 31(15.0) 17(18.3) 19(29.2) AST[例(%)] 89.514 <0.001 ≤45 U/L 188(90.8) 78(83.9) 24(36.9) >45 U/L 19(9.2) 15(16.1) 41(63.1) Alb[例(%)] 111.260 <0.001 ≥35 g/L 207(100.0) 72(77.4) 31(47.7) <35 g/L 0(0) 21(22.6) 34(52.3) TBil[例(%)] 48.447 <0.001 ≤20 μmol/L 165(79.7) 64(68.8) 22(33.8) >20 μmol/L 42(20.3) 29(31.2) 43(66.2) PLT[例(%)] 100.611 <0.001 ≥100×109/L 160(77.3) 42(45.2) 6(9.2) <100×109/L 47(22.7) 51(54.8) 59(90.8) 淋巴细胞计数[例(%)] 76.494 <0.001 ≤1.18×109/L 63(30.4) 66(71.0) 54(83.1) >1.18×109/L 144(69.6) 27(29.0) 11(16.9) AFP[例(%)] 8.285 0.016 ≤15 ng/mL 123(59.4) 46(49.5) 26(40.0) >15 ng/mL 84(40.6) 47(50.5) 39(60.0) ALBI分级[例(%)] 229.489 <0.001 1级 191(92.3) 31(33.3) 4(6.2) 2级 16(7.7) 62(66.7) 54(83.1) 3级 0(0) 0(0) 7(10.8) 肿瘤数目[例(%)] 0.765 0.954 1个 164(79.2) 72(77.4) 51(78.5) 2个 32(15.5) 17(18.3) 10(15.4) 3个 11(5.3) 4(4.3) 4(6.2) 肿瘤直径[例(%)] 8.699 0.013 ≤2.5 cm 102(49.3) 55(59.1) 45(69.2) >2.5 cm 105(50.7) 38(40.9) 20(30.8) BCLC分期[例(%)] 2.609 0.271 0期 52(25.1) 26(28.0) 23(35.4) A期 155(74.9) 67(72.0) 42(64.6) 表 3 影响患者RFS的Cox回归模型分析
Table 3. Analysis of Cox proportional hazards model affecting RFS
因素 单因素分析 多因素分析 HR(95%CI) χ2值 P值 HR(95%CI) χ2值 P值 年龄(<55岁/≥55岁) 1.123(0.834~1.511) 0.580 0.446 性别(女/男) 1.107(0.816~1.502) 0.426 0.514 肝硬化(无/有) 1.468(0.929~2.321) 2.704 0.100 肝病原因 1.294 0.730 乙型肝炎 1.000 丙型肝炎 0.790(0.499~1.252) 1.008 0.315 酒精肝 0.981(0.547~1.758) 0.004 0.949 其他 0.835(0.466~1.496) 0.368 0.544 肝癌家族史(无/有) 1.128(0.777~1.637) 0.401 0.527 糖尿病史(无/有) 1.392(1.029~1.882) 4.614 0.032 1.418(1.046~1.922) 5.068 0.024 AFP(≤15 ng/mL/>15 ng/mL) 1.255(0.974~1.616) 3.089 0.079 ALBI分级 22.179 <0.001 1级 1.000 2级 1.856(1.434~2.402) 22.105 <0.001 3级 1.500(0.613~3.667) 0.790 0.374 肿瘤数目 12.565 0.002 12.856 0.002 1个 1.000 1.000 2个 1.515(1.095~2.096) 6.291 0.012 1.516(1.094~2.101) 6.245 0.012 3个 2.088(1.251~3.487) 7.925 0.005 2.146(1.278~3.604) 8.340 0.004 肿瘤直径(≤2.5 cm/>2.5 cm) 1.055(0.817~1.361) 0.167 0.683 BCLC分期(0期/A期) 1.245(0.933~1.663) 2.210 0.137 FIB-4-PNI 30.337 <0.001 32.828 <0.001 0分 1.000 1.000 1分 1.764(1.306~2.384) 13.668 <0.001 1.875(1.385~2.539) 16.530 <0.001 2分 2.308(1.678~3.176) 26.395 <0.001 2.350(1.706~3.236) 27.339 <0.001 表 4 影响患者OS的Cox回归模型分析
Table 4. Analysis of Cox proportional hazards model affecting OS
因素 单因素分析 多因素分析 HR(95%CI) χ2值 P值 HR(95%CI) χ2值 P值 年龄(<55岁/≥55岁) 0.688(0.432~1.096) 2.481 0.115 性别(女/男) 0.884(0.538~1.452) 0.236 0.627 肝硬化(无/有) 3.188(1.006~10.099) 3.883 0.049 肝病原因 0.335 0.953 乙型肝炎 1.000 丙型肝炎 1.207(0.601~2.424) 0.281 0.596 酒精肝 1.150(0.418~3.163) 0.074 0.786 其他 1.005(0.366~2.760) 0.000 0.993 肝癌家族史(无/有) 1.247(0.689~2.255) 0.531 0.466 糖尿病史(无/有) 1.065(0.624~1.817) 0.053 0.817 AFP(≤15 ng/mL/>15 ng/mL) 1.577(1.018~2.443) 4.166 0.041 ALBI分级 18.443 <0.001 1级 1.000 2级 2.522(1.617~3.936) 16.609 <0.001 3级 3.762(1.152~12.286) 4.813 0.028 肿瘤数目 9.839 0.007 12.787 0.002 1个 1.000 1.000 2个 1.647(0.958~2.833) 3.258 0.071 1.732(1.005~2.983) 3.913 0.048 3个 2.922(1.392~6.132) 8.033 0.005 3.511(1.658~7.433) 10.768 0.001 肿瘤直径(≤2.5 cm/>2.5 cm) 1.323(0.858~2.040) 1.602 0.206 BCLC分期(0期/A期) 1.703(0.986~2.940) 3.645 0.056 FIB-4-PNI 23.400 <0.001 25.812 <0.001 0分 1.000 1.000 1分 2.060(1.211~3.504) 7.118 0.008 2.094(1.230~3.565) 7.411 0.006 2分 3.606(2.139~6.081) 23.159 <0.001 3.908(2.306~6.624) 25.640 <0.001 -
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68( 6): 394- 424. DOI: 10.3322/caac.21492. [2] YANG JD, HAINAUT P, GORES GJ, et al. A global view of hepatocellular carcinoma: Trends, risk, prevention and management[J]. Nat Rev Gastroenterol Hepatol, 2019, 16( 10): 589- 604. DOI: 10.1038/s41575-019-0186-y. [3] FENG K, YAN J, LI XW, et al. A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma[J]. J Hepatol, 2012, 57( 4): 794- 802. DOI: 10.1016/j.jhep.2012.05.007. [4] DHIR M, MELIN AA, DOUAIHER J, et al. A review and update of treatment options and controversies in the management of hepatocellular carcinoma[J]. Ann Surg, 2016, 263( 6): 1112- 1125. DOI: 10.1097/SLA.0000000000001556. [5] TSAI MY, YEN YH, HUANG PY, et al. The pre- and postoperative FIB-4 indexes are good predictors to the outcomes of HBV-related HCC patients after resection[J]. Gastroenterol Res Pract, 2019, 2019: 8945798. DOI: 10.1155/2019/8945798. [6] SAITO Y, IMURA S, MORINE Y, et al. Preoperative prognostic nutritional index predicts short- and long-term outcomes after liver resection in patients with hepatocellular carcinoma[J]. Oncol Lett, 2021, 21( 2): 153. DOI: 10.3892/ol.2020.12414. [7] CHU MO, SHEN CH, CHANG TS, et al. Pretreatment inflammation-based markers predict survival outcomes in patients with early stage hepatocellular carcinoma after radiofrequency ablation[J]. Sci Rep, 2018, 8( 1): 16611. DOI: 10.1038/s41598-018-34543-z. [8] General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer(2022 edition)[J]. J Clin Hepatol, 2022, 38( 2): 288- 303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38( 2): 288- 303. DOI: 10.3969/j.issn.1001-5256.2022.02.009. [9] ONODERA T, GOSEKI N, KOSAKI G. Prognostic nutritional index in gastrointestinal surgery of malnourished cancer patients[J]. Nihon Geka Gakkai Zasshi, 1984, 85( 9): 1001- 1005. [10] STERLING RK, LISSEN E, CLUMECK N, et al. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection[J]. Hepatology, 2006, 43( 6): 1317- 1325. DOI: 10.1002/hep.21178. [11] Chinese Expert Consensus Statement Chinese Society of Liver Cancer CSLC, Chinese Society of Clinical Oncology CSCO, Liver Cancer Group, Chinese Society of Hepatology. Guidelines for radiofrequency ablation therapy of liver cancer[J]. J Clin Hepatol, 2011, 27( 3): 236- 238, 244.中国抗癌协会肝癌专业委员会, 中国抗癌协会临床肿瘤学协作委员会, 中华医学会肝病学分会肝癌学组. 肝癌射频消融治疗规范的专家共识[J]. 临床肝胆病杂志, 2011, 27( 3): 236- 238, 244. [12] KULIK L, EL-SERAG HB. Epidemiology and management of hepatocellular carcinoma[J]. Gastroenterology, 2019, 156( 2): 477- 491. e 1. DOI: 10.1053/j.gastro.2018.08.065. [13] WEI CY, CHAU GY, CHEN PH, et al. A comparison of prognoses between surgical resection and radiofrequency ablation therapy for patients with hepatocellular carcinoma and esophagogastric varices[J]. Sci Rep, 2020, 10( 1): 17259. DOI: 10.1038/s41598-020-74424-y. [14] GUPTA P, MARALAKUNTE M, KUMAR-M P, et al. Overall survival and local recurrence following RFA, MWA, and cryoablation of very early and early HCC: A systematic review and Bayesian network meta-analysis[J]. Eur Radiol, 2021, 31( 7): 5400- 5408. DOI: 10.1007/s00330-020-07610-1. [15] ZHANG F, LU SX, HU KS, et al. Albumin-to-alkaline phosphatase ratio as a predictor of tumor recurrence and prognosis in patients with early-stage hepatocellular carcinoma undergoing radiofrequency ablation as initial therapy[J]. Int J Hyperthermia, 2021, 38( 1): 1- 10. DOI: 10.1080/02656736.2020.1850885. [16] CHU WK, WU X, ZHANG P, et al. Value of inflammatory biomarkers in predicting the prognosis of early small hepatocellular carcinoma after radiofre-quency ablation[J]. J Clin Hepatol, 2022, 38( 4): 843- 850. DOI: 10.3969/j.issn.1001-5256.2022.04.020.楚伟可, 吴雪, 张鹏, 等. 炎症标志物对早期小肝癌行射频消融术预后的预测价值[J]. 临床肝胆病杂志, 2022, 38( 4): 843- 850. DOI: 10.3969/j.issn.1001-5256.2022.04.020. [17] O’ROURKE JM, SAGAR VM, SHAH T, et al. Carcinogenesis on the background of liver fibrosis: Implications for the management of hepatocellular cancer[J]. World J Gastroenterol, 2018, 24( 39): 4436- 4447. DOI: 10.3748/wjg.v24.i39.4436. [18] KIM MN, LEE JH, CHON YE, et al. Fibrosis-4, aspartate transaminase-to-platelet ratio index, and gamma-glutamyl transpeptidase-to-platelet ratio for risk assessment of hepatocellular carcinoma in chronic hepatitis B patients: Comparison with liver biopsy[J]. Eur J Gastroenterol Hepatol, 2020, 32( 3): 433- 439. DOI: 10.1097/MEG.0000000000001520. [19] XU XL, JIANG LS, WU CS, et al. The role of fibrosis index FIB-4 in predicting liver fibrosis stage and clinical prognosis: A diagnostic or screening tool?[J]. J Formos Med Assoc, 2022, 121( 2): 454- 466. DOI: 10.1016/j.jfma.2021.07.013. [20] ZHANG Y, WANG R, YANG XJ. FIB-4 index serves as a noninvasive prognostic biomarker in patients with hepatocellular carcinoma: A meta-analysis[J]. Medicine, 2018, 97( 51): e13696. DOI: 10.1097/MD.0000000000013696. [21] EDITORS PLOS ONE. Retraction: The prognostic value of prognostic nutritional index in hepatocellular carcinoma patients: A meta-analysis of observational studies[J]. PLoS One, 2022, 17( 8): e0273618. DOI: 10.1371/journal.pone.0273618. [22] NAJAFI M, FARHOOD B, MORTEZAEE K. Contribution of regulatory T cells to cancer: A review[J]. J Cell Physiol, 2019, 234( 6): 7983- 7993. DOI: 10.1002/jcp.27553. [23] CHEN Y, YANG Y, ZHANG XY, et al. Nomogram based on neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio to predict recurrence in patients with hepatocellular carcinoma after radiofrequency ablation[J]. Cardiovasc Intervent Radiol, 2021, 44( 10): 1551- 1560. DOI: 10.1007/s00270-021-02872-8. [24] ZHANG CY, LIU S, YANG M. Hepatocellular carcinoma and obesity, type 2 diabetes mellitus, cardiovascular disease: Causing factors, molecular links, and treatment options[J]. Front Endocrinol, 2021, 12: 808526. DOI: 10.3389/fendo.2021.808526. [25] PEARSON-STUTTARD J, PAPADIMITRIOU N, MARKOZANNES G, et al. Type 2 diabetes and cancer: An umbrella review of observational and Mendelian randomization studies[J]. Cancer Epidemiol Biomarkers Prev, 2021, 30( 6): 1218- 1228. DOI: 10.1158/1055-9965.EPI-20-1245. [26] XU XF, XING H, HAN J, et al. Risk factors, patterns, and outcomes of late recurrence after liver resection for hepatocellular carcinoma: A multicenter study from China[J]. JAMA Surg, 2019, 154( 3): 209- 217. DOI: 10.1001/jamasurg.2018.4334. [27] LEE HA, LEE YS, KIM BK, et al. Change in the recurrence pattern and predictors over time after complete cure of hepatocellular carcinoma[J]. Gut Liver, 2021, 15( 3): 420- 429. DOI: 10.5009/gnl20101. 期刊类型引用(2)
1. 陈培升,林泽毅,覃柯璋,邓钰城. 术前血清热休克蛋白90α水平联合预后营养指数对肝细胞癌经动脉化疗栓塞后的预后预测价值. 中国普外基础与临床杂志. 2025(03): 319-324 .  百度学术
百度学术2. 余鸿,谷申森. 肝癌患者术前营养风险评估及营养干预对体成分的影响. 感染、炎症、修复. 2024(02): 140-142+152 .  百度学术
百度学术其他类型引用(3)
-




 PDF下载 ( 1118 KB)
PDF下载 ( 1118 KB)


 下载:
下载:



 下载:
下载:
 百度学术
百度学术





