经治慢性乙型肝炎患者低病毒血症发生率和影响因素的Meta分析
DOI: 10.12449/JCH240709
Incidence rate of low-level viremia and related influencing factors in treatment-experienced chronic hepatitis B patients: A Meta-analysis
-
摘要:
目的 系统评价慢性乙型肝炎(CHB)患者低病毒血症(LLV)的发生率及其影响因素,为临床有效干预和预防LLV的发生提供循证医学证据。 方法 本研究根据PRISMA指南完成,PROSPERO注册号:CRD42023455304。计算机检索中国知网、万方数据库、维普、中国生物医学文献服务系统、PubMed、Embase、Web of Science、Cochrane Library中有关CHB患者LLV发生及影响因素的观察性研究,检索时间为建库至2023年7月21日。应用Stata 16.0软件进行Meta分析。 结果 共纳入文献12篇,总样本量3 408例,包括LLV患者1 181例。Meta分析结果显示,经治CHB患者LLV发生率为32.8%(95%CI:27.6%~38.3%);HBsAg定量高(OR=2.107,95%CI:1.782~2.491,P<0.001)、HBeAg阳性(OR=3.258,95%CI:2.629~4.038,P<0.001)、高基线HBV DNA水平(OR=1.286,95%CI:1.157~1.430,P<0.001)及有恩替卡韦治疗史(OR=3.089,95%CI:1.880~5.074,P<0.001)是LLV发生的危险因素;抗病毒时间≥3年(OR=0.175,95%CI:0.093~0.331,P<0.001)和高基线ALT水平(OR=0.985,95%CI:0.978~0.992,P<0.001)是LLV的保护因素。敏感性分析显示效应值未发生明显变化,提示Meta分析结果相对稳定。纳入研究漏斗图基本对称,Egger’s检验和Begg’s检验结果提示纳入文献不存在明显发表偏倚。 结论 临床医生应根据LLV的影响因素,综合临床证据有效指导决策,降低远期临床风险,避免不良结局。 Abstract:Objective To systematically evaluate the incidence rate of low-level viremia (LLV) in chronic hepatitis B (CHB) patients and related influencing factors, and to provide evidence-based medicine evidence for effective intervention and prevention of LLV in clinical practice. Methods This study was conducted according to the PRISMA guideline, with a PROSPERO registration number of CRD42023455304. CNKI, Wanfang Data, VIP, SinoMed, PubMed, Embase, Web of Science, and the Cochrane library were searched for observational studies on LLV and related influencing factors in CHB patients published up to July 21, 2023. Stata 16.0 software was used to perform the meta-analysis. Results A total of 12 articles were included, with a total sample size of 3408 cases, among whom there were 1181 patients with LLV. The meta-analysis showed that the incidence rate of LLV was 32.8% (95% confidence interval [CI]: 27.6% — 38.3%) in treatment-experienced CHB patients. High HBsAg quantification (odds ratio [OR]=2.107, 95%CI: 1.782 — 2.491, P<0.001), positive HBeAg (OR=3.258, 95%CI: 2.629 — 4.038, P<0.001), high HBV DNA level at baseline (OR=1.286, 95%CI: 1.157 — 1.430, P<0.001), and history of entecavir treatment (OR=3.089, 95%CI: 1.880 — 5.074, P<0.001) were risk factors for LLV; duration of antiviral therapy ≥3 years (OR=0.175, 95%CI: 0.093 — 0.331, P<0.001) and high alanine aminotransferase level at baseline (OR=0.985, 95%CI: 0.978 — 0.992, P<0.001) were protective factors against LLV. The sensitivity analysis showed no significant change in effective value, suggesting that the results of the meta-analysis were relatively stable. The funnel plot of the studies included was basically symmetrical, and the results of the Egger’s test and the Begg’s test suggested that there was no obvious publication bias in the articles included. Conclusion Clinicians should guide decision making based on the influencing factors for LLV and related clinical evidence, so as to reduce long-term clinical risks and avoid adverse outcomes. -
Key words:
- Hepatitis B, Chronic /
- Low Level Viremia /
- Meta-Analysis
-
据世界卫生组织估计,2019年慢性HBV感染者有2.96亿,因乙型肝炎相关肝硬化和癌症死亡人数82万。尽管疫苗接种和预防支持降低了HBV感染发病率,但每年仍有150万新发HBV感染者[1]。我国一般人群HBsAg流行率约为6.89%,慢性HBV感染者超过8 000万例[2]。血清HBV DNA病毒载量是影响预后的重要因素[3-5],最大限度地长期抑制HBV复制,减轻肝细胞炎症坏死及肝纤维化,延缓和减少相关并发症,改善患者生命质量,延长其生存时间是慢性乙型肝炎(CHB)抗病毒治疗的目标[6-7]。恩替卡韦(ETV)、富马酸替诺福韦酯(TDF)和富马酸丙酚替诺福韦(TAF)因其抗病毒作用强、耐药性低、副作用小等优势已作为一线用药在临床广泛应用。经过48周的抗病毒治疗,50%~80%的患者可以实现完全病毒学应答,但仍有10%~45%的患者存在持续或间歇低病毒血症(low level viremia,LLV)[8]。LLV是指排除依从性问题及病毒耐药突变,经过48周规范一线抗病毒药物治疗后,使用灵敏qPCR法(检测下限为20 IU/mL或10 IU/mL)仍可检测到,但<2 000 IU/mL[9]。研究[10]表明,持续的低病毒载量可以加速肝纤维化进程,是肝细胞癌发生及复发的危险因素[11-12]。因此,了解CHB患者LLV发生率及其影响因素,是减少并发症发生,改善患者预后,提高生存质量,进一步针对患者制订个体化治疗方案的重要环节,对实现“2030计划”消除病毒性肝炎损害的目标具有重要意义。证据是临床决策的核心,高质量的证据能为临床工作者提供有价值的参考[13]。但是,目前关于CHB患者LLV发生率及影响因素的报告证据分散,且差异性较大,不利于指导临床决策。故本研究旨在通过Meta分析的方法将现有临床证据进行定量分析,对经治CHB患者LLV的发生率及影响因素进行探讨,综合现有证据,为优化个性化治疗方案、有效干预和预防LLV的发生提供循证医学证据。
1. 资料与方法
1.1 规程与注册
本研究根据PRISMA指南完成,PROSPERO注册号:CRD42023455304。
1.2 检索策略
计算机检索中国知网、万方数据库、维普网、中国生物医学文献服务系统、PubMed、Embase、Web of Science、Cochrane Library数据库。检索时间为建库至2023年7月21日。检索方式为主题词和自由词相结合。中文检索词为“乙肝”“乙型肝炎”“乙型病毒性肝炎”“慢乙肝”“慢性乙型肝炎”“慢性乙型病毒性肝炎”“低病毒血症”“低病毒载量”“影响因素”“危险因素”。英文检索词为“hepatitis B”“low level viremia”“hypoviremia”“risk factor”“influencing factor”。
1.3 文献纳入与排除标准
1.3.1 纳入标准
(1)研究类型:队列研究、横断面研究和病例对照研究;(2)研究地点为中国,研究对象为中国人群,符合乙型肝炎诊断标准且抗病毒疗程至少为48周;(3)研究结局为LLV的发生;(4)语言限定为中、英文文献。
1.3.2 排除标准
(1)研究对象合并其他任意疾病(如艾滋病、丙型肝炎、肝癌等);(2)综述类文献;(3)数据无法提取;(4)无法获取全文的文献;(5)重复发表文献。
1.4 文献筛选及数据提取
由两名研究者严格按照检索策略和纳排标准独立进行文献检索、文献筛选及数据提取。主要提取内容包括:第一作者、发表年份、研究类型、研究地点、地理区域、样本量、LLV发生例数、多因素分析中的影响因素等。如遇分歧,由两名研究者讨论决定,协商不一致时,由第三名研究者决定。
1.5 文献质量评价
对纳入文献进行质量评价。队列研究和病例对照研究使用纽卡斯尔-渥太华质量评估量表进行评价,评分0~3分为低质量文献,4~6分为中等质量文献,7~9分为较高质量文献;横断面研究使用美国卫生保健质量和研究机构评价量表进行评价,条目中“是”计1分,“否”或“不清楚”计0分,总分0~3分为低质量文献,4~7分为中等质量文献,8~11分为高质量文献[14]。文献质量评价亦由两名研究者独立进行,如遇分歧讨论决定,不能统一时由第三方决定。
1.6 统计学方法
应用Stata 16.0软件进行Meta分析。影响因素采用比值比(OR)及95%可信区间(95%CI)合并效应量。采用Q检验及I2统计量评估纳入研究的异质性大小,若I2≤50%、P≥0.10,提示各研究间无明显异质性,采用固定效应模型进行Meta分析;若I2>50%、P<0.10,提示各研究间异质性较大,采用随机效应模型进行Meta分析,并通过亚组分析、敏感性分析以寻找异质性来源。当影响因素研究数量低于2篇或数据不能进行合并时,对结果进行描述性分析。将纳入文献数量≥10篇的研究结果使用Egger’s检验和Begg’s检验进行发表偏倚评估,并绘制漏斗图。P<0.05为差异有统计学意义。
2. 结果
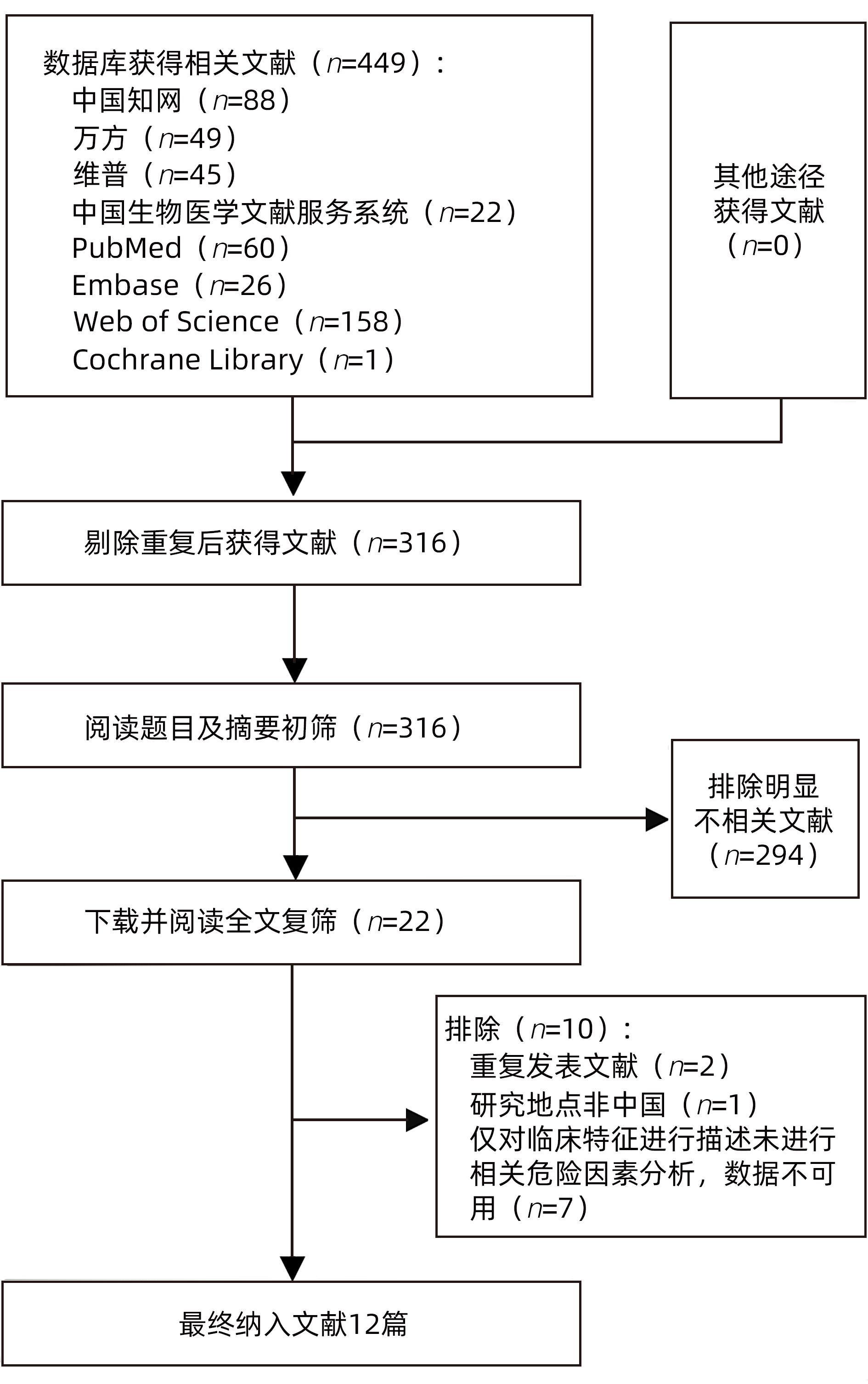
2.1 文献检索结果
初步检索共获得文献449篇,经过文献筛选后,最终纳入文献12篇[15-26],文献筛选流程见图1。总样本量3 408例,包括LLV患者1 181例。4篇为高质量文献,余8篇为中等质量文献。12篇文献共提取HBeAg阳性、既往或目前使用非一线核苷(酸)类似物(NAs)抗病毒药、高基线HBV DNA水平等16个影响因素,结果见表1。
表 1 纳入文献基本特征及质量评价结果Table 1. Basic characteristics and quality evaluation results纳入文献 年份 研究类型 研究地点 地理区域 LLV(例) 总样本量(例) 影响因素 质量评价 危险 保护 评分 分级 张玉容[15] 2021 横断面 福建 南方 35 86 ①② ⑭ 6 中 杨雪芳等[16] 2023 横断面 云南 南方 55 121 ①③④ 6 中 宣碧碧等[17] 2022 横断面 山东 北方 173 417 ① ⑭⑮ 9 高 李光海等[18] 2023 横断面 海南 南方 101 322 ①⑥⑦ ⑬⑯ 5 中 漆江红[19] 2022 横断面 甘肃 北方 84 223 ①③⑥ 5 中 李彤等[20] 2023 横断面 甘肃 北方 189 509 ①③⑥⑧⑨ ⑪⑫ 7 中 黄永栩等[21] 2023 横断面 广东 南方 40 260 ①③⑦ 7 中 程齐齐等[22] 2022 横断面 江西 南方 20 78 ③⑥ ⑪ 6 中 陈贺等[23] 2021 横断面 江苏 南方 204 560 ①③⑥ 5 中 Lu等[24] 2022 病例对照 广东 南方 139 278 ①⑥ 5 中 Li等[25] 2023 队列 江苏 南方 90 394 ①⑤⑩ 7 高 Han等[26] 2023 横断面 上海 南方 51 160 ①⑧ ⑭ 7 中 注:①HBeAg阳性;②既往或目前使用非一线NAs类抗病毒药物;③基线HBV DNA水平高;④使用二线抗病毒药物;⑤HBV DNA水平≥1.0×108 IU/mL;⑥HBsAg定量高;⑦治疗期间依从性差;⑧ETV治疗史;⑨高HBeAg水平;⑩抗-HBc水平<3 log10 IU/mL;⑪基线ALT水平高;⑫治疗中HBV DNA水平下降幅度大;⑬治疗期间依从性好;⑭抗病毒治疗时间≥3年;⑮2年≤抗病毒治疗时间<3年;⑯基线HBV DNA水平低。 2.2 LLV发生率的Meta分析
2.2.1 发病率
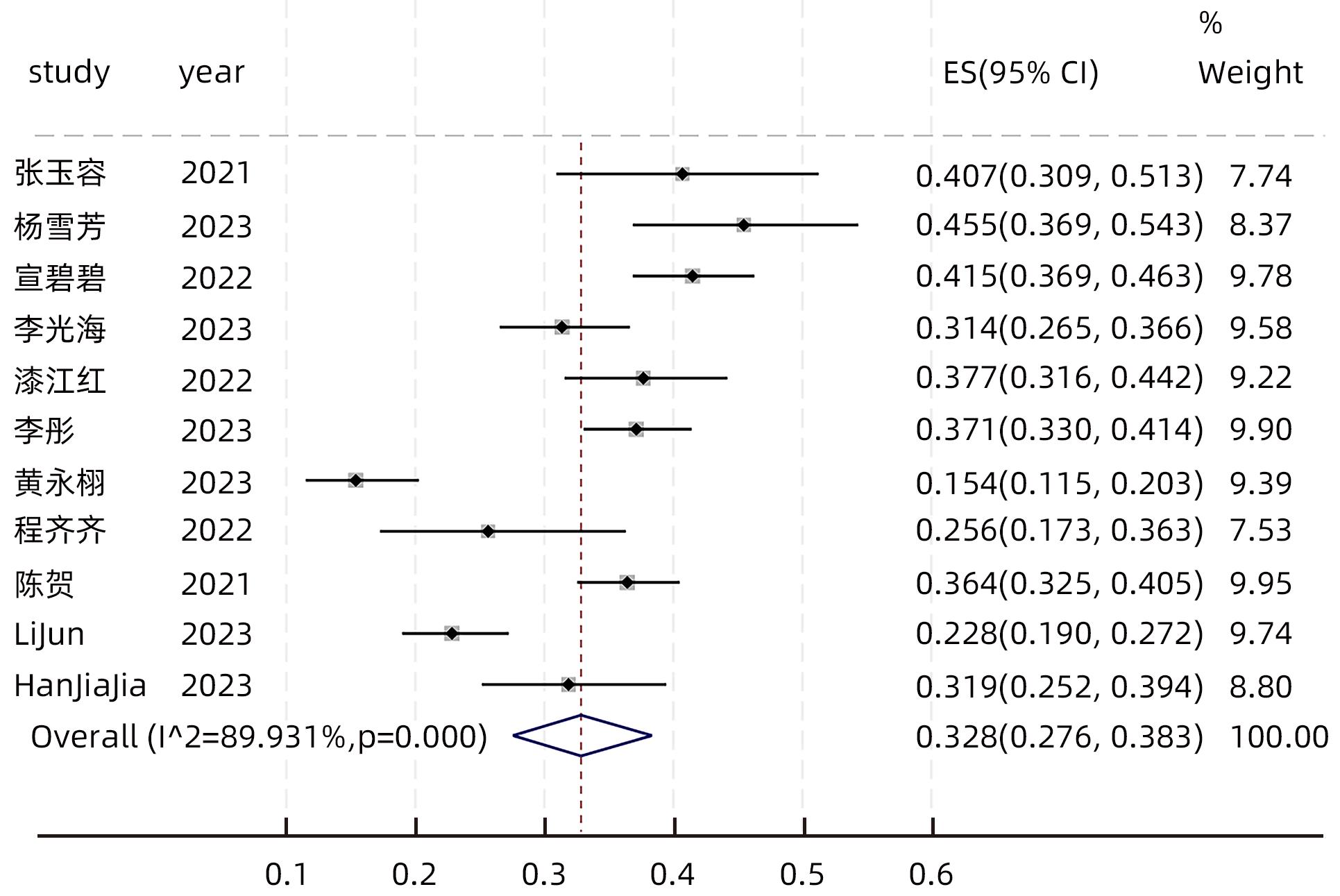
11篇文献[15-23,25-26]对LLV发生率进行了研究。异质性检验显示各研究间存在明显异质性(I2=89.931%,P<0.001),故采用随机效应模型分析。结果显示,中国CHB患者LLV的发生率为32.8%(95%CI:27.6%~38.3%)(图2)。
2.2.2 亚组分析
将纳入研究[15-23,25-26]按照研究地理区域(南方/北方)进行亚组分析。结果显示,南方和北方CHB患者LLV发生率分别为38.8%(95%CI:36.0%~41.6%)、28.4%(26.4%~30.3%)(表2)。
2.2.3 敏感性分析
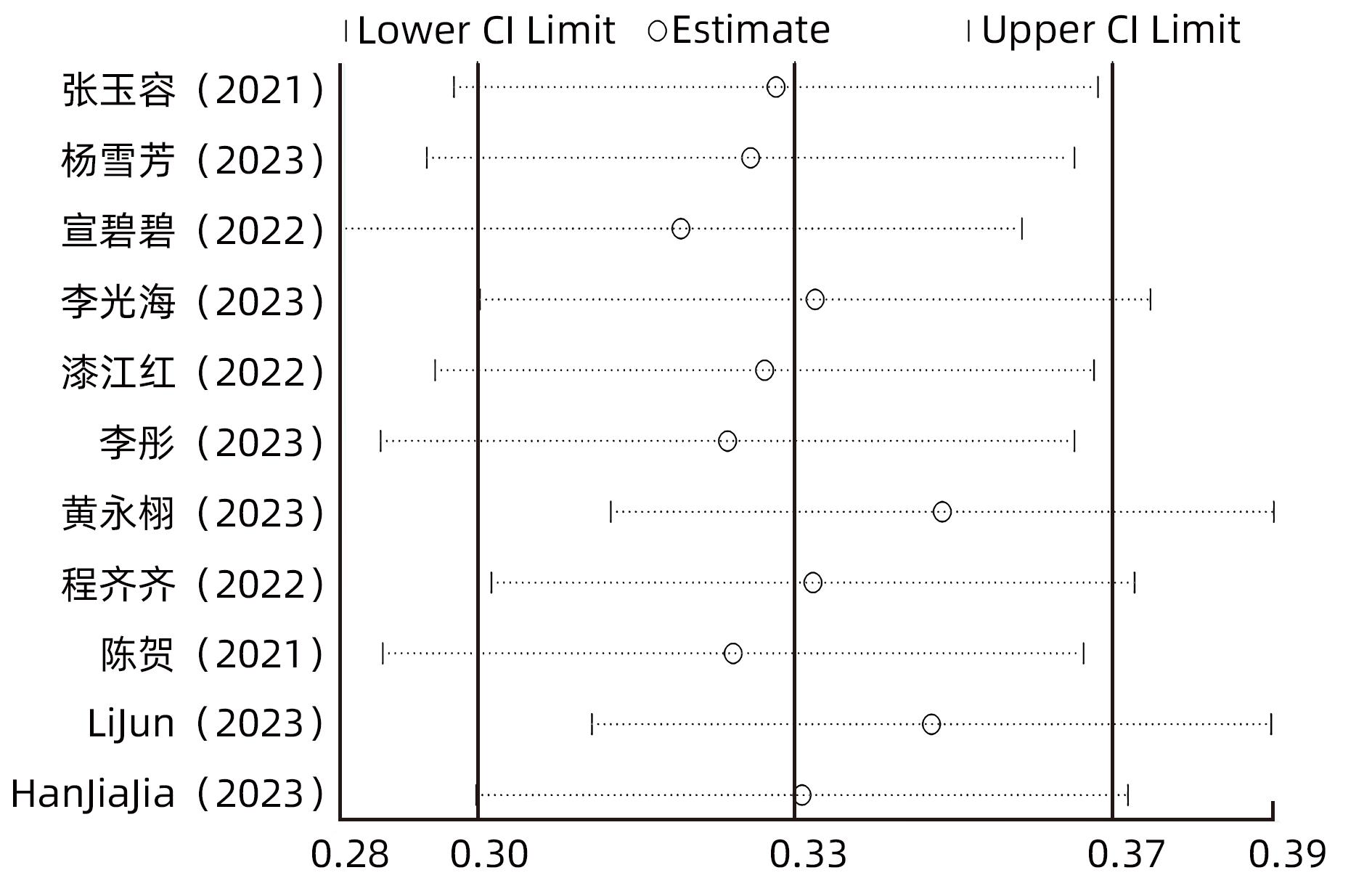
对总发生率采用逐一剔除法进行敏感性分析,结果显示逐个剔除后合并效应值未发生明显变化,结果相对稳定。敏感性分析结果见图3。
2.2.4 发表偏倚
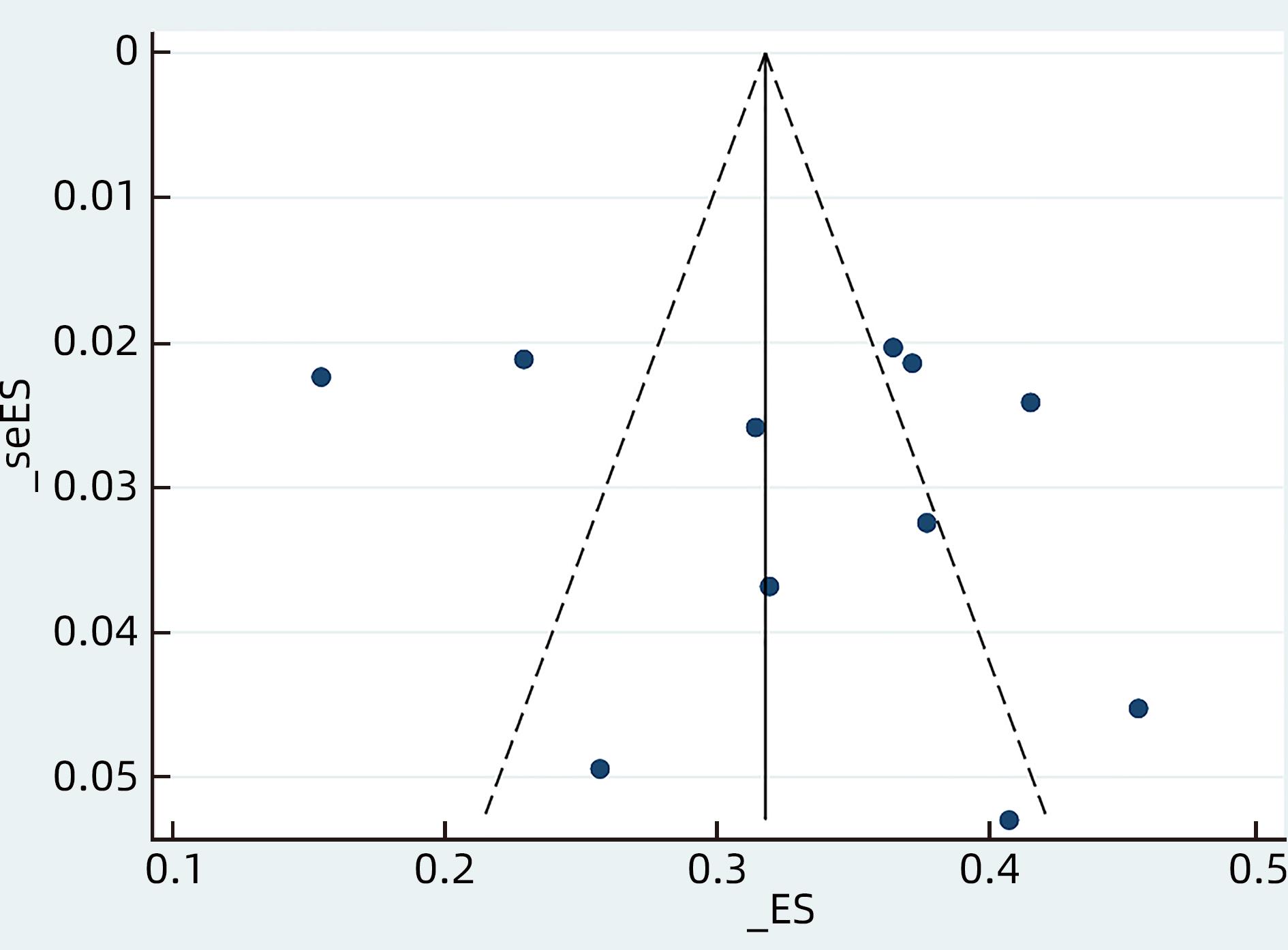
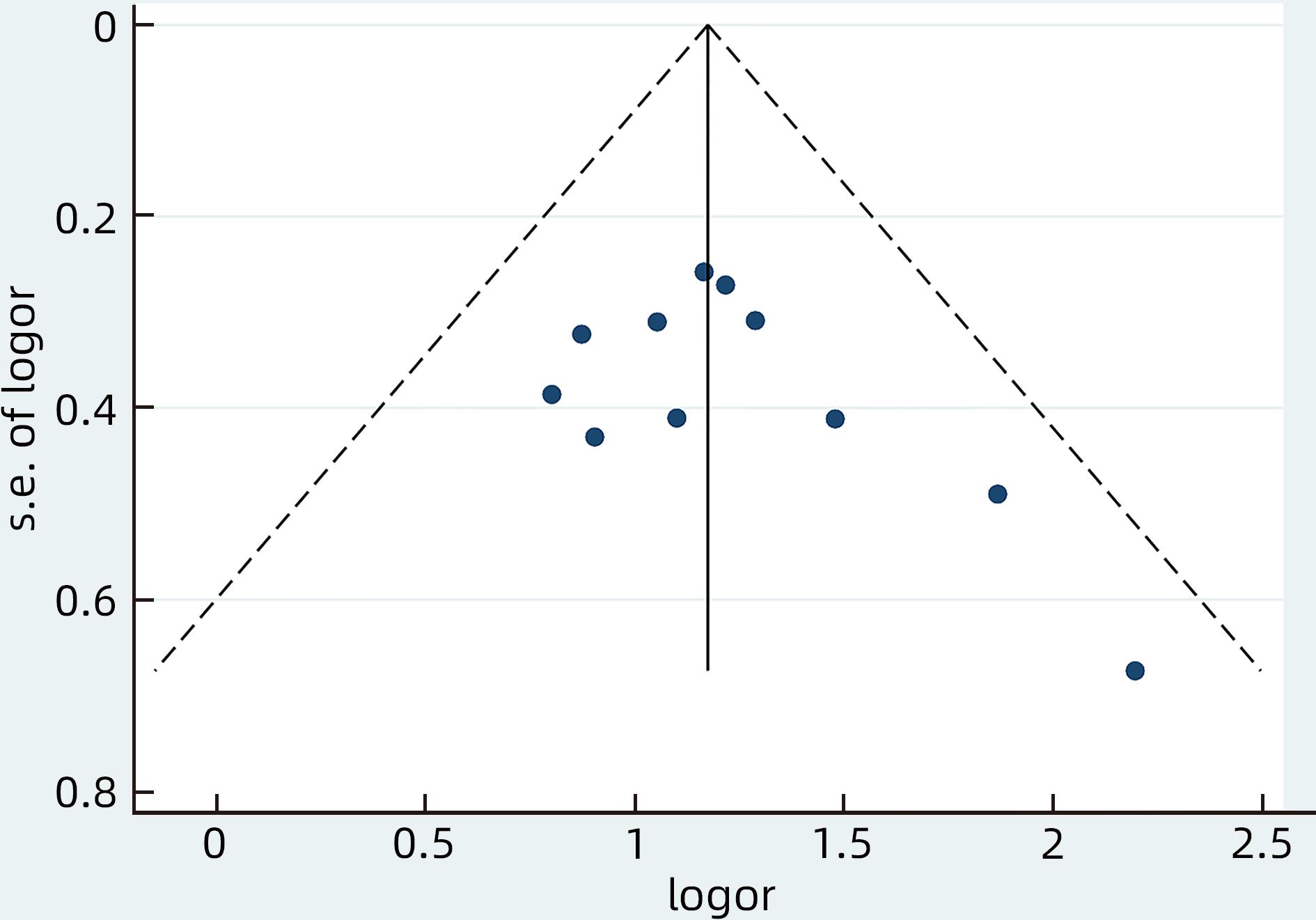
采用Egger’s检验和Begg’s检验对纳入的11篇文献[15-23,25-26]中CHB患者LLV发生率的发表偏倚进行评估并绘制漏斗图(图4)。Egger’s检验(P=0.498)和Begg’s检验(P=0.755)结果提示发表偏倚较低。
2.3 LLV影响因素的Meta分析
2.3.1 影响因素
对纳入的12篇文献[15-26]进行影响因素的Meta分析。提取出可以进行效应量合并分析的影响因素共6个,各研究结果之间无明显异质性,故选择固定效应模型进行分析。结果显示,HBeAg阳性(OR=3.258)、基线HBV DNA水平高(OR=1.286)、高HBsAg定量水平(OR=2.107)和有ETV治疗史(OR=3.089)是经治CHB患者发生LLV的危险因素(P值均<0.001);高基线ALT水平(OR=0.985)和抗病毒治疗疗程≥3年(OR=0.175)是LLV发生的保护因素(P值均<0.001)(表3)。
表 3 影响因素的Meta分析结果Table 3. Results of meta-analysis of influencing factors影响因素 文献篇数 异质性 效应模型 合并效应量 P值 I2值 P值 OR(95%CI) Z值 HBeAg阳性 11[15-21,23-26] 0% 0.600 固定 3.258(2.629~4.038) 10.790 <0.001 基线HBV DNA水平高 6[16,19-23] 20.3% 0.285 固定 1.286(1.157~1.430) 4.656 <0.001 HBsAg定量高 6[18-20,22-24] 36.3% 0.165 固定 2.107(1.782~2.491) 8.728 <0.001 ETV治疗史 2[20,26] 10.2% 0.291 固定 3.089(1.880~5.074) 4.453 <0.001 基线ALT水平高 2[20,22] 48.2% 0.165 固定 0.985(0.978~0.992) -4.337 <0.001 抗病毒治疗时间≥3年 3[15,17,26] 0% 0.966 固定 0.175(0.093~0.331) -5.378 <0.001 2.3.2 描述性分析
将纳入文献中不能够进行合并的影响因素进行描述性分析。张玉荣[15]研究显示,既往或目前使用非一线NAs类抗病毒药是经治CHB患者LLV发生的危险因素(OR=7.38,95%CI:2.15~25.34,P=0.001)。杨雪芳等[16]研究发现使用二线药物进行抗病毒治疗是LLV发生的危险因素(OR=14.982,95%CI:1.390~161.506,P=0.026)。Li等[25]研究发现HBV DNA水平>1.0×108 IU/mL(OR=2.871,95%CI:1.563~5.272,P<0.001)、抗-HBc水平<3 log10 IU/mL(OR=2.384,95%CI:1.223~4.645,P=0.011)是LLV发生的危险因素。黄永栩等[21]研究发现治疗期间依从性差是LLV发生的危险因素(OR=2.927,95%CI:1.078~7.949,P=0.035)。李彤等[20]研究发现高HBeAg水平是LLV发生的危险因素(OR=1.001,95%CI:1.000~1.002,P<0.05)。
关于保护因素,李光海等[18]研究发现治疗期间依从性好(OR=0.241,95%CI:0.114~0.510,P=0.001)、基线HBV DNA水平低(OR=0.445,95%CI:0.323~0.614,P<0.001)是发生LLV的保护因素。宣碧碧等[17]研究发现2年≤抗病毒治疗疗程<3年是LLV发生的保护因素(OR=0.175,95%CI:0.046~0.674,P=0.01)。李彤等[20]研究发现,抗病毒治疗中HBV DNA载量下降幅度大是LLV发生的保护因素(OR=0.205,95%CI:0.147~0.287,P<0.05)。
2.3.3 敏感性分析
将CHB患者LLV发生的影响因素中HBeAg阳性、高基线HBV DNA水平、HBsAg定量高、抗病毒治疗时间≥3年的合并结果通过逐一剔除法进行敏感性分析,结果显示效应值未发生明显变化,提示研究结果较稳定。余影响因素纳入文献≤2篇,未进行敏感性分析。
2.3.4 发表偏倚
对影响因素中的HBeAg阳性进行发表偏倚分析,漏斗图见图5。Egger’s检验(P=0.130)和Begg’s检验(P=0.371)结果提示不存在明显发表偏倚。其余15个影响因素因纳入的文献数量均低于10篇,故未对影响因素的发表偏倚进行分析。
3. 讨论
本研究结果显示,我国经治CHB患者LLV的发生率合并值为32.8%(95%CI:27.6%~38.3%),高于韩国一项回顾性研究[27]报道的26.8%及意大利研究[28]报道的20%。亚组分析发现,我国北方LLV发生率高于南方地区。这可能与南北方经济发展差异、受教育程度及对疾病认识和治疗程度的差异有关。由于本研究纳入文献数量较少,可能存在选择偏倚,需要高质量、大样本的流行病学调查加以验证。
本研究分析结果提示,HBsAg定量高、HBeAg阳性及高HBeAg水平、抗-HBc水平<3 log10 IU/mL、高基线HBV DNA水平(或HBV DNA水平≥1.0×108 IU/mL)、既往或目前使用非一线NAs类抗病毒药(使用二线药物抗病毒治疗)、有ETV治疗史可能是影响LLV发生的危险因素。
HBsAg是HBV感染的血清学标志。HBsAg定量能反映疾病进展、肝细胞核内共价闭合环状DNA(cccDNA)转录水平、HBV DNA复制情况,是监测或预测抗病毒治疗的有效标志物[29]。卢建华等[30]研究发现,患者HBsAg定量与HBV复制程度之间具有相关性,随着HBsAg定量的增高,HBV DNA的表达量增加,HBeAg阳性率也在不断增高。HBeAg是一种由HBV前核基因编码的非结构蛋白,由肝细胞修饰和分泌。通常HBeAg阳性是病毒复制活跃、传染性强的标志[31]。张晓晶等[32]发现与HBeAg阴性患者相比,HBeAg阳性患者HBV RNA表达水平、HBV DNA阳性率及肝功能异常率均更高,提示HBeAg阳性患者肝细胞内cccDNA转录活性更高,病毒复制活跃。HBeAg血清学转换是慢性HBV感染自然史重要的一环,与HBeAg阳性患者相比,实现HBeAg阴转的患者其远期预后往往更佳[33]。HBV感染的病程受先天免疫应答程度的影响,而HBeAg作为HBV的辅助蛋白,与感染期间宿主的免疫应答调节直接相关,高HBeAg定量水平能诱导T淋巴细胞耐受,使HBV逃避先天免疫反应建立慢性感染[34],在基线和治疗期间测量HBeAg定量有助于识别抗病毒治疗反应[35]。Geng等[36]研究发现较低的HBeAg定量(<313 S/CO)与较高的血清转化率相关。Hudu等[37]通过对82例初治CHB患者的研究发现,高HBeAg定量患者肝硬化比例更高,预后较差。
抗-HBc是HBV感染者B淋巴细胞产生的针对HBcAg的非保护性抗体,在宿主急性HBV感染的免疫反应早期产生,是既往或目前感染HBV的标志,在人体内长期甚至终生存在。Zhang等[38]通过对1 376例CHB患者抗-HBc定量(qAnti-HBc)及肝组织学炎症的研究发现,在初治患者中qAnti-HBc与肝脏炎症呈正相关,在治疗患者中qAnti-HBc降低与肝脏炎症缓解呈正相关。Wang等[39]研究亦证实了qAnti-HBc与肝脏炎症之间的关系。Li等[40]研究发现qAnti-HBc水平与纤维化分期呈正相关(r=0.367,P<0.001),对于疾病的分期、抗病毒疗效的监测具有重要价值,同时对于CHB患者HBsAg清除及停用核苷酸类似物后是否病毒学复发也具有预测作用[41]。本研究发现基线抗-HBc<3 log10 IU/mL是LLV发生的危险因素。作为可以预测肝脏炎症严重程度的标志物,血清抗-HBc水平在ALT水平正常的CHB患者中表现出较高的诊断准确性。Li等[25]研究发现,在49例抗-HBc<3 log10 IU/mL的患者中,有22例(约44.9%)没有发生完全病毒学应答,这些患者极有可能处于免疫耐受期,HBsAg水平、HBeAg状态、HBV DNA载量共同影响了患者最终的病毒学应答。
HBV DNA作为HBV病毒学检测的重要内容,能够帮助诊断HBV感染,判断HBV复制程度,在治疗监测、评估抗病毒疗效等方面具有重要意义[42]。有研究[19-23]显示,LLV组患者基线HBV DNA中位水平≥7 lg IU/mL,明显高于未发生组。对于高HBV DNA定量水平的描述,美国肝病学会2018版指南[7]定义为≥1×106 IU/mL;而我国《慢性乙型肝炎防治指南(2022年版)》[6]并未明确界定范围。尽管关于高HBV DNA定量水平的具体数值未达成一致,但基线HBV DNA水平的高低作为影响LLV发生、乙型肝炎相关肝癌预后及复发的危险因素仍然值得密切关注[43]。目前国际上公认的“金标准”是COBAS AmpliPrep-COBAS TaqMan(CAP-CTM)实时荧光PCR HBV DNA定量检测试剂盒,具有灵敏度、特异度高,准确率及重复率好的特点[44],为乙型肝炎患者抗病毒治疗过程中的病情监测提供了有力支撑[45]。对于LLV患者,高敏HBV DNA可有效指导临床决策,降低远期临床风险,避免不良结局。由于病毒基因组在受感染肝细胞的细胞核中转化为cccDNA,因此在治疗过程中很难真正消除HBV[46]。作为病毒模板和维持慢性HBV感染的补充库,了解cccDNA的生物学特性对抗病毒治疗至关重要,但传统的分子生物学手段很难检测,新兴的检测方法如实时荧光定量PCR、磁珠杂交捕获法、滚环扩增结合原位PCR技术和微滴数字PCR、单细胞HBV cccDNA检测等,用于临床病情的长期监测存在时间及成本上的限制[47]。试纸条作为基于单克隆技术、胶体金标记技术和免疫层析技术的检测方法,因其操作简单、反应快、设备便携等优点得到了快速发展[48]。首都医科大学北京佑安医院段钟平教授团队[49]研发的基于RRA-CRISPR/Cas13a的快速便携式HBV DNA检测条可用于LLV患者的检测,是一种直观、快速的替代方法,能扩大HBV感染者的诊断筛查能力和覆盖范围,简化抗病毒的疗效验证过程。
作为一线抗病毒用药,ETV是较早被批准使用的NAs,国内外关于LLV的相关研究也多集中在ETV经治患者中,这可能是有ETV治疗史是LLV发生的危险因素的原因。国内外研究[50-51]均发现,序贯或联合使用TAF延长抗病毒疗程能有效提高ETV经治后发生LLV的CHB患者的完全病毒学应答率。Sanai等[52]通过混合决策树马尔可夫状态转换模型研究发现,既往接受ETV治疗的LLV患者改用TAF,可提高完全病毒学应答的比例,降低不良事件发生率并减少37%的肝脏相关死亡,并增加成本效益比。尽管目前使用TAF的治疗成本较高,但就远期成本而言,改用TAF是一种成本-效益更优的策略,晚期肝病事件的减少不仅能降低经济成本,更能提高患者生存质量,延长生存周期。
虽然国内外指南均推荐首选强效低耐药的ETV、TDF、TAF等,但由于种种原因,目前仍存在部分患者使用拉米夫定(LAM)、替比夫定(LdT)等非一线抗病毒药物。非一线NAs药物往往抗病毒作用不足,耐药率较高。研究[53]发现,在目前使用ETV或TDF抗病毒治疗的患者中,既往有LAM用药史者与既往无LAM用药史者相比,病毒学应答率更低,且耐药率更高。这可能也是ETV治疗史是LLV发生的危险因素的原因。
关于保护因素,本研究结果提示治疗期间依从性好、坚持抗病毒治疗(抗病毒时间≥3年和2年≤抗病毒时间<3年)、高基线ALT、治疗中HBV DNA下降幅度大可能是经治CHB患者发生LLV的保护因素。
由于NAs对HBV感染肝细胞的cccDNA没有直接作用,HBsAg清除率每年<1%[54],因此长期的NAs治疗通常是维持病毒学反应所必需的。研究[55]显示,ETV和TDF治疗8年的病毒学应答率可达98%~99%,同时随着治疗时间的增加,肝细胞癌的发生风险不断降低[56]。此外,良好的服药依从性能最大限度地提高治疗效果并降低耐药性的发展。Allard等[57]分析了2010—2013年墨尔本4所主要医院642例CHB抗病毒治疗患者的药学和病理学记录,发现依从性与良好的结局之间呈线性相关,随着依从性的下降,病毒学突破的风险增加。Shin等[58]对894例初治CHB患者10年的纵向观察研究同样证实了依从性差的患者比依从性好的患者有更高的病毒学突破风险(HR=22.42,95%CI:19.57~52.52,P<0.001),且肝细胞癌的发生风险增加2.9倍(95%CI:1.761~4.643,P<0.001),肝硬化并发症的发生风险也增加2.9倍(95%CI:1.925~4.247,P<0.001),全因死亡率的风险增加5.0倍,肝脏相关死亡率的风险增加14.3倍,这种不利影响在肝硬化患者中表现得更为突出。特别强调的是,采用最佳的服用方式(ETV需空腹;TDF与食物同服)也能有效提高病毒学应答率,降低LLV发生风险[59]。值得注意的是在纳入研究中均未指出依从性的明确定义,这可能造成结果在合并时出现偏倚,但是依从性对于抗病毒疗效的影响是毋庸置疑的。在长期的抗病毒治疗中临床医生定期对依从性进行评估十分必要。
血清ALT水平变化可反映肝脏的炎症活动程度,亦可反映机体抗HBV免疫应答的强弱,是肝细胞损伤的主要标志。研究[60]表明,ALT水平越高,表明机体免疫反应越强烈,发生血清HBeAg阴转的可能性就越高,是HBeAg血清转换最关键的独立预测因素。
本研究发现治疗中高HBV DNA下降幅度是LLV发生的保护因素。Boglione等[61]研究证实HBV DNA下降幅度是持续病毒学应答的预测因子。Hansen等[62]亦发现治疗24周内HBV DNA下降2 lg IU/mL与完全病毒学应答密切相关(OR=5.7,95%CI:1.7~20.0,P=0.004)。宿主免疫影响CHB患者的抗病毒疗效,辅助性T淋巴细胞17(Th17)/调节性T淋巴细胞(Treg)在介导抗病毒治疗的免疫应答中起重要作用。研究[63]发现HBV病毒载量高低与机体Th17和Treg及其比率之间存在直接关系,随着病毒载量的增加,Th17、Treg细胞及其比率均增高;经抗病毒治疗后,病毒载量下降,机体炎症反应减弱,Th17、Treg细胞及其比率也随之降低。Th17/Treg平衡失调已经被证实与CHB患者肝功能损伤和肝纤维化相关[64],积极有效的抗病毒治疗能最大程度地抑制病毒在体内的复制,有助于恢复CHB患者的T淋巴细胞免疫。Liu等[65]通过对接受NAs治疗3~5年后HBeAg消失、抗-HBe存在、ALT水平持续正常且HBV DNA低于检测下限的CHB患者分析发现,经过抗病毒治疗且病毒复制抑制后,循环CD56dim自然杀伤细胞和Th17/Treg平衡得到恢复,并有助于降低患者HBsAg水平。
本研究的局限性在于:(1)受研究类型、纳入排除标准的影响,关于LLV发生率和影响因素的原始研究数量有限,纳入文献数量较少,可能对结果合并造成一定影响,需要更高质量、大样本的研究加以验证。(2)原始研究中存在诸多不能进行合并的影响因素,而在可合并的影响因素中标准不统一,如未明确定义依从性好/差、高基线HBV DNA水平等,上述问题可能影响Meta分析结果。
-
表 1 纳入文献基本特征及质量评价结果
Table 1. Basic characteristics and quality evaluation results
纳入文献 年份 研究类型 研究地点 地理区域 LLV(例) 总样本量(例) 影响因素 质量评价 危险 保护 评分 分级 张玉容[15] 2021 横断面 福建 南方 35 86 ①② ⑭ 6 中 杨雪芳等[16] 2023 横断面 云南 南方 55 121 ①③④ 6 中 宣碧碧等[17] 2022 横断面 山东 北方 173 417 ① ⑭⑮ 9 高 李光海等[18] 2023 横断面 海南 南方 101 322 ①⑥⑦ ⑬⑯ 5 中 漆江红[19] 2022 横断面 甘肃 北方 84 223 ①③⑥ 5 中 李彤等[20] 2023 横断面 甘肃 北方 189 509 ①③⑥⑧⑨ ⑪⑫ 7 中 黄永栩等[21] 2023 横断面 广东 南方 40 260 ①③⑦ 7 中 程齐齐等[22] 2022 横断面 江西 南方 20 78 ③⑥ ⑪ 6 中 陈贺等[23] 2021 横断面 江苏 南方 204 560 ①③⑥ 5 中 Lu等[24] 2022 病例对照 广东 南方 139 278 ①⑥ 5 中 Li等[25] 2023 队列 江苏 南方 90 394 ①⑤⑩ 7 高 Han等[26] 2023 横断面 上海 南方 51 160 ①⑧ ⑭ 7 中 注:①HBeAg阳性;②既往或目前使用非一线NAs类抗病毒药物;③基线HBV DNA水平高;④使用二线抗病毒药物;⑤HBV DNA水平≥1.0×108 IU/mL;⑥HBsAg定量高;⑦治疗期间依从性差;⑧ETV治疗史;⑨高HBeAg水平;⑩抗-HBc水平<3 log10 IU/mL;⑪基线ALT水平高;⑫治疗中HBV DNA水平下降幅度大;⑬治疗期间依从性好;⑭抗病毒治疗时间≥3年;⑮2年≤抗病毒治疗时间<3年;⑯基线HBV DNA水平低。 表 2 亚组分析结果
Table 2. Subgroup analysis results
表 3 影响因素的Meta分析结果
Table 3. Results of meta-analysis of influencing factors
影响因素 文献篇数 异质性 效应模型 合并效应量 P值 I2值 P值 OR(95%CI) Z值 HBeAg阳性 11[15-21,23-26] 0% 0.600 固定 3.258(2.629~4.038) 10.790 <0.001 基线HBV DNA水平高 6[16,19-23] 20.3% 0.285 固定 1.286(1.157~1.430) 4.656 <0.001 HBsAg定量高 6[18-20,22-24] 36.3% 0.165 固定 2.107(1.782~2.491) 8.728 <0.001 ETV治疗史 2[20,26] 10.2% 0.291 固定 3.089(1.880~5.074) 4.453 <0.001 基线ALT水平高 2[20,22] 48.2% 0.165 固定 0.985(0.978~0.992) -4.337 <0.001 抗病毒治疗时间≥3年 3[15,17,26] 0% 0.966 固定 0.175(0.093~0.331) -5.378 <0.001 -
[1] World Health Organization. Hepatitis B[EB/OL].( 2023-7-18)[ 2023-9-16]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b [2] WANG H, MEN PX, XIAO YF, et al. Hepatitis B infection in the general population of China: A systematic review and meta-analysis[J]. BMC Infect Dis, 2019, 19( 1): 811. DOI: 10.1186/s12879-019-4428-y. [3] LOK AS, MCMAHON BJ, BROWN RS Jr, et al. Antiviral therapy for chronic hepatitis B viral infection in adults: A systematic review and meta-analysis[J]. Hepatology, 2016, 63( 1): 284- 306. DOI: 10.1002/hep.28280. [4] CHEN CF, LEE WC, YANG HI, et al. Changes in serum levels of HBV DNA and alanine aminotransferase determine risk for hepatocellular carcinoma[J]. Gastroenterology, 2011, 141( 4): 1240- 1248. DOI: 10.1053/j.gastro.2011.06.036. [5] KIM GA, HAN S, CHOI GH, et al. Moderate levels of serum hepatitis B virus DNA are associated with the highest risk of hepatocellular carcinoma in chronic hepatitis B patients[J]. Aliment Pharmacol Ther, 2020, 51( 11): 1169- 1179. DOI: 10.1111/apt.15725. [6] Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Infectious Diseases, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B(2022 version)[J]. Chin J Infect Dis, 2023, 41( 1): 3- 28. DOI: 10.3760/cma.j.cn311365-20230220-00050.中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2022年版)[J]. 中华传染病杂志, 2023, 41( 1): 3- 28. DOI: 10.3760/cma.j.cn311365-20230220-00050. [7] TERRAULT NA, LOK ASF, MCMAHON BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance[J]. Hepatology, 2018, 67( 4): 1560- 1599. DOI: 10.1002/hep.29800. [8] YIN GQ, LI J, ZHONG B, et al. New therapeutic options for persistent low-level viremia in patients with chronic hepatitis B virus infection: Increase of entecavir dosage[J]. World J Gastroenterol, 2021, 27( 8): 666- 676. DOI: 10.3748/wjg.v27.i8.666. [9] LU FM, FENG B, ZHENG SJ, et al. Current status of the research on low-level viremia in chronic hepatitis B patients receiving nucleos(t)ide analogues[J]. J Clin Hepatol, 2021, 37( 6): 1268- 1274. DOI: 10.3969/j.issn.1001-5256.2021.06.007.鲁凤民, 封波, 郑素军, 等. 核苷(酸)类似物经治的慢性乙型肝炎患者低病毒血症的研究现状[J]. 临床肝胆病杂志, 2021, 37( 6): 1268- 1274. DOI: 10.3969/j.issn.1001-5256.2021.06.007. [10] SUN YM, WU XN, ZHOU JL, et al. Persistent low level of hepatitis B virus promotes fibrosis progression during therapy[J]. Clin Gastroenterol Hepatol, 2020, 18( 11): 2582- 2591. DOI: 10.1016/j.cgh.2020.03.001. [11] YANG J, CHOI WM, SHIM JH, et al. Low level of hepatitis B viremia compared with undetectable viremia increases the risk of hepatocellular carcinoma in patients with untreated compensated cirrhosis[J]. Am J Gastroenterol, 2023, 118( 6): 1010- 1018. DOI: 10.14309/ajg.0000000000002181. [12] SUN FR, LIU ZF, WANG BY. Correlation between low-level viremia and hepatitis B-related hepatocellular carcinoma and recurrence: A retrospective study[J]. BMC Cancer, 2021, 21( 1): 1103. DOI: 10.1186/s12885-021-08483-3. [13] LIU SN, GUO XF, WU DR, et al. Construction of clinical evidence grading system of TCM intervention based on evidence-based medicine principles[J]. Chin J Integr Tradit West Med, 2023, 43( 8): 911- 915.刘少南, 郭新峰, 吴大嵘, 等. 基于循证医学原则的中医干预类临床证据分级系统的构建[J]. 中国中西医结合杂志, 2023, 43( 8): 911- 915. [14] ZENG XT, LIU H, CHEN X, et al. Meta-analysis series IV: Quality evaluation tools for observational research[J]. Chin J Evid Based Cardiovasc Med, 2012, 4( 4): 297- 299. DOI: 10.3969/j.1674-4055.2012.04.004.曾宪涛, 刘慧, 陈曦, 等. Meta分析系列之四: 观察性研究的质量评价工具[J]. 中国循证心血管医学杂志, 2012, 4( 4): 297- 299. DOI: 10.3969/j.1674-4055.2012.04.004. [15] ZHANG YR. Profile of low level viremia in patients with chronic hepatitis B[D]. Fuzhou: Fujian Medical University, 2021.张玉容. 慢性乙型肝炎患者低病毒血症状况研究[D]. 福州: 福建医科大学, 2021. [16] YANG XF, XU Y, ZHANG BT, et al. Analysis of clinical characteristics and risk factors of low level viremia in patients with chronic hepatitis B after treatment[J]. Chin J Gastroenterol Hepatol, 2023, 32( 3): 276- 281. DOI: 10.3969/j.issn.1006-5709.2023.03.008.杨雪芳, 胥莹, 张帮婷, 等. 经治慢性乙型肝炎患者低病毒血症的临床特征及危险因素分析[J]. 胃肠病学和肝病学杂志, 2023, 32( 3): 276- 281. DOI: 10.3969/j.issn.1006-5709.2023.03.008. [17] XUAN BB, XU YH, DU ZC, et al. Influencing factors for low-level viremia in patients with chronic hepatitis B or hepatitis B liver cirrhosis and its association with the progression of liver inflammation and liver fibrosis[J]. J Clin Hepatol, 2022, 38( 10): 2252- 2259. DOI: 10.3969/j.issn.1001-5256.2022.10.011.宣碧碧, 徐永红, 杜忠彩, 等. 慢性乙型肝炎和乙型肝炎肝硬化患者发生低病毒血症的影响因素及其与肝脏炎症、肝纤维化进展的关系[J]. 临床肝胆病杂志, 2022, 38( 10): 2252- 2259. DOI: 10.3969/j.issn.1001-5256.2022.10.011. [18] LI GH, SUN L. Risk factors of low level viremia in chronic hepatitis B treated with nucleosides(acids)[J]. Med Health, 2023( 2): 165- 168.李光海, 孙龙. 核苷(酸)类药物治疗慢性乙型肝炎低病毒血症危险因素分析[J]. 医药卫生, 2023( 2): 165- 168. [19] QI JH. Analysis of influencing factors of hypoviremia in patients with chronic hepatitis B and liver cirrhosis[J]. J Front Med, 2022, 12( 35): 52- 54. DOI: 10.3969/j.issn.2095-1752.2022.35.015.漆江红. 慢性乙肝及肝硬化患者低病毒血症的影响因素分析[J]. 医药前沿, 2022, 12( 35): 52- 54. DOI: 10.3969/j.issn.2095-1752.2022.35.015. [20] LI T, KONG Y, LIU YY, et al. Demographic characteristics and associated influencing factors in treated patients with chronic hepatitis B with hypoviremia: A single-center retrospective cross-sectional study[J]. Chin J Hepatol, 2023, 31( 1): 42- 48. DOI: 10.3760/cma.j.cn501113-20220121-00039.李彤, 孔银, 刘元元, 等. 经治慢性乙型肝炎低病毒血症患者人群特征及其相关影响因素: 一项单中心横断面回顾性研究[J]. 中华肝脏病杂志, 2023, 31( 1): 42- 48. DOI: 10.3760/cma.j.cn501113-20220121-00039. [21] HUANG YX, CHEN C, BAO ZH, et al. Influencing factors of low-level viremia in patients with chronic hepatitis B treated with Entecavir[J]. Chin Hepatol, 2023, 28( 3): 320- 324. DOI: 10.3969/j.issn.1008-1704.2023.03.015.黄永栩, 陈超, 保紫红, 等. 恩替卡韦治疗的慢性乙型肝炎患者低病毒血症的影响因素[J]. 肝脏, 2023, 28( 3): 320- 324. DOI: 10.3969/j.issn.1008-1704.2023.03.015. [22] CHENG QQ, YANG LX, CAI TP, et al. Influencing factors for low-level viremia and their dynamic changes in patients with chronic hepatitis B treated with nucleos(t)ide analogues for the first time[J]. J Clin Hepatol, 2022, 38( 12): 2716- 2722. DOI: 10.3969/j.issn.1001-5256.2022.12.008.程齐齐, 杨丽霞, 蔡天盼, 等. 核苷(酸)类似物初治的慢性乙型肝炎患者发生低病毒血症的影响因素及其动态变化分析[J]. 临床肝胆病杂志, 2022, 38( 12): 2716- 2722. DOI: 10.3969/j.issn.1001-5256.2022.12.008. [23] CHEN H, FU JJ, LI L, et al. Influencing factors for low-level viremia in chronic hepatitis B patients treated with long-term entecavir antiviral therapy[J]. J Clin Hepatol, 2021, 37( 3): 556- 559. DOI: 10.3969/j.issn.1001-5256.2021.03.011.陈贺, 傅涓涓, 李丽, 等. 长期恩替卡韦经治慢性乙型肝炎患者低病毒血症的相关影响因素[J]. 临床肝胆病杂志, 2021, 37( 3): 556- 559. DOI: 10.3969/j.issn.1001-5256.2021.03.011. [24] LU JH, ZHANG CN, HE PY, et al. Risk factors for very low-level viremia in patients with chronic hepatitis B virus infection: A single-center retrospective study[J]. Liver Res, 2022, 6( 1): 39- 44. DOI: 10.1016/j.livres.2022.02.001. [25] LI J, DONG XQ, CAO LH, et al. Factors associated with persistent positive in HBV DNA level in patients with chronic Hepatitis B receiving entecavir treatment[J]. Front Cell Infect Microbiol, 2023, 13: 1151899. DOI: 10.3389/fcimb.2023.1151899. [26] HAN JJ, GUO YF, ZHANG XY, et al. Prevalence and associated factors of low-level viremia in chronic hepatitis B patients after long-term therapy with nucleos(t)ide analogs[J]. Turk J Gastroenterol, 2023, 34( 1): 53- 61. DOI: 10.5152/tjg.2023.21978. [27] LEE SB, JEONG J, PARK JH, et al. Low-level viremia and cirrhotic complications in patients with chronic hepatitis B according to adherence to entecavir[J]. Clin Mol Hepatol, 2020, 26( 3): 364- 375. DOI: 10.3350/cmh.2020.0012. [28] AGARWAL K, BRUNETTO M, SETO WK, et al. 96 weeks treatment of tenofovir alafenamide vs. tenofovir disoproxil fumarate for hepatitis B virus infection[J]. J Hepatol, 2018, 68( 4): 672- 681. DOI: 10.1016/j.jhep.2017.11.039. [29] PAVLOVIC V, YANG L, CHAN HLY, et al. Peginterferon alfa-2a(40 kD) stopping rules in chronic hepatitis B: A systematic review and meta-analysis of individual participant data[J]. Antivir Ther, 2019, 24( 2): 133- 140. DOI: 10.3851/IMP3304. [30] LU JH, YANG L, YE LH, et al. Clinical significance of HBsAg quantitative detection in the diagnosis and treatment of patients with chronic hepatitis B[J]. Mod J Integr Tradit Chin West Med, 2020, 29( 33): 3674- 3678. DOI: 10.3969/j.issn.1008-8849.2020.33.007.卢建华, 杨莉, 叶立红, 等. HBsAg定量检测在慢性乙型病毒性肝炎患者诊疗中的临床意义[J]. 现代中西医结合杂志, 2020, 29( 33): 3674- 3678. DOI: 10.3969/j.issn.1008-8849.2020.33.007. [31] HOOFNAGLE JH, DI BISCEGLIE AM. Serologic diagnosis of acute and chronic viral hepatitis[J]. Semin Liver Dis, 1991, 11( 2): 73- 83. DOI: 10.1055/s-2008-1040426. [32] ZHANG XJ, WU R, HUANG W, et al. Clinical study of hepatitis B virus RNA in different HBeAg states in chronic hepatitis B[J]. Chin J Health Lab Technol, 2023, 33( 3): 257- 260.张晓晶, 武瑞, 黄伟, 等. 乙型肝炎病毒RNA在慢性乙型病毒性肝炎不同HBeAg状态下的临床研究[J]. 中国卫生检验杂志, 2023, 33( 3): 257- 260. [33] LEE WM, KING WC, JANSSEN HLA, et al. Hepatitis B e antigen loss in adults and children with chronic hepatitis B living in North America: A prospective cohort study[J]. J Viral Hepat, 2021, 28( 11): 1526- 1538. DOI: 10.1111/jvh.13591. [34] LAU GKK, WANG FS. Uncover the immune biomarkers underlying hepatitis B e antigen(HBeAg) seroconversion: A need for more translational study[J]. J Hepatol, 2012, 56( 4): 753- 755. DOI: 10.1016/j.jhep.2011.12.006. [35] WANG CT, ZHANG YF, SUN BH, et al. Models for predicting hepatitis B e antigen seroconversion in response to interferon-α in chronic hepatitis B patients[J]. World J Gastroenterol, 2015, 21( 18): 5668- 5676. DOI: 10.3748/wjg.v21.i18.5668. [36] GENG MF, LI YX, GAO FY, et al. A scoring model predicts hepatitis B e antigen seroconversion in chronic hepatitis B patients treated with nucleos(t)ide analogs: Real-world clinical practice[J]. Int J Infect Dis, 2017, 62: 18- 25. DOI: 10.1016/j.ijid.2017.06.016. [37] HUDU SA, NIAZLIN MT, NORDIN SA, et al. Quantitative hepatitis B e antigen: A better predictor of hepatitis B virus DNA than quantitative hepatitis B surface antigen[J]. Clin Lab, 2018, 64( 4): 443- 449. DOI: 10.7754/Clin.Lab.2017.170916. [38] ZHANG C, LIU YQ, LI JW, et al. Dose-response relationship between qAnti-HBc and liver inflammation in chronic hepatitis B with normal or mildly elevated alanine transaminase based on liver biopsy[J]. J Med Virol, 2022, 94( 8): 3911- 3923. DOI: 10.1002/jmv.27779. [39] WANG XM, GAO XZ, WU RH, et al. Serum qAnti-HBc combined with ALT and HBsAg predicts significant hepatic inflammation in HBeAg-positive immune active patients[J]. J Gastroenterol Hepatol, 2022, 37( 9): 1806- 1814. DOI: 10.1111/jgh.15881. [40] LI J, MAO RC, LI XL, et al. A novel noninvasive index for the prediction of moderate to severe fibrosis in chronic hepatitis B patients[J]. Dig Liver Dis, 2018, 50( 5): 482- 489. DOI: 10.1016/j.dld.2017.12.028. [41] XIE YD, LI MH, OU XJ, et al. IP10 and anti-HBc can predict virological relapse and HBsAg loss in chronic hepatitis B patients after nucleos(t)ide analog discontinuation[J]. Dig Dis, 2023, 41( 6): 922- 931. DOI: 10.1159/000533515. [42] YU XG, DENG JK, HE XH, et al. Performance verification and clinical evaluation of HBV DNA high-sensitivity detection kit[J]. J Mol Diagn Ther, 2019, 11( 2): 111- 116. DOI: 10.3969/j.issn.1674-6929.2019.02.009.余学高, 邓间开, 何小洪, 等. HBV DNA高敏检测试剂盒的性能验证和临床应用评价[J]. 分子诊断与治疗杂志, 2019, 11( 2): 111- 116. DOI: 10.3969/j.issn.1674-6929.2019.02.009. [43] XIE L, LIU GW, GUO HJ. Analysis of the correlation between HBV DNA load level and hepatitis B hepatocellular carcinoma indicators and the effect on the outcome[J]. Chin J Integr Tradit West Med Liver Dis, 2023, 33( 10): 925- 929. DOI: 10.3969/j.issn.1005-0264.2023.010.014.谢露, 刘光伟, 郭会军. HBV DNA载量水平与乙型肝炎相关肝癌指标的相关性分析及其对预后的影响[J]. 中西医结合肝病杂志, 2023, 33( 10): 925- 929. DOI: 10.3969/j.issn.1005-0264.2023.010.014. [44] LI J, BI YH, HUANG YH, et al. Consistency and the value of high-sensitivity and conventional fluorescence quantitative PCR in different viral load in patients with chronic hepatitis B[J]. J Trop Med, 2023, 23( 2): 198- 202. DOI: 10.3969/j.issn.1672-3619.2023.02.013.李静, 毕燕华, 黄月华, 等. 高敏与普通荧光定量PCR技术在不同病毒载量慢乙肝患者HBV-DNA检测的一致性及应用价值[J]. 热带医学杂志, 2023, 23( 2): 198- 202. DOI: 10.3969/j.issn.1672-3619.2023.02.013. [45] LONG L, ZHANG Q, XIONG Y, et al. Application of high-sensitivity hepatitis B virus-DNA testing in the monitoring of antiviral therapy in patients with low-level viremia[J]. Guizhou Med J, 2022, 46( 8): 1182- 1183, 1186. DOI: 10.3969/j.issn.1000-744X.2022.08.002.龙黎, 张卿, 熊晏, 等. 高敏HBV-DNA检测在低病毒血症患者抗病毒治疗监测中的应用研究[J]. 贵州医药, 2022, 46( 8): 1182- 1183, 1186. DOI: 10.3969/j.issn.1000-744X.2022.08.002. [46] GISH RG, GIVEN BD, LAI CL, et al. Chronic hepatitis B: Virology, natural history, current management and a glimpse at future opportunities[J]. Antiviral Res, 2015, 121: 47- 58. DOI: 10.1016/j.antiviral.2015.06.008. [47] SUN FL, XIA W, OUYANG YL. Research progress on detection methods for hepatitis B virus covalently closed circular DNA[J]. J Viral Hepat, 2023, 30( 5): 366- 373. DOI: 10.1111/jvh.13817. [48] PARK HD. Current status of clinical application of point-of-care testing[J]. Arch Pathol Lab Med, 2021, 145( 2): 168- 175. DOI: 10.5858/arpa.2020-0112-RA. [49] TIAN Y, FAN ZH, XU L, et al. CRISPR/Cas13a-assisted rapid and portable HBV DNA detection for low-level viremia patients[J]. Emerg Microbes Infect, 2023, 12( 1): e2177088. DOI: 10.1080/22221751.2023.2177088. [50] LIU LP, WU XP, CAI TP, et al. Analysis of efficacy and factors influencing sequential combination therapy with tenofovir alafenamide fumarate after treatment with entecavir in chronic hepatitis B patients with low-level viremia[J]. Chin J Hepatol, 2023, 31( 2): 118- 125. DOI: 10.3760/cma.j.cn501113-20221019-00507.刘丽萍, 邬小萍, 蔡天盼, 等. 恩替卡韦经治后低病毒血症的慢性乙型肝炎患者序贯联合富马酸丙酚替诺福韦治疗的疗效及影响因素分析[J]. 中华肝脏病杂志, 2023, 31( 2): 118- 125. DOI: 10.3760/cma.j.cn501113-20221019-00507. [51] ISHIDO S, TAMAKI N, UCHIHARA N, et al. Switching from entecavir to tenofovir alafenamide for maintaining complete virological response in chronic hepatitis B[J]. JGH Open, 2023, 7( 8): 567- 571. DOI: 10.1002/jgh3.12950. [52] SANAI FM, ALJAWAD M, ALGHAMDI AS, et al. Long-term health and economic benefits of switching to tenofovir alafenamide versus continuing on entecavir in chronic hepatitis B patients with low-level viremia in Saudi Arabia[J]. Saudi J Gastroenterol, 2024, 30( 1): 23- 29. DOI: 10.4103/sjg.sjg_170_23. [53] CHOI J, KIM HJ, LEE J, et al. Risk of hepatocellular carcinoma in patients treated with entecavir vs tenofovir for chronic hepatitis B: A Korean nationwide cohort study[J]. JAMA Oncol, 2019, 5( 1): 30- 36. DOI: 10.1001/jamaoncol.2018.4070. [54] DUSHEIKO G. Will we need novel combinations to cure HBV infection?[J]. Liver Int, 2020, 40( Suppl 1): 35- 42. DOI: 10.1111/liv.14371. [55] GROSSI G, VIGANÒ M, LOGLIO A, et al. Hepatitis B virus long-term impact of antiviral therapy nucleot(s)ide analogues(NUCs)[J]. Liver Int, 2017, 37( Suppl 1): 45- 51. DOI: 10.1111/liv.13291. [56] PAPATHEODORIDIS GV, IDILMAN R, DALEKOS GN, et al. The risk of hepatocellular carcinoma decreases after the first 5 years of entecavir or tenofovir in Caucasians with chronic hepatitis B[J]. Hepatology, 2017, 66( 5): 1444- 1453. DOI: 10.1002/hep.29320. [57] ALLARD NL, MACLACHLAN JH, DEV A, et al. Adherence in chronic hepatitis B: Associations between medication possession ratio and adverse viral outcomes[J]. BMC Gastroenterol, 2020, 20( 1): 140. DOI: 10.1186/s12876-020-01219-w. [58] SHIN JW, JUNG SW, LEE SB, et al. Medication nonadherence increases hepatocellular carcinoma, cirrhotic complications, and mortality in chronic hepatitis B patients treated with entecavir[J]. Am J Gastroenterol, 2018, 113( 7): 998- 1008. DOI: 10.1038/s41395-018-0093-9. [59] TAO YC, WANG ML, ZHANG DM, et al. Optimal drug administration manner would rescue partial virological response in chronic hepatitis B patients with entecavir or tenofovir treatment[J]. J Viral Hepat, 2020, 27( 7): 731- 738. DOI: 10.1111/jvh.13275. [60] WANG CH, CHANG KK, LIN RC, et al. Consolidation period of 18 months no better at promoting off-treatment durability in HBeAg-positive chronic hepatitis B patients with tenofovir disoproxil fumarate treatment than a 12-month period: A prospective randomized cohort study[J]. Medicine(Baltimore), 2020, 99( 18): e19907. DOI: 10.1097/MD.0000000000019907. [61] BOGLIONE L, CUSATO J, CARITI G, et al. Role of HBsAg decline in patients with chronic hepatitis B HBeAg-negative and E genotype treated with pegylated-interferon[J]. Antiviral Res, 2016, 136: 32- 36. DOI: 10.1016/j.antiviral.2016.10.011. [62] HANSEN BE, BUSTER EH, STEYERBERG EW, et al. Prediction of the response to peg-interferon-alfa in patients with HBeAg positive chronic hepatitis B using decline of HBV DNA during treatment[J]. J Med Virol, 2010, 82( 7): 1135- 1142. DOI: 10.1002/jmv.21778. [63] GAO P, LUO YP, LI JF, et al. Effects of hepatitis B virus on Th17, Treg and Th17/Treg ratio in different alanine aminetransferase stages[J]. J Peking Univ Health Sci, 2022, 54( 2): 272- 277. DOI: 10.19723/j.issn.1671-167X.2022.02.012.高鹏, 雒艳萍, 李俊峰, 等. 乙型肝炎病毒在不同丙氨酸氨基转移酶状态下对Th17、Treg细胞及其比率的影响[J]. 北京大学学报(医学版), 2022, 54( 2): 272- 277. DOI: 10.19723/j.issn.1671-167X.2022.02.012. [64] LAN YT, WANG ZL, TIAN P, et al. Treg/Th17 imbalance and its clinical significance in patients with hepatitis B-associated liver cirrhosis[J]. Diagn Pathol, 2019, 14( 1): 114. DOI: 10.1186/s13000-019-0891-4. [65] LIU NQ, LIU B, ZHANG L, et al. Recovery of circulating CD56dim NK cells and the balance of Th17/Treg after nucleoside analog therapy in patients with chronic hepatitis B and low levels of HBsAg[J]. Int Immunopharmacol, 2018, 62: 59- 66. DOI: 10.1016/j.intimp.2018.06.043. 期刊类型引用(2)
1. 周召,鲁凤民. 细胞核受体结合蛋白1通过促进乙肝病毒核心启动子活性增强病毒复制. 国际病毒学杂志. 2024(05): 371-375 .  百度学术
百度学术2. 丁秋雅,和振坤. 一波三折:慢性乙型肝炎适时调整用药方案实现临床治愈1例. 中华肝脏病杂志. 2024(S1): 41-43 .  百度学术
百度学术其他类型引用(0)
-




 PDF下载 ( 1341 KB)
PDF下载 ( 1341 KB)


 下载:
下载:




 下载:
下载:
 百度学术
百度学术






