基于烟酰胺磷酸核糖转移酶(NAMPT)探讨红景天苷在非酒精性脂肪性肝病小鼠模型中的保护作用
DOI: 10.12449/JCH240112
Role of salidroside in a mouse model of non-alcoholic fatty liver disease: A study based on nicotinamide phosphoribosyltransferase
-
摘要:
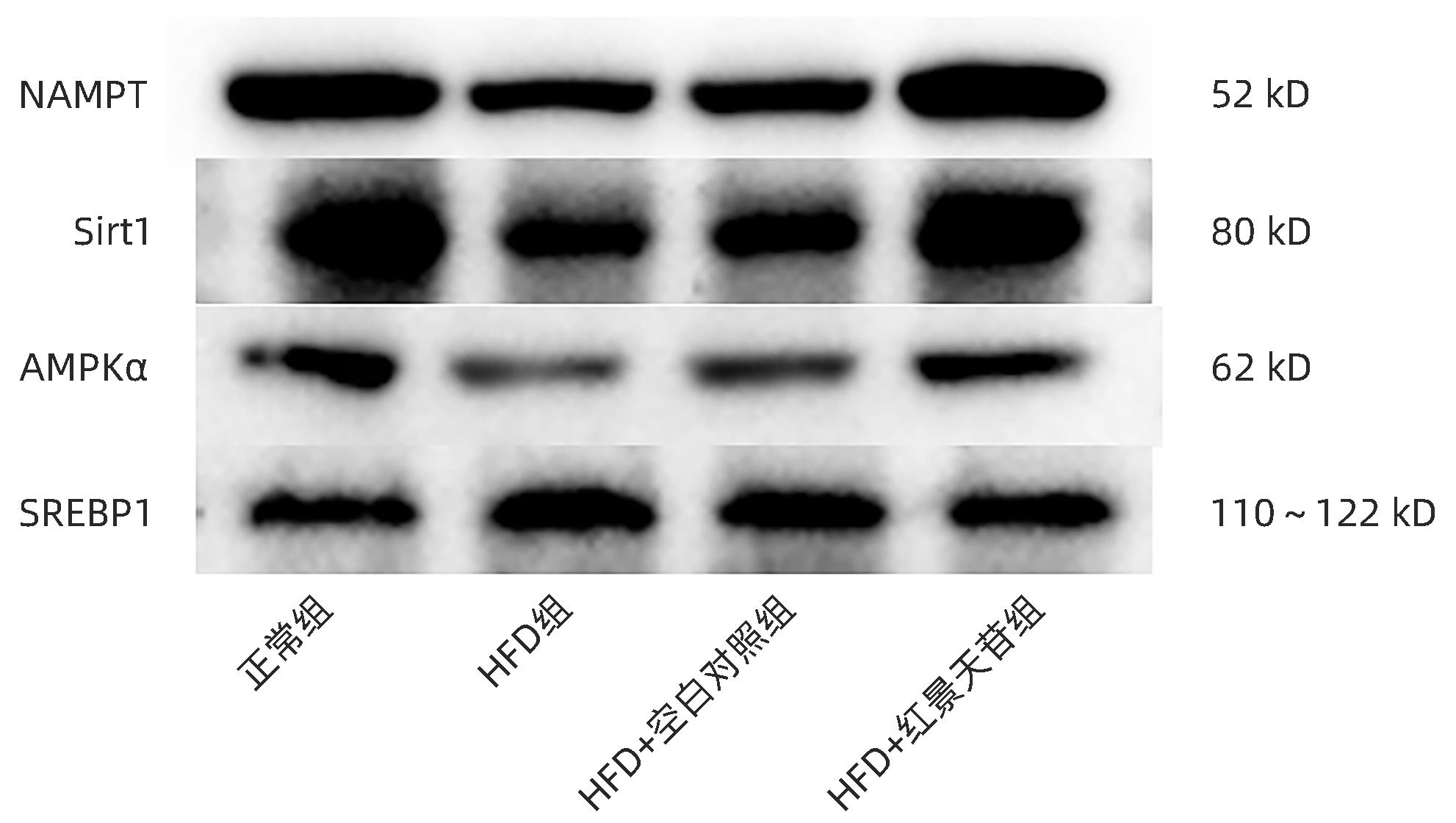
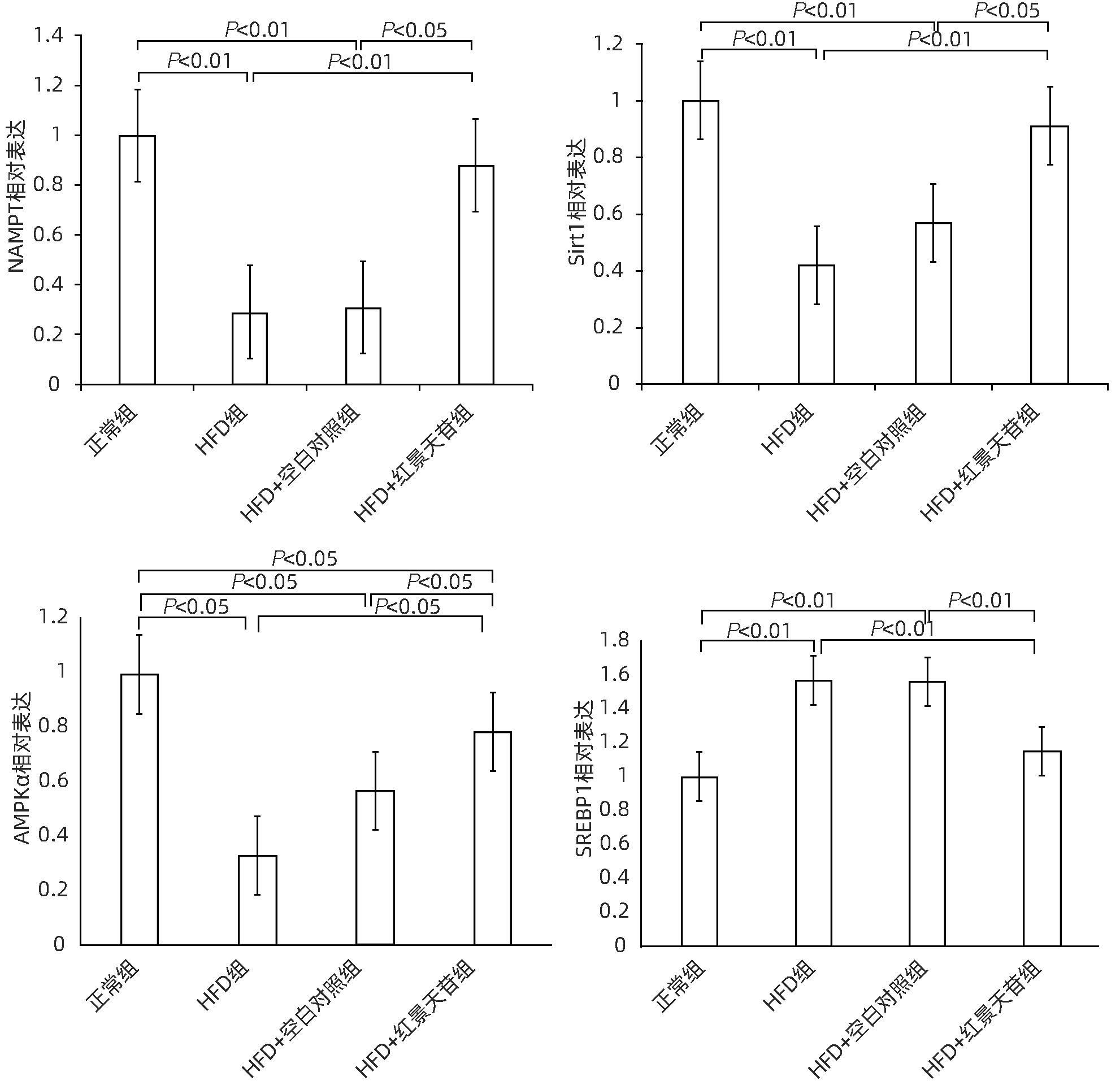
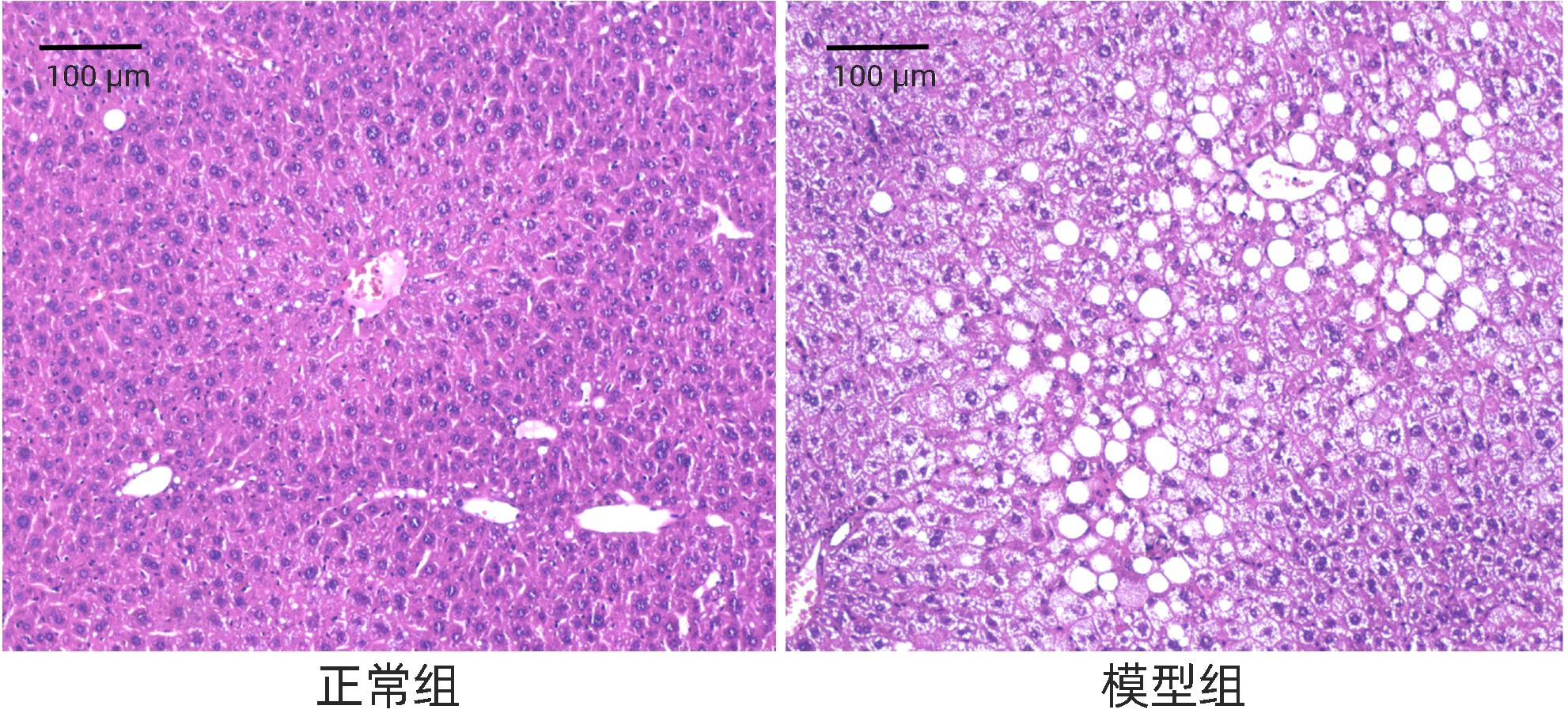
目的 研究红景天苷对非酒精性脂肪性肝病(NAFLD)的保护作用,并探讨其作用机制。 方法 将24只雄性KM小鼠随机分为正常组、高脂饮食(HFD)组、HFD+空白对照组、HFD+红景天苷组,每组6只,正常组小鼠予以普通饲料喂养,其余各组高脂饮食,造模14周开始给予100 mg·kg-1·d-1红景天苷灌胃给药,22周末取材。酶联免疫法测定血清ALT、AST、TG、TC、HDL-C、LDL-C等相关生化指标;HE染色和NAFLD活动评分(NAS)观察小鼠肝组织病理。Western Blot检测肝组织内烟酰胺磷酸核糖转移酶(NAMPT)、Sirt1、AMPKα、SREBP1的表达变化。多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。 结果 与正常组比较,HFD组小鼠肝组织存在广泛较大的脂肪滴,脂肪变性明显,NAS评分升高(P<0.01),外周血AST、ALT、TG、TC、LDL-C的含量明显增高(P值均<0.05),HDL-C含量降低(P<0.05),肝组织内NAMPT、AMPKα、Sirt1的表达降低(P值均<0.05),SERBP1的表达增加(P<0.01)。而HFD+红景天苷组较HFD组、HFD+空白对照组肝组织空泡状脂滴分布、小叶内炎症减少,肝细胞气球样变减轻,NAS评分下降(P<0.01),外周血AST、ALT、TG、LDL-C的含量明显降低(P值均<0.05),HDL-C含量升高(P<0.05),NAMPT、AMPKα、Sirt1的表达增加(P值均<0.05),SERBP1的表达减少(P<0.01)。 结论 红景天苷能明显改善高脂饮食诱导小鼠NAFLD的病理状态,并通过增加NAMPT、Sirt1、AMPKα的表达,减少SERBP1的表达,发挥其对 NAFLD的保护作用。 -
关键词:
- 烟酰胺磷酸核糖基转移酶 /
- 红景天苷 /
- 非酒精性脂肪性肝病 /
- 小鼠
Abstract:Objective To investigate the protective effect of salidroside against nonalcoholic fatty liver disease (NAFLD) and its mechanism of action. Methods A total of 24 male KM mice were randomly divided into normal group, HFD group, HFD+blank control group, and HFD+salidroside group, with 6 mice in each group. The mice in the normal group were given normal diet, and those in the other groups were given high-fat diet. After 14 weeks of modeling, the mice were given salidroside 100 mg/kg/day by gavage, and related samples were collected at the end of week 22. Enzyme-linked immunosorbent assay was used to measure the serum levels of related biochemical parameters including alanine aminotransferase (ALT), aspartate aminotransferase (AST), triglyceride (TG), total cholesterol (TC), high-density lipoprotein cholesterol (HDL-C), and low-density lipoprotein cholesterol (LDL-C); HE staining and NAFLD activity score (NAS) were used to observe the liver histopathology of mice; Western blot was used to measure the changes in the expression of NAMPT, Sirt1, AMPKα, and SREBP1 in liver tissue. A one-way analysis of variance was used for comparison between multiple groups, and the least significant difference t-test was used for further comparison between two groups. Results Compared with the normal group, the HFD group had obvious steatosis and extensive large lipid droplets in liver tissue, with significant increases in NAS score (P<0.01) and the content of AST, ALT, TG, TC, and LDL-C in peripheral blood (all P<0.05) and a significant reduction in the content of HDL-C (P<0.05), as well as significant reductions in the expression levels of NAMPT, AMPKα, and Sirt1 in liver tissue (all P<0.05) and a significant increase in the expression level of SERBP1 (P<0.01). Compared with the HFD group and the HFD+blank control group, the HFD+salidroside group had reductions in the distribution of vacuolar lipid droplets and intralobular inflammation in liver tissue, alleviation of the ballooning degeneration of hepatocytes, significant reductions in NAS score (P<0.01) and the content of AST, ALT, TG, and LDL-C in peripheral blood (all P<0.05), and a significant increase in the content of HDL-C (P<0.05), as well as significant increases in the expression levels of NAMPT, AMPKα, and Sirt1 in liver tissue (all P<0.05) and a significant reduction in the expression level of SERBP1 (P<0.01). Conclusion Salidroside can significantly improve the pathological state of mice with NAFLD induced by high-fat diet and exert a protective effect against NAFLD by increasing the expression of NAMPT, Sirt1, and AMPKα and reducing the expression of SERBP1. -
表 1 NAS评分标准
Table 1. NAS scoring criteria for liver tissue
组织学标志 评分(分) 评分标准 脂肪变性 0 <5% 1 5%~33% 2 33%~66% 3 >66% 小叶炎症 0 无 1 <2 2 2~4 3 >4 气球样变 0 无 1 很少;不明显 2 大量;显著 表 2 红景天苷对KM小鼠血清生化指标的影响
Table 2. The effect of Salidroside on serum biochemical indicators in KM mice
项目 正常组 (n=6) HFD组 (n=6) HFD+空白对照组(n=6) HFD+红景天苷组(n=6) F值 P值 ALT(U/L) 60.48±11.03 83.17±9.611) 85.17±9.291) 67.21±7.202)3) 9.940 <0.001 AST(U/L) 243.78±60.49 532.7±80.551) 575.25±114.491) 403.91±80.171)2)3) 17.970 <0.001 TG(mmol/L) 1.92±0.17 3.51±0.701) 3.90±0.851) 2.64±0.772)3) 5.180 <0.010 TC(mmol/L) 0.42±0.08 0.81±0.301) 0.88±0.271) 0.70±0.161) 10.270 <0.001 HDL-C(mmol/L) 4.29±0.95 2.39±0.631) 2.64±0.661) 3.63±0.562)3) 9.050 <0.05 LDL-C(mmol/L) 0.36±0.12 0.65±0.081) 0.67±0.111) 0.45±0.122)3) 11.510 <0.001 注:与正常组比较,1)P<0.05;与HFD组比较,2)P<0.05;与HFD+空白对照比较,3)P<0.05。 表 3 各组小鼠肝组织NAS评分
Table 3. The NAS score of liver tissue in mice of each group
组别 动物数(只) 评分(分) 正常组 6 0.33±0.52 HFD组 6 6.17±0.981) HFD+空白对照组 6 5.5±1.051) HFD+红景天苷组 6 2.5±0.551)2)3) F值 67.07 P值 <0.001 注:与正常组比较,1)P<0.01;与HFD组比较,2)P<0.01;与HFD+空白对照组比较,3)P<0.01。 -
[1] FAN JG. Epidemiology of alcoholic and nonalcoholic fatty liver disease in China[J]. J Gastroenterol Hepatol, 2013, 28( Suppl 1): 11- 17. DOI: 10.1111/jgh.12036. [2] LAZARUS JV, MARK HE, VILLOTA-RIVAS M, et al. The global NAFLD policy review and preparedness index: Are countries ready to address this silent public health challenge?[J]. J Hepatol, 2022, 76( 4): 771- 780. DOI: 10.1016/j.jhep.2021.10.025. [3] YOUNOSSI ZM, KOENIG AB, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64( 1): 73- 84. DOI: 10.1002/hep.28431. [4] CHEN SD, ZHOU HH, ZHAO ZX, et al. Jiangzhi and Hepatoprotective effect of salidroside on nonalcoholic fatty liver disease[J]. China J Tradit Chin Med Pharm, 2013, 28( 9): 2701- 2703.陈少东, 周海虹, 赵正晓, 等. 红景天苷对非酒精性脂肪性肝炎的降脂保肝作用研究[J]. 中华中医药杂志, 2013, 28( 9): 2701- 2703. [5] YANG ZR, WANG HF, ZUO TC, et al. Salidroside alleviates oxidative stress in the liver with non- alcoholic steatohepatitis in rats[J]. BMC Pharmacol Toxicol, 2016, 17: 16. DOI: 10.1186/s40360-016-0059-8. [6] SUN P, SONG SZ, JIANG S, et al. Salidroside regulates inflammatory response in raw 264.7 macrophages via TLR4/TAK1 and ameliorates inflammation in alcohol binge drinking-induced liver injury[J]. Molecules, 2016, 21( 11): 1490. DOI: 10.3390/molecules21111490. [7] ZHANG Z, PING J, XU LM. Screening Chinese medicine components for inhibition of human hepatic stellate cell migration[J]. J Clin Hepatol, 2012, 28( 3): 183- 188, 191. DOI: 10.3969/j.issn.1001-5256.2012.03.007.张展, 平键, 徐列明. 抑制人肝星状细胞株迁移的中药组分筛选[J]. 临床肝胆病杂志, 2012, 28( 3): 183- 188, 191. DOI: 10.3969/j.issn.1001-5256.2012.03.007. [8] WANG LF, WANG XN, HUANG CC, et al. Inhibition of NAMPT aggravates high fat diet-induced hepatic steatosis in mice through regulating Sirt1/AMPKα/SREBP1 signaling pathway[J]. Lipids Health Dis, 2017, 16( 1): 82. DOI: 10.1186/s12944-017-0464-z. [9] KOBYLIAK N, ABENAVOLI L. The role of liver biopsy to assess non-alcoholic fatty liver disease[J]. Rev Recent Clin Trials, 2014, 9( 3): 159- 169. DOI: 10.2174/1574887109666141216102231. [10] ALAMEDDINE A, FAJLOUN Z, BOURREAU J, et al. The cardiovascular effects of salidroside in the Goto-Kakizaki diabetic rat model[J]. J Physiol Pharmacol, 2015, 66( 2): 249- 257. [11] WANG SY, ZHAO XX, YANG SX, et al. Salidroside alleviates high glucose-induced oxidative stress and extracellular matrix accumulation in rat glomerular mesangial cells by the TXNIP-NLRP3 inflammasome pathway[J]. Chem Biol Interact, 2017, 278: 48- 53. DOI: 10.1016/j.cbi.2017.10.012. [12] FAN XJ, WANG Y, WANG L, et al. Salidroside induces apoptosis and autophagy in human colorectal cancer cells through inhibition of PI3K/Akt/mTOR pathway[J]. Oncol Rep, 2016, 36( 6): 3559- 3567. DOI: 10.3892/or.2016.5138. [13] WANG MH, LUO L, YAO LL, et al. Salidroside improves glucose homeostasis in obese mice by repressing inflammation in white adipose tissues and improving leptin sensitivity in hypothalamus[J]. Sci Rep, 2016, 6: 25399. DOI: 10.1038/srep25399. [14] GUO Y, WANG SY, YI JJ, et al. Effect of salidroside on apoptosis of CD71+ nucleated red blood cells in bone marrow in high altitude polycythemia model rats[J]. J Jilin Univ(Med Ed), 2023, 49( 5): 1174- 1181. DOI: 10.13481/j.1671-587X.20230510.郭勇, 王生艳, 易静静, 等. 红景天苷对高原红细胞增多症模型大鼠骨髓CD71+有核红细胞凋亡的影响[J]. 吉林大学学报(医学版), 2023, 49( 5): 1174- 1181. DOI: 10.13481/j.1671-587X.20230510. [15] DAI N, ZOU Y, WANG HF, et al. Inhibitory effect of salidroside on liver oxidative stress in rats with non-alcoholic steatohepatitis[J]. Chin J Pathophysiol, 2013, 29( 9): 1704- 1708. DOI: 10.3969/j.issn.1000-4718.2013.09.030.戴宁, 邹原, 王慧芳, 等. 红景天苷对非酒精性脂肪性肝炎大鼠肝组织氧化应激的抑制作用[J]. 中国病理生理杂志, 2013, 29( 9): 1704- 1708. DOI: 10.3969/j.issn.1000-4718.2013.09.030. [16] ZHANG XR. The mechanism of salidroside regulating glucose and lipid metabolism in type 2 diabetes mice through microRNA[D]. Changchun: Jilin University, 2016.张新茹. 红景天苷在2型糖尿病小鼠中通过microRNA改善糖脂代谢的机制研究[D]. 长春: 吉林大学, 2016. [17] WU TF, LIAO XH, ZHONG BH. Epidemiology of nonalcoholic fatty liver disease in some regions of China[J]. J Clin Hepatol, 2020, 36( 6): 1370- 1373. DOI: 10.3969/j.issn.1001-5256.2020.06.039.吴挺丰, 廖献花, 钟碧慧. 中国部分地区非酒精性脂肪肝病的流行情况[J]. 临床肝胆病杂志, 2020, 36( 6): 1370- 1373. DOI: 10.3969/j.issn.1001-5256.2020.06.039. [18] LI YY, XIE ZY. Advances in the etiology and treatment of non-obese nonalcoholic fatty liver disease[J]. J Clin Hepatol, 2021, 37( 2): 452- 457. DOI: 10.3969/j.issn.1001-5256.2021.02.043.李洋洋, 谢正元. 非肥胖型非酒精性脂肪性肝病的病因及治疗进展[J]. 临床肝胆病杂志, 2021, 37( 2): 452- 457. DOI: 10.3969/j.issn.1001-5256.2021.02.043. [19] National Workshop on Fatty Liver and Alcoholic Liver Disease, Chinese Society of Hepatology, Chinese Medical Association, Fatty Liver Expert Committee, Chinese Medical Doctor Association. Guidelines of prevention and treatment for nonalcoholic fatty liver disease: A 2018 update[J]. J Clin Hepatol, 2018, 34( 5): 947- 957. DOI: 10.3969/j.issn.1001-5256.2018.05.007.中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 非酒精性脂肪性肝病防治指南(2018年更新版)[J]. 临床肝胆病杂志, 2018, 34( 5): 947- 957. DOI: 10.3969/j.issn.1001-5256.2018.05.007. [20] RONGVAUX A, SHEA RJ, MULKS MH, et al. Pre-B-cell colony-enhancing factor, whose expression is up-regulated in activated lymphocytes, is a nicotinamide phosphoribosyltransferase, a cytosolic enzyme involved in NAD biosynthesis[J]. Eur J Immunol, 2002, 32( 11): 3225- 3234. DOI: 3.0.CO;2-L">10.1002/1521-4141(200211)32: 11<3225: AID-IMMU3225>3.0.CO;2-L. [21] KOHJIMA M, HIGUCHI N, KATO M, et al. SREBP-1c, regulated by the insulin and AMPK signaling pathways, plays a role in nonalcoholic fatty liver disease[J]. Int J Mol Med, 2008, 21( 4): 507- 511. [22] JEON TI, OSBORNE TF. SREBPs: Metabolic integrators in physiology and metabolism[J]. Trends Endocrinol Metab, 2012, 23( 2): 65- 72. DOI: 10.1016/j.tem.2011.10.004. -



 PDF下载 ( 1759 KB)
PDF下载 ( 1759 KB)

 下载:
下载: