四烯甲萘醌(MK-4)对CCl4诱导的急性肝损伤小鼠模型的保护作用分析
DOI: 10.12449/JCH240121
Menaquinone-4 exerts a protective effect against carbon tetrachloride-induced acute liver injury in mice by alleviating ferroptosis
-
摘要:
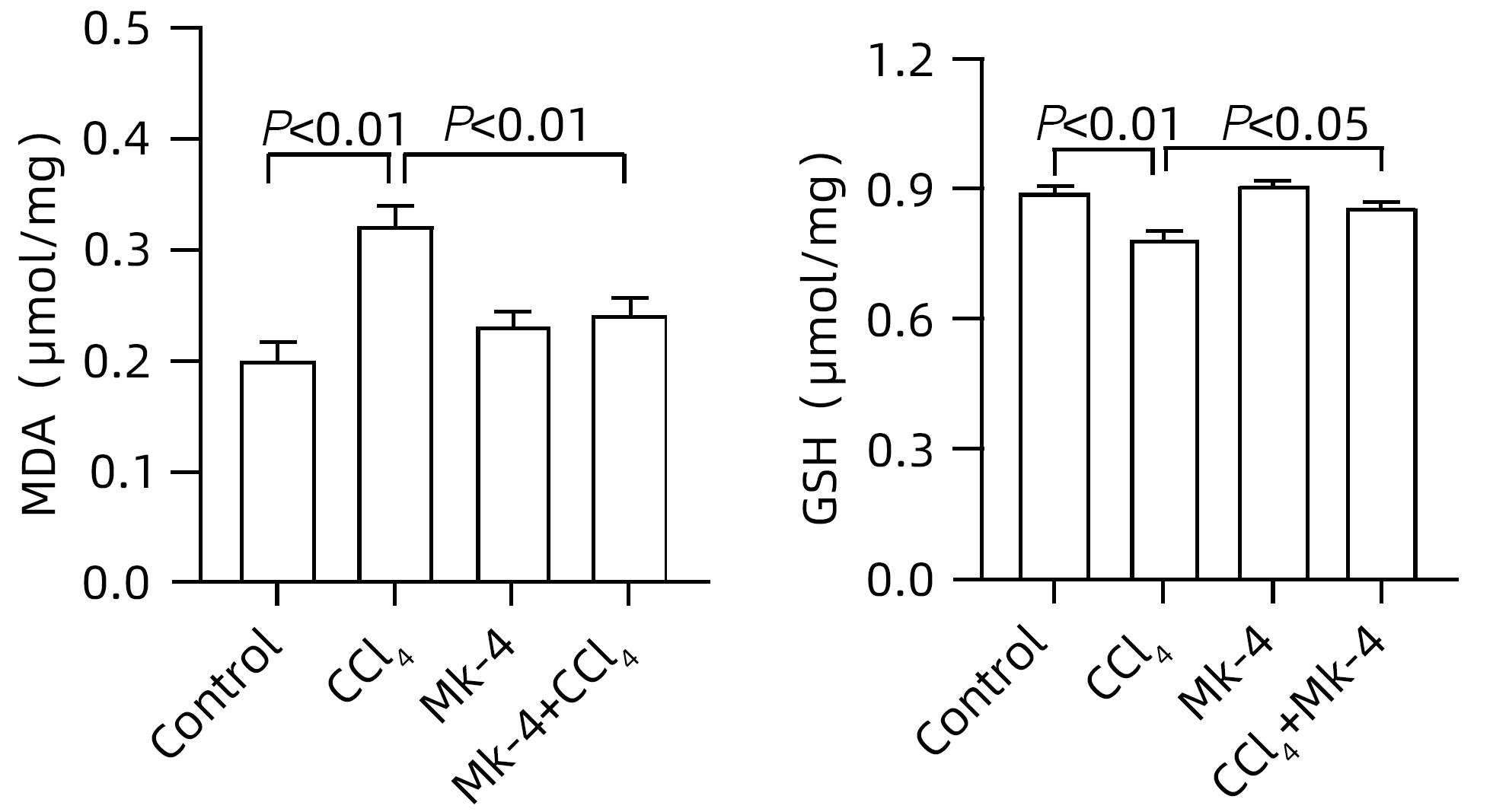
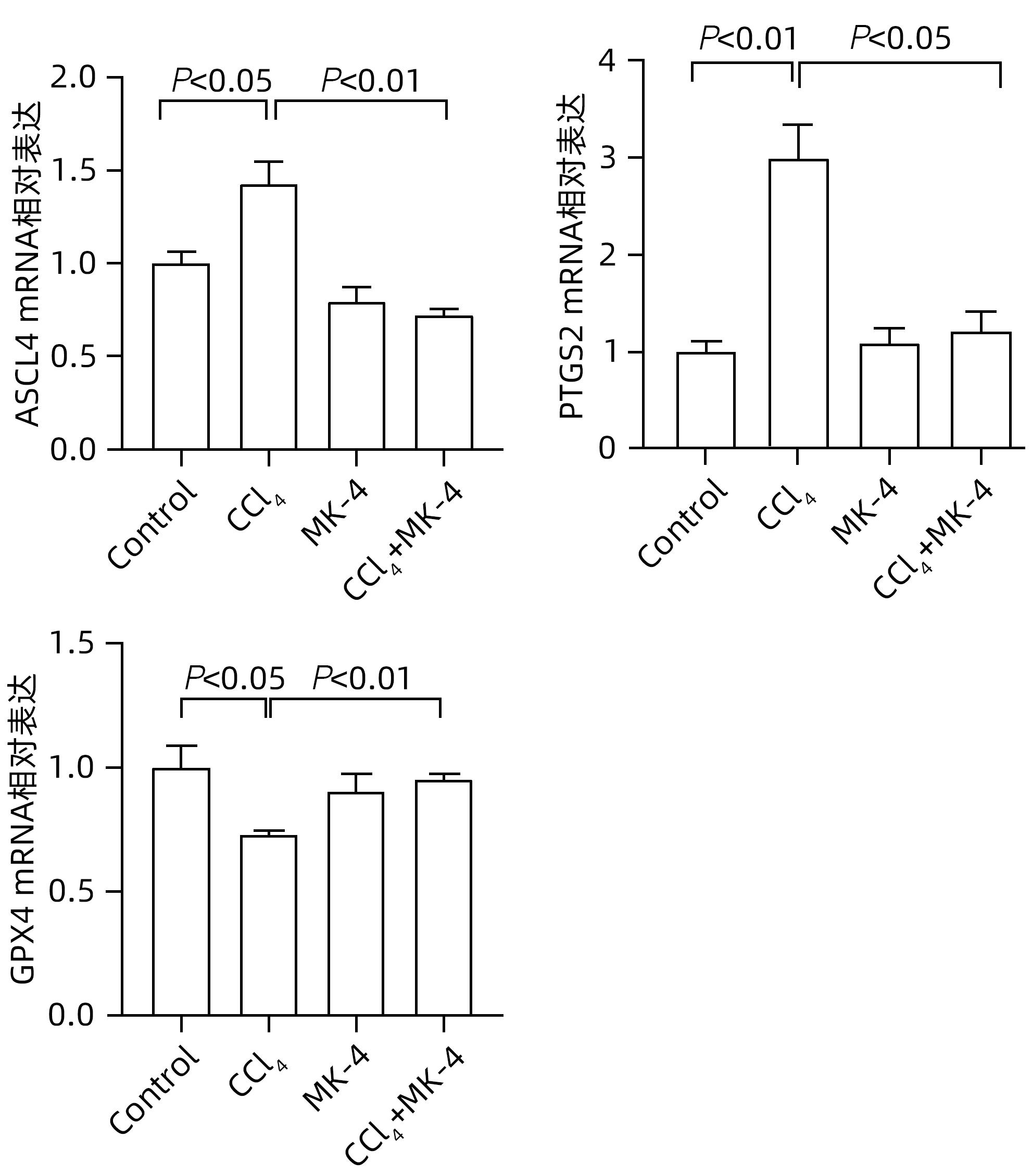
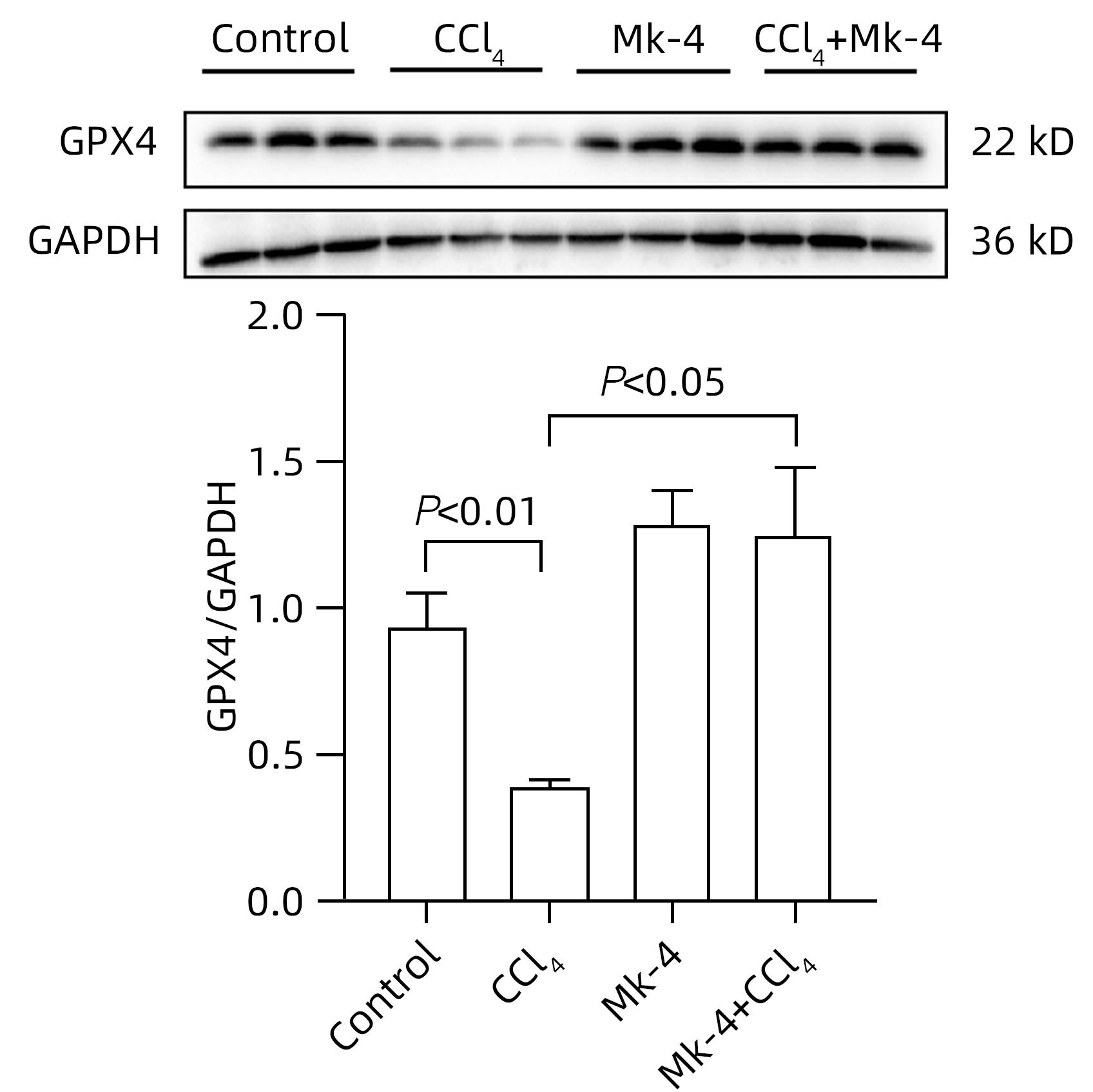
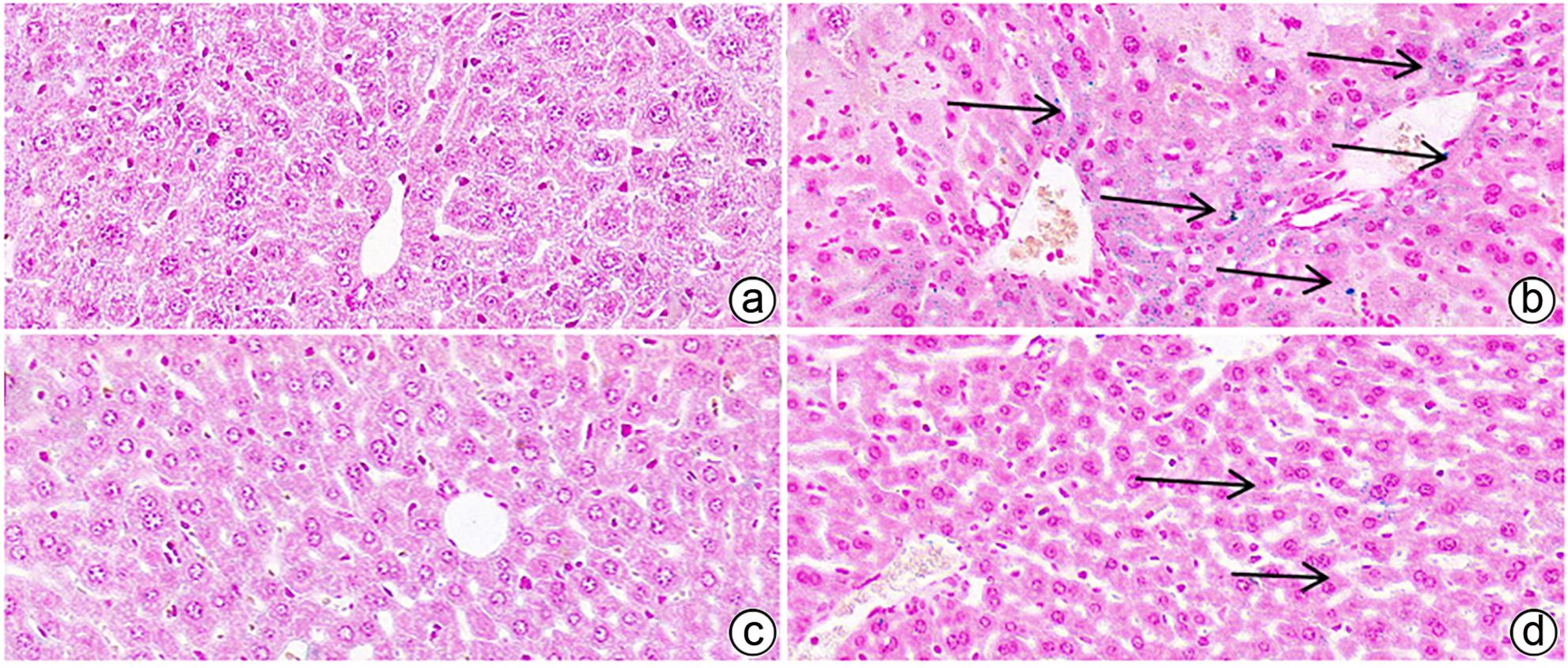
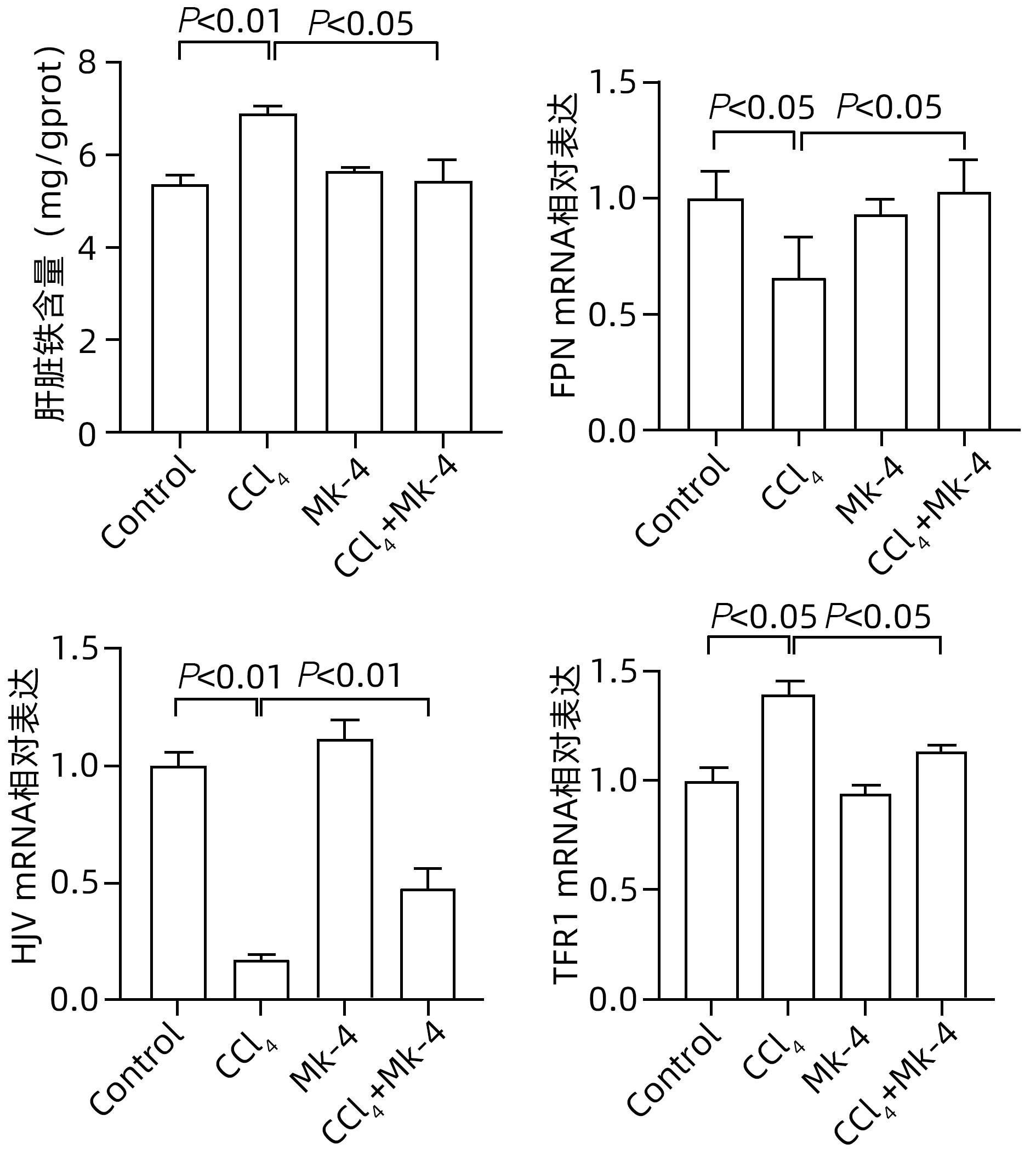
目的 探究四烯甲萘醌(MK-4)通过减轻铁死亡对四氯化碳(CCl4)诱导的急性肝损伤(ALI)小鼠的保护作用及其机制。 方法 选用8周龄成年ICR雄鼠,适应性饲养后,分为Control组、MK-4组、CCl4模型组(6、12、24 h)、MK-4+CCl4组(6、12、24 h),每组6只。Control组腹腔注射同等剂量玉米油;MK-4组腹腔注射40 mg/kg的MK-4溶液,1 h后腹腔注射同等剂量玉米油;MK-4+CCl4组(6、12、24 h)先腹腔注射40 mg/kg的MK-4溶液,1 h后和CCl4模型组(6、12、24 h)同时腹腔注射0.3 mL/kg CCl4溶液,分别在6、12、24 h进行取材。通过HE染色观察小鼠肝脏的病理变化;普鲁士蓝染色检测肝组织中铁聚集;生化仪检测小鼠血清中AST和ALT水平;试剂盒检测肝匀浆中组织铁含量、氧化应激指标丙二醛(MDA)、谷胱甘肽(GSH)水平;RT-PCR检测铁死亡标志基因长链脂酰辅酶A合成酶4(ACSL4)、前列腺素内过氧化物酶2(PTGS2)和谷胱甘肽过氧化物酶4(GPX4)以及铁代谢相关基因铁调素调节蛋白(HJV)、转铁蛋白受体1(TFR1)和膜转铁蛋白(FPN)的表达,Western Blot检测GPX4的蛋白表达水平。计量资料多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。 结果 在时效研究中,与Control组相比,CCl4模型组(12、24 h)的肝质量系数和血清ALT、AST水平明显上升(P值均<0.05),且通过HE染色结果也反映出,肝损伤程度随着时间延长逐渐加重。同时,MK-4+CCl4(6、12、24 h)组和CCl4模型组(6、12、24 h)相比时,MK-4+CCl4(12 h)组的肝质量系数和血清ALT、AST水平下降(P值均<0.05),且肝组织的坏死面积减少,因此在后续研究中采用12 h的小鼠各组织样本进行检测。与Control组相比,CCl4组MDA上升,GSH下降,差异均有统计学意义(P值均<0.05);与CCl4组相比,MK-4+CCl4组MDA下降,GSH上升,差异均有统计学意义(P值均<0.05)。铁死亡关键指标ASCL4、PTGS2,与Control组相比,CCl4组显著上升,GPX4则显著下降,差异均有统计学意义(P值均<0.05);MK-4+CCl4组较CCl4组而言,ASCL4、PTGS2的mRNA水平下降,GPX4的mRNA水平上升,差异均有统计学意义(P值均<0.05)。蛋白质免疫印迹的结果显示,与Control组相比,CCl4组蛋白表达水平下降,MK-4+CCl4组较CCl4组相比,蛋白表达水平上升,差异均有统计学意义(P值均<0.05)。普鲁士蓝染色结果显示:与Control组相比,CCl4组铁聚集明显上升,MK-4干预后,MK-4+CCl4组较CCl4组铁聚集点下降。同时在对小鼠肝脏铁代谢基因的检测中发现,与Control组相比,CCl4组铁含量显著上升,FPN、HJV的mRNA水平下降,TFR1的mRNA水平上升,差异均有统计学意义(P值均<0.05);进行MK-4进行保护后,铁含量下降,FPN、HJV的mRNA水平上升,TFR1的mRNA水平下降,差异均有统计学意义(P值均<0.05)。 结论 MK-4提前干预可减轻CCl4诱导的小鼠ALI,其机制可能主要是通过抑制铁死亡并改善了小鼠肝脏铁代谢相关基因的表达。 Abstract:Objective To investigate whether menaquinone-4 (MK-4) can exert a protective effect against carbon tetrachloride (CCl4)-induced acute liver injury (ALI) in mice by alleviating ferroptosis. Methods After adaptive feeding, adult male ICR mice, aged 8 weeks, were divided into Control group, MK-4 group, CCl4 model group (6-hour, 12-hour, and 24-hour), and MK-4+CCl4 group (6-hour, 12-hour, and 24-hour), with 6 mice in each group. The mice in the Control group were given intraperitoneal injection of an equal dose of corn oil; the mice in the MK-4 group were given intraperitoneal injection of 40 mg/kg MK-4 solution, followed by an equal dose of corn oil after 1 hour; the mice in the MK-4+CCl4 group (6-hour, 12-hour, and 24-hour) were given intraperitoneal injection of 40 mg/kg MK-4 solution, and after 1 hour, the mice in this group and the CCl4 model group (6-hour, 12-hour, and 24-hour) were given intraperitoneal injection of 0.3 mL/kg CCl4 solution, with samples collected at 6, 12, and 24 hours. HE staining was used to observe the pathological changes of mouse liver; Prussian blue staining was used to observe iron accumulation in liver tissue; a biochemical analyzer was used to measure the serum levels of aspartate aminotransferase (AST) and alanine aminotransferase (ALT); related kits were used to measure the levels of tissue iron content and the oxidative stress indices malondialdehyde (MDA) and glutathione (GSH) in liver homogenate; RT-PCR was used to measure the expression levels of ferroptosis marker genes (acyl-CoA synthetase long-chain family member 4 [ACSL4], prostaglandin-endoperoxide synthase 2 [PTGS2], and glutathione peroxidase 4 [GPX4]) and iron metabolism-related genes (hemojuvelin [HJV], transferrin receptor 1 [TFR1], and ferroportin [FPN]), and Western blot was used to measure the protein expression level of GPX4. A one-way analysis of variance was used for comparison of continuous data between multiple groups, and the least significant difference t-test was used for further comparison between two groups. Results In the aging study, compared with the Control group, the CCl4 model group (6-hour, 12-hour, and 24-hour) had significant increases in liver weight coefficient and the serum levels of ALT and AST (all P<0.05), and HE staining also showed that liver injury gradually aggravated over time. Meanwhile, compared with the CCl4 model group (6-hour, 12-hour, and 24-hour), the MK-4+CCl4 (12-hour) group had significant reductions in liver weight coefficient and the serum levels of ALT and AST (all P<0.05), with a reduction in the necrotic area of liver tissue, and therefore, 12-hour mouse tissue samples were used for detection in the following study. Compared with the Control group, the CCl4 group had a significant increase in MDA and a significant reduction in GSH (both P<0.05), and compared with the CCl4 group, the MK-4+CCl4 group had a significant reduction in MDA and a significant increase in GSH (both P<0.05). Compared with the Control group, the CCl4 group had significant increases in the key ferroptosis indices ASCL4 and PTGS2 and a significant reduction in GPX4 (all P<0.05); compared with the CCl4 group, the MK-4+CCl4 group had significant reductions in the mRNA expression levels of ASCL4 and PTGS2 and a significant increase in the mRNA expression level of GPX4 (all P<0.05). Western blotting showed that compared with the Control group, the CCl4 group had a significant reduction in the protein expression level of GPX4 (P<0.05), and compared with the CCl4 group, the MK-4+CCl4 group had a significant increase in the protein expression level of GPX4 (P<0.05). Prussian blue staining showed that compared with the Control group, the CCl4 group had a significant increase in iron accumulation; after MK-4 intervention, compared with the CCl4 group, the MK-4+CCl4 group had a significant reduction in iron accumulation. As for the measurement of iron metabolism genes in mouse liver, compared with the Control group, the CCl4 group had a significant increase in iron content, significant reductions in the mRNA expression levels of FPN and HJV, and a significant increase in the mRNA expression level of TFR1 (all P<0.05); after protection with MK-4, there was a significant reduction in iron content, significant increases in the mRNA expression levels of FPN and HJV, and a significant reduction in the mRNA expression level of TFR1 (all P<0.05). Conclusion MK-4 intervention in advance can alleviate CCl4-induced ALI in mice, possibly by inhibiting ferroptosis and improving the expression of iron metabolism-related genes in mouse liver. -
Key words:
- Liver Failure, Acute /
- Ferroptosis /
- Menaquinone-4 /
- Mice, Inbred ICR
-
表 1 基因的引物序列
Table 1. The primer sequence of the gene
序号 基因名 序列(5′-3′) 1 18S F:GTAACCCGTTGAACCCCATT R:CCATCCAATCGGTAGTAGCG 2 ACSL4 F:CTTCCTCTTAAGGCCGGGAC R:TGCCATAGCGTTTTTCTTAGATTT 3 PTGS2 F: GGGCTCAGCCAGGCAGCAAAT R:GCACTGTGTTTGGGGTGGGCT 4 GPX4 F:GCAACCAGTTTGGGAGGCAGGA R:CCTCCATGGGACCATAGCGCTTC 5 FPN F:ATGGCTACCGCTGGTGTGGC R:CACCTTGCCATCGTTGCGGC 6 HJV F:ATGGGCCAGTCCCCTAGTC R:GACGAGACATACTCGGCATTG 7 TFR1 F:CGAACTGGCTGGTCATCT R:TGTCTCTTGTCTCTACATTCCT 表 2 各组小鼠肝质量系数比较
Table 2. Liver weight coefficient of mice in each group
组别 动物数(只) 肝质量系数 Control组 6 0.049±0.003 MK-4组 6 0.046±0.002 CCl4(6 h)组 6 0.054±0.003 CCl4(12 h)组 6 0.056±0.0031) CCl4(24 h)组 6 0.053±0.0021) MK-4+CCl4(6 h)组 6 0.051±0.002 MK-4+CCl4(12 h)组 6 0.052±0.0032) MK-4+CCl4(24 h)组 6 0.055±0.002 F值 8.088 P值 <0.01 注:与Control组比较,1)P<0.05;与CCl4(12 h)组比较,2)P<0.05。 表 3 各组小鼠血清中 ALT、AST 水平
Table 3. Serum ALT and AST levels of mice in each group
组别 动物数(只) ALT(U/L) AST(U/L) Control组 6 42.920±2.676 134.480±21.603 MK-4组 6 51.200±10.232 140.000±25.140 CCl4(6 h)组 6 231.540±73.9191) 245.500±29.8441) CCl4(12 h)组 6 9 285.600±1 990.9301) 7 611.000±2 429.2691) CCl4(24 h)组 6 31 123.750±3 635.7681) 18 536.000±7 222.5131) MK-4+CCl4(6 h)组 6 215.700±48.565 242.850±25.378 MK-4+CCl4(12 h)组 6 5 053.000±380.3912) 3 258.000±1280.5552) MK-4+CCl4(24 h)组 6 29 431.250±2 538.912 11 605.000±6 190.560 F值 275.144 13.426 P值 <0.001 <0.01 注:与Control组比较,1)P<0.01;与CCl4(12 h)组比较,2)P<0.05。 -
[1] SHRESTHA DB, BUDHATHOKI P, SEDHAI YR, et al. N-acetyl cysteine versus standard of care for non-acetaminophen induced acute liver injury: A systematic review and meta-analysis[J]. Ann Hepatol, 2021, 24: 100340. DOI: 10.1016/j.aohep.2021.100340. [2] BHAKUNI GS, BEDI O, BARIWAL J, et al. Animal models of hepatotoxicity[J]. Inflamm Res, 2016, 65( 1): 13- 24. DOI: 10.1007/s00011-015-0883-0. [3] LIANG DG, MINIKES AM, JIANG XJ. Ferroptosis at the intersection of lipid metabolism and cellular signaling[J]. Mol Cell, 2022, 82( 12): 2215- 2227. DOI: 10.1016/j.molcel.2022.03.022. [4] JIANG XJ, STOCKWELL BR, CONRAD M. Ferroptosis: Mechanisms, biology and role in disease[J]. Nat Rev Mol Cell Biol, 2021, 22( 4): 266- 282. DOI: 10.1038/s41580-020-00324-8. [5] LIN FY, CHEN WY, ZHOU JH, et al. Mesenchymal stem cells protect against ferroptosis via exosome-mediated stabilization of SLC7A11 in acute liver injury[J]. Cell Death Dis, 2022, 13( 3): 271. DOI: 10.1038/s41419-022-04708-w. [6] VERVOORT LM, RONDEN JE, THIJSSEN HH. The potent antioxidant activity of the vitamin K cycle in microsomal lipid peroxidation[J]. Biochem Pharmacol, 1997, 54( 8): 871- 876. DOI: 10.1016/s0006-2952(97)00254-2. [7] LI JR, LIN JC, WANG H, et al. Novel role of vitamin k in preventing oxidative injury to developing oligodendrocytes and neurons[J]. J Neurosci, 2003, 23( 13): 5816- 5826. DOI: 10.1523/JNEUROSCI.23-13-05816.2003. [8] MISHIMA E, ITO J, WU ZJ, et al. A non-canonical vitamin K cycle is a potent ferroptosis suppressor[J]. Nature, 2022, 608( 7924): 778- 783. DOI: 10.1038/s41586-022-05022-3. [9] DIXON SJ, LEMBERG KM, LAMPRECHT MR, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149( 5): 1060- 1072. DOI: 10.1016/j.cell.2012.03.042. [10] QIAN MY, LIU MY, TAO CL, et al. Research progress of macrophages death[J]. Chin J Immun, 2023, 39( 1): 204- 210. DOI: 10.3969/j.issn.1000-484X.2023.01.034.钱敏雅, 刘满宇, 陶晨璐, 等. 巨噬细胞死亡方式的研究进展[J]. 中国免疫学杂志, 2023, 39( 1): 204- 210. DOI: 10.3969/j.issn.1000-484X.2023.01.034. [11] SAMRA YA, HAMED MF, EL-SHEAKH AR. Hepatoprotective effect of allicin against acetaminophen-induced liver injury: Role of inflammasome pathway, apoptosis, and liver regeneration[J]. J Biochem Mol Toxicol, 2020, 34( 5): e22470. DOI: 10.1002/jbt.22470. [12] SATO T, SCHURGERS LJ, UENISHI K. Comparison of menaquinone-4 and menaquinone-7 bioavailability in healthy women[J]. Nutr J, 2012, 11: 93. DOI: 10.1186/1475-2891-11-93. [13] YANG WS, SRIRAMARATNAM R, WELSCH ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156( 1-2): 317- 331. DOI: 10.1016/j.cell.2013.12.010. [14] STOCKWELL BR, ANGELI JPF, BAYIR H, et al. Ferroptosis: A regulated cell death nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171( 2): 273- 285. DOI: 10.1016/j.cell.2017.09.021. [15] PIETRANGELO A. Genetics, genetic testing, and management of hemochromatosis: 15 years since hepcidin[J]. Gastroenterology, 2015, 149( 5): 1240- 1251.e4. DOI: 10.1053/j.gastro.2015.06.045. [16] ZHANG L, LIAO YQ, XIA QC, et al. Ferroptosis regulatory signaling pathway and its research progress in related diseases[J]. Chin J Clin Pharmacol Ther, 2022, 27( 2): 227- 234. DOI: 10.12092/j.issn.1009-2501.2022.02.015.张亮, 廖勇群, 夏秦川, 等. 铁死亡调控信号通路以及在相关疾病中的研究进展[J]. 中国临床药理学与治疗学, 2022, 27( 2): 227- 234. DOI: 10.12092/j.issn.1009-2501.2022.02.015. [17] YANG WS, STOCKWELL BR. Ferroptosis: Death by lipid peroxidation[J]. Trends Cell Biol, 2016, 26( 3): 165- 176. DOI: 10.1016/j.tcb.2015.10.014. [18] FENG H, STOCKWELL BR. Unsolved mysteries: How does lipid peroxidation cause ferroptosis[J]. PLoS Biol, 2018, 16( 5): e2006203. DOI: 10.1371/journal.pbio.2006203. -



 PDF下载 ( 2106 KB)
PDF下载 ( 2106 KB)


 下载:
下载: