NOD样受体蛋白3(NLRP3)炎性小体在肝细胞癌发生发展中的作用
DOI: 10.12449/JCH240229
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:余学海负责课题设计,查阅文献,撰写论文;刘伊敏、马勇新、张旭升、周红才负责查阅收集文献,修改论文;马海燕负责图片制作和格式修改;陈本栋负责拟定写作思路,指导撰写文章并最后定稿。
Role of NOD-like receptor protein 3 inflammasome in the development and progression of hepatocellular carcinoma
-
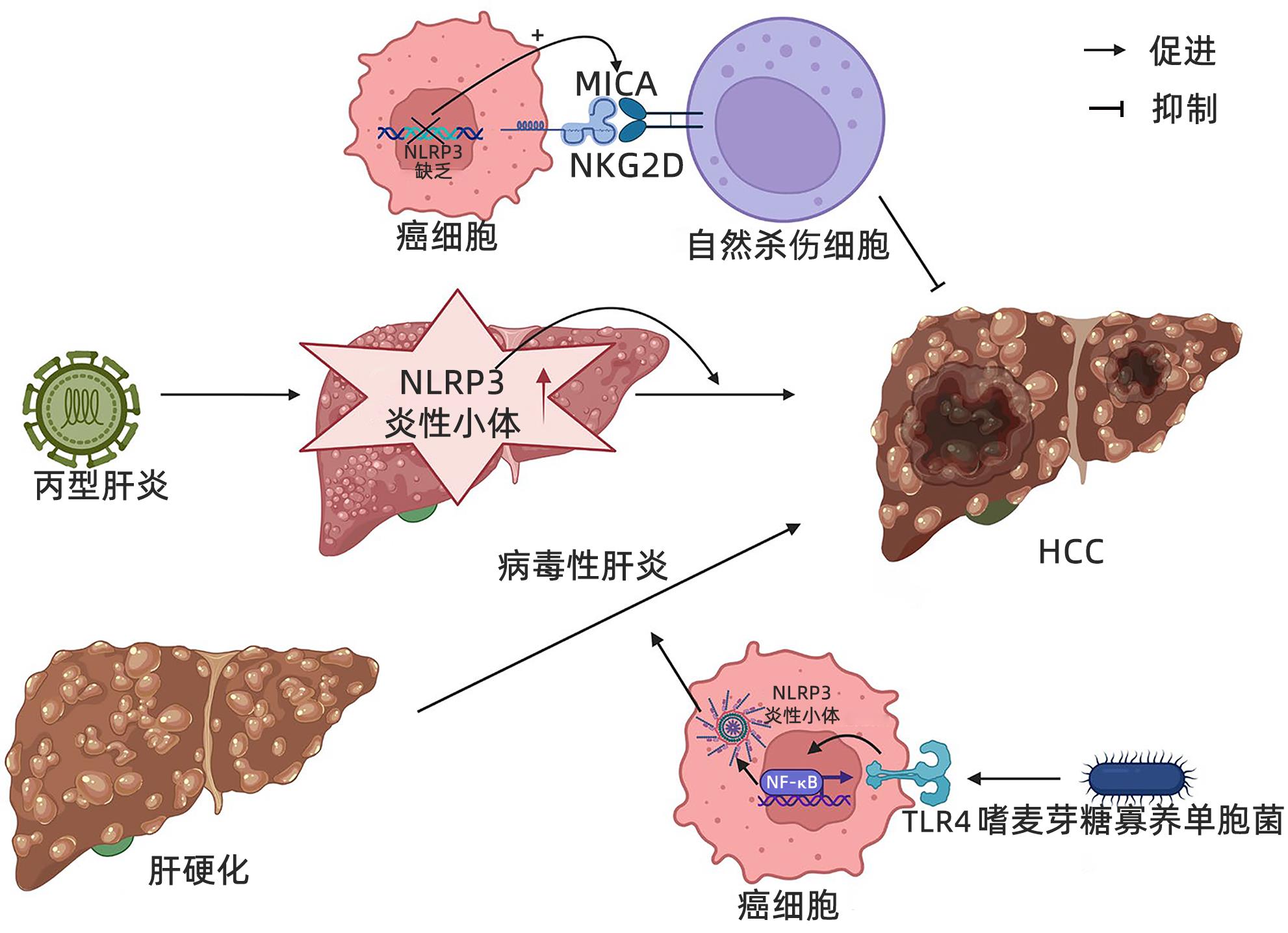
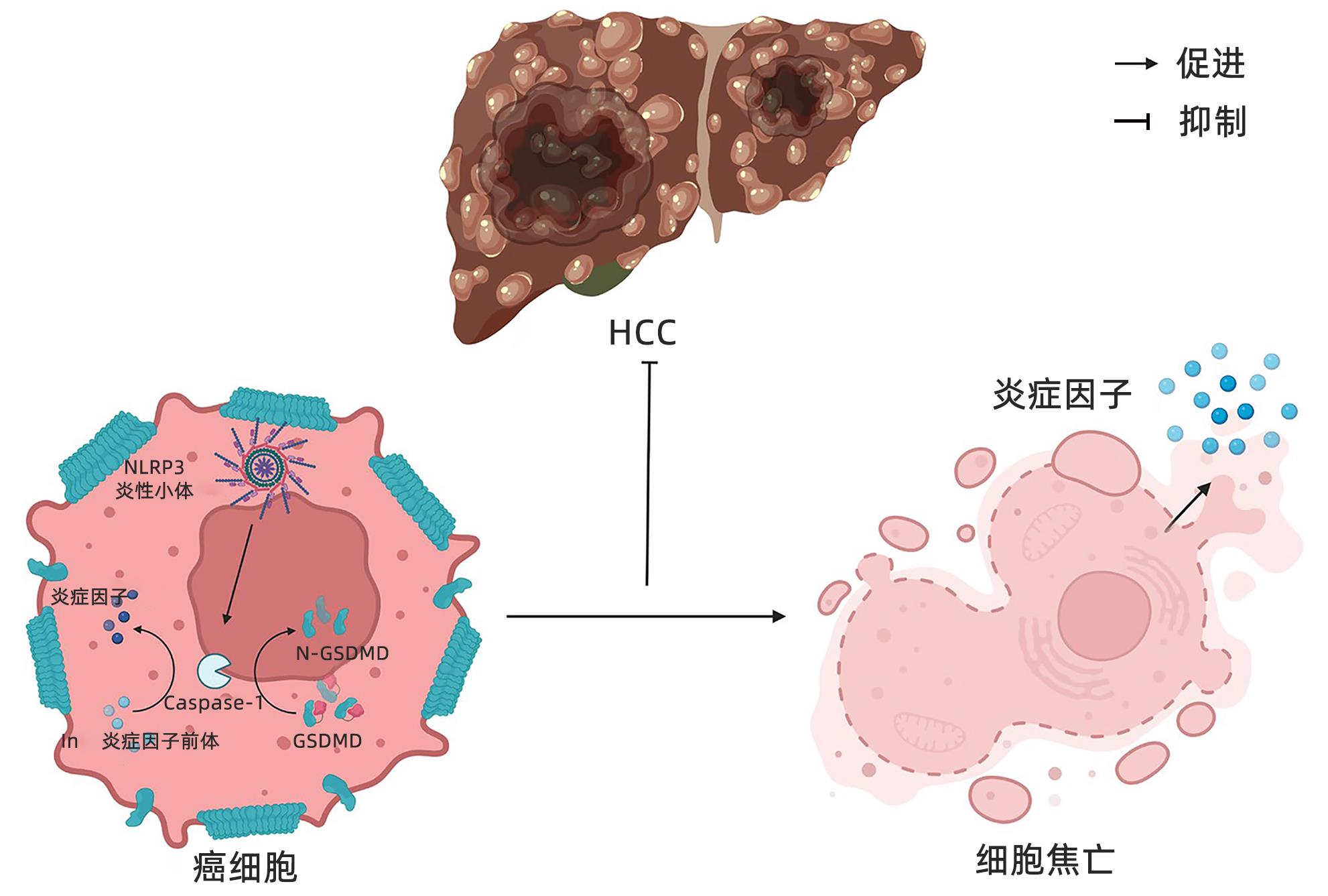
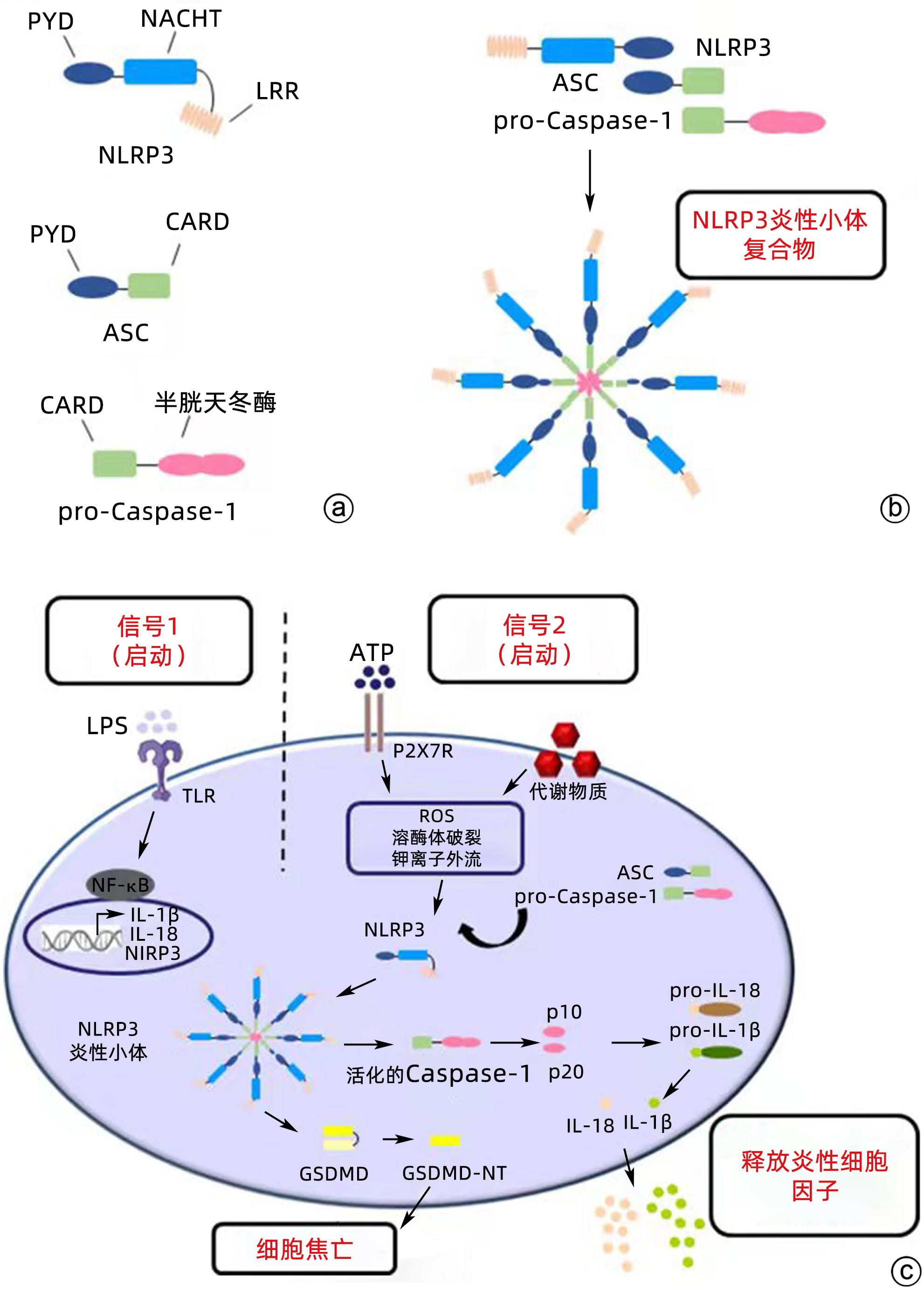
摘要: 近年来,关于NOD样受体蛋白3(NLRP3)炎性小体在肿瘤中的研究已成为热点话题,尤其是在黑色素瘤、结直肠癌、肺癌、乳腺癌等肿瘤中,越来越多的证据表明炎症在促进肿瘤的发生发展、血管生成和肿瘤侵袭中具有重要的作用。肝细胞癌(HCC)是原发性肝癌中最常见的类型,而关于NLRP3炎性小体在HCC发生发展中的作用仍争议不断。因此,本文就NLRP3炎性小体在HCC进展过程中的潜在影响以及在抗癌治疗中的作用机制作一综述,认为NLRP3炎性小体可以作为HCC患者的有效治疗靶点。
-
关键词:
- 癌, 肝细胞 /
- NLR家族, 热蛋白结构域包含蛋白3 /
- 细胞焦亡
Abstract: In recent years, NOD-like receptor protein 3 (NLRP3) inflammasome in tumors has become a research hotspot, especially in melanoma, colorectal cancer, lung cancer, and breast cancer, and more and more evidence has shown that inflammation plays a role in the development, progression, angiogenesis, and invasion of cancer. Hepatocellular carcinoma (HCC) is the most common type of primary liver cancer, and there are still controversies over the role of NLRP3 inflammasome in the development and progression of HCC. Therefore, this article reviews the potential impact of NLRP3 inflammasome in the progression of HCC and its mechanism of action in anticancer therapy, and it is believed that NLRP3 inflammasome can be used as an effective therapeutic target for HCC patients. -
-
[1] LI Z, ZHU JY. Interpretation of standard for diagnosis and treatment of primary liver cancer(2022 edition)[J]. J Clin Hepatol, 2022, 38( 5): 1027- 1029. DOI: 10.3969/j.issn.1001-5256.2022.05.010.李照, 朱继业.《原发性肝癌诊疗指南(2022年版)》解读[J]. 临床肝胆病杂志, 2022, 38( 5): 1027- 1029. DOI: 10.3969/j.issn.1001-5256.2022.05.010. [2] YANG JD, HAINAUT P, GORES GJ, et al. A global view of hepatocellular carcinoma: Trends, risk, prevention and management[J]. Nat Rev Gastroenterol Hepatol, 2019, 16( 10): 589- 604. DOI: 10.1038/s41575-019-0186-y. [3] HUANG XY, CHAO X, HUANG F. Research progress on role of pyroptosis in progress of primary liver cancer[J]. Drug Eval Res, 2021, 44( 7): 1535- 1540. DOI: 10.7501/j.issn.1674-6376.2021.07.026.黄鑫悦, 晁旭, 黄峰. 细胞焦亡在原发性肝癌进展中的作用研究进展[J]. 药物评价研究, 2021, 44( 7): 1535- 1540. DOI: 10.7501/j.issn.1674-6376.2021.07.026. [4] KARKI R, KANNEGANTI TD. Diverging inflammasome signals in tumorigenesis and potential targeting[J]. Nat Rev Cancer, 2019, 19( 4): 197- 214. DOI: 10.1038/s41568-019-0123-y. [5] KANTONO M, GUO BC. Inflammasomes and cancer: The dynamic role of the inflammasome in tumor development[J]. Front Immunol, 2017, 8: 1132. DOI: 10.3389/fimmu.2017.01132. [6] XIA XJ, WANG X, CHENG Z, et al. The role of pyroptosis in cancer: Pro-cancer or pro-“host”?[J]. Cell Death Dis, 2019, 10( 9): 650. DOI: 10.1038/s41419-019-1883-8. [7] DAGENAIS M, SKELDON A, SALEH M. The inflammasome: In memory of Dr. Jurg Tschopp[J]. Cell Death Differ, 2012, 19( 1): 5- 12. DOI: 10.1038/cdd.2011.159. [8] SCHRODER K, TSCHOPP J. The inflammasomes[J]. Cell, 2010, 140( 6): 821- 832. DOI: 10.1016/j.cell.2010.01.040. [9] MISSIROLI S, PERRONE M, BONCOMPAGNI C, et al. Targeting the NLRP3 inflammasome as a new therapeutic option for overcoming cancer[J]. Cancers, 2021, 13( 10): 2297. DOI: 10.3390/cancers13102297. [10] MALIK A, KANNEGANTI TD. Inflammasome activation and assembly at a glance[J]. J Cell Sci, 2017, 130( 23): 3955- 3963. DOI: 10.1242/jcs.207365. [11] PATEL MN, CARROLL RG, GALVÁN-PEÑA S, et al. Inflammasome priming in sterile inflammatory disease[J]. Trends Mol Med, 2017, 23( 2): 165- 180. DOI: 10.1016/j.molmed.2016.12.007. [12] MOOSSAVI M, PARSAMANESH N, BAHRAMI A, et al. Role of the NLRP3 inflammasome in cancer[J]. Mol Cancer, 2018, 17( 1): 158. DOI: 10.1186/s12943-018-0900-3. [13] TSAI YM, CHIANG KH, HUNG JY, et al. Der f1 induces pyroptosis in human bronchial epithelia via the NLRP3 inflammasome[J]. Int J Mol Med, 2018, 41( 2): 757- 764. DOI: 10.3892/ijmm.2017.3310. [14] TANG YL, TAO Y, ZHU L, et al. Role of NLRP3 inflammasome in hepatocellular carcinoma: A double-edged sword[J]. Int Immunopharmacol, 2023, 118: 110107. DOI: 10.1016/j.intimp.2023.110107. [15] SHI JJ, ZHAO Y, WANG K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526( 7575): 660- 665. DOI: 10.1038/nature15514. [16] HAMARSHEH S, ZEISER R. NLRP3 inflammasome activation in cancer: A double-edged sword[J]. Front Immunol, 2020, 11: 1444. DOI: 10.3389/fimmu.2020.01444. [17] MAMUN A AL, MIMI AA, AZIZ MA, et al. Role of pyroptosis in cancer and its therapeutic regulation[J]. Eur J Pharmacol, 2021, 910: 174444. DOI: 10.1016/j.ejphar.2021.174444. [18] INCHINGOLO R, POSA A, MARIAPPAN M, et al. Locoregional treatments for hepatocellular carcinoma: Current evidence and future directions[J]. World J Gastroenterol, 2019, 25( 32): 4614- 4628. DOI: 10.3748/wjg.v25.i32.4614. [19] CHEN WQ, ZHENG RS, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66( 2): 115- 132. DOI: 10.3322/caac.21338. [20] ZENG HM, CHEN WQ, ZHENG RS, et al. Changing cancer survival in China during 2003-15: A pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6( 5): e555- e567. DOI: 10.1016/S2214-109X(18)30127-X. [21] SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71( 3): 209- 249. DOI: 10.3322/caac.21660. [22] VOGEL A, MEYER T, SAPISOCHIN G, et al. Hepatocellular carcinoma[J]. Lancet, 2022, 400( 10360): 1345- 1362. DOI: 10.1016/S0140-6736(22)01200-4. [23] WEI Q, MU K, LI T, et al. Deregulation of the NLRP3 inflammasome in hepatic parenchymal cells during liver cancer progression[J]. Lab Invest, 2014, 94( 1): 52- 62. DOI: 10.1038/labinvest.2013.126. [24] LIU BY, ZHOU ZW, JIN Y, et al. Hepatic stellate cell activation and senescence induced by intrahepatic microbiota disturbances drive progression of liver cirrhosis toward hepatocellular carcinoma[J]. J Immunother Cancer, 2022, 10( 1): e003069. DOI: 10.1136/jitc-2021-003069. [25] THI HTH, HONG S. Inflammasome as a therapeutic target for cancer prevention and treatment[J]. J Cancer Prev, 2017, 22( 2): 62- 73. DOI: 10.15430/JCP.2017.22.2.62. [26] JIANG S, ZHANG Y, ZHENG JH, et al. Potentiation of hepatic stellate cell activation by extracellular ATP is dependent on P2X7R-mediated NLRP3 inflammasome activation[J]. Pharmacol Res, 2017, 117: 82- 93. DOI: 10.1016/j.phrs.2016.11.040. [27] FAN SH, WANG YY, LU J, et al. Luteoloside suppresses proliferation and metastasis of hepatocellular carcinoma cells by inhibition of NLRP3 inflammasome[J]. PLoS One, 2014, 9( 2): e89961. DOI: 10.1371/journal.pone.0089961. [28] DALEY D, MANI VR, MOHAN N, et al. NLRP3 signaling drives macrophage-induced adaptive immune suppression in pancreatic carcinoma[J]. J Exp Med, 2017, 214( 6): 1711- 1724. DOI: 10.1084/jem.20161707. [29] DING Y, YAN YL, DONG YH, et al. NLRP3 promotes immune escape by regulating immune checkpoints: A pan-cancer analysis[J]. Int Immunopharmacol, 2022, 104: 108512. DOI: 10.1016/j.intimp.2021.108512. [30] WAN LF, YUAN X, LIU MT, et al. miRNA-223-3p regulates NLRP3 to promote apoptosis and inhibit proliferation of hep3B cells[J]. Exp Ther Med, 2018, 15( 3): 2429- 2435. DOI: 10.3892/etm.2017.5667. [31] SONOHARA F, INOKAWA Y, KANDA M, et al. Association of inflammasome components in background liver with poor prognosis after curatively-resected hepatocellular carcinoma[J]. Anticancer Res, 2017, 37( 1): 293- 300. DOI: 10.21873/anticanres.11320. [32] WANG L, QIN XW, LIANG JM, et al. Induction of pyroptosis: A promising strategy for cancer treatment[J]. Front Oncol, 2021, 11: 635774. DOI: 10.3389/fonc.2021.635774. [33] CHEN YF, LI S, SHI Y, et al. Research progress on atherosclerosis induced by clonal hematopoiesis of indeterminate potential and the therapeutic effect of NLRP3 inflammasome[J]. China Med Herald, 2023, 20( 21): 40- 44. DOI: 10.20047/j.issn1673-7210.2023.21.08.陈雅芳, 李思, 史洋, 等. 潜质未定克隆性造血致动脉粥样硬化及NLRP3炎性小体治疗作用研究进展[J]. 中国医药导报, 2023, 20( 21): 40- 44. DOI: 10.20047/j.issn1673-7210.2023.21.08. [34] CHU Q, JIANG YN, ZHANG W, et al. Pyroptosis is involved in the pathogenesis of human hepatocellular carcinoma[J]. Oncotarget, 2016, 7( 51): 84658- 84665. DOI: 10.18632/oncotarget.12384. [35] CHEN YF, QI HY, WU FL. Euxanthone exhibits anti-proliferative and anti-invasive activities in hepatocellular carcinoma by inducing pyroptosis: Preliminary results[J]. Eur Rev Med Pharmacol Sci, 2018, 22( 23): 8186- 8196. DOI: 10.26355/eurrev_201812_16511. [36] WEI Q, ZHU R, ZHU JY, et al. E2-induced activation of the NLRP3 inflammasome triggers pyroptosis and inhibits autophagy in HCC cells[J]. Oncol Res, 2019, 27( 7): 827- 834. DOI: 10.3727/096504018X15462920753012. [37] SHARIF H, WANG L, WANG WL, et al. Structural mechanism for NEK7-licensed activation of NLRP3 inflammasome[J]. Nature, 2019, 570( 7761): 338- 343. DOI: 10.1038/s41586-019-1295-z. [38] YAN ZL, DA QG, LI ZF, et al. Inhibition of NEK7 suppressed hepatocellular carcinoma progression by mediating cancer cell pyroptosis[J]. Front Oncol, 2022, 12: 812655. DOI: 10.3389/fonc.2022.812655. -



 PDF下载 ( 942 KB)
PDF下载 ( 942 KB)

 下载:
下载: