1,25(OH)2D3改善胆碱缺乏氨基酸饮食诱导的非酒精性脂肪性肝炎大鼠模型肝脏炎症的机制分析
DOI: 10.12449/JCH250210
Mechanism of 1,25(OH)2D3 improving liver inflammation in a rat model of nonalcoholic steatohepatitis induced by choline-deficient L-amino acid-defined diet
-
摘要:
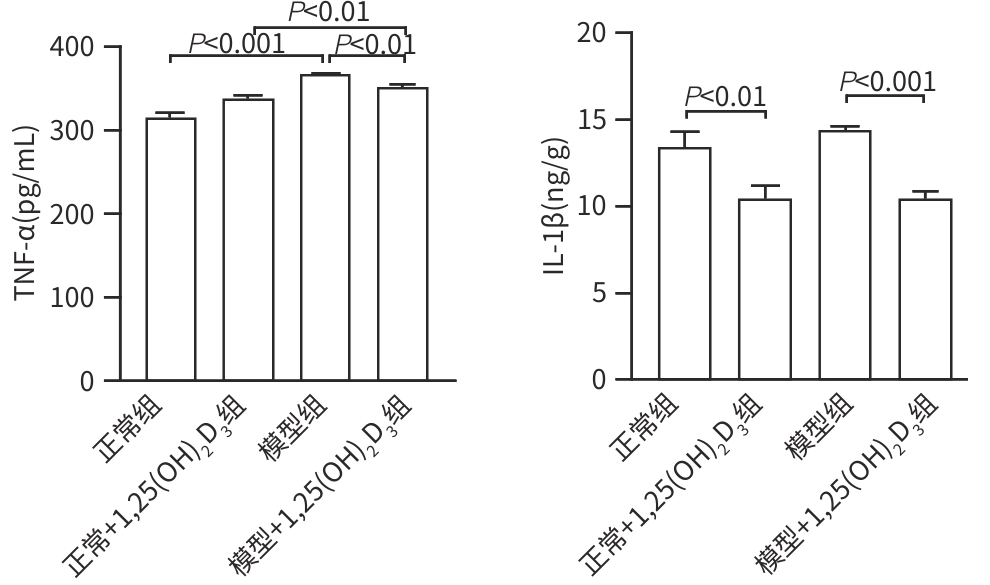
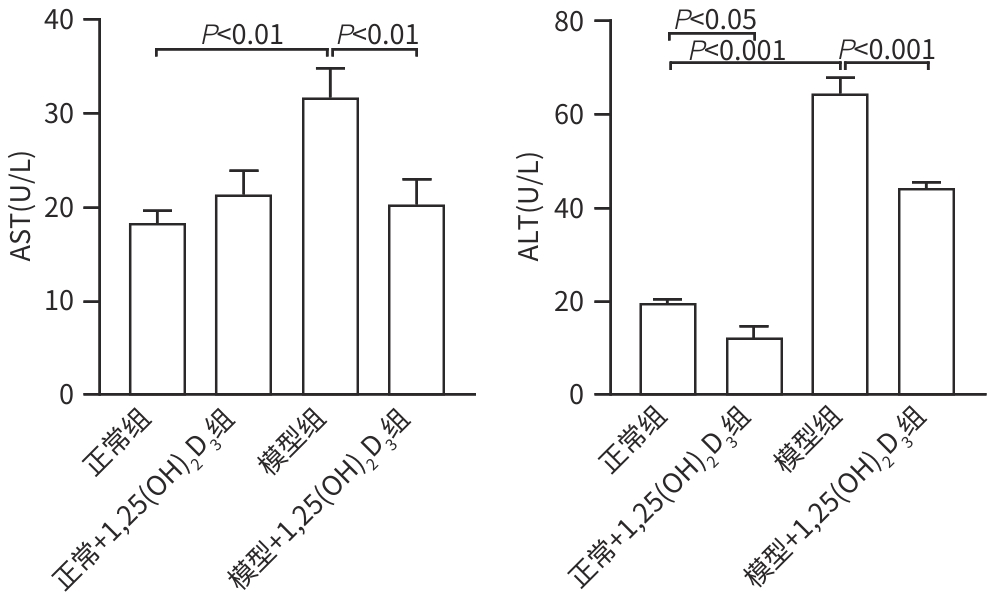
目的 分析1,25(OH)2D3对非酒精性脂肪性肝炎(NASH)大鼠模型肝脏过氧化物酶体增殖物激活受体γ(PPAR-γ)水平以及肝巨噬细胞表型、肝脏炎症的影响,初步探讨1,25(OH)2D3改善NASH肝脏炎症的相关机制。 方法 将24只SPF级Wistar大鼠适应性喂养1周后,随机分为4组。正常组(n=6):给予胆碱充足的氨基酸(CSAA)饮食;正常+1,25(OH)2D3组(n=6):给予CSAA饮食+1,25(OH)2D3干预;模型组(n=6):给予胆碱缺乏的氨基酸(CDAA)饮食;模型+1,25(OH)2D3组(n=6):给予CDAA饮食+1,25(OH)2D3干预。1,25(OH)2D3剂量为5 μg/kg,经腹腔注射,每周2次,共12周。检测每组大鼠血清AST、ALT水平;观察肝组织病理学严重程度,评估SAF评分。检测肝组织M1型、M2型肝巨噬细胞,分析肝巨噬细胞表型变化;并检测肝组织TNF-α、IL-1β、IL-4、IL-10水平以及PPAR-γ的mRNA水平。组间比较采用双因素方差分析,进一步比较采用LSD-t多重检验,相关性分析采用Pearson相关法。 结果 与正常组比较,CDAA饮食诱导的NASH模型AST和ALT水平均升高(P值分别为0.019、<0.001),肝组织病理学SAF评分(P<0.001)、M1型肝巨噬细胞表达水平(P<0.001)、M1/M2表型比值(P=0.001)、TNF-α表达水平显著增加(P<0.001),IL-4表达水平降低(P=0.025);1,25(OH)2D3显著降低了CDAA饮食诱导NASH大鼠血清ALT水平(P<0.001)、肝组织病理学SAF评分(P<0.001)、M1型肝巨噬细胞水平(P<0.001)、M1/M2型比值(P=0.001)、IL-1β水平(P<0.001),增加了M2型肝巨噬细胞水平(P=0.017)、IL-10水平(P=0.039)、IL-4水平(P<0.001)、PPAR-γ水平(P=0.016)。CDAA饮食诱导的NASH模型和1,25(OH)2D3在大鼠血清AST和ALT水平(P值分别为0.007、0.008)、肝组织病理学SAF评分(P<0.001)、M1型肝巨噬细胞水平(P<0.001)、M2型肝巨噬细胞水平(P=0.008)、M1/M2表型比值(P=0.005)、TNF-α水平(P<0.001)、IL-10水平(P=0.038)、IL-4水平(P<0.001)、PPAR-γ水平(P=0.009)中有显著交互作用。相关性分析结果示:PPAR-γ与肝巨噬细胞M1/M2表型比值呈负相关(r=-0.415,P=0.044);与M2型肝巨噬细胞、IL-10、IL-4均呈正相关(r值分别为0.435、0.433、0.532,P值分别为0.033、0.035、0.007)。 结论 1,25(OH)2D3激活PPAR-γ调控肝巨噬细胞表型转变,改善NASH肝脏炎症。 -
关键词:
- 非酒精性脂肪性肝炎 /
- 骨化三醇 /
- 炎症 /
- PPARγ /
- 大鼠, Wistar
Abstract:Objective To investigate the effect of 1,25(OH)2D3 on the level of peroxisome proliferator-activated receptor-γ (PPAR-γ) in the liver, the phenotype of hepatic macrophages, and liver inflammation in a rat model of nonalcoholic steatohepatitis (NASH), as well as the mechanism of 1,25(OH)2D3 improving liver inflammation. Methods After 1 week of adaptive feeding, 24 specific pathogen-free Wistar rats were randomly divided into normal group [choline-supplemented L-amino acid-defined (CSAA) diet], normal+1,25(OH)2D3 group [CSAA diet+1,25(OH)2D3], model group [choline-deficient L-amino acid-defined diet (CDAA) diet], and model+1,25(OH)2D3 group [CDAA diet+1,25(OH)2D3], with 6 rats in each group. The dose of 1,25(OH)2D3 was 5 μg/kg for intraperitoneal injection twice a week for 12 weeks. The serum levels of aspartate aminotransferase (AST) and alanine aminotransferase (ALT) were measured, liver histopathology was observed, and SAF score was assessed. M1 hepatic macrophages and M2 hepatic macrophages were measured to analyze in the change in the phenotype of hepatic macrophages, and ELISA was used to measure the levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), interleukin-4 (IL-4), and interleukin-10 (IL-10) in liver tissue, and qPCR was used to measure the mRNA level of PPAR-γ. The two-factor analysis of variance was use for comparison between groups, and the least significant difference t-test was used for further comparison; the Pearson method was used for correlation analysis. Results Compared with the normal group, the model rats with CDAA diet-induced NASH had significant increases in the serum levels of AST and ALT (P=0.019 and P<0.001), the SAF score of liver histopathology (P<0.001), the level of M1 hepatic macrophages (P<0.001), and the ratio of M1 and M2 hepatic macrophages (P<0.001), as well as a significant increase in the level of TNF-α (P<0.001) and a significant reduction in the level of IL-4 in liver tissue (P=0.025). The 1,25(OH)2D3 group had significant reductions in the serum levels of ALT (P<0.001), the SAF score of liver histopathology (P<0.001), the level of M1 hepatic macrophages (P<0.001), and the ratio of M1 and M2 hepatic macrophages (P=0.001), the level of IL-1β (P<0.001) and a significant increase in the level of M2 hepatic macrophages (P=0.017), the level of IL-10 (P=0.039), the level of IL-4 (P<0.001), the level of PPAR-γ (P=0.016). There were significant interactions between CDAA diet-induced NASH model and 1,25(OH)2D3 in serum the levels of AST and ALT (P=0.007 and P=0.008), the SAF scores of liver histopathology (P<0.001), the level of M1 hepatic macrophages (P<0.001), the level of M2 hepatic macrophages (P=0.008), the ratio of M1 and M2 of hepatic macrophages (P=0.005), the level of TNF-α (P<0.001), the level of IL-10 (P=0.038), the level of IL-4 (P<0.001) and the level of PPAR-γ (P=0.009). The correlation analysis showed that PPAR-γ was negatively correlated with the ratio of M1 and M2 hepatic macrophages (r=-0.415, P=0.044) and was positively correlated with M2 hepatic macrophages (r=0.435, P=0.033), IL-10 (r=0.433, P=0.035), and IL-4 (r=0.532, P=0.007). Conclusion This study shows that 1,25(OH)2D3 improves liver inflammation in NASH by activating PPAR-γ to regulate the phenotypic transformation of hepatic macrophages. -
Key words:
- Non-alcoholic Steatohepatitis /
- Calcitriol /
- Inflammation /
- PPAR gamma /
- Rats, Wistar
-
表 1 引物序列
Table 1. Primer sequence
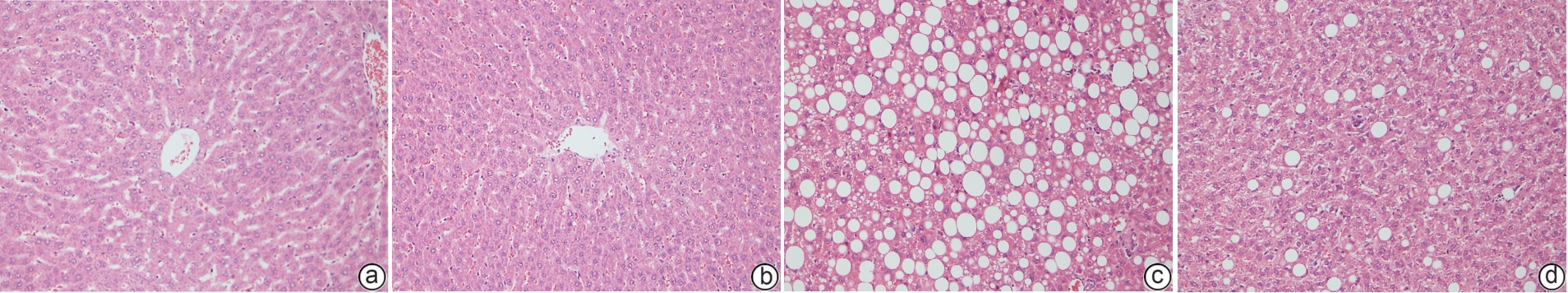
基因 序列(5'-3') 长度 参考序列号 PPAR-γ F:CCTTTACCACGGTTGATTTCTC 141 bp NM_013124.3 R:CAGGCTCTACTTTGATCGCACT GAPDH F:TTCAACGGCACAGTCAAGG 114 bp NM_017008.4 R:CTCAGCACCAGCATCACC 表 2 1,25(OH)2D3对NASH大鼠肝组织病理学以及SAF评分的影响
Table 2. Effects of 1,25(OH)2D3 on hepatic histology and scores
分组 脂肪变性(分) 气球样变(分) 小叶炎症(分) 活动度(分) SAF评分(分) 正常组 0 0 0 0 0 正常+1,25(OH)2D3组 0 0 0 0 0 模型组 2.67±0.521) 1.09±0.091) 1.33±0.261) 2.42±0.331) 5.09±0.841) 模型+1,25(OH)2D3组 1.00±0.022) 0.23±0.232) 0.48±0.122) 0.71±0.312) 1.71±0.312) 注:与正常组相比,1)P<0.001;与模型组相比,2)P<0.001。
-
[1] MA KF, CHEN YH, LIANG XG, et al. Inhibition of 5-lipoxygenase inhibitor zileuton in high-fat diet-induced nonalcoholic fatty liver disease progression model[J]. Iran J Basic Med Sci, 2017, 20( 11): 1207- 1212. DOI: 10.22038/IJBMS.2017.9482. [2] YOUNOSSI ZM, KOENIG AB, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64( 1): 73- 84. DOI: 10.1002/hep.28431. [3] TAKEGOSHI K, HONDA M, OKADA H, et al. Branched-chain amino acids prevent hepatic fibrosis and development of hepatocellular carcinoma in a non-alcoholic steatohepatitis mouse model[J]. Oncotarget, 2017, 8( 11): 18191- 18205. DOI: 10.18632/oncotarget.15304. [4] MIURA K, ISHIOKA M, IIJIMA K. The roles of the gut microbiota and toll-like receptors in obesity and nonalcoholic fatty liver disease[J]. J Obes Metab Syndr, 2017, 26( 2): 86- 96. DOI: 10.7570/jomes.2017.26.2.86. [5] REMMERIE A, MARTENS L, SCOTT CL. Macrophage subsets in obesity, aligning the liver and adipose tissue[J]. Front Endocrinol(Lausanne), 2020, 11: 259. DOI: 10.3389/fendo.2020.00259. [6] DUARTE N, COELHO IC, PATARRÃO RS, et al. How inflammation impinges on NAFLD: A role for kupffer cells[J]. Biomed Res Int, 2015, 2015: 984578. DOI: 10.1155/2015/984578. [7] RANNOU E, FRANÇOIS A, TOULLEC A, et al. In vivo evidence for an endothelium-dependent mechanism in radiation-induced normal tissue injury[J]. Sci Rep, 2015, 5: 15738. DOI: 10.1038/srep15738. [8] TANG DS, CAO F, YAN CS, et al. Extracellular vesicle/macrophage axis: Potential targets for inflammatory disease intervention[J]. Front Immunol, 2022, 13: 705472. DOI: 10.3389/fimmu.2022.705472. [9] NI YH, NAGASHIMADA M, ZHAN LL, et al. Prevention and reversal of lipotoxicity-induced hepatic insulin resistance and steatohepatitis in mice by an antioxidant carotenoid, β-cryptoxanthin[J]. Endocrinology, 2015, 156( 3): 987- 999. DOI: 10.1210/en.2014-1776. [10] HAN H, CUI M, YOU X, et al. A role of 1, 25(OH)2D3 supplementation in rats with nonalcoholic steatohepatitis induced by choline-deficient diet[J]. Nutr Metab Cardiovasc Dis, 2015, 25( 6): 556- 561. DOI: 10.1016/j.numecd.2015.02.011. [11] LUO WJ, XU QY, WANG Q, et al. Effect of modulation of PPAR-γ activity on Kupffer cells M1/M2 polarization in the development of non-alcoholic fatty liver disease[J]. Sci Rep, 2017, 7: 44612. DOI: 10.1038/srep44612. [12] ZHANG XL, ZHOU M, GUO YF, et al. 1, 25-dihydroxyvitamin D₃ promotes high glucose-induced M1 macrophage switching to M2 via the VDR-PPARγ signaling pathway[J]. Biomed Res Int, 2015, 2015: 157834. DOI: 10.1155/2015/157834. [13] European Association for the Study of the Liver, European Association for the Study of Diabetes, European Association for the Study of Obesity. EASL-EASD-EASO clinical practice guidelines for the management of non-alcoholic fatty liver disease[J]. J Hepatol, 2016, 64( 6): 1388- 1402. DOI: 10.1016/j.jhep.2015.11.004. [14] BEDOSSA P, PATHOLOGY CONSORTIUM FLIP. Utility and appropriateness of the fatty liver inhibition of progression(FLIP) algorithm and steatosis, activity, and fibrosis(SAF) score in the evaluation of biopsies of nonalcoholic fatty liver disease[J]. Hepatology, 2014, 60( 2): 565- 575. DOI: 10.1002/hep.27173. [15] YANG YM, WANG ZJ, MATSUDA M, et al. Inhibition of hyaluronan synthesis by 4-methylumbelliferone ameliorates non-alcoholic steatohepatitis in choline-deficient L-amino acid-defined diet-induced murine model[J]. Arch Pharm Res, 2021, 44( 2): 230- 240. DOI: 10.1007/s12272-021-01309-7. [16] NAKANISHI K, KAJI K, KITADE M, et al. Exogenous administration of low-dose lipopolysaccharide potentiates liver fibrosis in a choline-deficient l-amino-acid-defined diet-induced murine steatohepatitis model[J]. Int J Mol Sci, 2019, 20( 11): 2724. DOI: 10.3390/ijms20112724. [17] KUCSERA D, TÓTH VE, GERGŐ D, et al. Characterization of the CDAA diet-induced non-alcoholic steatohepatitis model: Sex-specific differences in inflammation, fibrosis, and cholesterol metabolism in middle-aged mice[J]. Front Physiol, 2021, 12: 609465. DOI: 10.3389/fphys.2021.609465. [18] POVERO D, EGUCHI A, LI HY, et al. Circulating extracellular vesicles with specific proteome and liver microRNAs are potential biomarkers for liver injury in experimental fatty liver disease[J]. PLoS One, 2014, 9( 12): e113651. DOI: 10.1371/journal.pone.0113651. [19] XU L, KITADE H, NI YH, et al. Roles of chemokines and chemokine receptors in obesity-associated insulin resistance and nonalcoholic fatty liver disease[J]. Biomolecules, 2015, 5( 3): 1563- 1579. DOI: 10.3390/biom5031563. [20] VONGHIA L, MAGRONE T, VERRIJKEN A, et al. Peripheral and hepatic vein cytokine levels in correlation with non-alcoholic fatty liver disease(NAFLD)-related metabolic, histological, and haemodynamic features[J]. PLoS One, 2015, 10( 11): e0143380. DOI: 10.1371/journal.pone.0143380. [21] CIMINI FA, BARCHETTA I, CAROTTI S, et al. Relationship between adipose tissue dysfunction, vitamin D deficiency and the pathogenesis of non-alcoholic fatty liver disease[J]. World J Gastroenterol, 2017, 23( 19): 3407- 3417. DOI: 10.3748/wjg.v23.i19.3407. [22] NELSON JE, ROTH CL, WILSON LA, et al. Vitamin D deficiency is associated with increased risk of non-alcoholic steatohepatitis in adults with non-alcoholic fatty liver disease: Possible role for MAPK and NF-κB?[J]. Am J Gastroenterol, 2016, 111( 6): 852- 863. DOI: 10.1038/ajg.2016.51. [23] ZHANG HW, LIU YM, FANG X, et al. Vitamin D3 protects mice from diquat-induced oxidative stress through the NF-κB/Nrf2/HO-1 signaling pathway[J]. Oxid Med Cell Longev, 2021, 2021: 6776956. DOI: 10.1155/2021/6776956. [24] KHEDER R, HOBKIRK J, SAEED Z, et al. Vitamin D3 supplementation of a high fat high sugar diet ameliorates prediabetic phenotype in female LDLR-/- and LDLR+/+ mice[J]. Immun Inflamm Dis, 2017, 5( 2): 151- 162. DOI: 10.1002/iid3.154. [25] REDA D, ELSHOPAKEY GE, ALBUKHARI TA, et al. Vitamin D3 alleviates nonalcoholic fatty liver disease in rats by inhibiting hepatic oxidative stress and inflammation via the SREBP-1-c/PPARα-NF-κB/IR-S2 signaling pathway[J]. Front Pharmacol, 2023, 14: 1164512. DOI: 10.3389/fphar.2023.1164512. [26] YIN Y, YU ZW, XIA M, et al. Vitamin D attenuates high fat diet-induced hepatic steatosis in rats by modulating lipid metabolism[J]. Eur J Clin Invest, 2012, 42( 11): 1189- 1196. DOI: 10.1111/j.1365-2362.2012.02706.x. [27] ZHANG XL, GUO YF, SONG ZX, et al. Vitamin D prevents podocyte injury via regulation of macrophage M1/M2 phenotype in diabetic nephropathy rats[J]. Endocrinology, 2014, 155( 12): 4939- 4950. DOI: 10.1210/en.2014-1020. [28] MU YM, LI JT, KANG JH, et al. A lipid-based nanocarrier containing active vitamin D3 ameliorates NASH in mice via direct and intestine-mediated effects on liver inflammation[J]. Biol Pharm Bull, 2020, 43( 9): 1413- 1420. DOI: 10.1248/bpb.b20-00432. [29] SHAB-BIDAR S, NEYESTANI TR, DJAZAYERY A, et al. Improvement of vitamin D status resulted in amelioration of biomarkers of systemic inflammation in the subjects with type 2 diabetes[J]. Diabetes Metab Res Rev, 2012, 28( 5): 424- 430. DOI: 10.1002/dmrr.2290. [30] KOMISARENKO YI, BOBRYK MI. Vitamin D deficiency and immune disorders in combined endocrine pathology[J]. Front Endocrinol(Lausanne), 2018, 9: 600. DOI: 10.3389/fendo.2018.00600. -



 PDF下载 ( 4284 KB)
PDF下载 ( 4284 KB)

 下载:
下载: