线粒体翻译起始因子(MTIF2)基因甲基化的特征及其与肝细胞癌发生的相关性分析
DOI: 10.12449/JCH250214
Characteristics of mitochondrial translational initiation factor 2 gene methylation and its association with the development of hepatocellular carcinoma
-
摘要:
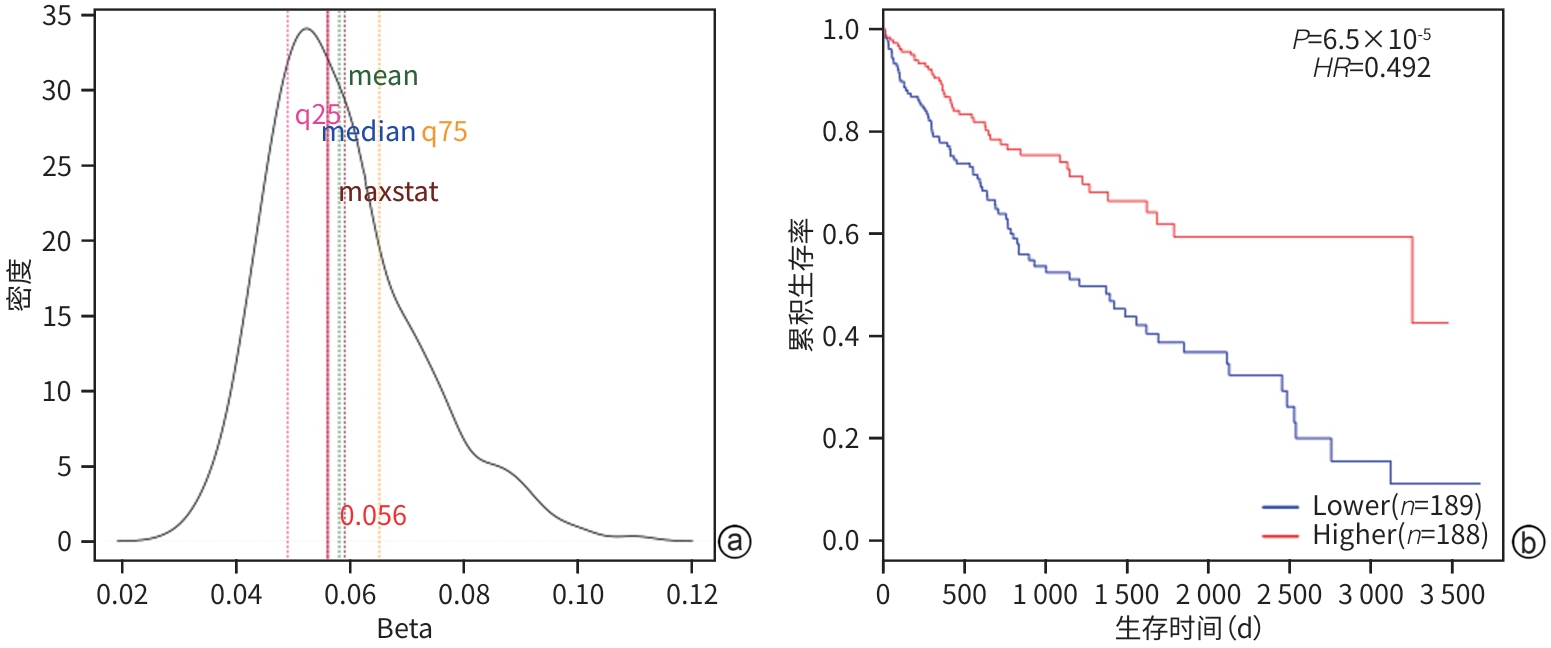
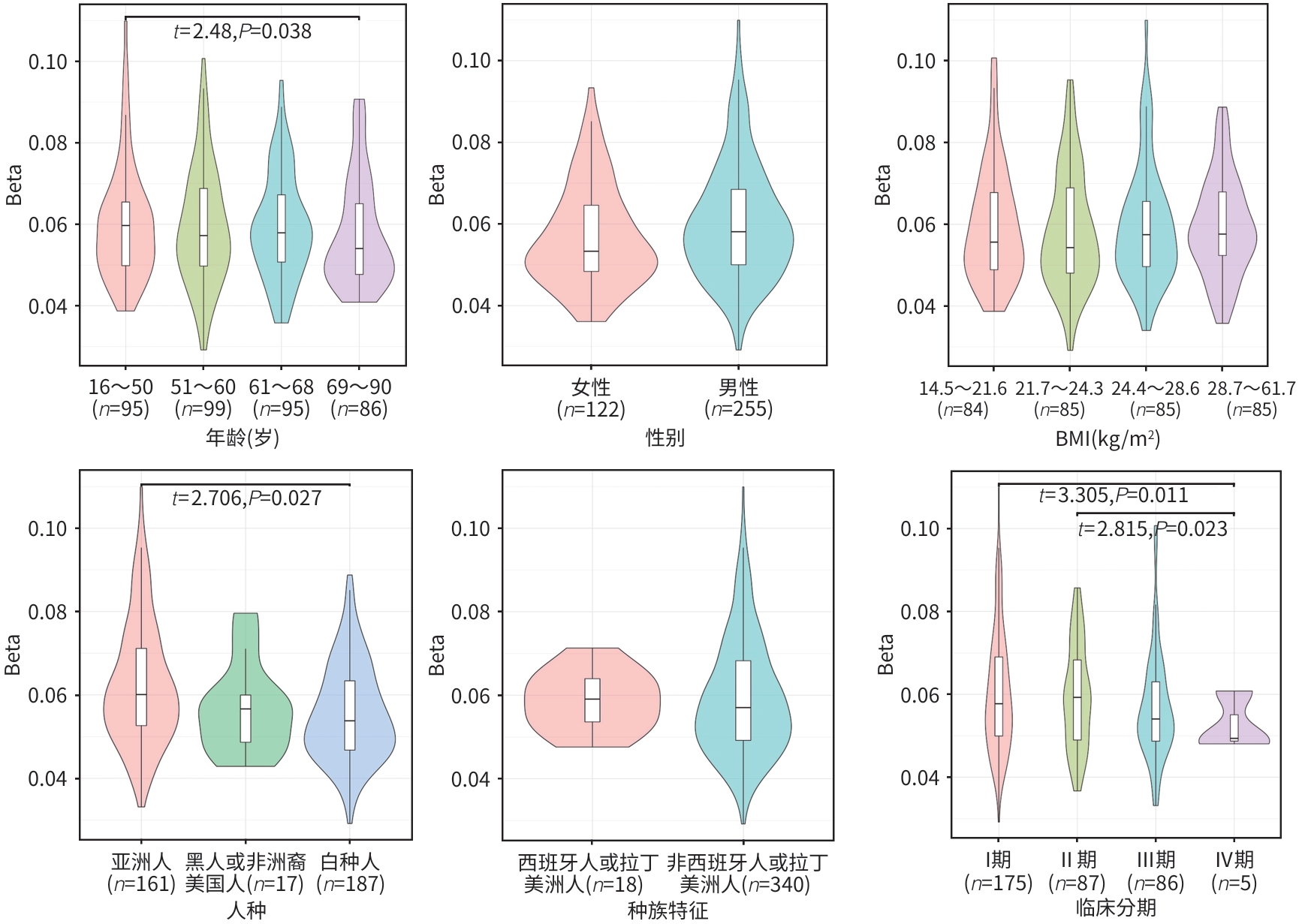
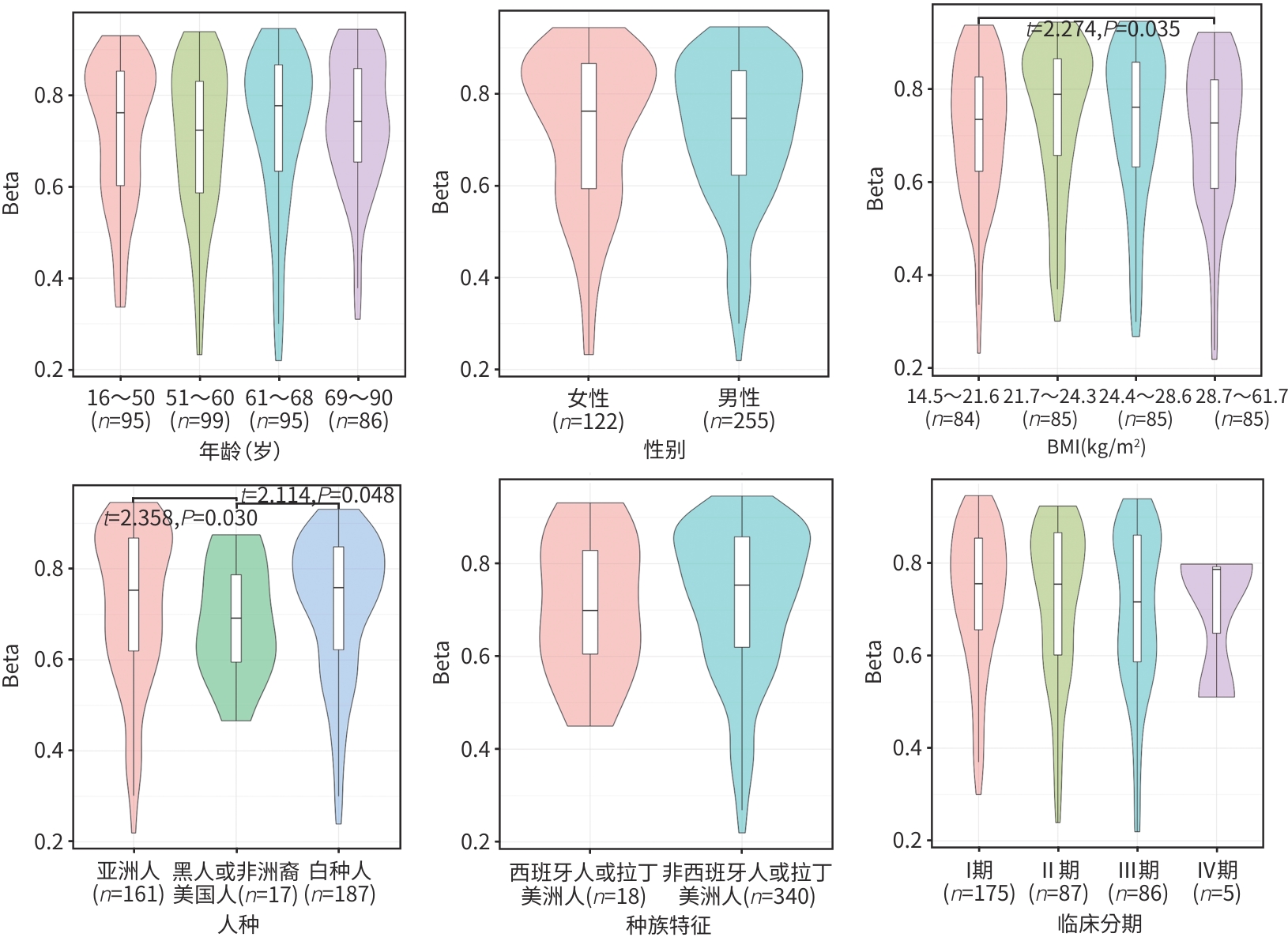
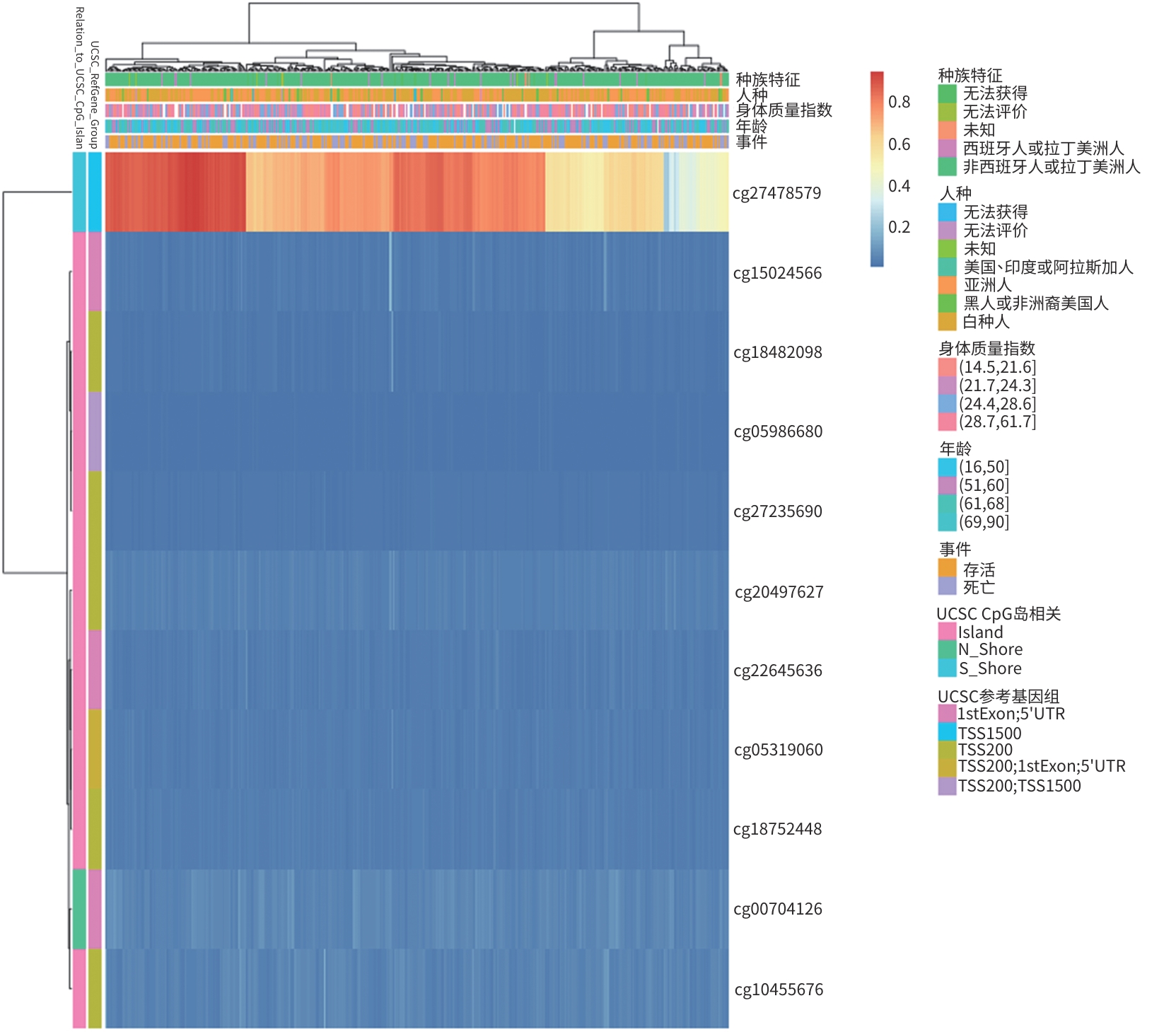
目的 结合生物信息学分析方法对线粒体翻译起始因子(MTIF2)基因的甲基化特征进行分析,并探讨其与肝细胞癌发生发展的关系。 方法 应用MethSurv、EWAS Data Hub软件对MTIF2甲基化样本进行标准化分析和聚类分析,内容包括生存曲线分析、甲基化特征分析、肿瘤信号通路相关性及泛癌数据库比对分析。计量资料两组间比较采用成组t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。使用Cox比例风险模型基于患者CpG部位的甲基化水平执行单变量和多变量生存分析。通过Kaplan-Meier图标识较低和较高甲基化患者组之间的生存差异。Log-likelihood ratio法用于组间生存差异分析。 结果 MTIF2甲基化整体聚类表明在种族、人种、BMI、年龄等特征间MTIF2基因甲基化水平没有明显差异。Kaplan-Meier生存曲线分析发现,MTIF2基因N-Shore高甲基化的患者预后明显好于低甲基化患者(HR=0.492,P<0.001),而CpG island和S-Shore甲基化的高低与生存率无明显差异(P值均>0.05)。基于不同年龄、性别、BMI、人种、种族、临床分期绘制MTIF2基因甲基化谱发现,随年龄增长会降低MTIF2基因N-Shore和CpG island的甲基化水平,白种人的MTIF2基因N-Shore的甲基化水平明显低于亚洲人(P<0.05),临床分期Ⅳ期患者MTIF2基因N-Shore和CpG island的甲基化水平明显低于Ⅰ/Ⅱ期患者(P值均<0.05)。临床验证试验表明,Ⅲ/Ⅳ期肝细胞癌患者MTIF2甲基化水平明显低于Ⅰ/Ⅱ期患者(P<0.05),且低于健康人群(P<0.05)。 结论 MTIF2基因N-Shore低甲基化是肝细胞癌发生发展的危险因素。 Abstract:Objective To investigate the characteristics of mitochondrial translational initiation factor 2 (MTIF2) gene methylation and its association with the development and progression of hepatocellular carcinoma (HCC). Methods MethSurv and EWAS Data Hub were used to perform the standardized analysis and the cluster analysis of MTIF2 methylation samples, including survival curve analysis, methylation signature analysis, the association of tumor signaling pathways, and a comparative analysis based on pan-cancer database. The independent-samples t test was used for comparison between two groups; a one-way analysis of variance was used for comparison between multiple groups, and the least significant difference t-test was used for further comparison between two groups. The Cox proportional hazards model was used to perform the univariate and multivariate survival analyses of methylation level at the CpG site. The Kaplan-Meier method was used to investigate the survival differences between the patients with low methylation level and those with high methylation level, and the Log-likelihood ratio method was used for survival difference analysis. Results Global clustering of MTIF2 methylation showed that there was no significant difference in MTIF2 gene methylation level between different races, ethnicities, BMI levels, and ages. The Kaplan-Meier survival curve analysis showed that the patients with N-Shore hypermethylation of the MTIF2 gene had a significantly better prognosis than those with hypomethylation (hazard ratio [HR]=0.492, P<0.001), while there was no significant difference in survival rate between the patients with different CpG island and S-Shore methylation levels (P>0.05). The methylation profile of the MTIF2 gene based on different ages, sexes, BMI levels, races, ethnicities, and clinical stages showed that the N-Shore and CpG island methylation levels of the MTIF2 gene decreased with the increase in age, and the Caucasian population had significantly lower N-Shore methylation levels of the MTIF2 gene than the Asian population (P<0.05); the patients with clinical stage Ⅳ had significantly lower N-Shore and CpG island methylation levels of the MTIF2 gene than those with stage Ⅰ/Ⅱ (P<0.05). Clinical validation showed that the patients with stage Ⅲ/Ⅳ HCC had a significantly lower methylation level of the MTIF2 gene than those with stage Ⅰ/Ⅱ HCC and the normal population (P<0.05). Conclusion N-Shore hypomethylation of the MTIF2 gene is a risk factor for the development and progression of HCC. -
表 1 MTIF2基因甲基化与肿瘤数据库的相关性
Table 1. Correlation of MTIF2 gene methylation and tumor databases
癌症类型 HR 95%CI P值 UCSC_CpG岛相关 UCEC 2.386 1.253~4.545 0.008 159 461 Open_Sea HCC 2.263 1.391~3.680 0.001 000 446 Island MESO 2.075 1.228~3.506 0.006 371 877 Open_Sea LAML 2.052 1.403~3.000 0.000 208 04 Island LUSC 1.721 1.166~2.541 0.006 277 936 N_Shore STAD 1.586 1.150~2.187 0.004 938 885 Island LAML 0.612 0.424~0.884 0.008 793 252 Island HNSC 0.608 0.453~0.815 0.000 859 021 Open_Sea HCC 0.536 0.376~0.763 0.000 548 768 Island KIRC 0.532 0.355~0.797 0.002 235 637 Open_Sea LAML 0.529 0.355~0.789 0.001 799 266 Island HCC 0.524 0.362~0.759 0.000 627 134 Island CESC 0.476 0.299~0.758 0.001 750 699 Open_Sea SARC 0.472 0.316~0.706 0.000 250 39 S_Shore HCC 0.456 0.313~0.663 0.000 039 1 N_Shore MESO 0.452 0.254~0.803 0.006 767 643 S_Shore KIRC 0.438 0.253~0.758 0.003 181 905 Island LGG 0.365 0.218~0.612 0.000 132 975 S_Shore KIRC 0.347 0.197~0.614 0.000 274 918 Island ACC 0.225 0.105~0.482 0.000 125 941 S_Shore 注:ACC,腺样囊性癌;LGG,低级别神经胶质瘤;LAML,骨髓癌;SARC,软组织癌;KIRC,肾透明细胞癌;HNSC,头颈部鳞癌;CESC,宫颈鳞状细胞癌;STAD,胃癌;LUSC,肺鳞状细胞癌;MESO,胸膜癌;UCEC,子宫内膜癌。
-
[1] PANNEERSELVAM S, WILSON C, KUMAR P, et al. Overview of hepatocellular carcinoma: From molecular aspects to future therapeutic options[J]. Cell Adh Migr, 2023, 17( 1): 1- 21. DOI: 10.1080/19336918.2023.2258539. [2] ZENG YY, FU J, LIN KY, et al. Current status and prospects of postoperative adjuvant therapy for hepatocellular carcinoma[J]. Chin J Dig Surg, 2024, 23( 2): 221- 227. DOI: 10.3760/cma.j.cn115610-20231128-00220.曾永毅, 傅俊, 林孔英, 等. 肝细胞癌术后辅助治疗的现状与展望[J]. 中华消化外科杂志, 2024, 23( 2): 221- 227. DOI: 10.3760/cma.j.cn115610-20231128-00220. [3] CHANG K, NA WL, LIU CX, et al. A study on the mechanism of Avilamycin intervention MTIF2 regulating ribosomal translation process to inhibit hepatitis B virus replication[J]. Acta Univ Med Anhui, 2022, 57( 2): 203- 207. DOI: 10.19405/j.cnki.issn1000-1492.2022.02.008.常凯, 那琬琳, 刘晨霞, 等. 阿维霉素干预MTIF2调控核糖体翻译进程抑制乙型肝炎病毒复制的机制研究[J]. 安徽医科大学学报, 2022, 57( 2): 203- 207. DOI: 10.19405/j.cnki.issn1000-1492.2022.02.008. [4] WU DQ, LI YJ. Application of adoptive cell therapy in hepatocellular carcinoma[J]. Immunology, 2023, 170( 4): 453- 469. DOI: 10.1111/imm.13677. [5] WANG J, WANG FF, WANG N, et al. Diagnostic and prognostic value of protein post-translational modifications in hepatocellular carcinoma[J]. J Clin Transl Hepatol, 2023, 11( 5): 1192- 1200. DOI: 10.14218/JCTH.2022.00006S. [6] GRASSO DG, CHRISTIAN BE, SPENCER A, et al. Overexpression and purification of mammalian mitochondrial translational initiation factor 2 and initiation factor 3[J]. Methods Enzymol, 2007, 430: 59- 78. DOI: 10.1016/S0076-6879(07)30004-9. [7] LI XD, CHEN JL, MENG J. Comprehensive analysis of the prognostic values and immune implication of ESYT3 in lung adenocarcinoma[J]. Medicine(Baltimore), 2023, 102( 35): e34557. DOI: 10.1097/MD.0000000000034557. [8] XIE ZH, HUANG JP, LI YJ, et al. Single-cell RNA sequencing revealed potential targets for immunotherapy studies in hepatocellular carcinoma[J]. Sci Rep, 2023, 13( 1): 18799. DOI: 10.1038/s41598-023-46132-w. [9] HAN YX, JI LY, GUAN YF, et al. An epigenomic landscape of cervical intraepithelial neoplasia and cervical cancer using single-base resolution methylome and hydroxymethylome[J]. Clin Transl Med, 2021, 11( 7): e498. DOI: 10.1002/ctm2.498. [10] XU RH, WEI W, KRAWCZYK M, et al. Circulating tumour DNA methylation markers for diagnosis and prognosis of hepatocellular carcinoma[J]. Nat Mater, 2017, 16( 11): 1155- 1161. DOI: 10.1038/nmat4997. [11] CHANG K, WANG YY, JIANG ZY, et al. Proteomic analysis and validation of DNA repair regulation in the process of hepatocellular carcinoma recurrence[J]. J Clin Hepatol, 2024, 40( 2): 319- 326. DOI: 10.12449/JCH240216.常凯, 王艳艳, 江忠勇, 等. 肝细胞癌复发进程中DNA修复调节的蛋白质组学分析及验证[J]. 临床肝胆病杂志, 2024, 40( 2): 319- 326. DOI: 10.12449/JCH240216. [12] WANG Y, ZHANG JQ, YANG Y, et al. Single-cell analysis revealed that MTIF2 could promote hepatocellular carcinoma progression through modulating the ROS pathway[J]. Heliyon, 2024, 10( 14): e34438. DOI: 10.1016/j.heliyon.2024.e34438. [13] XU DF, WANG Y, WU JC, et al. MTIF2 impairs 5 fluorouracil-mediated immunogenic cell death in hepatocellular carcinoma in vivo: Molecular mechanisms and therapeutic significance[J]. Pharmacol Res, 2021, 163: 105265. DOI: 10.1016/j.phrs.2020.105265. -



 PDF下载 ( 3131 KB)
PDF下载 ( 3131 KB)

 下载:
下载: