62例不明原因肝内胆汁淤积的病因谱、临床特征及基因突变分析
DOI: 10.12449/JCH250217
Etiology spectrum, clinical features, and gene mutations of unexplained intrahepatic cholestasis: An analysis of 62 cases
-
摘要:
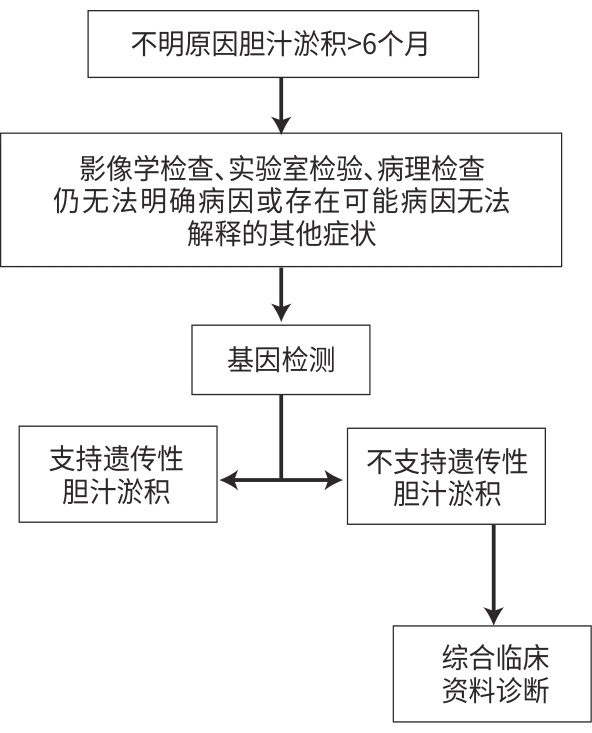
目的 回顾性分析62例不明原因肝内胆汁淤积患者的病史、病理结果、基因测序结果,了解其病因、临床特征,以及全外显子组测序(WES)对该类疾病的诊断价值。 方法 回顾性分析2017年1月—2023年12月因不明原因肝功能异常于南京市第二医院行WES的480例患者的临床资料,并根据患者的实验室资料筛选出不明原因肝内胆汁淤积患者62例,通过影像学资料、病理表现及基因测序明确诊断。分析不明原因肝内胆汁淤积患者的人口学特征、临床表现、病因谱和基因谱。 结果 纳入患者中男35例,女27例,中位年龄42(7~77)岁。通过WES明确诊断21例(33.87%),其中家族性肝内胆汁淤积症占比最高(52.38%,11/21);通过WES排除遗传代谢相关疾病共34例,占比最高的为药物性肝损伤和脓毒症肝损伤(55.88%,19/34),原发性胆汁性胆管炎、原发性硬化性胆管炎占20.59%(7/34),肝内胆管结石占17.65%(6/34),仍无法明确诊断占11.29%(7/62)。共发现21个既往未见报道的突变位点。 结论 遗传代谢相关疾病占不明原因肝内胆汁淤积的重要部分。WES对诊断不明原因肝内胆汁淤积有重要意义。 Abstract:Objective To investigate the etiology and clinical features of intrahepatic cholestasis and the diagnostic value of whole exome sequencing (WES) through a retrospective analysis of the medical history, pathological results, and gene sequencing data of 62 patients with unexplained intrahepatic cholestasis. Methods A retrospective analysis was performed for the clinical data of 480 patients who underwent WES due to unexplained liver function abnormalities in Nanjing Second Hospital from January 2017 to December 2023, among whom 62 patients with unexplained intrahepatic cholestasis were selected based on laboratory data, and a confirmed diagnosis was made based on imaging data, pathological findings, and gene sequencing data. The patients with unexplained intrahepatic cholestasis were analyzed in terms of demographic features, clinical manifestation, etiology spectrum, and genetic profile. Results A total of 62 patients with unexplained intrahepatic cholestasis were included, among whom there were 35 male patients and 27 female patients, with a median age of 42 (7 — 77) years. WES was used to make a definite diagnosis in 21 patients (33.87%), among whom the patients with familial intrahepatic cholestasis accounted for the highest proportion of 52.38% (11/21); genetic metabolic disorders were excluded by WES in 34 patients, with drug-induced liver injury and sepsis-associated liver injury accounting for the highest proportion of 55.88% (19/34), followed by primary biliary cholangitis and primary sclerosing cholangitis accounting for 20.59% (7/34) and intrahepatic bile duct stones accounting for 17.65% (6/34), while the patients with a lack of confirmed diagnosis accounted for 11.29% (7/62). A total of 21 novel mutation sites which were not reported in previous articles were identified in this study. Conclusion Genetic metabolic disorders constitute a significant proportion of unexplained intrahepatic cholestasis, and WES plays a crucial role in the diagnosis of unexplained intrahepatic cholestasis. -
Key words:
- Liver Diseases /
- Cholestasis, Intrahepatic /
- Diagnosis /
- Mutation
-
表 1 62例不明原因肝内胆汁淤积病例的最终病因构成和临床特征
Table 1. The final etiology and clinical characteristics of 62 cases of unexplained intrahepatic cholestasis
诊断 例数 男/女(例) 年龄
(岁)
ALT
(U/L)
AST
(U/L)
ALP
(U/L)
GGT
(U/L)
TBil(μmol/L) TBA(μmol/L) 遗传代谢相关疾病 PFIC-3 8 6/2 33.00±13.05 139.89(35.10~
421.70)
150.09(34.70~
594.60)
426.83(163.40~
948.20)
500.39(226.00~
1 507.10)
46.55
(10.20~145.20)
107.96
(4.30~327.50)
BRIC-2 2 0/2 31.50±4.95 218.35
(24.70~412.00)
148.80
(40.60~257.00)
326.00
(168.00~484.00)
249.00
(15.00~483.00)
184.55
(145.30~223.80)
201.901) PFIC-1 1 1/0 27.00 9.10 22.50 167.00 31.00 215.90 256.60 ICP 1 0/1 24.00 476.00 201.70 256.00 11.90 14.20 43.80 ALGS 2 1/1 15.50±4.95 306.10
(303.40~308.80)
243.60
(239.40~247.80)
406.00
(282.00~530.00)
760.70
(152.40~
1 369.00)
25.60
(21.90~29.30)
42.75
(38.60~46.90)
Wilson病 2 1/1 13.50±2.12 149.95
(130.80~169.10)
115.05
(93.00~137.10)
335.95
(197.00~474.90)
151.00
(150.70~151.30)
22.80
(14.90~30.70)
63.00
(3.30~122.70)
ARPKD 2 1/1 45.50±7.78 33.70
(16.10~
51.30)
38.10
(17.70~58.50)
202.50
(170.00~235.00)
201.00
(176.00~226.00)
8.40
(6.70~
10.10)
13.55
(10.30~16.80)
ADPKD 1 0/1 49.00 503.60 137.60 231.00 546.00 60.20 246.80 PLD 1 0/1 42.00 56.40 46.50 211.00 312.00 13.30 11.80 17q12微缺
失综合征
1 1/0 12.00 208.90 138.20 556.00 241.00 4.20 23.20 非遗传代谢相关疾病 DILI 9 3/6 48.33±14.03 397.17
(16.60~
1 583.80)
298.69
(21.00~
1 252.90)
309.22
(174.90~529.00)
463.72
(161.00~
1 227.30)
60.34
(11.30~122.80)
66.49
(2.70~274.90)
脓毒症肝损伤 10 7/3 41.20±18.56 321.31
(18.90~
1 922.80)
183.97
(23.10~943.70)
444.46
(164.00~
1 233.00)
659.60
(128.00~
2 059.00)
86.95
(10.80~387.00)
74.64
(3.60~211.00)
PBC 4 1/3 50.50±9.26 194.95
(22.00~
469.10)
100.05
(29.90~129.30)
398.60
(188.00~656.40)
523.53
(139.00~716.00)
68.98
(7.30~210.00)
64.23
(5.30~210.00)
PSC 3 2/1 11.00(7.00~44.00) 140.17
(37.00~
246.50)
130.63
(55.20~204.10)
772.03
(241.00~
1 494.10)
324.20
(150.00~538.60)
43.17
(23.60~69.80)
52.93
(27.60~100.90)
肝内胆管结石 6 4/2 52.50(10.00~77.00) 90.35
(26.60~
150.90)
85.50
(23.70~185.20)
428.25
(224.00~654.30)
307.72
(123.00~684.00)
286.52
(10.70~908.80)
113.00
(10.10~226.80)
Budd-Chiari综合征 1 1/0 50.00 64.30 86.50 481.00 803.90 17.90 9.70 Abernethy畸形 1 0/1 51.00 810.00 448.00 221.00 199.00 148.00 未明确病因 7 6/1 46.86±17.36 54.95
(24.40~
128.60)
39.47
(20.00~
81.10)
261.21
(164.50~433.00)
318.33
(176.60~573.50)
23.10
(5.70~
38.60)
29.55
(8.40~94.20)
注:ICP,妊娠期肝内胆汁淤积症;ALGS,Alagille综合征;ARPKD,常染色体隐性多囊肾病;ADPKD,常染色体显性多囊肾病;PLD,多囊肝病;DILI,药物性肝损伤。1) 只有1例患者。
表 2 20例通过WES明确诊断的患者的基因突变信息
Table 2. Genetic mutation information of 20 patients with a definitive diagnosis through WES
病例序号 基因 核苷酸变化 氨基酸变化 ACMG评级 父亲 母亲 是否新发突变 1 JAG1 c.2990C>A Ser997* 致病性 未检查 未检查 是 2 PKHD1 c.2507T>C p.Val836Arg 可疑致病性 未检测到 杂合 是 PKHD1 c.8417T>G p.Ile2806Ser 临床意义未明 杂合 未检测到 否 3 ABCB4 c.434A>G p.Gln145Arg 临床意义未明 未检查 未检查 否 4 PKD1 c.12835C>T p.Arg4279Trp 临床意义未明 未检查 未检查 否 5 ABCB4 c.833+2T>C p.? 致病性 未检查 未检查 否 6 PKHD1 c.2312_2313insA p.Gly772fs 致病性 未检查 未检查 否 PKHD1 c.8624T>C p.Ile2875Thr 临床意义未明 未检查 未检查 否 7 ATP7B c.3809A>G p.Asn1270Ser 致病性 未检查 未检查 是 ATP7B c.2621C>T p.Ala874Val 致病性 未检查 未检查 是 8 ABCB4 c.2362C>T p.Arg788Trp 可疑致病性 未检查 未检查 是 ABCB4 c.2777C>T p.Pro926Leu 临床意义未明 未检查 未检查 否 9 ABCB4 c.3378dupT p.Ala1127fs 病理性 未检查 未检查 否 10 JAG1 c.254_258dup p.Thr87fs 病理性 未检查 未检查 否 11 ATP8B1 c.2822G>A p.Arg941Gln 临床意义未明 未检查 未检查 否 12 ALG8 c.95+5G>A p.? 临床意义未明 未检查 未检查 否 13 ABCB4 c.3250C>T p.Arg1084Trp 临床意义未明 未检查 未检查 否 14 ABCB4 c.122G>C p.Gly41Ala 临床意义未明 未检查 未检查 否 15 ATP7B c.1708-1G>C p.? 致病性 未检测到 杂合 否 ATP7B c.3316G>A p.Val1106Ile 临床意义未明 未检测到 未检测到 是 16 ABCB4 c.2362C>T p.Arg788Trp 临床意义未明 未检查 未检查 是 ABCB4 c.537-32G>T p.? 临床意义未明 未检查 未检查 否 17 ABCB11 c.239T>C p.Leu80Pro 临床意义未明 未检查 未检查 否 ATP7B c.3889G>A p.Val1297Ile 临床意义未明 未检查 未检查 否 ATP7B c.3671G>A p.Arg1224Gln 临床意义未明 未检查 未检查 否 18 ABCB11 c.1331T>C p.Val444Ala 临床意义未明 未检查 未检查 是 19 ATP8B1 c.2081T>A p.Ile694Asn 可疑致病性 未检查 未检查 是 ATP8B1 c.1288_1290del p.Lys430del 临床意义未明 未检查 未检查 否 20 ABCB4 c.1865G>A p.Gly622Glu 临床意义未明 未检查 未检查 否 表 3 常见肝内胆汁淤积的肝脏病理表现
Table 3. Common hepatic pathological manifestations of intrahepatic cholestasis
疾病 病理表现 ALGS 汇管区缺乏肝小叶间胆管(胆管缺失),也无汇管区炎症和小胆管反应,肝细胞间毛细胆管缺乏CD10的表达 CHF 与PKD有关。汇管区-肝实质界面处可见许多不规则扩张的胆管(胆管板畸形)。胆管内可含浓缩的胆汁或嗜伊红物质 Wilson病 早期常见全肝小叶轻度大泡性脂肪变性和汇管区周围的肝细胞糖原核。晚期汇管区炎症加重,轻度界面炎,汇管区纤维化。与慢性胆汁淤积性肝病汇管区周围肝细胞改变相似 PFIC 表现胆汁淤积、胆管损伤、胆汁性纤维化,不同亚型PFIC病理特征不一 BRIC 表现胆汁淤积,通常不伴胆汁性纤维化,不同亚型BRIC病理表现不一 ICP 认为其与ABCB4和ABCB11等编码的蛋白缺陷有关。毛细胆管扩张,肝细胞和Kupffer细胞内可见胆红素淤积 脓毒症 浓缩的胆汁淤积导致胆管扩张(胆管性淤积),扩张的毛细胆管内可见大量的胆栓栓子 药物诱导的肝内
胆汁淤积
合成类固醇诱导的单纯性淤胆:肝细胞和毛细胆管显著淤胆,不伴有明显活动性炎症;药物诱导的急性淤胆型肝炎:中央静脉周围坏死伴有明显的肝细胞和毛细胆管胆汁淤积 PBC 可存在不同程度的胆管损伤,损伤胆管被密集的淋巴组织细胞浸润的旺炽性胆管病变是PBC突出病理特点。早期PBC的毛细胆管淤胆不常见,直到PBC晚期才会形成 PSC 胆管树的炎症、狭窄及囊性扩张为特点。胆管周围水肿、同心圆纤维化、细胆管增生、汇管区炎症、小胆管萎缩或消失也提示该病 注:PKD,多囊肾病。
-
[1] Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the management of cholestasis liver diseases(2021)[J]. J Clin Hepatol, 2022, 38( 1): 62- 69. DOI: 10.3969/j.issn.1001-5256.2022.01.010.中华医学会肝病学分会. 胆汁淤积性肝病管理指南(2021)[J]. 临床肝胆病杂志, 2022, 38( 1): 62- 69. DOI: 10.3969/j.issn.1001-5256.2022.01.010. [2] BORTOLINI M, ALMASIO P, BRAY G, et al. Multicentre survey of the prevalence of intrahepatic cholestasis in 2520 consecutive patients with newly diagnosed chronic liver disease[J]. Drug Investig, 1992, 4( 4): 83- 89. DOI: 10.1007/BF03258368. [3] NG SB, BUCKINGHAM KJ, LEE C, et al. Exome sequencing identifies the cause of a Mendelian disorder[J]. Nat Genet, 2010, 42( 1): 30- 35. DOI: 10.1038/ng.499. [4] BOTSTEIN D, RISCH N. Discovering genotypes underlying human phenotypes: Past successes for Mendelian disease, future approaches for complex disease[J]. Nat Genet, 2003, 33 Suppl: 228- 237. DOI: 10.1038/ng1090. [5] European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of cholestatic liver diseases[J]. J Hepatol, 2009, 51( 2): 237- 267. DOI: 10.1016/j.jhep.2009.04.009. [6] GUNAYDIN M, BOZKURTER CIL AT. Progressive familial intrahepatic cholestasis: Diagnosis, management, and treatment[J]. Hepat Med, 2018, 10: 95- 104. DOI: 10.2147/HMER.S137209. [7] GUO J, XIE SY, YANG LR, et al. Clinical characteristics of 2 cases of progressive familial intrahepatic cholestasis and literature review[J/CD]. Chin J Liver Dis(Electronic Version), 2024, 16( 1): 67- 72. DOI: 10.3969/j.issn.1674-7380.2024.01.012.郭静, 谢双宇, 杨玲蓉, 等. 进行性家族性肝内胆汁淤积症2例临床特点分析及文献复习[J/CD]. 中国肝脏病杂志(电子版), 2024, 16( 1): 67- 72. DOI: 10.3969/j.issn.1674-7380.2024.01.012. [8] WENG YH, XIONG QF, LIU DX, et al. Clinical and pathological features of progressive familial intrahepatic cholestasis type 3[J]. J Clin Hepatol, 2022, 38( 1): 154- 159. DOI: 10.3969/j.issn.1001-5256.2022.01.024.翁宇航, 熊清芳, 刘杜先, 等. 进行性家族性肝内胆汁淤积症3型临床病理特征分析[J]. 临床肝胆病杂志, 2022, 38( 1): 154- 159. DOI: 10.3969/j.issn.1001-5256.2022.01.024. [9] GOTTHARDT D, RUNZ H, KEITEL V, et al. A mutation in the canalicular phospholipid transporter gene, ABCB4 is associated with cholestasis, ductopenia, and cirrhosis in adults[J]. Hepatology, 2008, 48( 4): 1157- 1166. DOI: 10.1002/hep.22485. [10] HALAWI A, IBRAHIM N, BITAR R. Triggers of benign recurrent intrahepatic cholestasis and its pathophysiology: A review of literature[J]. Acta Gastroenterol Belg, 2021, 84( 3): 477- 486. DOI: 10.51821/84.3.013. [11] CHEN FF, PENG LQ, WANG J. Correlation between serum glycocholic acid and liver biochemical indexes and inflammatory cytokines in patients with intrahepatic chole-stasis of pregnancy[J]. J Clin Exp Med, 2023, 22( 14): 1534- 1537. DOI: 10.3969/j.issn.1671-4695.2023.14.021.陈福芳, 彭丽钦, 汪洁. 妊娠期肝内胆汁淤积症患者血清甘胆酸与肝生化指标、炎性细胞因子水平变化相关性分析[J]. 临床和实验医学杂志, 2023, 22( 14): 1534- 1537. DOI: 10.3969/j.issn.1671-4695.2023.14.021. [12] Obstetrics Subgroup, Society of Obstetrics and Gynecology, Chinese Medical Association; Society of Perinatal Medicine, Chinese Medical Association. Guidelines for clinical diagnosis, treatment and management of intrahepatic cholestasis of pregnancy(2024)[J]. Chin J Obstet Gynecol, 2024, 59( 2): 97- 107. DOI: 10.3760/cma.j.cn112141-20230914-00099.中华医学会妇产科学分会产科学组, 中华医学会围产医学分会. 妊娠期肝内胆汁淤积症临床诊治和管理指南(2024版)[J]. 中华妇产科杂志, 2024, 59( 2): 97- 107. DOI: 10.3760/cma.j.cn112141-20230914-00099. [13] AYDıN GA, ÖZGEN G, GÖRÜKMEZ O. The role of genetic mutations in intrahepatic cholestasis of pregnancy[J]. Taiwan J Obstet Gynecol, 2020, 59( 5): 706- 710. DOI: 10.1016/j.tjog.2020.07.014. [14] NAYAGAM JS, WILLIAMSON C, JOSHI D, et al. Review article: Liver disease in adults with variants in the cholestasis-related genes ABCB11 ABCB4 and ATP8B1[J]. Aliment Pharmacol Ther, 2020, 52( 11-12): 1628- 1639. DOI: 10.1111/apt.16118. [15] AYOUB MD, KAMATH BM. Alagille syndrome: Current understanding of pathogenesis, and challenges in diagnosis and management[J]. Clin Liver Dis, 2022, 26( 3): 355- 370. DOI: 10.1016/j.cld.2022.03.002. [16] LI LT, DONG JB, WANG XH, et al. JAG1 mutation spectrum and origin in Chinese children with clinical features of alagille syndrome[J]. PLoS One, 2015, 10( 6): e0130355. DOI: 10.1371/journal.pone.0130355. [17] Inherited Metabolic Liver Disease Collaboration Group, Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the diagnosis and treatment of hepatolenticular degeneration(2022 edition)[J]. Chin J Hepatol, 2022, 30( 1): 9- 20. DOI: 10.3760/cma.j.cn501113-20211217-00603.中华医学会肝病学分会遗传代谢性肝病协作组. 肝豆状核变性诊疗指南(2022年版)[J]. 中华肝脏病杂志, 2022, 30( 1): 9- 20. DOI: 10.3760/cma.j.cn501113-20211217-00603. [18] DANKS DM. Copper and liver disease[J]. Eur J Pediatr, 1991, 150( 3): 142- 148. DOI: 10.1007/BF01963553. [19] HASBAOUI BE, RIFAI Z, SAGHIR S, et al. Congenital hepatic fibrosis: Case report and review of literature[J]. Pan Afr Med J, 2021, 38: 188. DOI: 10.11604/pamj.2021.38.188.27941. [20] Writing Group For Practice Guidelines For Diagnosis And Treatment Of Genetic Diseases Medical Genetics Branch Of Chinese Medical Association. Clinical practice guidelines for polycystic kidney diseases[J]. Chin J Med Genet, 2020, 37( 3): 277- 283. DOI: 10.3760/cma.j.issn.1003-9406.2020.03.009.中华医学会医学遗传学分会遗传病临床实践指南撰写组. 多囊肾病的临床实践指南[J]. 中华医学遗传学杂志, 2020, 37( 3): 277- 283. DOI: 10.3760/cma.j.issn.1003-9406.2020.03.009. [21] KARHUNEN PJ, TENHU M. Adult polycystic liver and kidney diseases are separate entities[J]. Clin Genet, 1986, 30( 1): 29- 37. DOI: 10.1111/j.1399-0004.1986.tb00565.x. [22] LANKTREE MB, HAGHIGHI A, di BARI I, et al. Insights into autosomal dominant polycystic kidney disease from genetic studies[J]. Clin J Am Soc Nephrol, 2021, 16( 5): 790- 799. DOI: 10.2215/CJN.02320220. [23] DIXIT A, PATEL C, HARRISON R, et al. 17q12 microdeletion syndrome: Three patients illustrating the phenotypic spectrum[J]. Am J Med Genet A, 2012, 158 A( 9): 2317- 2321. DOI: 10.1002/ajmg.a.35520. [24] Technology Committee on DILI Prevention and Management, Chinese Medical Biotechnology Association; Study Group of Drug-Induced Liver Disease, Chinese Medical Association for the Study of Liver Diseases. Chinese guideline for diagnosis and management of drug-induced liver injury(2023 version)[J]. Chin J Gastroenterol, 2023, 28( 7): 397- 431. DOI: 10.3760/cma.j.cn501113-20230419-00176.中国医药生物技术协会药物性肝损伤防治技术专业委员会, 中华医学会肝病学分会药物性肝病学组. 中国药物性肝损伤诊治指南(2023年版)[J]. 胃肠病学, 2023, 28( 7): 397- 431. DOI: 10.3760/cma.j.cn501113-20230419-00176. [25] Biliary Surgery Group of the Surgery Branch of the Chinese Medical Association. Guidelines for diagnosis and treatment of hepatolithiasis[J]. Chin J Dig Surg, 2007, 6( 2): 156- 161. DOI: 10.3760/cma.j.issn.1673-9752.2007.02.028.中华医学会外科学分会胆道外科学组. 肝胆管结石病诊断治疗指南[J]. 中华消化外科杂志, 2007, 6( 2): 156- 161. DOI: 10.3760/cma.j.issn.1673-9752.2007.02.028. [26] YAO X, LIU Y, YU LD, et al. Rare portal hypertension caused by abernethy malformation(type IIC): A case report[J]. World J Radiol, 2023, 15( 8): 250- 255. DOI: 10.4329/wjr.v15.i8.250. [27] ENNAIFER R, BACHA D, ROMDHANE H, et al. Budd-chiari syndrome: An unusual presentation of multisystemic sarcoidosis[J]. Clin Pract, 2015, 5( 3): 768. DOI: 10.4081/cp.2015.768. [28] WOJCIK MH, LEMIRE G, BERGER E, et al. Genome sequencing for diagnosing rare diseases[J]. N Engl J Med, 2024, 390( 21): 1985- 1997. DOI: 10.1056/NEJMoa2314761. -



 PDF下载 ( 1558 KB)
PDF下载 ( 1558 KB)


 下载:
下载: