层粘连蛋白α3亚基(LAMA3)对胰腺癌上皮间质转化、侵袭和转移能力的影响
DOI: 10.12449/JCH250219
Effect of laminin subunit α3 on epithelial-mesenchymal transition, invasion, and metastasis abilities of pancreatic cancer
-
摘要:
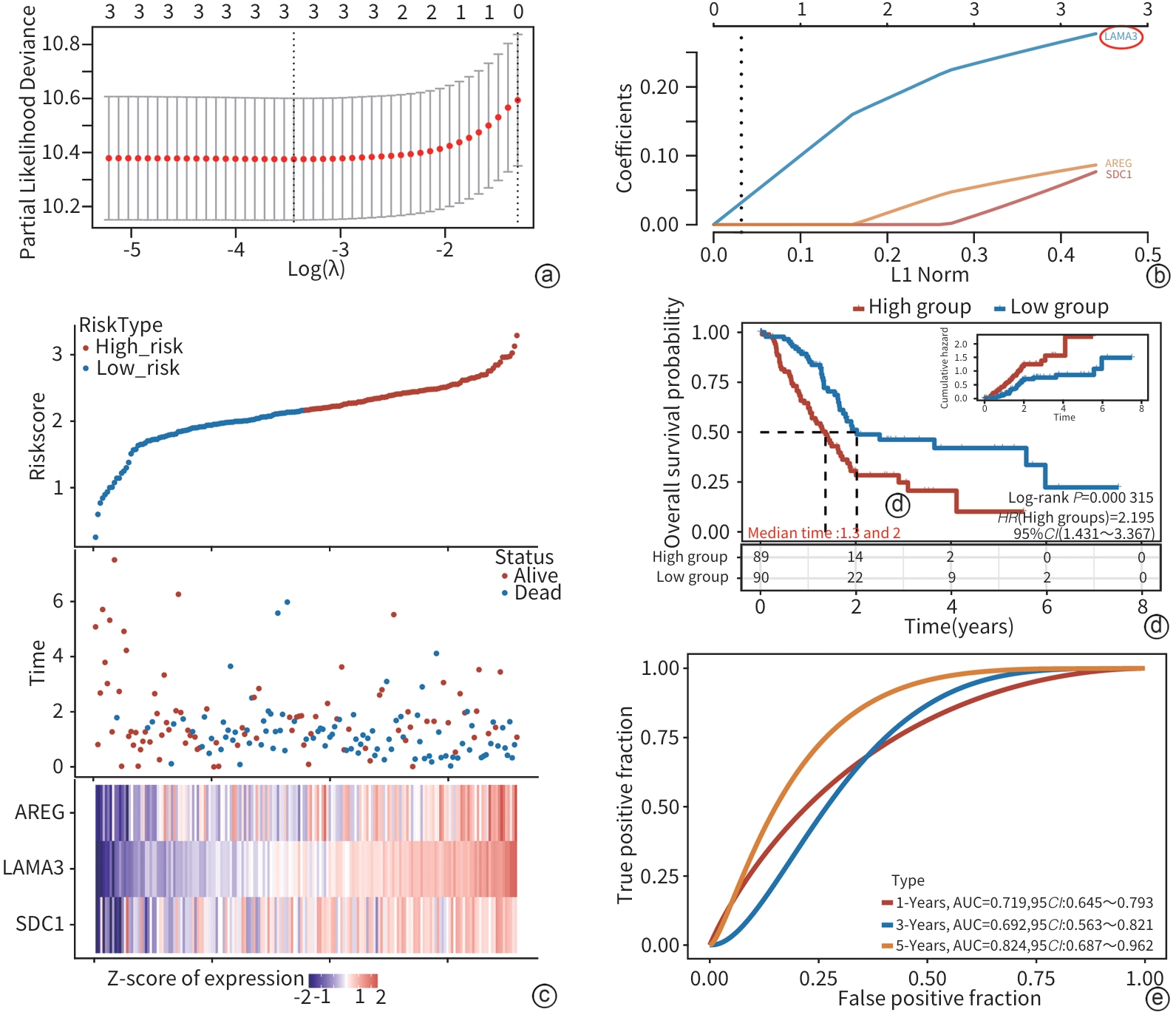
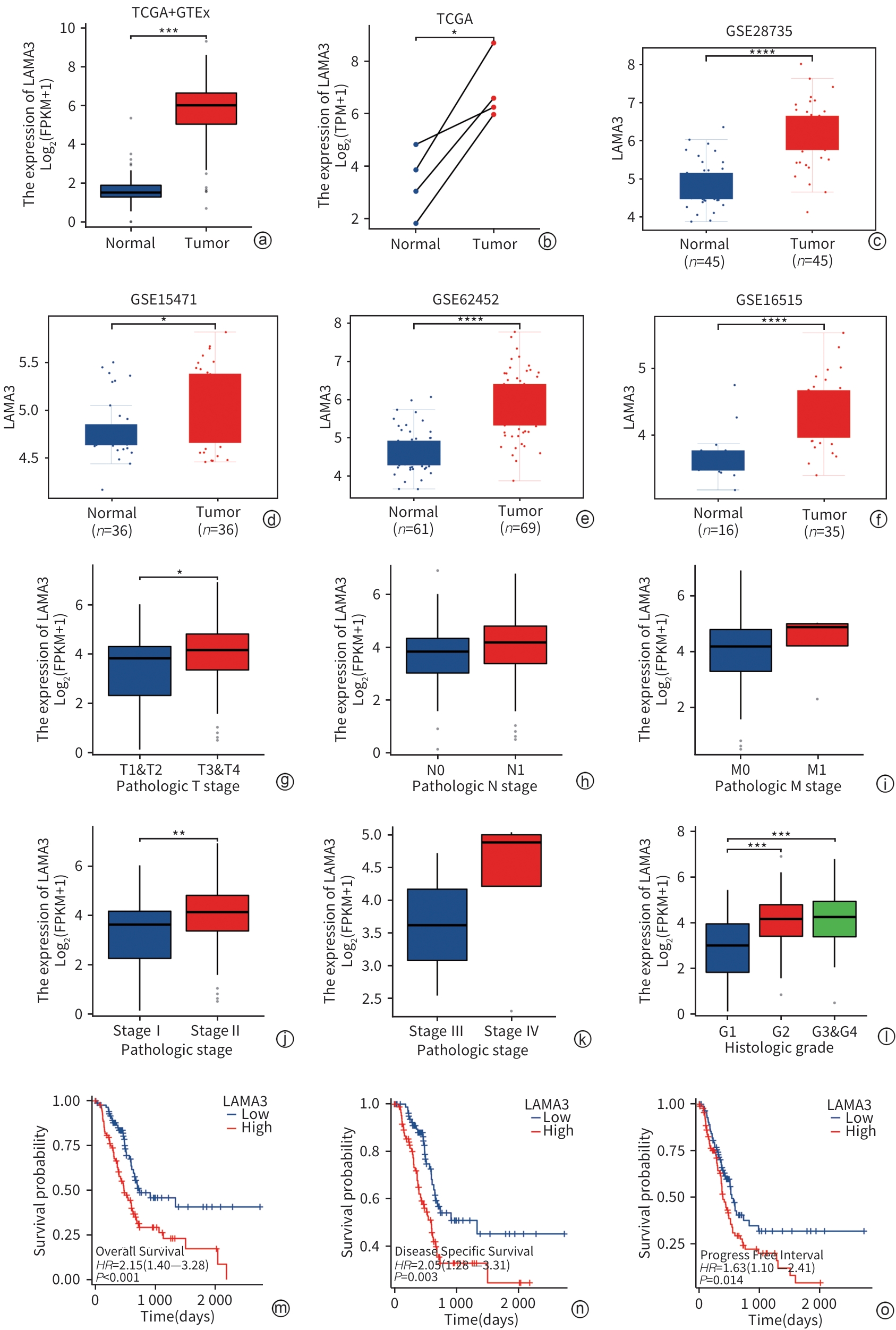
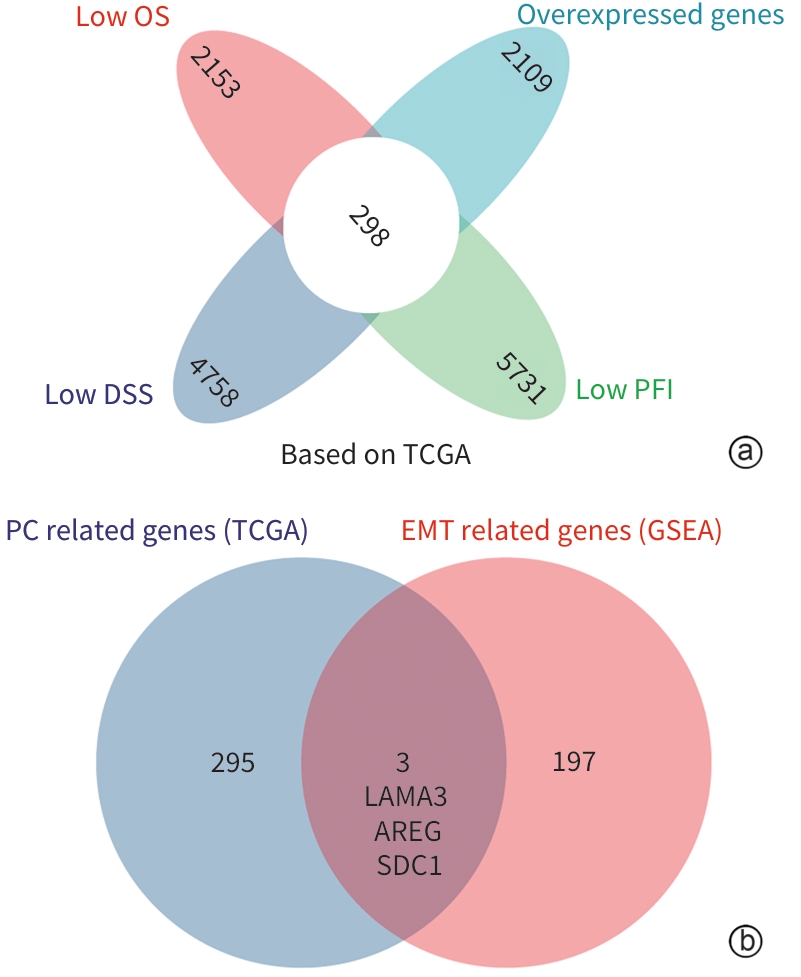
目的 探索层粘连蛋白α3亚基(LAMA3)对胰腺癌(PC)上皮间质转化(EMT)、侵袭和转移能力的影响。 方法 综合分析肿瘤和EMT相关数据库,筛选出与PC相关的EMT基因LAMA3。通过qRT-PCR和Western Blot检测LAMA3在PC组织和细胞系中的表达水平,免疫荧光确定LAMA3在PANC-1细胞中的定位,Transwell实验评估LAMA3对PC细胞侵袭和迁移能力的影响。计量资料组间比较采用t检验。 结果 利用TCGA数据库筛选出3个EMT相关PC致癌因子LAMA3、AREG和SDC1。LASSO-Cox回归模型显示,LAMA3对PC预后影响最为显著(风险评分=0.256 1×LAMA3+0.043 1×SDC1+0.071 4×AREG)。Cox回归模型和列线图显示,LAMA3的高表达是PC不良预后的独立危险因素(HR=1.32,95%CI:1.07~1.62,P<0.01)。实验结果显示,相对于正常胰腺组织,LAMA3在PC组织中的表达显著上调。相对于HPDE细胞株,LAMA3在PC细胞株AsPC-1、BxPC-3、PANC-1、MIA PaCa-2、SW1990中的表达均有不同程度的升高,其中在PANC-1细胞中的表达最高。富集分析表明,LAMA3与EMT、胶原代谢、细胞外基质降解、TGF-β通路和PI3K通路等生物过程和信号通路相关。敲低LAMA3后,N-Cadherin、Vimentin和Snail的表达水平下降,而E-Cadherin的表达水平上升。Transwell实验结果显示,LAMA3敲低后,PANC-1细胞的侵袭和迁移能力明显减弱。 结论 LAMA3在PC中高表达,促进PC细胞EMT、侵袭和迁移,可能是PC的新型诊断标志物和基因治疗靶点。 Abstract:Objective To investigate the effect of laminin subunit α3 (LAMA3) on the epithelial-mesenchymal transition (EMT), invasion, and metastasis abilities of pancreatic cancer (PC). Methods A comprehensive analysis was performed for tumor- and EMT-related databases to identify the EMT genes associated with PC, especially LAMA3. The methods of qRT-PCR and Western blot were used to measure the expression level of LAMA3 in PC tissue and cell lines; immunofluorescence assay was used to determine the localization of LAMA3 in PANC-1 cells; Transwell assay was used to investigate the effect of LAMA3 on the invasion and migration abilities of PC cells. The t-test was used for comparison of continuous data between groups. Results The analysis of the TCGA database identified 3 EMT-related oncogenes for PC, i.e., LAMA3, AREG, and SDC1. The LASSO-Cox regression model showed that LAMA3 had the most significant impact on the prognosis of PC (risk score=0.256 1×LAMA3+0.043 1×SDC1+0.071 4×AREG). The Cox model and nomogram showed that the high expression of LAMA3 was an independent risk factor for the poor prognosis of PC (hazard ratio=1.32, 95% confidence interval: 1.07 — 1.62, P<0.01). Experimental results showed that there was a significant increase in the expression of LAMA3 in pancreatic cancer tissue compared with the normal pancreatic tissue. Compared with the HPDE cell line, there were varying degrees of increase in the expression of LAMA3 in pancreatic cancer AsPC-1, BxPC-3, PANC-1, MIA PaCa-2, and SW1990 cell lines, with the highest expression level in PANC-1 cells. The enrichment analysis showed that LAMA3 was associated with the biological processes and signaling pathways such as EMT, collagen metabolism, extracellular matrix degradation, the TGF-β pathway, and the PI3K pathway. After the knockdown of LAMA3, there were significant reductions in the expression levels of N-Cadherin, Vimentin, and Snail, while there was a significant increase in the expression level of E-Cadherin. Transwell assay showed that there were significant reductions in the invasion and migration abilities of PANC-1 cells after the knockdown of LAMA3. Conclusion LAMA3 is highly expressed in PC and can promote the EMT, invasion, and migration of PC cells, and therefore, LAMA3 may be used as a novel diagnostic marker and a new therapeutic target for PC. -
注: a~f,ssGSEA分析显示LAMA3与EMT标志基因、胶原代谢、细胞外基质降解、活性氧代谢、TGF-β通路、PI3K通路存在明显的正相关性;g~h,小干扰RNA转染效率的验证;i,敲低LAMA3使EMT间质标志物表达降低,上皮标志物表达升高;j~k,敲低LAMA3显著抑制PANC-1的侵袭和迁移能力。*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
图 7 LAMA3对PC细胞EMT、侵袭和迁移的调控作用
Figure 7. The regulatory role of LAMA3 in EMT, invasion, and migration of PC cells
表 1 多因素Cox回归分析临床特征和LAMA3表达与PC预后的关系
Table 1. Multivariate Cox regression analysis of clinical characteristics and LAMA3 expression in relation to prognosis of pancreatic cancer
特征 例数 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 性别 女 80 男 99 0.813(0.541~1.222) 0.319 年龄 ≤65岁 94 >65岁 85 1.285(0.853~1.937) 0.230 T分期 T1 & T2 31 T3 & T4 146 2.035(1.079~3.838) 0.028 2.225(0.808~6.126) 0.122 N分期 N0 50 N1 124 2.161(1.287~3.627) 0.004 2.343(1.192~4.607) 0.014 M分期 M0 80 M1 5 0.773(0.185~3.227) 0.724 临床分期 Stage Ⅰ 21 Stage Ⅱ 147 2.349(1.077~5.123) 0.032 0.367(0.086~1.563) 0.175 Stage Ⅳ & Ⅲ 8 1.464(0.374~5.734) 0.585 0.346(0.059~2.026) 0.239 病理分级 G1 31 G2 96 1.974(1.016~3.834) 0.045 1.586(0.798~3.152) 0.188 G3 & G4 50 2.586(1.288~5.192) 0.008 1.919(0.948~3.883) 0.070 LAMA3 低表达 89 高表达 90 2.145(1.401~3.284) < 0.001 1.805(1.155~2.821) 0.010 -
[1] HALBROOK CJ, LYSSIOTIS CA, PASCA DI MAGLIANO M, et al. Pancreatic cancer: Advances and challenges[J]. Cell, 2023, 186( 8): 1729- 1754. DOI: 10.1016/j.cell.2023.02.014. [2] GAIANIGO N, MELISI D, CARBONE C. EMT and treatment resistance in pancreatic cancer[J]. Cancers, 2017, 9( 9): 122. DOI: 10.3390/cancers9090122. [3] FRIEND C, PARAJULI P, RAZZAQUE MS, et al. Deciphering epithelial-to-mesenchymal transition in pancreatic cancer[J]. Adv Cancer Res, 2023, 159: 37- 73. DOI: 10.1016/bs.acr.2023.02.008. [4] KECHAGIA Z, SÁEZ P, GÓMEZ-GONZÁLEZ M, et al. The laminin-keratin link shields the nucleus from mechanical deformation and signalling[J]. Nat Mater, 2023, 22( 11): 1409- 1420. DOI: 10.1038/s41563-023-01657-3. [5] TAYEM R, NIEMANN C, PESCH M, et al. Laminin 332 is indispensable for homeostatic epidermal differentiation programs[J]. J Invest Dermatol, 2021, 141( 11): 2602- 2610. e 3. DOI: 10.1016/j.jid.2021.04.008. [6] O’CONNELL P. Of LAMA3 and LAMB3: A novel gene therapy for epidermolysis bullosa[J]. Mol Ther, 2024, 32( 5): 1197- 1198. DOI: 10.1016/j.ymthe.2024.04.014. [7] YAMASHITA H, TRIPATHI M, HARRIS MP, et al. The role of a recombinant fragment of laminin-332 in integrin alpha3beta1-dependent cell binding, spreading and migration[J]. Biomaterials, 2010, 31( 19): 5110- 5121. DOI: 10.1016/j.biomaterials.2010.03.003. [8] ZENZO GD, HACHEM ME, DIOCIAIUTI A, et al. A truncating mutation in the laminin-332α chain highlights the role of the LG45 proteolytic domain in regulating keratinocyte adhesion and migration[J]. Br J Dermatol, 2014, 170( 5): 1056- 1064. DOI: 10.1111/bjd.12816. [9] TOMCZAK K, CZERWIŃSKA P, WIZNEROWICZ M. The Cancer Genome Atlas(TCGA): An immeasurable source of knowledge[J]. Contemp Oncol, 2015, 19( 1A): A68- A77. DOI: 10.5114/wo.2014.47136. [10] SUBRAMANIAN A, TAMAYO P, MOOTHA VK, et al. Gene set enrichment analysis: A knowledge-based approach for interpreting genome-wide expression profiles[J]. Proc Natl Acad Sci U S A, 2005, 102( 43): 15545- 15550. DOI: 10.1073/pnas.0506580102. [11] CARITHERS LJ, MOORE HM. The genotype-tissue expression(GTEx) project[J]. Biopreserv Biobank, 2015, 13( 5): 307- 308. DOI: 10.1089/bio.2015.29031.hmm. [12] BARRETT T, WILHITE SE, LEDOUX P, et al. NCBI GEO: Archive for functional genomics data sets: Update[J]. Nucleic Acids Res, 2013, 41( Database issue): D991- D995. DOI: 10.1093/nar/gks1193. [13] UHLEN M, ZHANG C, LEE S, et al. A pathology atlas of the human cancer transcriptome[J]. Science, 2017, 357( 6352): eaan2507. DOI: 10.1126/science.aan2507. [14] HUANG CQ, CHEN J. Laminin-332 mediates proliferation, apoptosis, invasion, migration and epithelial-to-mesenchymal transition in pancreatic ductal adenocarcinoma[J]. Mol Med Rep, 2021, 23( 1): 11. DOI: 10.3892/mmr.2020.11649. [15] TRAUB B, LINK KH, KORNMANN M. Curing pancreatic cancer[J]. Semin Cancer Biol, 2021, 76: 232- 246. DOI: 10.1016/j.semcancer.2021.05.030. [16] PARK W, CHAWLA A, O’REILLY EM. Pancreatic cancer: A review[J]. JAMA, 2021, 326( 9): 851- 862. DOI: 10.1001/jama.2021.13027. [17] DERYNCK R, WEINBERG RA. EMT and cancer: More than meets the eye[J]. Dev Cell, 2019, 49( 3): 313- 316. DOI: 10.1016/j.devcel.2019.04.026. [18] PALAMARIS K, FELEKOURAS E, SAKELLARIOU S. Epithelial to mesenchymal transition: Key regulator of pancreatic ductal adenocarcinoma progression and chemoresistance[J]. Cancers, 2021, 13( 21): 5532. DOI: 10.3390/cancers13215532. [19] SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66( 1): 7- 30. DOI: 10.3322/caac.21332. [20] LI DD, XIA LY, HUANG P, et al. Heterogeneity and plasticity of epithelial-mesenchymal transition(EMT) in cancer metastasis: Focusing on partial EMT and regulatory mechanisms[J]. Cell Prolif, 2023, 56( 6): e13423. DOI: 10.1111/cpr.13423. [21] REN H, DU PZ, GE ZY, et al. TWIST1 and BMI1 in cancer metastasis and chemoresistance[J]. J Cancer, 2016, 7( 9): 1074- 1080. DOI: 10.7150/jca.14031. [22] PAUL MC, SCHNEEWEIS C, FALCOMATÀ C, et al. Non-canonical functions of SNAIL drive context-specific cancer progression[J]. Nat Commun, 2023, 14( 1): 1201. DOI: 10.1038/s41467-023-36505-0. [23] WEI T, ZHANG XY, ZHANG Q, et al. Vimentin-positive circulating tumor cells as a biomarker for diagnosis and treatment monitoring in patients with pancreatic cancer[J]. Cancer Lett, 2019, 452: 237- 243. DOI: 10.1016/j.canlet.2019.03.009. [24] MALTSEVA DV, RODIN SA. Laminins in metastatic cancer[J]. Mol Biol, 2018, 52( 3): 411- 434. DOI: 10.7868/S0026898418030059. [25] ROUSSELLE P, SCOAZEC JY. Laminin 332 in cancer: When the extracellular matrix turns signals from cell anchorage to cell movement[J]. Semin Cancer Biol, 2020, 62: 149- 165. DOI: 10.1016/j.semcancer.2019.09.026. [26] NING BS, MEI YE. LAMA3 promotes tumorigenesis of oral squamous cell carcinoma by METTL3-mediated N6-methyladenosine modification[J]. Crit Rev Immunol, 2024, 44( 2): 49- 59. DOI: 10.1615/CritRevImmunol.2023051066. [27] ISLAM K, BALASUBRAMANIAN B, VENKATRAMAN S, et al. Upregulated LAMA3 modulates proliferation, adhesion, migration and epithelial-to-mesenchymal transition of cholangiocarcinoma cells[J]. Sci Rep, 2023, 13( 1): 22598. DOI: 10.1038/s41598-023-48798-8. [28] FENG LY, HUANG YZ, ZHANG W, et al. LAMA3 DNA methylation and transcriptome changes associated with chemotherapy resistance in ovarian cancer[J]. J Ovarian Res, 2021, 14( 1): 67. DOI: 10.1186/s13048-021-00807-y. -



 PDF下载 ( 4709 KB)
PDF下载 ( 4709 KB)

 下载:
下载: