经口胆道镜联合经皮胆道穿刺引流会师术治疗Beger术后胆瘘1例报告
DOI: 10.12449/JCH250220
伦理学声明:本例报告已获得患者知情同意。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:王语馨负责资料分析,撰写论文;顾伟刚参与收集数据,修改论文;金正参与论文修改;张筱凤指导撰写文章,修改并最后定稿。
Successful treatment of biliary fistula after Beger surgery by oral choledochoscopy-assisted percutaneous-endoscopic rendezvous technique: A case report
-
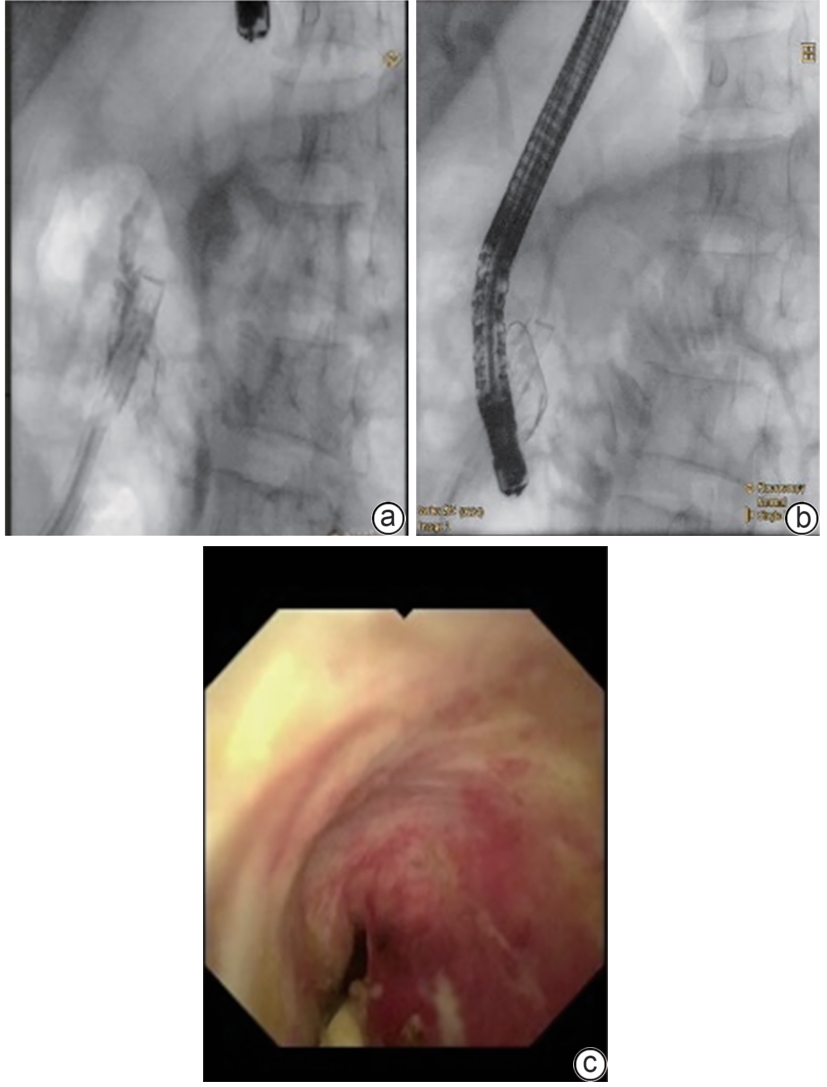
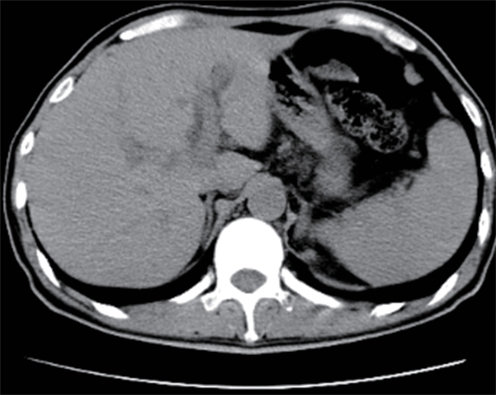
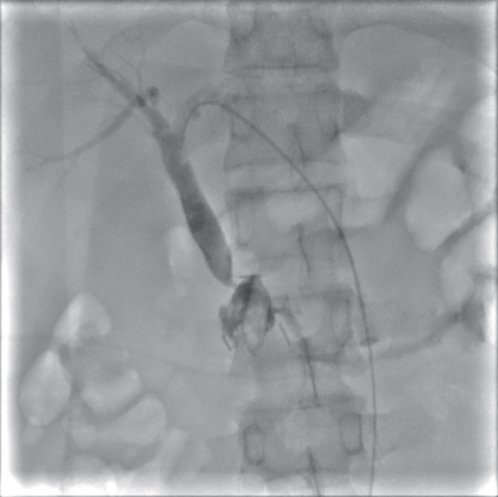
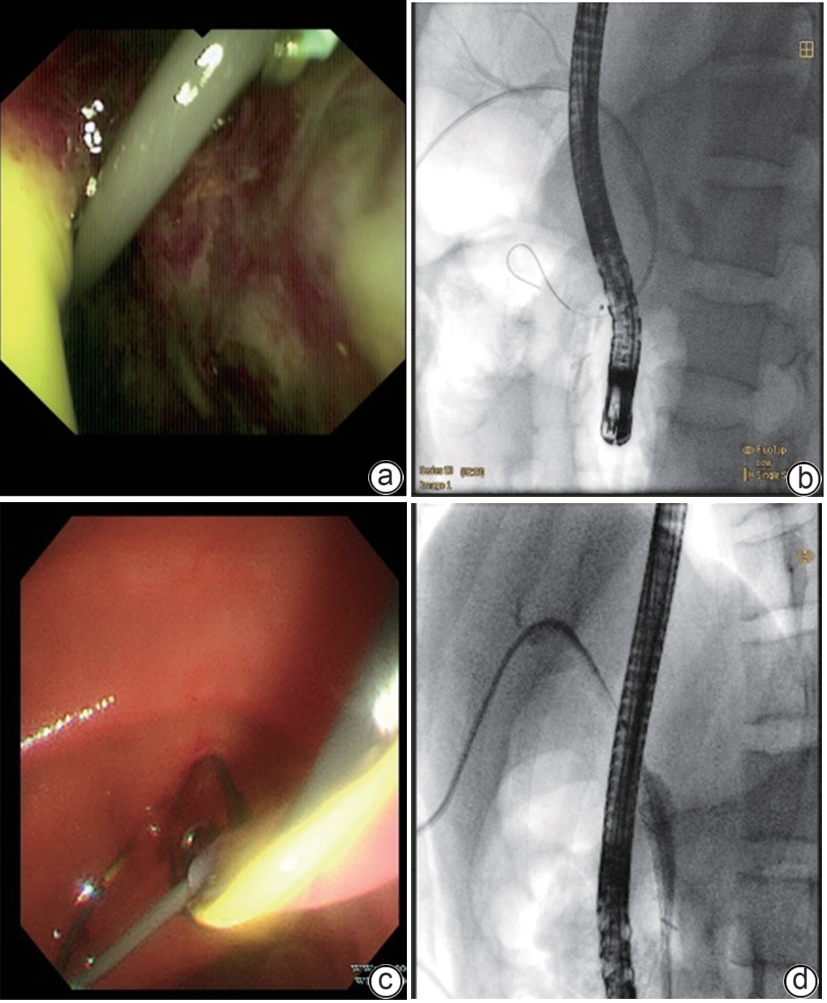
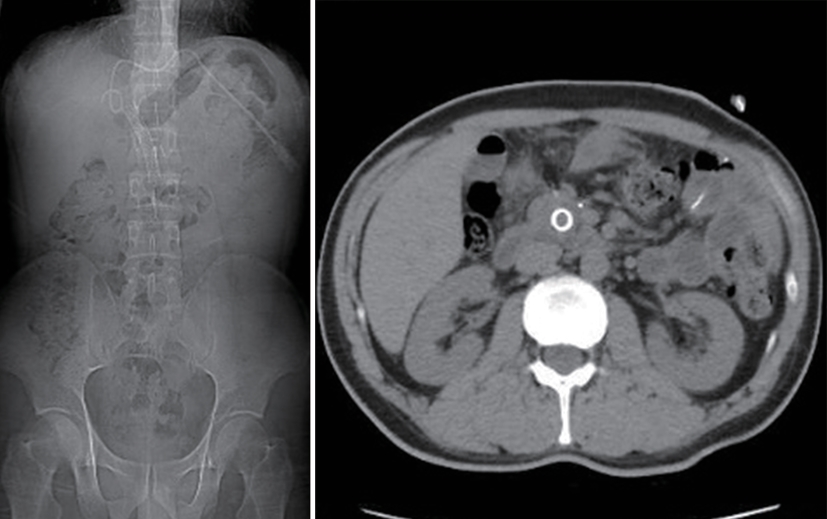
摘要: 保留十二指肠胰头局部切除术(Beger术)术后胆管损伤发生率较高,而胆管损伤的治疗方式取决于损伤严重程度,内镜治疗在胆管损伤严重的情况下较困难。近期西湖大学附属杭州市第一人民医院收治1例因Beger术后出现胆瘘的患者,通过经口胆道镜联合经皮胆道穿刺引流会师术成功诊治,取得良好效果。
-
关键词:
- 胆瘘 /
- 穿刺抽液术 /
- 胰胆管造影术, 内窥镜逆行
Abstract: Duodenum-preserving pancreatic head resection, also known as Beger surgery, has a high incidence rate of bile duct injury after surgery, while the treatment modality for bile duct injury depends on the severity of the injury, and endoscopic therapy is often challenging in case of severe bile duct injury. Recently a patient with biliary fistula after Beger surgery was admitted to Affiliated Hangzhou First People’s Hospital, Westlake University, and successful diagnosis and treatment were achieved through oral choledochoscopy-assisted percutaneous-endoscopic rendezvous technique. -
-
[1] BUSQUETS J, FABREGAT J, BOROBIA FG, et al. Organ-preserving surgery for benign lesions and low-grade malignancies of the pancreatic head: A matched case-control study[J]. Surg Today, 2010, 40( 2): 125- 131. DOI: 10.1007/s00595-008-4038-6. [2] BEGER HG, SIECH M, POCH B, et al. Limited surgery for benign tumours of the pancreas: A systematic review[J]. World J Surg, 2015, 39( 6): 1557- 1566. DOI: 10.1007/s00268-015-2976-x. [3] BEGER HG, MAYER B, RAU BM. Parenchyma-sparing, limited pancreatic head resection for benign tumors and low-risk periampullary cancer: A systematic review[J]. J Gastrointest Surg, 2016, 20( 1): 206- 217. DOI: 10.1007/s11605-015-2981-2. [4] BEGER HG, NAKAO A, MAYER B, et al. Duodenum-preserving total and partial pancreatic head resection for benign tumors: Systematic review and meta-analysis[J]. Pancreatology, 2015, 15( 2): 167- 178. DOI: 10.1016/j.pan.2015.01.009. [5] BEGER HG, MAYER B, RAU BM. Parenchyma-sparing, limited pancreatic head resection for benign tumors and low-risk periampullary cancer—a systematic review[J]. J Gastrointest Surg, 2016, 20( 1): 206- 217. DOI: 10.1007/s11605-015-2981-2. [6] GU W, WANG Y, SHEN H, et al. Value of endoscopic biliary and pancreatic duct stents in local resection of intraductal papillary myxoma of pancreatic head[J]. J Hepatobiliary Surg, 2023, 31( 4): 296- 299. DOI: 10.3969/j.issn.1006-4761.2023.04016. [7] LU C, XU BW, MOU YP, et al. Laparoscopic duodenum-preserving pancreatic head resection with real-time indocyanine green guidance of different dosage and timing: Enhanced safety with visualized biliary duct and its long-term metabolic morbidity[J]. Langenbecks Arch Surg, 2022, 407( 7): 2823- 2832. DOI: 10.1007/s00423-022-02570-0. [8] de REUVER PR, GROSSMANN I, BUSCH OR, et al. Referral pattern and timing of repair are risk factors for complications after reconstructive surgery for bile duct injury[J]. Ann Surg, 2007, 245( 5): 763- 770. DOI: 10.1097/01.sla.0000252442.91839.44. [9] BEKTAS H, SCHREM H, WINNY M, et al. Surgical treatment and outcome of iatrogenic bile duct lesions after cholecystectomy and the impact of different clinical classification systems[J]. Br J Surg, 2007, 94( 9): 1119- 1127. DOI: 10.1002/bjs.5752. [10] RAZA A, OMER A, IQBAL S, et al. Efficacy of nasobiliary tubes and biliary stents in management of patients with bile leak after liver transplantation: A systematic review[J]. Clin Endosc, 2019, 52( 2): 159- 167. DOI: 10.5946/ce.2018.118. [11] WEBER A, FEUSSNER H, WINKELMANN F, et al. Long-term outcome of endoscopic therapy in patients with bile duct injury after cholecystectomy[J]. J Gastroenterol Hepatol, 2009, 24( 5): 762- 769. DOI: 10.1111/j.1440-1746.2008.05713.x. [12] LEE Y, PARK CH, CHO E, et al. Management of post-liver transplantation biliary stricture inaccessible by endoscopic retrograde cholangiopancreatography: A case report[J]. World J Clin Cases, 2023, 11( 34): 8235- 8241. DOI: 10.12998/wjcc.v11.i34.8235. [13] ISHIDA T, HAYASHI E, TOJIMA Y, et al. Rupture of the common bile duct due to blunt trauma, presenting difficulty in diagnosis[J]. BMJ Case Rep, 2018, 11( 1): e226467. DOI: 10.1136/bcr-2018-226467. -



 PDF下载 ( 4794 KB)
PDF下载 ( 4794 KB)


 下载:
下载: