基于代谢组学探讨益气养阴解毒化瘀方对肝硬化轻微型肝性脑病肠道代谢物的影响
DOI: 10.12449/JCH250312
Effect of Yiqi Yangyin Jiedu Huayu prescription on intestinal metabolites in liver cirrhosis with minimal hepatic encephalopathy: A study based on metabolomics
-
摘要:
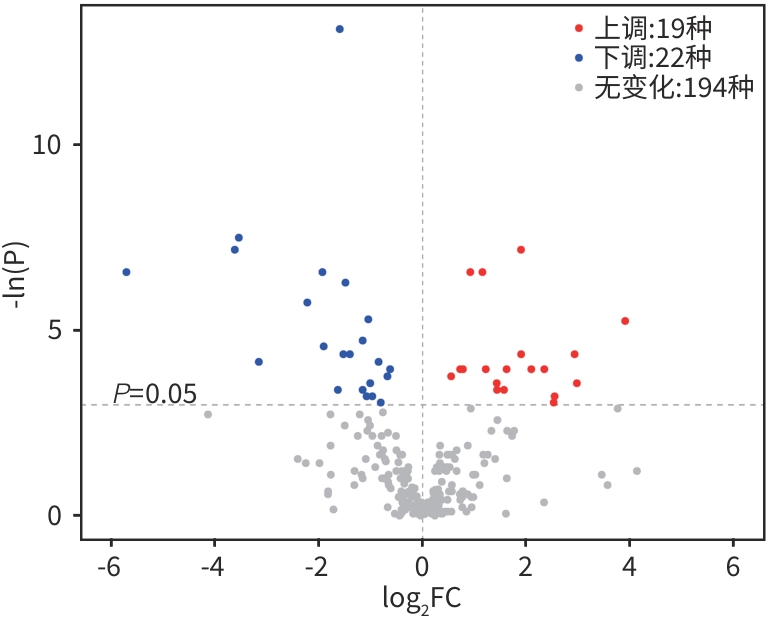
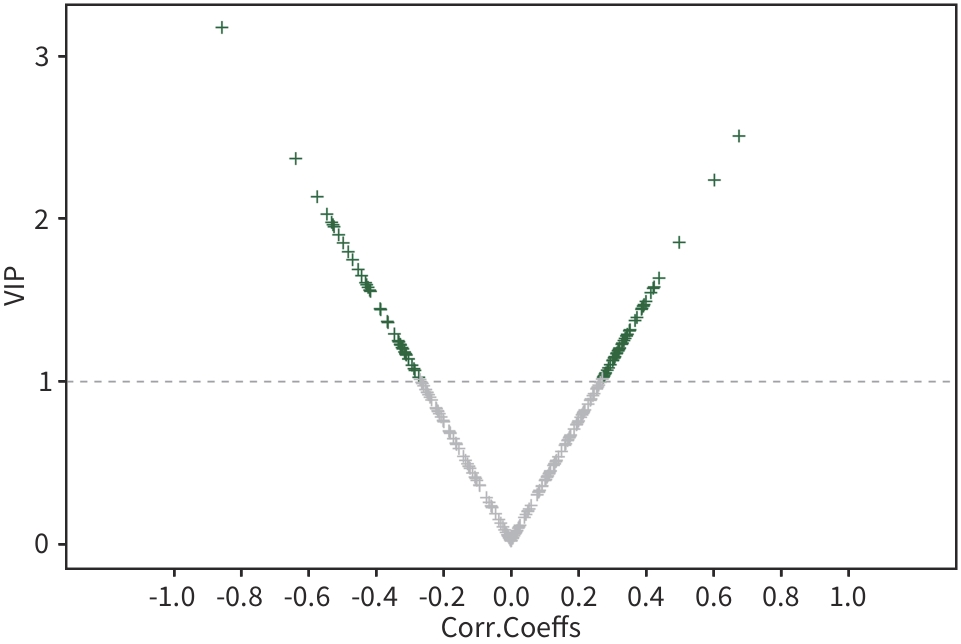
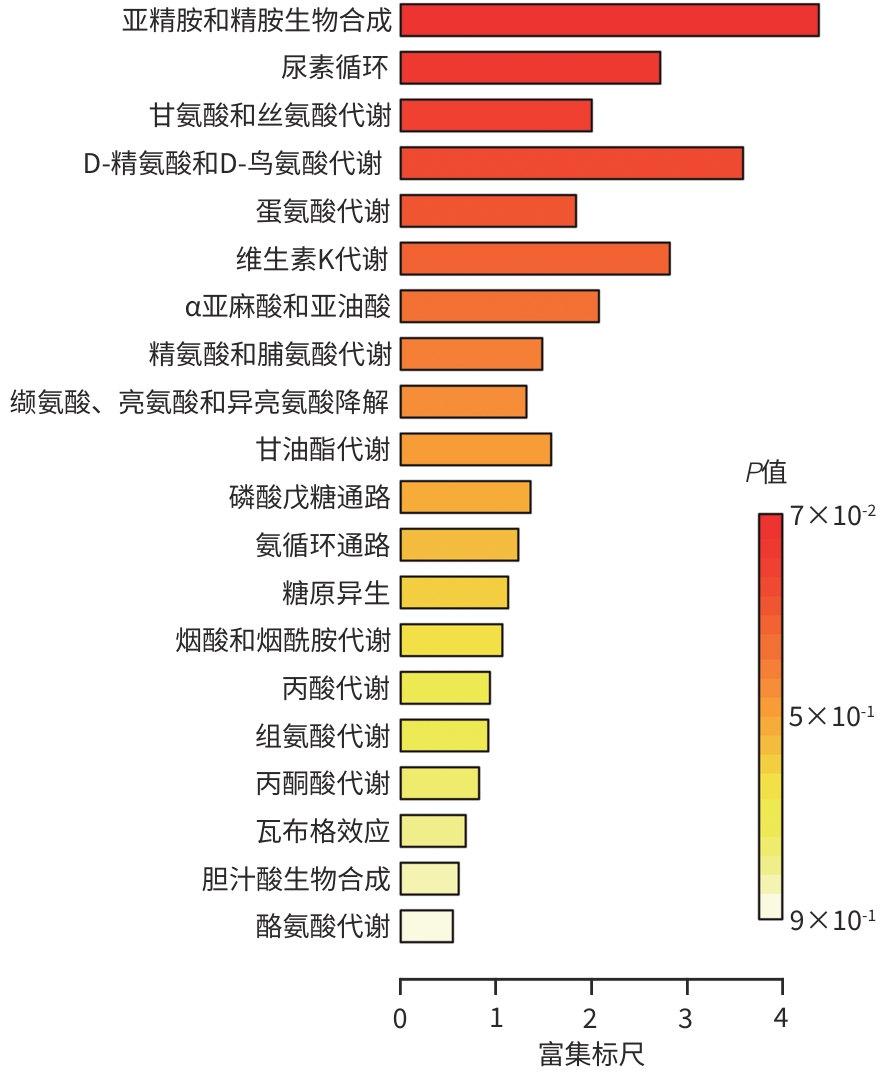
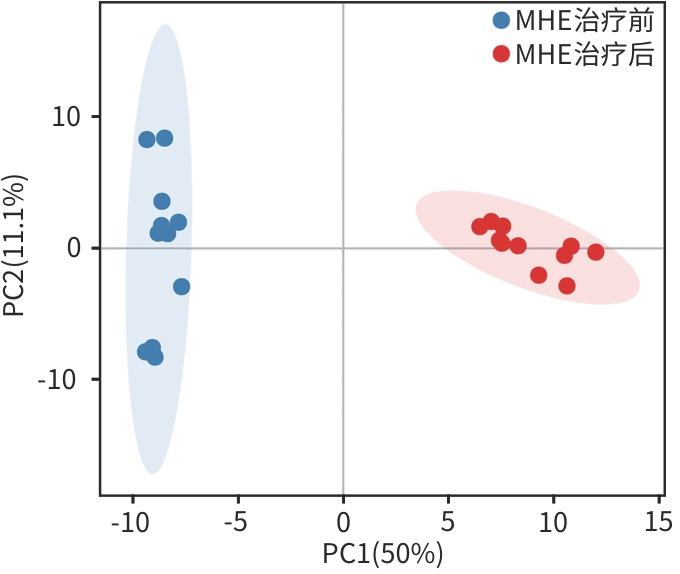
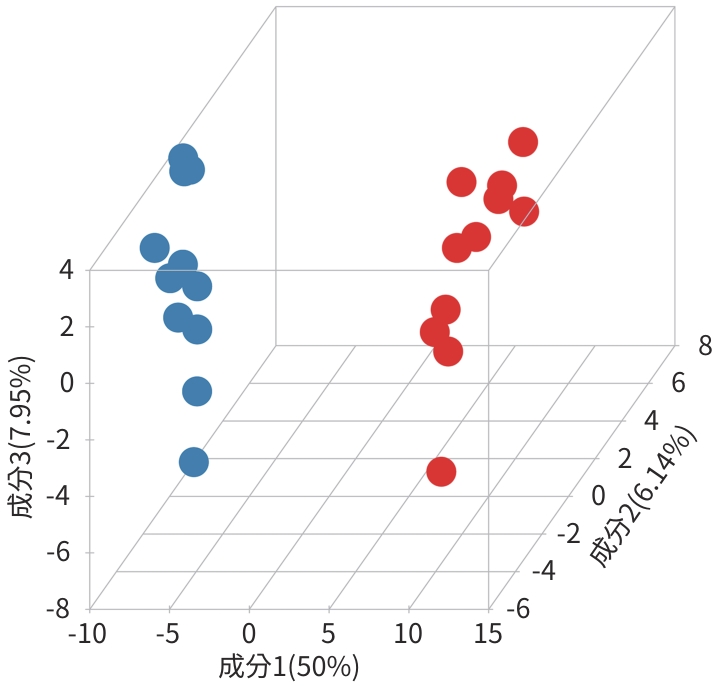
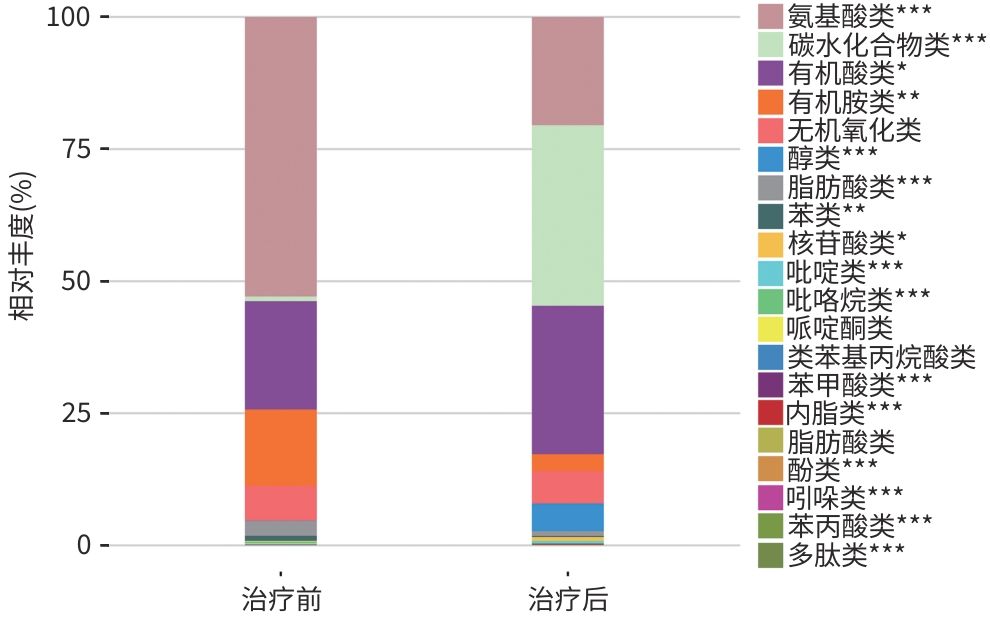
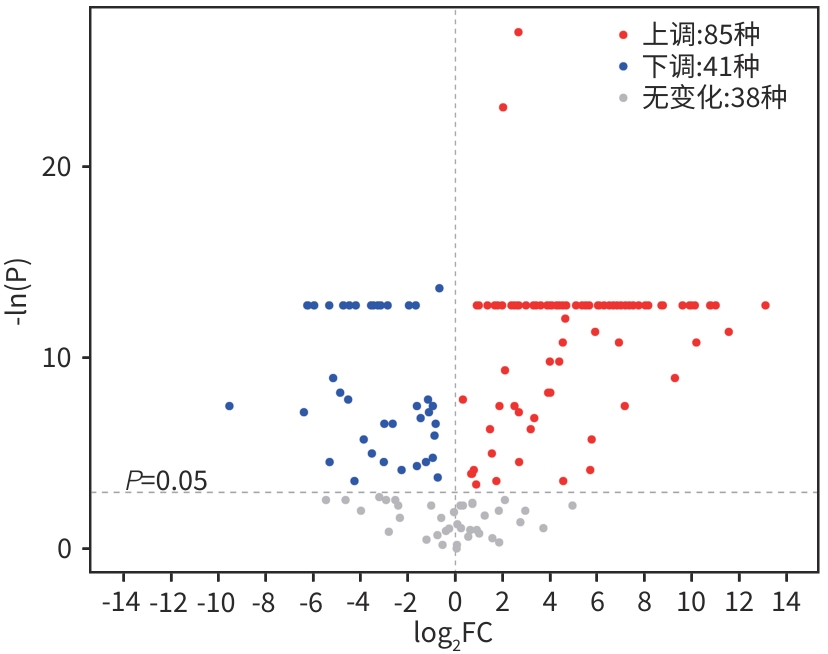
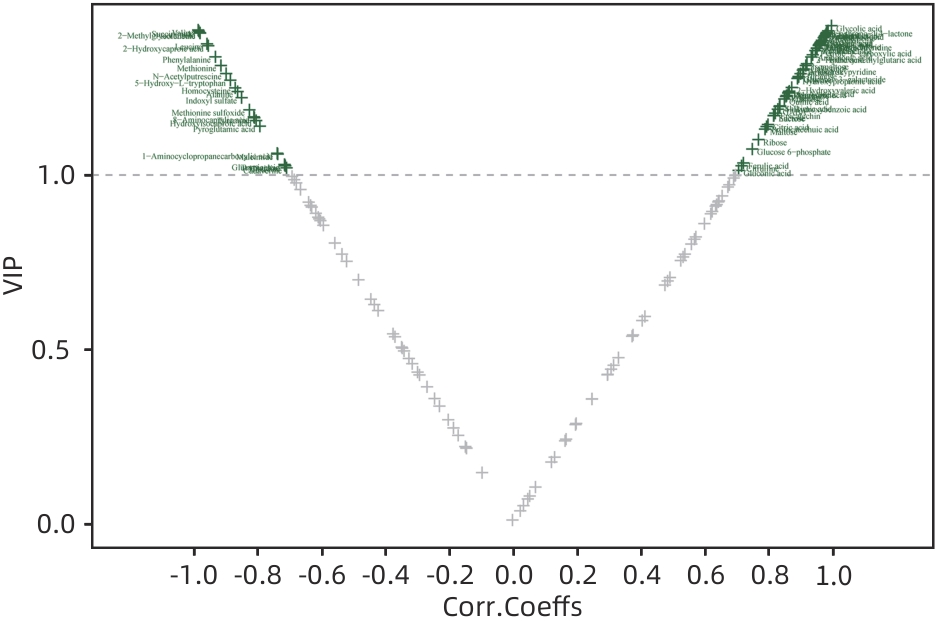
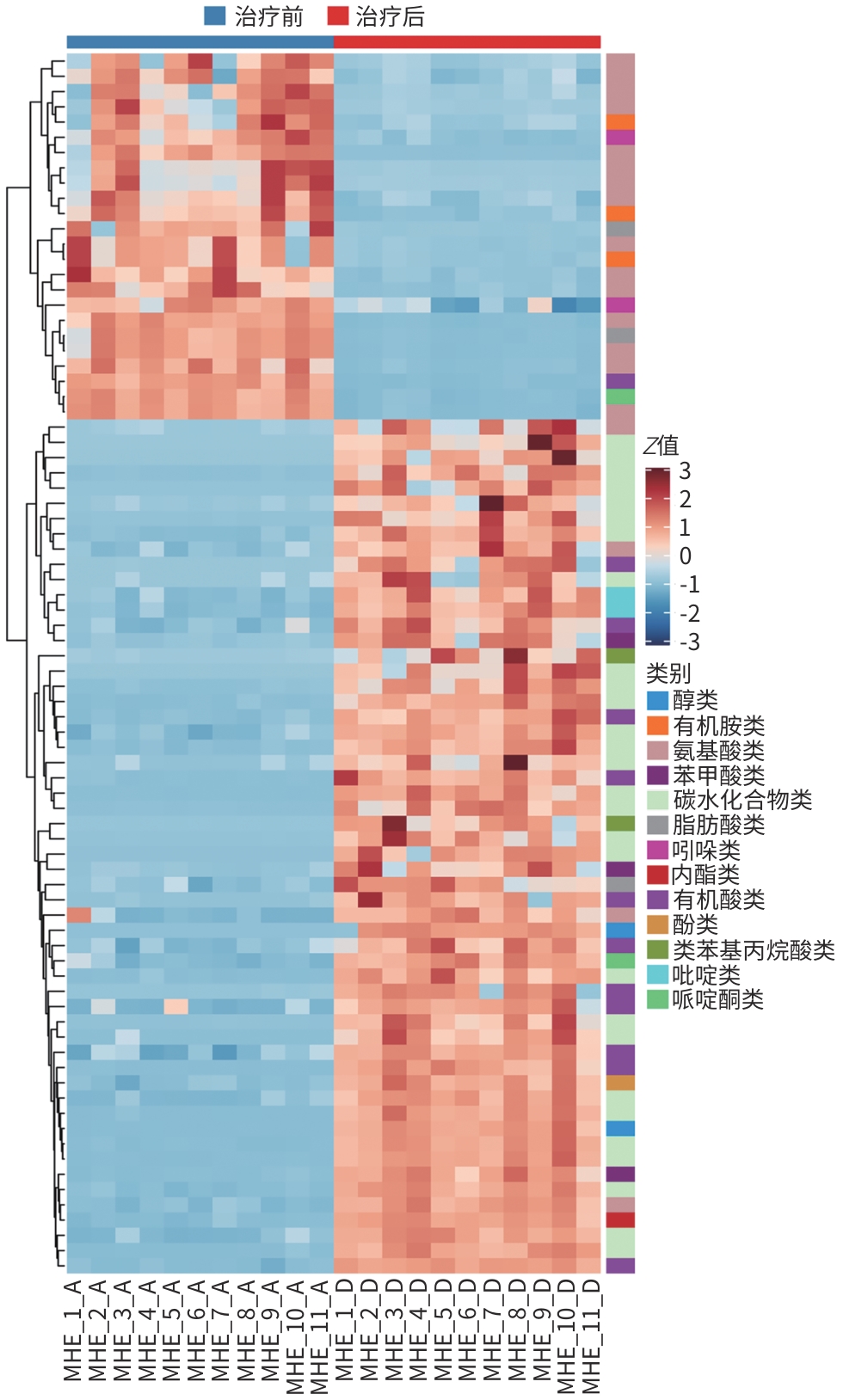
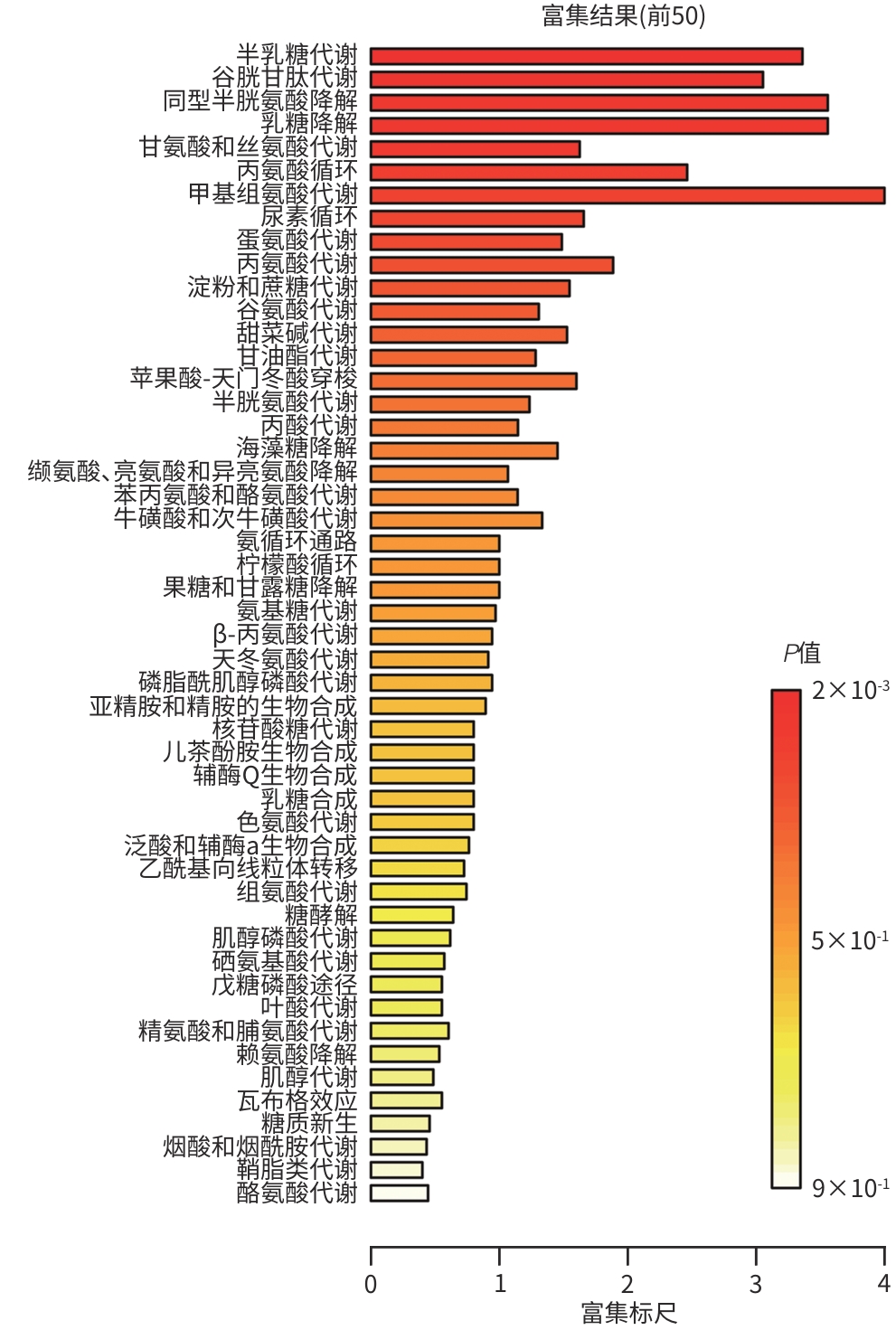
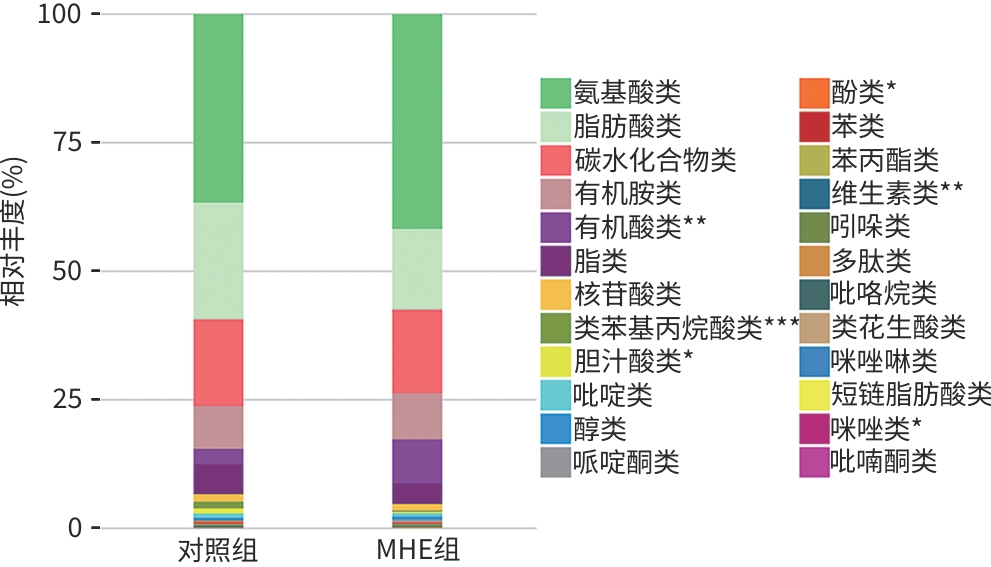
目的 通过肠道代谢组学探讨益气养阴解毒化瘀方对肝硬化轻微型肝性脑病(MHE)的作用。 方法 选取2024年3月—2024年5月于首都医科大学附属北京地坛医院住院且经肝性脑病心理测量评分诊断为MHE的肝硬化患者(n=11)作为研究对象,同时招募健康患者家属作为对照组(n=11)。通过采集对照组及益气养阴解毒化瘀方治疗前后MHE患者的粪便进行代谢组学分析,探索MHE患者的肠道代谢物特征,并通过人群队列探讨益气养阴解毒化瘀方对MHE患者肠道代谢的影响。计数资料两组间比较采用Fisher精确检验;符合正态分布的计量资料两组间比较采用成组t检验,同一组内治疗前后的比较采用配对t检验,非正态分布的计量资料两组间及同组内治疗前后的比较采用Wilcoxon秩和检验。 结果 MHE组与对照组共检测出29种差异代谢物,差异代谢物主要为氨基酸类、有机酸类、有机胺类、碳水化合物类、脂肪酸类和维生素类,MHE组明显上调12种,下调17种,主要富集在鸟氨酸代谢通路、支链氨基酸代谢通路和芳香氨基酸代谢通路。MHE患者经益气养阴解毒化瘀方治疗前后共检测出80种差异代谢物,差异代谢物主要为碳水化合物类、有机酸类和氨基酸类,中药治疗后上调56种,下调24种,差异通路也主要富集在鸟氨酸代谢通路、支链氨基酸代谢通路和芳香氨基酸代谢通路。 结论 益气养阴解毒化瘀方可能通过调节MHE患者的肠道代谢发挥治疗作用。 Abstract:Objective To investigate the effect of Yiqi Yangyin Jiedu Huayu prescription on minimal hepatic encephalopathy in liver cirrhosis based on intestinal metabolomics. Methods A total of 11 patients with liver cirrhosis who were hospitalized in Beijing Ditan Hospital, Capital Medical University, from March to May 2024, and were diagnosed with MHE based on psychometric hepatic encephalopathy score were enrolled as subjects, and 11 healthy family members of the patients were enrolled as control group. Fecal samples were collected for metabolomics analysis from the control group and the patients with MHE before and after treatment with Yiqi Yangyin Jiedu Huayu prescription, and a population cohort study was conducted to investigate the effect of Yiqi Yangyin Jiedu Huayu prescription on intestinal metabolism of patients with MHE. The Fisher’s exact test was used for categorical data between two groups; the independent samples t-test was used for comparison of normally distributed continuous data between two groups, the paired t-test was used for comparision before and after treatment within the same group, and the Wilcoxon rank-sum test was used for comparison of non-normally distributed continuous data between two groups. Results A total of 29 differentially expressed metabolites were detected between the MHE group and the control group, mainly amino acids, organic acids, organic amines, carbohydrates, fatty acids, and vitamins, and there were 12 upregulated metabolites and 17 downregulated metabolites in the MHE group, which were mainly enriched in the metabolic pathways of ornithine, branched-chain amino acid, and aromatic amino acid. After the treatment with Yiqi Yangyin Jiedu Huayu prescription, 80 differentially expressed metabolites were detected in the patients with MHE, mainly carbohydrates, organic acids, and amino acids, and there were 56 upregulated metabolites and 24 downregulated metabolites, which were mainly enriched in the metabolic pathways of ornithine, branched-chain amino acid, and aromatic amino acid. Conclusion Yiqi Yangyin Jiedu Huayu prescription can exert a therapeutic effect on patients with MHE by regulating intestinal metabolism. -
表 1 MHE组和对照组的基线资料
Table 1. Baseline characteristics of patients with MHE and control groups
项目 MHE组(n=11) 对照组(n=11) 统计值 P值 男/女(例) 8/3 7/4 0.833 年龄(岁) 61.00±11.17 60.00±8.44 t=0.237 0.815 BMI(kg/m2) 20.73±5.26 21.90±5.53 t=-0.513 0.613 NCT-A(s) 68.90±23.00 36.82±15.80 t=3.506 0.002 DST(分) 17.80±4.50 49.18±16.35 t=-6.101 <0.05 表 2 12种上调的代谢物
Table 2. 12 up-regulated metabolites
代谢物分类 代谢物 脂肪酸类 柠苹酸 有机胺类 尿素、酪胺 有机酸类 乳酸、甲基丙二酸 氨基酸类 鸟氨酸 碳水化合物类 乳果糖、核糖核酸、木糖内酯、异麦芽糖 苯类 苯基乙胺 醇类 2,3-丁二醇 表 3 17种下调的代谢物
Table 3. 17 down-regulated metabolites
代谢物分类 代谢物 脂肪酸类 油酸、亚油酸、己二酸、神经酸 有机酸类 酮亮氨酸 有机胺类 亚精胺 氨基酸类 肌氨酸 碳水化合物类 甘油酸、核糖 苯丙酸类 3-(3-羟基苯基)-3-羟基丙酸 维生素类 δ-生育醇、α-生育酚、γ-生育酚 胆汁酸类 二氯乙酸 内脂类 2-油酸单甘油酯 吡啶类 烟酸 咪唑类 咪唑丙烯酸 表 4 益气养阴解毒化瘀方治疗前后肝功能的变化
Table 4. Changes in liver function before and after treatment with Yiqi Yangyin Jiedu Huayu prescription
指标 治疗前(n=11) 治疗后(n=11) 统计值 P值 ALT(U/L) 69.65±56.66 17.50±10.87 t=-3.532 0.005 AST(U/L) 53.80(31.90~87.50) 15.70(9.70~21.50) t=-3.513 <0.001 TBil(μmol/L) 72.70(39.90~78.95) 25.50(19.28~30.43) Z=-2.856 0.004 NH3(μmol/L) 43.70±10.96 21.74±6.97 t=5.608 <0.001 Child-Pugh评分(分) 11.36±2.25 6.73±1.62 t=5.551 <0.001 MELD评分(分) 12.50(10.63~17.38) 5.00(2.83~9.67) Z=-3.034 0.002 NCT-A(s) 68.90±23.00 46.18±16.48 t=2.093 0.049 DST(分) 17.80±4.50 23.45±5.43 t=-2.572 0.018 -
[1] BOHRA A, WORLAND T, HUI S, et al. Prognostic significance of hepatic encephalopathy in patients with cirrhosis treated with current standards of care[J]. World J Gastroenterol, 2020, 26( 18): 2221- 2231. DOI: 10.3748/wjg.v26.i18.2221. [2] Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the management of hepatic encephalopathy in cirrhosis[J]. J Clin Hepatol, 2018, 34( 10): 2076- 2089. DOI: 10.3969/j.issn.1001-5256.2018.10.007.中华医学会肝病学分会. 肝硬化肝性脑病诊疗指南[J]. 临床肝胆病杂志, 2018, 34( 10): 2076- 2089. DOI: 10.3969/j.issn.1001-5256.2018.10.007. [3] YANG XH, HUANG GC, WANG M, et al. TCM Mechanism of Dahuangjianji retention Enema treating minimal hepatic encephalopathy[J]. Jilin J Tradit Chin Med, 2016, 36( 12): 1220- 1222. DOI: 10.13463/j.cnki.jlzyy.2016.12.011.杨小徽, 黄国初, 王萌, 等. 大黄煎剂保留灌肠治疗轻微型肝性脑病[J]. 吉林中医药, 2016, 36( 12): 1220- 1222. DOI: 10.13463/j.cnki.jlzyy.2016.12.011. [4] ZHANG GG. Effect of rhubarb decoction retention Enema on endotoxin and blood ammonia levels in the treatment of mild hepatic encephalopathy[J]. J Pract Tradit Chin Med, 2018, 34( 5): 523- 524. DOI: 10.3969/j.issn.1004-2814.2018.05.013.张贵格. 大黄煎剂保留灌肠治疗轻微型肝性脑病对内毒素及血氨水平的影响[J]. 实用中医药杂志, 2018, 34( 5): 523- 524. DOI: 10.3969/j.issn.1004-2814.2018.05.013. [5] JIANG TT, YANG ZY, WANG XB, et al. Clinical efficacy of Yiqi Yangyin Jiedu Huayu formula modifications combined with western medicine in the treatment of minimal hepatic encephalopathy based on the stroop test[J]. J Tradit Chin Med, 2023, 64( 5): 490- 497. DOI: 10.13288/j.11-2166/r.2023.05.011.姜婷婷, 杨志云, 王宪波, 等. 基于Stroop测试探讨益气养阴解毒化瘀方加减联合西药治疗轻微型肝性脑病的临床疗效[J]. 中医杂志, 2023, 64( 5): 490- 497. DOI: 10.13288/j.11-2166/r.2023.05.011. [6] MANCINI A, CAMPAGNA F, AMODIO P, et al. Gut: Liver: Brain axis: The microbial challenge in the hepatic encephalopathy[J]. Food Funct, 2018, 9( 3): 1373- 1388. DOI: 10.1039/c7fo01528c. [7] American Association for the Study of Liver Diseases, European Association for the Study of the Liver. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the European association for the study of the liver and the American association for the study of liver diseases[J]. J Hepatol, 2014, 61( 3): 642- 659. DOI: 10.1016/j.jhep.2014.05.042. [8] LI SW, WANG K, YU YQ, et al. Psychometric hepatic encephalopathy score for diagnosis of minimal hepatic encephalopathy in China[J]. World J Gastroenterol, 2013, 19( 46): 8745- 8751. DOI: 10.3748/wjg.v19.i46.8745. [9] DHAREL N, BAJAJ JS. Definition and nomenclature of hepatic encephalopathy[J]. J Clin Exp Hepatol, 2015, 5( Suppl 1): S37- S41. DOI: 10.1016/j.jceh.2014.10.001. [10] RIDOLA L, NARDELLI S, GIOIA S, et al. Quality of life in patients with minimal hepatic encephalopathy[J]. World J Gastroenterol, 2018, 24( 48): 5446- 5453. DOI: 10.3748/wjg.v24.i48.5446. [11] RAKOSKI MO, MCCAMMON RJ, PIETTE JD, et al. Burden of cirrhosis on older Americans and their families: Analysis of the health and retirement study[J]. Hepatology, 2012, 55( 1): 184- 191. DOI: 10.1002/hep.24616. [12] YAO C, YAO F, XIE W, et al. Clinical observation on rhubarb decoction retention Enema in treatment of minimal hepatic encephalopathy[J]. Liaoning J Tradit Chin Med, 2013, 40( 3): 474- 476. DOI: 10.13192/j.ljtcm.2013.03.96.yaoch.089.姚春, 姚凡, 谢武, 等. 大黄煎剂保留灌肠治疗轻微肝性脑病临床研究[J]. 辽宁中医杂志, 2013, 40( 3): 474- 476. DOI: 10.13192/j.ljtcm.2013.03.96.yaoch.089. [13] YAO C, WANG M, HUANG GC, et al. Effect of the detoxification and dissipation blood stasis formula on quality of life and syndrome of traditional Chinese medicine in hepatic cirrhosis with minimal hepatic encephalopathy[J]. Guangming J Chin Med, 2014, 29( 6): 1175- 1178. DOI: 10.3969/j.issn.1003-8914.2014.06.029.姚春, 王萌, 黄国初, 等. 解毒化瘀方对肝硬化轻微型肝性脑病患者生存质量及中医证候的影响[J]. 光明中医, 2014, 29( 6): 1175- 1178. DOI: 10.3969/j.issn.1003-8914.2014.06.029. [14] WANG MG, WANG N, MAO DW, et al. The clinical research into minimal hepatic encephalopathy treated with Liuwei xingshen granule[J]. Henan Tradit Chin Med, 2016, 36( 12): 2112- 2114. DOI: 10.16367/j.issn.1003-5028.2016.12.0843.王明刚, 王娜, 毛德文, 等. 六味醒神颗粒治疗轻微型肝性脑病临床研究[J]. 河南中医, 2016, 36( 12): 2112- 2114. DOI: 10.16367/j.issn.1003-5028.2016.12.0843. [15] GOMAA EZ. Human gut microbiota/microbiome in health and diseases: A review[J]. Antonie Van Leeuwenhoek, 2020, 113( 12): 2019- 2040. DOI: 10.1007/s10482-020-01474-7. [16] LONG LY, HUANG Y. Research progress on astrocyte and microglia in the pathogenesis of hepatic encephalopathy[J/CD]. Chin J Liver Dis Electron Version, 2023, 15( 3): 28- 33. DOI: 10.3969/j.issn.1674-7380.2023.03.005.龙丽媛, 黄燕. 星形胶质细胞和小胶质细胞在肝性脑病发病机制中研究进展[J/CD]. 中国肝脏病杂志(电子版), 2023, 15( 3): 28- 33. DOI: 10.3969/j.issn.1674-7380.2023.03.005. [17] KAWAGUCHI T, TANIGUCHI E, SATA M. Effects of oral branched-chain amino acids on hepatic encephalopathy and outcome in patients with liver cirrhosis[J]. Nutr Clin Pract, 2013, 28( 5): 580- 588. DOI: 10.1177/0884533613496432. [18] GLUUD LL, DAM G, LES I, et al. Branched-chain amino acids for people with hepatic encephalopathy[J]. Cochrane Database Syst Rev, 2017, 5( 5): CD001939. DOI: 10.1002/14651858.CD001939.pub4. -



 PDF下载 ( 5152 KB)
PDF下载 ( 5152 KB)

 下载:
下载: