巨型肝血管平滑肌脂肪瘤伴包膜下破裂误诊为肝细胞癌1例报告
DOI: 10.12449/JCH250321
伦理学声明: 本例报告已获得患者及家属知情同意。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:张志伟、刘丰负责课题设计及文章撰写;张和钊对文章的知识性内容作批评性审阅;史志勇、王勤英提供技术或材料支持,指导撰写文章并最终定稿。
Rare giant hepatic angiomyolipoma with subcapsular rupture misdiagnosed as hepatocellular carcinoma: A case report
-
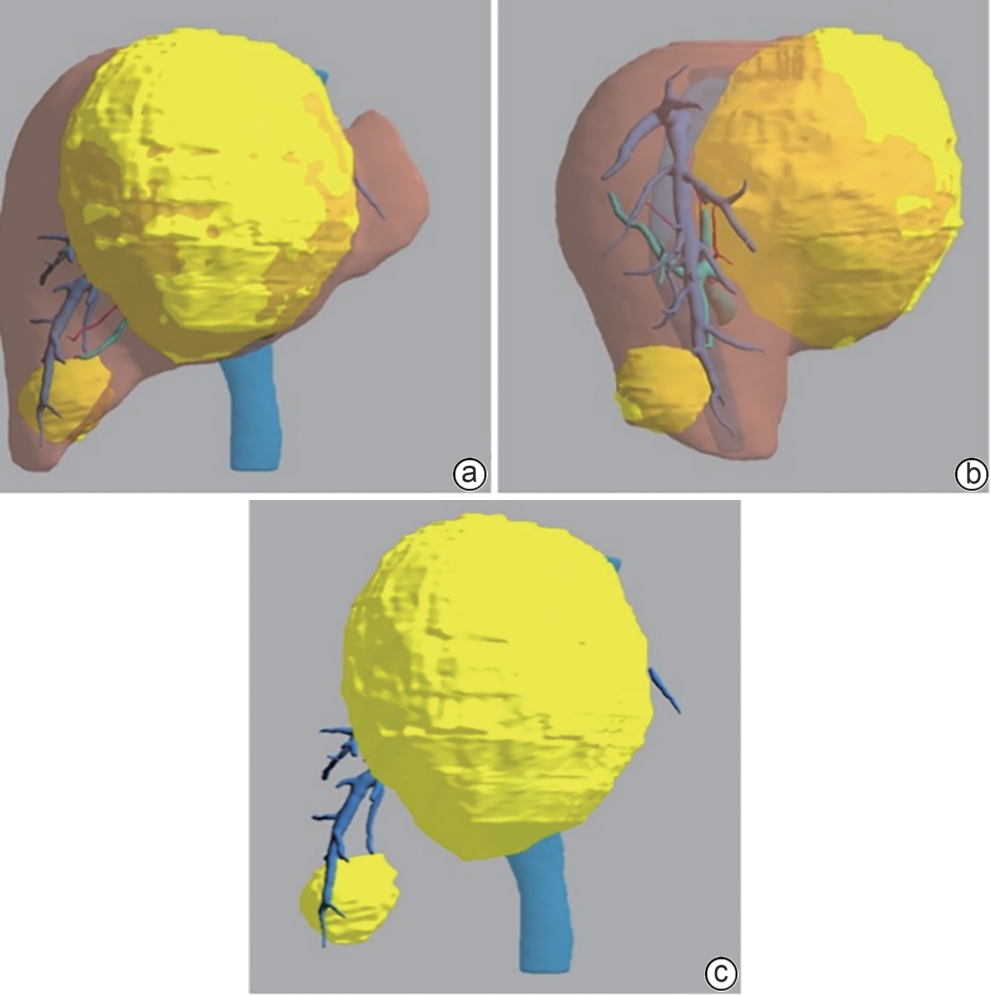
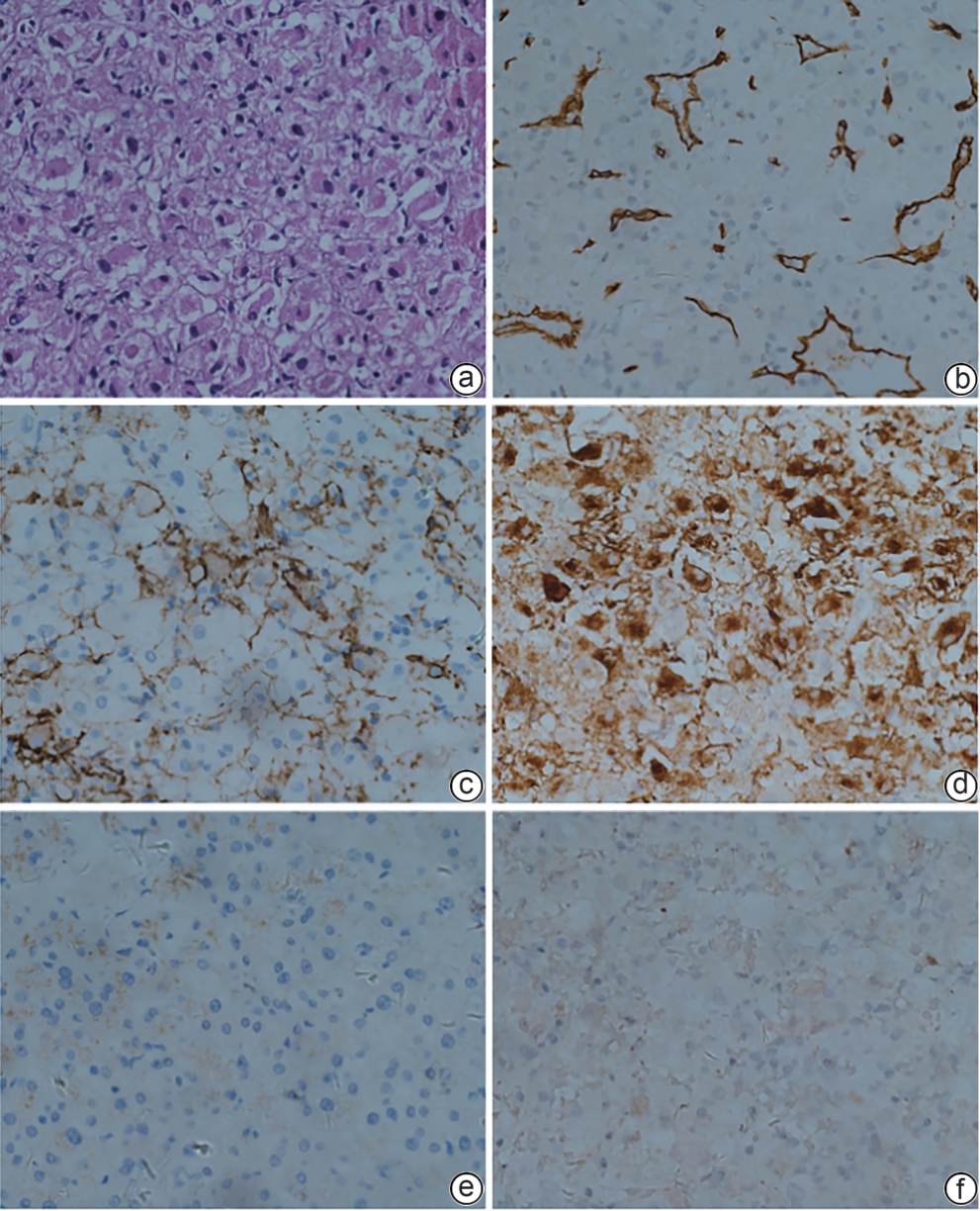
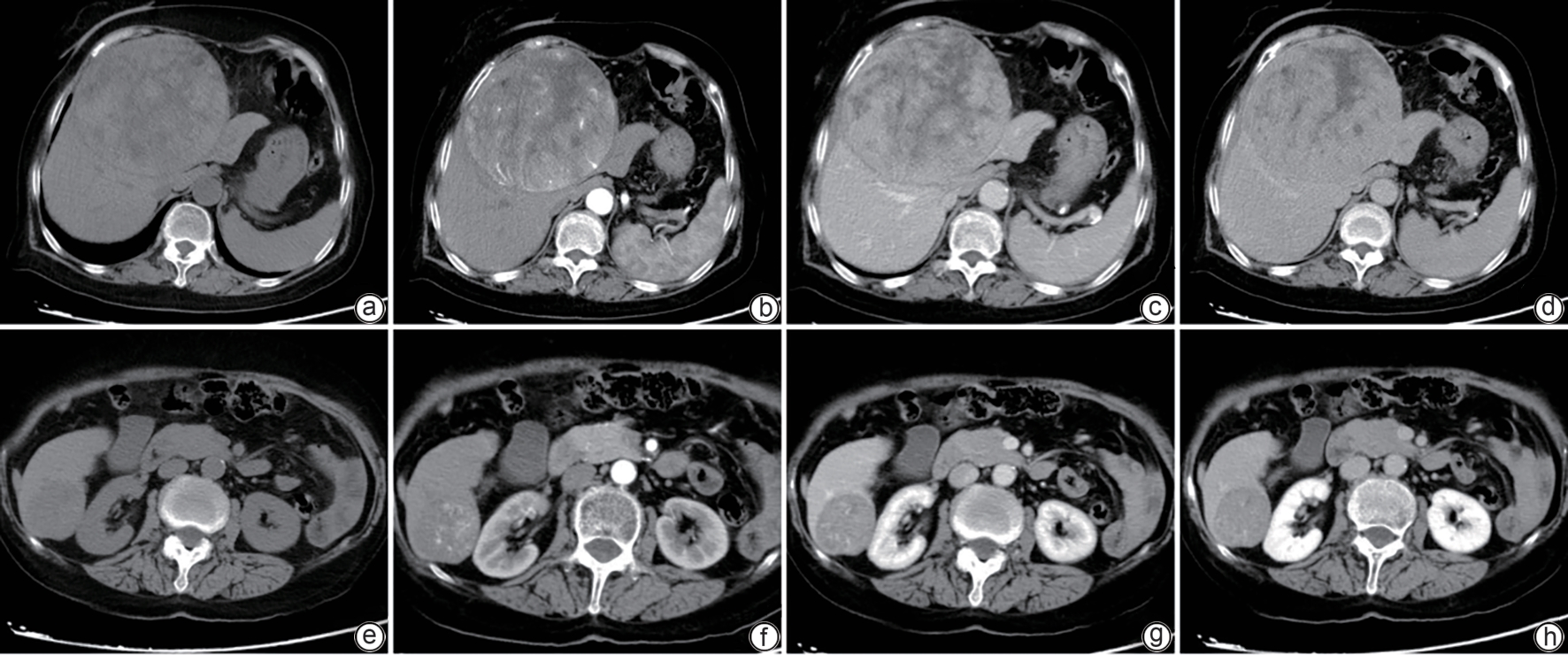
摘要: 肝血管平滑肌脂肪瘤(HAML)是一种罕见的良性间充质肿瘤,多发于中年女性,由于早期无明显症状,且缺乏特异的影像学表现,因此,诊断难度大,误诊率高。本文报道1例巨型HAML伴包膜下破裂误诊为肝细胞癌的病例,介绍其病例特点和诊治经过,期望为此类疾病的诊治提供参考。Abstract: Hepatic angiomyolipoma (HAML) is a rare benign mesenchymal tumor frequently observed in middle-aged women. Due to the absence of prominent symptoms in the early stage and the lack of specific imaging findings, the diagnosis of this disease can be challenging, leading to a high rate of misdiagnosis. This article reports a case of giant HAML with subcapsular rupture that was misdiagnosed as hepatocellular carcinoma and introduces the characteristics of the case and its diagnosis and treatment process, in order to provide a reference for the diagnosis and treatment of this type of disease.
-
Key words:
- Liver Neoplasms /
- Angiomyolipomas /
- Diagnostic Errors
-
-
[1] CALAME P, TYRODE G, WEIL VERHOEVEN D, et al. Clinical characteristics and outcomes of patients with hepatic angiomyolipoma: A literature review[J]. World J Gastroenterol, 2021, 27( 19): 2299- 2311. DOI: 10.3748/wjg.v27.i19.2299. [2] WU ML, ZHU Q, HU Y, et al. Invasive renal angiomyolipoma combined with pseudoaneurysm formation: A case report and literature review[J]. J Jilin Univ(Med Edit), 2024, 50( 1): 254- 259. DOI: 10.13481/j.1671-587X.20240131.吴明丽, 朱晴, 胡月, 等. 侵袭性肾血管平滑肌脂肪瘤伴假性动脉瘤形成1例报告及文献复习[J]. 吉林大学学报(医学版), 2024, 50( 1): 254- 259. DOI: 10.13481/j.1671-587X.20240131. [3] LIN ZY, DING Z, JIANG HT. Recurrent epithelioid angiomyolipoma of the adrenal gland: A case report and literature review[J]. AME Case Rep, 2024, 8: 57. DOI: 10.21037/acr-23-189. [4] KLOMPENHOUWER AJ, VERVER D, JANKI S, et al. Management of hepatic angiomyolipoma: A systematic review[J]. Liver Int, 2017, 37( 9): 1272- 1280. DOI: 10.1111/liv.13381. [5] PERVAIZ J Jr, ZAMAN S, KHALID S, et al. Hepatic angiomyolipoma with predominant lipomatous component: A rare entity[J]. Cureus, 2024, 16( 2): e54357. DOI: 10.7759/cureus.54357. [6] ISHAK KG. Primary hepatic tumors in childhood[J]. Prog Liver Dis, 1976, 5: 636- 667. [7] LIU WH, WANG JW, HUANG Q, et al. Comparison of MRI features of epithelioid hepatic angiomyolipoma and hepatocellular carcinoma: Imaging data from two centers[J]. Front Oncol, 2018, 8: 600. DOI: 10.3389/fonc.2018.00600. [8] KLOMPENHOUWER AJ, DWARKASING RS, DOUKAS M, et al. Hepatic angiomyolipoma: An international multicenter analysis on diagnosis, management and outcome[J]. HPB(Oxford), 2020, 22( 4): 622- 629. DOI: 10.1016/j.hpb.2019.09.004. [9] WU CT, YANG Y, TIAN F, et al. A rare case of giant hepatic angiomyolipoma with subcapsular rupture[J]. Front Surg, 2023, 10: 1164613. DOI: 10.3389/fsurg.2023.1164613. [10] DAI CL, XUE LP, LI YM. Multi-slice computed tomography manifestations of hepatic epithelioid angiomyolipoma[J]. World J Gastroenterol, 2014, 20( 12): 3364- 3368. DOI: 10.3748/wjg.v20.i12.3364. [11] ATTARD A, PISCOPO N, SCHEMBRI J, et al. A rare case of PEComa of the liver[J]. GE Port J Gastroenterol, 2021, 28( 3): 217- 221. DOI: 10.1159/000509192. [12] AMANTE MF. Hepatic perivascular epithelioid cell tumors: Benign, malignant, and uncertain malignant potential[J]. World J Gastroenterol, 2024, 30( 18): 2374- 2378. DOI: 10.3748/wjg.v30.i18.2374. [13] ALGASHAAMY K, MONTGOMERY EA, GARCIA-BUITRAGO M. Liver mesenchymal neoplasms: Something old, something new[J]. Pathology, 2022, 54( 2): 225- 235. DOI: 10.1016/j.pathol.2021.09.022. [14] WANG SQ, XIA HW, LIU XX, et al. Hepatic epithelioid angiomyolipoma mimicking hepatocellular carcinoma on MR and 18F-FDG PET/CT imaging: A case report and literature review[J]. Hell J Nucl Med, 2022, 25( 2): 205- 209. DOI: 10.1967/s002449912480. [15] NGUYEN CL, NGUYEN HH, LUONG TH, et al. Giant hepatic angiomyolipoma presenting with severe Anemia: A surgical case report and review of literature[J]. Int J Surg Case Rep, 2022, 94: 107087. DOI: 10.1016/j.ijscr.2022.107087. [16] KHADKA L, LUITEL P, PAUDEL S, et al. Hepatic angiomyolipoma masquerading as abdominal pain: A case report[J]. Int J Surg Case Rep, 2024, 117: 109516. DOI: 10.1016/j.ijscr.2024.109516. [17] MOENCH C, BURCK I, BUG R, et al. Hepatic angiomyolipoma: A rare liver tumor[J]. Z Gastroenterol, 2008, 46( 1): 54- 57. DOI: 10.1055/s-2007-963773. [18] TAJIMA S, SUZUKI A, SUZUMURA K. Ruptured hepatic epithelioid angiomyolipoma: A case report and literature review[J]. Case Rep Oncol, 2014, 7( 2): 369- 375. DOI: 10.1159/000363690. [19] WANG JJ, SHI RZ, LUO H, et al. Transcatheter arterial embolization followed by laparoscopic anatomic hepatectomy for spontaneous rupture of a giant hepatic angiomyolipoma: A case report[J]. Front Surg, 2023, 10: 1329535. DOI: 10.3389/fsurg.2023.1329535. [20] KIM SH, KANG TW, LIM K, et al. A case of ruptured hepatic angiomyolipoma in a young male[J]. Clin Mol Hepatol, 2017, 23( 2): 179- 183. DOI: 10.3350/cmh.2016.0027. [21] GÜNSTER SA, KIM M, LOCK JF, et al. Hepatic angiomyolipoma: A case report and literature review[J]. Int J Surg Case Rep, 2020, 77: 345- 348. DOI: 10.1016/j.ijscr.2020.11.045. [22] MACHIDA M, SUGO H, WATANOBE I. A huge hepatic angiomyolipoma with growth during 5 years of follow-up[J]. J Surg Case Rep, 2020, 2020( 9): rjaa353. DOI: 10.1093/jscr/rjaa353. [23] ALMAZEDI B, STUBBS C. Renal angiomyolipoma: From imaging to intervention[J]. Clin Radiol, 2024, 79( 1): 25- 32. DOI: 10.1016/j.crad.2023.09.028. [24] MCQUEEN S, COMBES A, BENZ D. Renal angiomyolipoma: Beyond size criteria for predicting rupture[J]. J Med Imaging Radiat Oncol, 2023, 67( 6): 619- 624. DOI: 10.1111/1754-9485.13547. [25] VELASCO-ALBENDEA FJ, GIL-BELMONTE MJ, ESTÉBANEZ-FERRERO B, et al. A case report of hepatic angiomyolipoma, inflammatory subtype. clinico-pathological characterization: A diagnostic challenge[J]. Diagn Pathol, 2023, 18( 1): 57. DOI: 10.1186/s13000-023-01343-7. [26] PARK A, SAVSANI K, ALFONSO A, et al. Robotic management of huge hepatic angiomyolipoma: A case report and literature review[J]. Ann Hepatobiliary Pancreat Surg, 2024, 28( 4): 527- 534. DOI: 10.14701/ahbps.24-033. [27] ZHANG XW, CHEN J, HUANG BF, et al. Case report: Hepatic epithelioid angiomyolipoma with elevated alpha-fetoprotein and a history of breast cancer[J]. Front Surg, 2022, 9: 991228. DOI: 10.3389/fsurg.2022.991228. [28] JIANG TJ, HU YJ, WANG JC, et al. Fat-poor hepatic angiomyolipoma in noncirrhotic livers: Imaging features, pathology, and differential diagnosis[J]. J Comput Assist Tomogr, 2024, 48( 5): 727- 733. DOI: 10.1097/RCT.0000000000001605. [29] LIU JQ, WANG QL, CAO J, et al. Clinical characteristics and misdiagnosis analysis of 12 patients with renal angiomyolipoma misdiagnosed as renal cell carcinoma[J]. Clin Misdiagn Misther, 2024, 37( 15): 5- 9. DOI: 10.3969/j.issn.1002-3429.2024.15.002.刘俊强, 王秋莲, 曹娟, 等. 肾血管平滑肌脂肪瘤误诊为肾细胞癌12例临床分析[J]. 临床误诊误治, 2024, 37( 15): 5- 9. DOI: 10.3969/j.issn.1002-3429.2024.15.002. [30] MINAMI Y, NISHIDA N, KUDO M. Imaging diagnosis of various hepatocellular carcinoma subtypes and its hypervascular mimics: Differential diagnosis based on conventional interpretation and artificial intelligence[J]. Liver Cancer, 2022, 12( 2): 103- 115. DOI: 10.1159/000528538. [31] JIA JJ, LUO J, PAN CG, et al. Single-center experience in the diagnosis and treatment of hepatic perivascular epithelioid cell neoplasm[J]. J Clin Transl Hepatol, 2022, 10( 1): 72- 79. DOI: 10.14218/JCTH.2020.00170. [32] PARK S, KIM MJ, HAN K, et al. Differentiation between hepatic angiomyolipoma and hepatocellular carcinoma in individuals who are not at-risk for hepatocellular carcinoma[J]. Eur J Radiol, 2023, 166: 110957. DOI: 10.1016/j.ejrad.2023.110957. [33] ASSARZADEGAN N, MONTGOMERY E. Uncommon benign neoplasms and pseudotumors of the liver[J]. Arch Pathol Lab Med, 2023, 147( 4): 390- 402. DOI: 10.5858/arpa.2021-0539-RA. [34] de la SANCHA C, KHAN S, ALRUWAII F, et al. Hepatic angiomyolipoma with predominant epithelioid component: Diagnostic clues on aspiration and core needle biopsies[J]. Diagn Cytopathol, 2021, 49( 7): E238- E241. DOI: 10.1002/dc.24688. [35] CAI XR, SUN SC, DENG YX, et al. Hepatic epithelioid angiomyolipoma is scattered and unsuitable for surgery: A case report[J]. J Int Med Res, 2023, 51( 2): 3000605231154657. DOI: 10.1177/03000605231154657. -



 PDF下载 ( 3282 KB)
PDF下载 ( 3282 KB)

 下载:
下载: