缺氧诱导因子1α对肝癌细胞HepG2干细胞特性及表阿霉素敏感性的影响
DOI: 10.3969/j.issn.1001-5256.2021.02.021
Effect of hypoxia-inducible factor-1α on stemness and epirubicin sensitivity of HepG2 hepatoma cells
-
摘要:
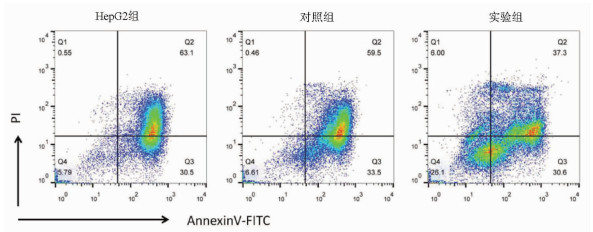
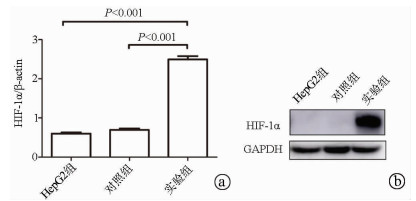
目的 探讨缺氧诱导因子(HIF)1α对肝癌细胞HepG2干细胞特性及表阿霉素敏感性的影响。 方法 以肝癌细胞为研究对象,肝癌细胞HepG2脂质体转染过表达HIF-1α的质粒作为实验组,转染pcDNA3.1空质粒作为对照组,单独HepG2细胞为HepG2组。实时荧光定量PCR检测HIF-1α mRNA表达,Western Blot检测HIF-1α蛋白表达;流式细胞术检测细胞表面CD133表达。不同浓度表阿霉素(0、6.25、12.5、25、50 μmol/L)作用3组细胞24 h,MTT法检测细胞活性,流式细胞术检测表阿霉素(50 μmol/L)处理后细胞凋亡情况。计量资料多组间比较采用单因素方差分析,进一步两两比较采用t检验。 结果 相较于HepG2组及对照组,实验组HIF-1α mRNA的表达水平明显升高,差异具有统计学意义(P值均<0.001);Western Blot结果显示实验组HIF-1α蛋白高表达。HepG2组、对照组和实验组细胞的CD133比例分别为0.040%±0.003%、0.030%±0.010%、20.110%±0.600%,实验组的CD133阳性率显著高于HepG2组和对照组(P值均<0.001)。表阿霉素浓度为25、50 μmol/L时,HepG2组和对照组的细胞活性明显受到抑制,显著低于实验组(P值均<0.05)。50 μmol/L表阿霉素作用48 h后,实验组的细胞凋亡率(67.9%±2.5%)较HepG2组(93.6%±1.5%)和对照组(93.0%±1.2%)明显降低(P值均<0.001)。 结论 过表达HIF-1α的质粒成功转染至HepG2细胞,HIF-1α可提高肝癌细胞干细胞比例使其对表阿霉素耐药。 -
关键词:
- 肝肿瘤, 实验性 /
- 缺氧诱导因子1, α亚基 /
- 表柔比星 /
- 干细胞 /
- 抗药性, 肿瘤
Abstract:Objective To investigate the effect of hypoxia-inducible factor-1α (HIF-1α) on the stemness and epirubicin sensitivity of hepatoma cells. Methods Hepatoma cells were selected for experiment. HepG2 hepatoma cells transfected with HIF-1α overexpression plasmid were selected as experimental group, and those transfected with pcDNA3.1 empty plasmid were selected as control group; HepG2 cells alone were selected as HepG2 group. Quantitative real-time PCR was used to measure the mRNA expression of HIF-1α; Western blot was used to measure the protein expression of HIF-1α; flow cytometry was used to measure the expression of CD133 on the surface of hepatoma cells. The three groups of cells were treated with epirubicin at different concentrations (0, 6.25, 12.5, 25, and 50 μmol/L) for 24 hours; MTT assay was used to measure cell viability, and flow cytometry was used to measure apoptosis after treatment with epirubicin (50 μmol/L). A one-way analysis of variance was used for comparison of continuous data between multiple groups, and the t-test was used for further comparison between two groups. Results Compared with the HepG2 group and the control group, the experimental group had a significant increase in the mRNA expression of HIF-1α (both P < 0.001), and Western blot showed high expression of HIF-1α in the experimental group. The percentage of CD133 cells was 0.040%±0.003% in the HepG2 group, 0.030%±0.010% in the control group, and 20.110%±0.600% in the experimental group, and the experimental group had a significantly higher positive rate of CD133+ than the HepG2 group and the control group (both P < 0.001). At an epirubicin concentration of 25 and 50 μmol/L, the HepG2 group and the control group had significantly inhibited cell viability and a significantly lower cell viability than the experimental group (both P < 0.05). After the treatment with 50 μmol/L epirubicin for 48 hours, the experimental group had a significantly lower cell apoptosis rate than the HepG2 group (67.9%±2.5% vs 93.6%±1.5%, P < 0.001) and the control group (67.9%±2.5% vs 93.0%±1.2%, P < 0.001). Conclusion HepG2 cells are successfully transfected with HIF-1α overexpression plasmid, and HIF-1α can increase the percentage of liver cancer stem cells and improve their resistance to epirubicin. -
非酒精性脂肪性肝病(NAFLD)是一种常见的慢性肝病,包括非酒精性脂肪肝、非酒精性脂肪性肝炎(NASH)及其相关肝纤维化和肝硬化[1],部分患者甚至进展为肝癌,现在被称为代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)[2-3],随着肥胖发病率逐年增高和低龄化趋势,NAFLD成为儿童慢性肝病的常见原因[4],肝硬化的三大主要原因之一。目前MAFLD的发病机制仍不清楚,临床上亦缺乏有效的药物治疗,因此MAFLD发病机制的研究是当前的热点。
黏膜相关恒定T(mucosal associated invariant T,MAIT)淋巴细胞是一类新的天然免疫T淋巴细胞,是最丰富的TCRαβ+T淋巴细胞,以1类主要组织相容性复合体相关分子和不依赖MR1的方式快速激活MAIT淋巴细胞[5],发挥生物学功能,释放多种细胞因子,如IFNγ、TNFα、IL-17和溶细胞产物穿孔素及颗粒素分泌并脱颗粒(将CD107a暴露于细胞表面)等杀伤性细胞因子[6],迅速诱导细胞溶解和靶细胞的死亡。国外相关报道[7-9]显示MAIT淋巴细胞在成人MAFLD发病中起到减少肝脏炎症及促肝纤维化作用,但在儿童MAFLD发病中作用的研究甚少。本研究通过分析MAFLD儿童外周血MAIT淋巴细胞的变化及其与临床指标的相关性,探讨MAIT淋巴细胞在儿童MAFLD发生发展中的作用。
1. 资料与方法
1.1 研究对象
收集2022年3月—2022年5月在本院肝病中心诊治的18例MAFLD患儿(MAFLD组)的外周血标本,根据年龄匹配的20例正常儿童作为对照(对照组),其外周血标本采集于本院健康管理中心。
1.2 纳入标准
MAFLD组纳入标准:脂肪肝合并超重/肥胖、2型糖尿病和代谢功能障碍中至少一项特征[1-2]。同时排除合并甲、乙、丙、丁、戊型肝炎病毒感染,自身免疫性肝病,人类免疫缺陷病毒等病毒感染。对照组纳入标准:肝功能正常,无慢性疾病,近期无感染史等。
1.3 方法
人外周血免疫细胞的制备:留取MAFLD组和对照组儿童外周血3 mL,将PBS加入3 mL新鲜全血中,吸取稀释后的外周血缓慢加到lymphoprep表面。全血在400×g室温下离心20 min,收集第二层外周血免疫细胞并转入含有PBS的离心管中,离心机800×g室温下离心10 min。离心结束后去上清,再加入10 mL PBS,离心机400×g室温下离心5 min,清洗外周血免疫细胞以彻底去除残留的lymphoprep。
应用流式细胞仪检测MAIT细胞,根据标准方案使用以下抗体:CD183(CXCR3)、CD279(PD-1), CD186(CXCR6)、CD3、TCRVα7.2、CD8、CD69、CD161、CD107a、CD196 (CCR6)、CD4和穿孔素抗体进行染色,上流式细胞仪(三激光八色流式细胞分析仪,型号:FacsCantoll,产地:美国)进行分析。外周血中MAIT细胞定义为CD3+CD161+TCRVα7.2+细胞。
收集MAFLD组和对照组儿童血常规及肝功能结果,使用瞬时弹性成像检测MAFLD组患儿的肝纤维化和脂肪含量,儿童MAFLD肝纤维化最佳临界值为6.65 kPa[10],区分有无脂肪变性的脂肪肝参数最佳临界值为222.5 dB/m[11]。
1.4 统计学方法
采用SPSS 23.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;非正态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。MAFLD组患儿外周血MAIT淋巴细胞频率与肝损伤、肝脏脂肪含量和纤维化相关性分析应用Spearman相关分析法。P<0.05为差异具有统计学意义。
2. 结果
2.1 一般资料
MAFLD组18例患儿年龄波动在6.17~13.08岁,对照组20例儿童年龄波动在5.83~13.00岁。MAFLD组的中性粒细胞、ALT、AST水平高于对照组(P值均<0.05)(表 1)。MAFLD组患儿肝纤维化弹性值为5.55(4.18~7.13)kPa,脂肪肝参数为(253.85±16.40) dB/m。
表 1 两组患儿临床资料比较Table 1. The comparation of clinical data between the two groups指标 MAFLD组(n=18) 对照组(n=20) 统计值 P值 男/女(例) 10/8 11/9 年龄(岁) 10.65(8.44~11.87) 9.00(7.40~11.25) Z=-1.083 0.279 ALT(U/L) 37.30(25.08~157.53) 13.65(11.75~17.00) Z=-4.474 <0.001 AST(U/L) 29.95(26.08~62.70) 20.95(18.90~24.23) Z=-3.304 0.001 WBC(×109/L) 7.31±2.56 7.00±1.50 t=0.937 0.355 中性粒细胞(×109/L) 4.47(3.36~5.18) 3.62(2.77~3.97) Z=-2.222 0.026 淋巴细胞(×109/L) 2.76(2.38~3.11) 2.44(1.82~2.91) Z=-1.608 0.112 2.2 儿童外周血MAIT淋巴细胞频率比较
与对照组相比,MAFLD组患儿外周血MAIT淋巴细胞占CD3+T淋巴细胞的比例明显升高(P<0.001),CD4+CD8-MAIT淋巴细胞、CD4+CD8+MAIT淋巴细胞所占MAIT淋巴细胞比例明显升高,CD4-CD8+MAIT淋巴细胞所占MAIT淋巴细胞比例降低(P值均<0.001),CD4-CD8-MAIT淋巴细胞所占MAIT淋巴细胞比例无变化(P>0.05)(表 2)。
表 2 两组患儿外周血MAIT淋巴细胞及各亚组MAIT淋巴细胞频率比较Table 2. The comparation of the peripheral blood MAIT lymphocytes and subtypes between the two groups指标 MAFLD组(n=18) 对照组(n=20) Z值 P值 MAIT淋巴细胞(%) 2.98(1.83~5.99) 0.29(0.09~0.69) -4.765 <0.001 CD4+CD8-MAIT淋巴细胞(%) 13.75(3.28~30.33) 0.38(0~1.55) -3.703 <0.001 CD4-CD8-MAIT淋巴细胞(%) 26.45(1.03~47.03) 31.25(24.05~50.33) 0.254 >0.05 CD4-CD8+MAIT淋巴细胞(%) 9.20(1.16~16.80) 43.65(29.65~64.98) -3.876 <0.001 CD4+CD8+MAIT淋巴细胞(%) 25.65(14.78~84.95) 9.36(6.04~22.45) -2.675 <0.001 2.3 外周血MAIT淋巴细胞表型和功能的差异
与对照组相比,MAFLD组患儿外周血表达PD-1、CD69、CD107α、CXCR3、CXCR6和CCR6的MAIT淋巴细胞比例均明显升高(P值均<0.05)(表 3)。
表 3 两组患儿外周血MAIT淋巴细胞表型和功能的差异Table 3. Differences in phenotype and function of peripheral blood MAIT lymphocytes between the two groups指标 MAFLD组(n=18) 对照组(n=20) Z值 P值 PD-1(%) 21.80(8.38~51.70) 4.43(2.07~11.29) -3.334 0.001 CD69(%) 56.00(28.93~68.35) 18.90(13.23~31.18) -2.646 0.008 穿孔素(%) 9.32(4.53~18.80) 4.16(1.35~9.53) -1.827 0.068 CD107α(%) 45.20(26.03~59.03) 10.95(6.80~17.18) -3.172 0.002 CXCR3(%) 87.35(80.08~96.03) 44.80(32.93~53.00) -4.678 <0.001 CXCR6(%) 30.40(8.24~54.90) 6.02(3.27~21.58) -2.939 0.003 CCR6(%) 26.80(13.03~77.70) 4.94(3.32~17.13) -2.749 0.006 2.4 MAFLD组患儿外周血MAIT淋巴细胞频率与肝脏炎症、脂肪含量和纤维化程度的关系
CD4+CD8+MAIT淋巴细胞和CD107α阳性MAIT淋巴细胞比例与ALT呈负相关(P值均<0.05);MAIT淋巴细胞、CD4+CD8-MAIT淋巴细胞、CD4-CD8+MAIT淋巴细胞比例与ALT无相关性(P值均>0.05);MAIT淋巴细胞、CD4+CD8-MAIT淋巴细胞、CD4-CD8+MAIT淋巴细胞、CD4+CD8+MAIT淋巴细胞和CD107α阳性MAIT淋巴细胞比例与AST、瞬时弹性成像中脂肪肝参数以及弹性值均无相关性(P值均>0.05)(表 4)。
表 4 MAFLD组患儿外周血MAIT细胞频率与肝脏炎症、脂肪含量和纤维化程度相关性分析Table 4. Correlation analysis between the frequency of MAIT lymphocytes in peripheral blood and the degree of liver inflammation, fat content, and fibrosis in children with MAFLD项目 ALT AST 弹性值 脂肪肝参数 MAIT淋巴细胞 r值 0.041 -1.050 0.064 0.112 P值 0.871 0.677 0.801 0.660 CD4+CD8-MAIT淋巴细胞 r值 -0.305 -0.330 -0.303 -0.272 P值 0.218 0.181 0.221 0.275 CD4-CD8+MAIT淋巴细胞 r值 0.140 -0.130 -0.047 0.228 P值 0.580 0.606 0.854 0.363 CD4+CD8+MAIT淋巴细胞 r值 -0.474 -0.436 -0.347 -0.115 P值 0.047 0.071 0.158 0.650 CD107α阳性MAIT淋巴细胞 r值 -0.550 -0.334 -0.201 -0.168 P值 0.018 0.176 0.432 0.504 3. 讨论
MAIT细胞与代谢功能障碍的发展有关, 肥胖儿童外周血MAIT细胞频率高于非肥胖儿童[12],其频率随着肥胖人群年龄的增长而下降,糖尿病和肥胖成人外周血MAIT细胞频率降低[13-15],肥胖成人和儿童中的高IL-17+表型在胰岛素抵抗发展中发挥着重要作用[12, 16]。目前MAIT淋巴细胞在MAFLD发病中作用机制的研究主要集中在成人,研究发现,MAFLD患者中循环MAIT淋巴细胞频率降低[7-9, 17],伴随着CXCR6表达的增加,而肝脏中MAIT淋巴细胞数量则明显增加,与MAFLD活动评分呈正相关[8]。本研究发现,MAFLD患儿外周血MAIT淋巴细胞频率明显升高的同时伴有趋化因子CCR6、CXCR6、CXCR3表达的增加,表明MAFLD患儿外周血MAIT淋巴细胞亦具有更强的迁移至肝脏的倾向[8],MAFLD患者外周血MAIT淋巴细胞频率的变化亦有着随着年龄增长而有下降的趋势,而这种下降的趋势可能与其迁移至肝脏有关。MAIT淋巴细胞可分为DP(CD4+CD8+)MAIT淋巴细胞、CD4+CD8-(CD4+)MAIT淋巴细胞、CD4-CD8+(CD8+)MAIT淋巴细胞和CD4-CD8-(DN)MAIT淋巴细胞。本研究发现健康儿童中以CD4-CD8-MAIT淋巴细胞和CD8+MAIT淋巴细胞为主[18],而MAFLD组患儿中以CD4-CD8-MAIT淋巴细胞和CD4+CD8+MAIT淋巴细胞为主,且与对照组相比,MAFLD组患儿CD4+MAIT淋巴细胞和CD4+CD8+MAIT淋巴细胞所占MAIT细胞比率升高,CD8+MAIT淋巴细胞所占MAIT淋巴细胞比率降低。
MAIT淋巴细胞在MAFLD中的作用为保护还是促进作用,与其所处疾病阶段有关。MAFLD成人患者中,外周血MAIT淋巴细胞降低的同时伴随着功能的改变,高表达CD69、PD-1及IL-4的产生增加,而IFNγ和TNFα的产生减少等。在蛋氨酸胆碱缺乏诱导的NASH模型中,MAIT细胞在肝脏中富集,并通过产生IL-4和IL-10以及诱导抗炎M2巨噬细胞来保护肝脏炎症[8]。随着病情的进展,肝内MAIT淋巴细胞的频率下降,在肝硬化和肝细胞癌的进展中起到促进作用[7, 17, 19]。本研究发现,MAFLD患儿外周血MAIT淋巴细胞水平明显升高的同时,伴有CD69、PD-1及CD107表达的增加,提示MAIT淋巴细胞被激活并功能性耗竭的同时,伴随着细胞毒性能力的增加。进一步研究显示CD4+CD8+MAIT淋巴细胞、CD107阳性MAIT淋巴细胞比例与ALT水平呈负相关,说明MAFLD患儿外周血MAIT细胞在肝脏炎症中具有保护作用,与文献[8]报道一致。
综上所述,MAIT淋巴细胞比例在MAFLD患儿外周血中明显升高,并在肝脏炎症中起着保护作用。本研究的局限性在于样本量偏少,进展期肝纤维化患儿病例数少,未检测肝脏组织MAIT淋巴细胞数量和其功能改变,MAIT淋巴细胞在儿童MAFLD发病中确切的免疫学机制及作用尚待进一步明确。
-
表 1 不同浓度表阿霉素作用24 h的细胞活性
组别 表阿霉素浓度(μmol/L) 0 6.25 12.5 25 50 HepG2组(%) 100 96.33±1.21 85.47±2.28 67.10±3.56 42.27±0.67 对照组(%) 100 92.60±1.54 86.80±2.40 59.03±2.60 45.50±0.56 实验组(%) 100 92.50±0.35 85.53±0.81 84.10±1.181)2) 72.30±2.071)2) F值 3.618 0.696 23.570 162.200 P值 0.093 0.535 0.001 <0.001 注:与对照组比较,1)P<0.05;与HepG2组比较,2)P<0.05。 -
[1] SIA D, VILLANUEVA A, FRIEDMAN SL, et al. Liver cancer cell of origin, molecular class, and effects on patient prognosis[J]. Gastroenterology, 2017, 152(4): 745-761. DOI: 10.1053/j.gastro.2016.11.048 [2] JIN J. Stem cell treatments[J]. JAMA, 2017, 317(3): 330. DOI: 10.1001/jama.2016.17822 [3] SUN JH, LUO Q, LIU LL, et al. Liver cancer stem cell markers: Progression and therapeutic implications[J]. World J Gastroenterol, 2016, 22(13): 3547-3557. DOI: 10.3748/wjg.v22.i13.3547 [4] HUANG Y, LIN D, TANIGUCHI CM. Hypoxia inducible factor (HIF) in the tumor microenvironment: Friend or foe?[J]. Sci China Life Sci, 2017, 60(10): 1114-1124. DOI: 10.1007/s11427-017-9178-y [5] QIAN J, RANKIN EB. Hypoxia-induced phenotypes that mediate tumor heterogeneity[J]. Adv Exp Med Biol, 2019, 1136: 43-55. [6] SAMANTA D, PARK Y, NI X, et al. Chemotherapy induces enrichment of CD47+/CD73+/PDL1+ immune evasive triple-negative breast cancer cells[J]. Proc Natl Acad Sci U S A, 2018, 115(6): e1239-e1248. DOI: 10.1073/pnas.1718197115 [7] LU H, SAMANTA D, XIANG L, et al. Chemotherapy triggers HIF-1-dependent glutathione synthesis and copper chelation that induces the breast cancer stem cell phenotype[J]. Proc Natl Acad Sci U S A, 2015, 112(33): e4600-e4609. DOI: 10.1073/pnas.1513433112 [8] LAN J, LU H, SAMANTA D, et al. Hypoxia-inducible factor 1-dependent expression of adenosine receptor 2B promotes breast cancer stem cell enrichment[J]. Proc Natl Acad Sci U S A, 2018, 115(41): e9640-e9648. DOI: 10.1073/pnas.1809695115 [9] SEMENZA GL. The genomics and genetics of oxygen homeostasis[J]. Annu Rev Genomics Hum Genet, 2020, 21: 183-204. DOI: 10.1146/annurev-genom-111119-073356 [10] MARIE-EGYPTIENNE DT, LOHSE I, HILL RP. Cancer stem cells, the epithelial to mesenchymal transition (EMT) and radioresistance: Potential role of hypoxia[J]. Cancer Lett, 2013, 341(1): 63-72. DOI: 10.1016/j.canlet.2012.11.019 [11] NOZAWA-SUZUKI N, NAGASAWA H, OHNISHI K, et al. The inhibitory effect of hypoxic cytotoxin on the expansion of cancer stem cells in ovarian cancer[J]. Biochem Biophys Res Commun, 2015, 457(4): 706-711. DOI: 10.1016/j.bbrc.2015.01.053 [12] BEN-PORATH I, THOMSON MW, CAREY VJ, et al. An embryonic stem cell-like gene expression signature in poorly differentiated aggressive human tumors[J]. Nat Genet, 2008, 40(5): 499-507. DOI: 10.1038/ng.127 [13] ALDERSON D, CUNNINGHAM D, NANKIVELL M, et al. Neoadjuvant cisplatin and fluorouracil versus epirubicin, cisplatin, and capecitabine followed by resection in patients with oesophageal adenocarcinoma (UK MRC OE05): An open-label, randomised phase 3 trial[J]. Lancet Oncol, 2017, 18(9): 1249-1260. DOI: 10.1016/S1470-2045(17)30447-3 [14] SONG B, BIAN Q, SHAO CH, et al. Ulinastatin reduces the resistance of liver cancer cells to epirubicin by inhibiting autophagy[J]. PLoS One, 2015, 10(3): e0120694. DOI: 10.1371/journal.pone.0120694 [15] LI J, DUAN B, GUO Y, et al. Baicalein sensitizes hepatocellular carcinoma cells to 5-FU and Epirubicin by activating apoptosis and ameliorating P-glycoprotein activity[J]. Biomed Pharmacother, 2018, 98: 806-812. DOI: 10.1016/j.biopha.2018.01.002 [16] PLAKS V, KONG N, WERB Z. The cancer stem cell niche: How essential is the niche in regulating stemness of tumor cells?[J]. Cell Stem Cell, 2015, 16(3): 225-238. DOI: 10.1016/j.stem.2015.02.015 -




 PDF下载 ( 2169 KB)
PDF下载 ( 2169 KB)

 下载:
下载:
 下载:
下载: