二维剪切波弹性成像测量脾硬度联合血小板/脾直径对乙型肝炎肝硬化患者中重度食管胃静脉曲张的评估价值
DOI: 10.3969/j.issn.1001-5256.2021.07.019
Value of spleen stiffness measured by two-dimensional shear wave elastography combined with platelet count/spleen diameter ratio in evaluating moderate-to-severe gastroesophageal varices in patients with hepatitis B cirrhosis
-
摘要:
目的 建立乙型肝炎肝硬化患者中重度食管胃静脉曲张(GEV)的无创性诊断模型。 方法 选取2017年10月—2019年12月于中国医科大学附属第一医院就诊的乙型肝炎肝硬化患者。以胃镜检查结果为金标准,分为无/轻度GEV组和中重度GEV组。不符合正态分布的计量资料两组间比较采用Mann-Whitney U检验;计数资料两组间比较采用χ2检验。采用logistic回归分析乙型肝炎肝硬化患者中重度食管胃静脉发生与二维剪切波弹性成像(2D-SWE)测量脾硬度、PLT/脾直径之间的关系,以后退法作为自变量筛选方法,建立回归方程即诊断模型并进行检验。绘制受试者工作特征曲线(ROC曲线)判断肝和脾硬度、PLT/脾直径以及诊断模型等无创性检查指标的诊断价值,得出最佳截断值,DeLong检验比较几种无创性检查指标的ROC曲线之间是否具有统计学意义。 结果 共纳入168例乙型肝炎肝硬化患者,其中有67例诊断为中重度GEV。肝硬化无/轻度和中重度GEV组PLT、ALT、Alb、WBC以及INR比较差异均有统计学意义(Z值分别为-6.508、-2.132、-2.470、-4.510、-5.298,P值均<0.05)。2D-SWE测量的脾硬度、脾脏直径以及PLT/脾脏直径在两组间差异均有统计学意义(Z值分别为-7.264、-5.924、-7.028,P值均<0.05)。PLT/脾直径ROC曲线下面积(AUC)为0.821(95%CI:0.754~0.875),截断值为≤6.7,敏感度为83.58%,特异度为74.26%。脾硬度AUC为0.831(95%CI:0.766~0.885),脾硬度截断值≥34.2 kPa,敏感度为85.07%,特异度为73.27%。肝硬度AUC为0.557(95%CI:0.479~0.634),肝硬度的截断值≥10.8 kPa,特异度为79.10%,敏感度为40.59%。肝硬度与脾硬度、PLT/脾直径对GEV诊断价值的AUC比较,差异均有统计学意义(Z值分别为4.878、5.536,P值均<0.001)。建立判断乙型肝炎肝硬化患者中重度GEV模型:Y=-0.682+0.068×脾硬度-0.225(PLT/脾直径)。诊断模型AUC为0.860(95%CI:0.799~0.909),敏感度为79.10%,特异度为81.19%,准确度为79.1%。 结论 据2D-SWE测量的脾硬度联合PLT/脾直径建立的无创性诊断模型可用于辅助判断乙型肝炎肝硬化患者中重度GEV,准确度较单独使用肝硬度或脾硬度判断中重度GEV高。 Abstract:Objective To establish a noninvasive diagnostic model for moderate-to-severe gastroesophageal varices (GEV) in patients with hepatitis B cirrhosis. Methods The patients with hepatitis B cirrhosis who attended The First Affiliated Hospital of China Medical University from October 2017 to December 2019 were enrolled, and with the results of gastroscopy as the gold standard, the patients were divided into none-to-mild GEV group and moderate-to-severe GEV group. The Mann-Whitney U test was used for comparison of non-normally distributed continuous data between groups, and the chi-square test was used for comparison of categorical data. A logistic regression analysis was used to investigate the association of moderate-to-severe GEV with spleen stiffness measured by two-dimensional shear wave elastography (2D-SWE) and platelet count (PLT)/spleen diameter ratio in patients with hepatitis B cirrhosis, and with the backward method for independent variable screening, a regression equation, i.e., a diagnostic model, was established and validated. The receiver operating characteristic (ROC) curve was plotted to investigate the diagnostic value of noninvasive examination indices including liver and spleen stiffness, PLT/spleen diameter ratio, and the above diagnostic model and obtain their cut-off values, the DeLong test was used to compare whether there is a statistical significance between the ROC curves of the above noninvasive indices. Results A total of 168 patients with hepatitis B cirrhosis were enrolled, among whom 67 were diagnosed with moderate-to-severe GEV. There were significant differences in PLT, alanine aminotransferase, albumin, white blood cell count, and international normalized ratio between the none-to-mild GEV group and the moderate-to-severe GEV group (Z=-6.508, -2.132, -2.470, -4.510, and -5.298, all P < 0.05). There were also significant differences in spleen stiffness measured by 2D-SWE, spleen diameter, and PLT/spleen diameter ratio between the two groups (Z=-7.264, -5.924, and -7.028, all P < 0.05). The PLT/spleen diameter ratio had an area under the ROC curve (AUC) of 0.821 (95% confidence interval [CI]: 0.754-0.875) at the cut-off value of ≤6.7, with a sensitivity of 83.58% and a specificity of 74.26%; spleen stiffness had an AUC of 0.831 (95%CI: 0.766-0.885) at the cut-off value of ≥34.2 kPa, with a sensitivity of 85.07% and a specificity of 73.27%; liver stiffness had an AUC of 0.557 (95%CI: 0.479-0.634) at the cut-off value of ≥10.8 kPa, with a specificity of 79.10% and a sensitivity of 40.59%. There was a significant difference in AUC between liver stiffness and spleen stiffness, as well as between liver stiffness and PLT/spleen diameter ratio (Z=4.878 and 5.536, P < 0.001). The model of Y=-0.682+0.068×spleen stiffness-0.225 (PLT/spleen diameter ratio) was established for predicting moderate-to-severe GEV in patients with hepatitis B cirrhosis, which had an AUC of 0.860 (95%CI: 0.799-0.909), a sensitivity of 79.10%, a specificity of 81.19%, and an accuracy of 79.1%. Conclusion The noninvasive diagnostic model based on spleen stiffness measured by 2D-SWE and PLT/spleen diameter ratio can be used to assist the judgment of moderate-to-severe GEV in patients with hepatitis B cirrhosis, with a higher accuracy than liver stiffness or spleen stiffness alone. -
食管胃静脉曲张(gastroesophageal varices,GEV)引起的急性出血是肝硬化最致命的并发症之一,也是肝硬化患者常见死亡原因之一[1]。GEV的静脉曲张程度是重要的出血危险因素,中重度GEV出血凶险,难以控制,威胁患者生命[1-2]。中华医学会[1, 3]建议对诊断为肝硬化的患者均应行胃镜检查以判断是否伴有GEV及其危险程度,同时胃镜检查也被认为是诊断GEV的金标准。然而,胃镜检查耗时长、经费高,且患者依从性差,难以成为长期随诊观察的检查方法,临床亟需便于随诊的无创检查方法。
GEV发生发展的根本原因是门静脉高压(portal hypertension,PH)。PH不仅会引起脾大,甚至会导致脾脏血流量改变、组织增生和纤维化[4],因此,利用脾硬度预测GEV具有一定理论依据。BavenoⅣ共识[2]认为:瞬时弹性成像技术(transient elastography, TE)可用于识别早期慢性肝病合并临床显著静脉曲张患者。然而一项荟萃分析[5]评估了TE检测肝硬化患者GEV的效果得出结论:由于不同的临界值、不同病因,TE测量的肝硬度不能准确判断食管静脉曲张的大小。且与二维剪切波弹性成像(two-dimensional shear wave elastography, 2D-SWE)相比,TE易受肥胖、腹水、炎症等因素影响,而2D-SWE更能反映组织弹性真实情况[6]。2D-SWE既解决了TE无二维图像对比,易受腹腔积液、肋间隙过窄、肥胖等因素限制的问题,又弥补了声辐射力脉冲成像取样面积有限,只能检测聚焦点附近组织弹性的缺点[7]。在2D-SWE评估慢性乙型肝炎肝纤维化临床应用指南中指出:目前运用2D-SWE评估慢性乙型肝炎患者肝纤维化的相关文献还不多,尤其缺少以病理结果为对照的研究[8-9]。对食管静脉曲张形成最好的预测因子是PLT与脾直径的比值,该比值认为PLT减少与脾脏大小有关,PLT减少是PH引起的脾脏肿大所导致脾功能亢进的结果[10]。目前,关于2D-SWE测量乙型肝炎肝硬化患者脾硬度以评估中重度GEV的研究报告较少,尚无2D-SWE测量脾硬度联合PLT/脾直径判断中重度GEV的研究。本研究旨在采用2D-SWE测量乙型肝炎肝硬化患者脾硬度,并联合PLT/脾直径建立预测乙型肝炎肝硬化患者中重度GEV的无创性诊断模型并评估其诊断价值。
1. 资料与方法
1.1 研究对象
纳入2017年10月—2019年12月于中国医科大学附属第一医院就诊的乙型肝炎肝硬化患者,经食管胃十二指肠镜检查,根据静脉形态、有无红色征及危险程度分为轻、中、重度[3, 11]:轻度为食管静脉曲张呈直线型或略有迂曲,无红色征;中度为食管静脉曲张呈直线型或略有迂曲、有红色征或食管静脉曲张呈蛇形迂曲隆起但无红色征;重度为食管静脉曲张呈蛇形迂曲隆起且有红色征或食管静脉呈串珠状、结节状或瘤状(无论有无红色征)。
1.2 纳入与排除标准
纳入标准: (1)符合《慢性乙型肝炎防治指南(2019年版)》[12]中乙型肝炎肝硬化诊断标准;(2)临床资料完整者。排除标准: (1)其他原因导致的肝硬化,如丙型肝炎、酒精代谢相关脂肪性肝病和自身免疫性肝病等;(2)合并其他严重并发症,如肝细胞癌、门静脉血栓形成和中重度腹水;(3)既往或目前正在接受降PH治疗(β受体阻滞剂、经颈静脉肝内门体分流术、食道静脉曲张套扎和硬化治疗等);(4)特发性门静脉高压。
1.3 研究方法
设计统一的数据采集表,内容包括:一般资料、实验室检查指标:WBC、PLT、AST、ALT等,以及肝硬度、脾硬度、门静脉直径、胃镜检查结果等。以胃镜检查结果为金标准,根据2D-SWE测量的脾硬度联合PLT/脾直径建立无创性诊断乙型肝炎肝硬化患者中重度GEV模型。
肝、脾硬度测量方法:使用法国声科生产的2D-SWE仪测量肝硬度、脾硬度。
肝硬度测量:受试者仰卧位,尽量外展右臂,充分暴露肋间隙,在右侧腋前线至腋中线的第7~9肋间隙,探头换能器的尖端垂直放置在肋骨间隙的皮肤上,每位患者测量10次,取中位数作为最终值,单位为kPa。
脾硬度测量:受试者仰卧位,左臂尽量外展充分暴露肋间隙,检查区域为左侧腋前线至腋中线的第9~11肋间隙,操作手法同肝硬度。
1.4 伦理学审查
本研究经中国医科大学附属第一院伦理委员会审批,批号:科伦审[2019]2018-284-2。所有患者及家属均知情同意。
1.5 统计学方法
应用SPSS 23.0以及Med Calc统计软件进行统计分析。不符合正态分布的计量资料采用M(P25~P75)表示,两组间比较采用Mann-Whitney U检验;计数资料两组间比较采用χ2检验。采用logistic回归分析乙型肝炎肝硬化患者中重度食管胃静脉发生与2D-SWE测量脾硬度、PLT/脾直径之间的关系,以后退法作为自变量筛选方法,建立回归方程即诊断模型并进行检验。绘制受试者工作特征曲线(ROC曲线)判断肝和脾硬度、PLT/脾直径以及诊断模型等无创性检查指标的诊断价值,得出最佳截断值,DeLong检验比较几种无创性检查指标的ROC之间是否具有统计学意义[13]。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
共收集168例肝硬化患者,其中男118例,女50岁,中位年龄53.42岁。其中经胃镜诊断为无/轻度GEV 101例,中重度GEV 67例。弹性成像相关结果以及相关实验室指标如表 1所示。
表 1 患者基本特征项目 结果 男/女(例) 118/50 年龄(岁) 53.42(46.17~61.06) 实验室检查 WBC(×109/L) 3.99(2.56~5.46) AST(U/L) 37.43(25.33~60.50) ALT(U/L) 30.71(20.14~58.50) Alb(g/L) 32.40(28.16~39.00) TBil(μmol/L) 21.65(13.00~39.95) DBil(μmol/L) 7.90(4.66~18.55) PLT(×109/L) 87.00(60.00~134.50) INR 1.19(1.05~1.41) 肌酐(μmol/L) 61.00(48.00~72.14) GEV(例) 无/轻 101 中重 67 弹性成像结果 门静脉直径(cm) 1.47(1.29~1.65) 肝硬度(kPa) 15.20(9.05~20.35) 脾硬度(kPa) 34.35(22.80~40.20) 脾直径(cm) 12.86(10.79~14.94) 2.2 肝硬化患者伴或不伴GEV临床特征比较
肝硬化无/轻度和中重度GEV组PLT、ALT、Alb、WBC以及INR比较差异均有统计学意义(P值均<0.05)。2D-SWE测量的肝硬度在无/轻度和中重度GEV组并无统计学差异(P=0.473),而脾脏相关测量值,包括:脾硬度、脾直径以及PLT/脾直径两组间比较差异均有统计学意义(P值均<0.05)(表 2)。
表 2 无/轻度GEV与中重度GEV肝硬化患者临床特征比较项目 无/轻度GEV(n=101) 中重度GEV(n=67) 统计值 P值 男/女(例) 72/29 46/21 χ2=0.133 0.716 年龄(岁) 53.00(44.50~61.00) 54.00(47.00~61.00) Z=-0.905 0.365 实验室指标 WBC(×109/L) 4.82(3.11~6.02) 3.19(2.02~4.04) Z=-4.510 <0.001 AST(U/L) 38.00(25.00~77.50) 33.00(25.00~55.00) Z=-1.115 0.265 ALT(U/L) 37.00(21.00~81.00) 29.00(18.00~42.00) Z=-2.132 0.033 Alb(g/L) 34.90(28.75~40.50) 30.30(27.60~35.40) Z=-2.470 0.014 TBil(μmol/L) 19.70(11.20~45.20) 23.00(15.20~35.10) Z=-1.095 0.274 DBil(μmol/L) 7.60(3.70~20.30) 8.70(5.70~18.20) Z=-1.545 0.122 PLT(109/L) 116.00(79.00~169.00) 64.00(51.00~83.00) Z=-6.508 <0.001 INR 1.07(1.00~1.29) 1.30(1.17~1.61) Z=-5.298 <0.001 肌酐(μmol/L) 61.00(49.00~74.00) 61.00(44.00~69.00) Z=-0.987 0.324 门静脉主干(cm) 1.45(1.20~1.62) 1.50(1.39~1.66) Z=-1.367 0.172 肝硬度(kPa) 14.00(8.45~20.20) 16.9(11.60~21.00) Z=-1.261 0.207 脾硬度(kPa) 26.60(20.55~35.70) 39.90(35.70~43.30) Z=-7.264 <0.001 脾直径(cm) 11.60(10.00~13.94) 14.45(12.80~16.30) Z=-5.942 <0.001 PLT/脾直径 10.15(6.54~16.98) 4.78(2.99~6.19) Z=-7.028 <0.001 2.3 肝硬度、脾硬度及PLT/脾直径对GEV的诊断价值
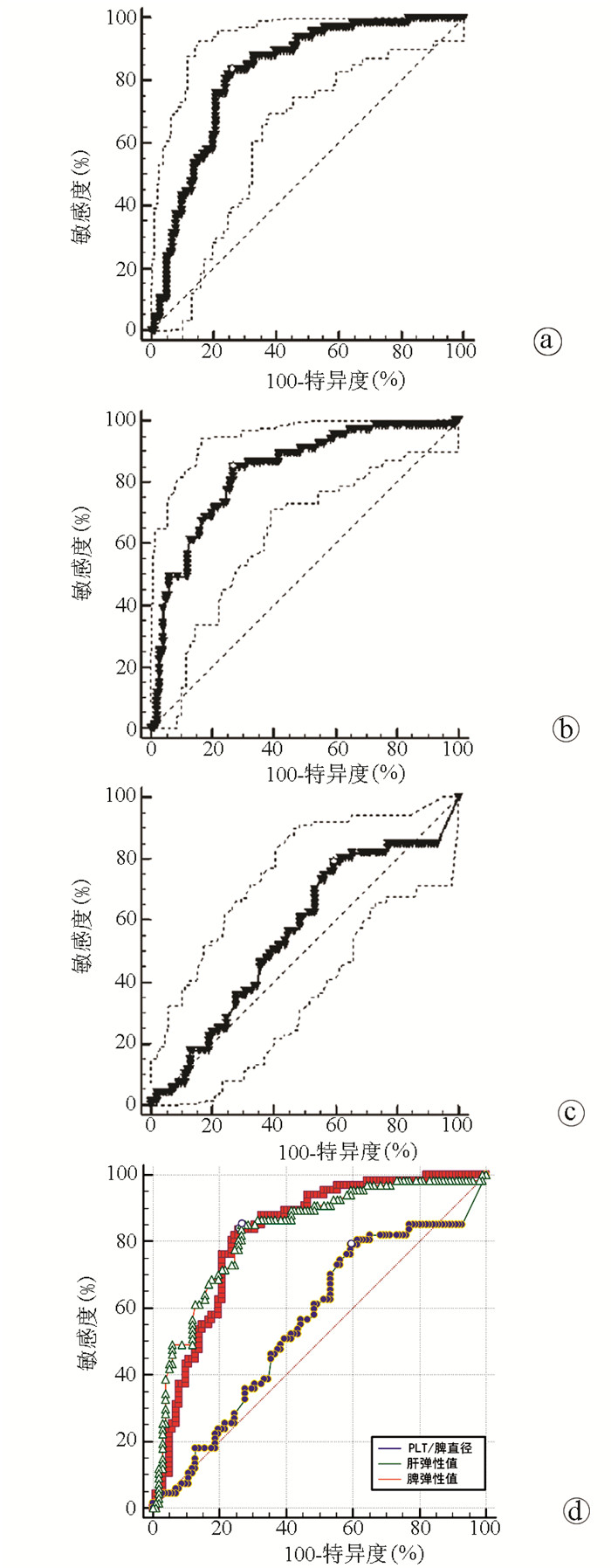
PLT/脾直径对GEV诊断价值的ROC曲线下面积(AUC)为0.821(95%CI:0.754~0.875),截断值为≤6.7,敏感度为83.58%,特异度为74.26%(图 1a)。脾硬度对GEV诊断价值的AUC为0.831(95%CI:0.766~0.885),截断值≥34.2 kPa,敏感度为85.07%,特异度为73.27%(图 1b)。肝硬度对GEV诊断价值的AUC为0.557(95%CI:0.479~0.634),截断值≥10.8 kPa,特异度为79.10%,敏感度为40.59%(图 1c)。三者AUC对比图见图 1d。
如表 3所示,脾硬度、肝硬度以及PLT/脾直径三者间AUC两两比较(DeLong检验),发现脾硬度和PLT/脾直径间AUC差异无统计学意义;肝硬度与脾硬度、PLT/脾直径AUC比较差异均有统计学意义(P值均<0.001),提示肝硬度的诊断价值较脾硬度、PLT/脾直径低。
表 3 肝硬度、脾硬度及PLT/脾直径对GEV诊断价值的ROC曲线比较组别 AUC差异值 95%CI Z值 P值 PLT/脾直径vs脾硬度 0.011 -0.066~0.088 0.274 0.784 PLT/脾直径vs肝硬度 0.263 0.157~0.369 4.878 <0.001 脾硬度vs肝硬度 0.274 0.177~0.371 5.536 <0.001 2.4 脾硬度联合PLT/脾直径无创性诊断模型的建立及其评价
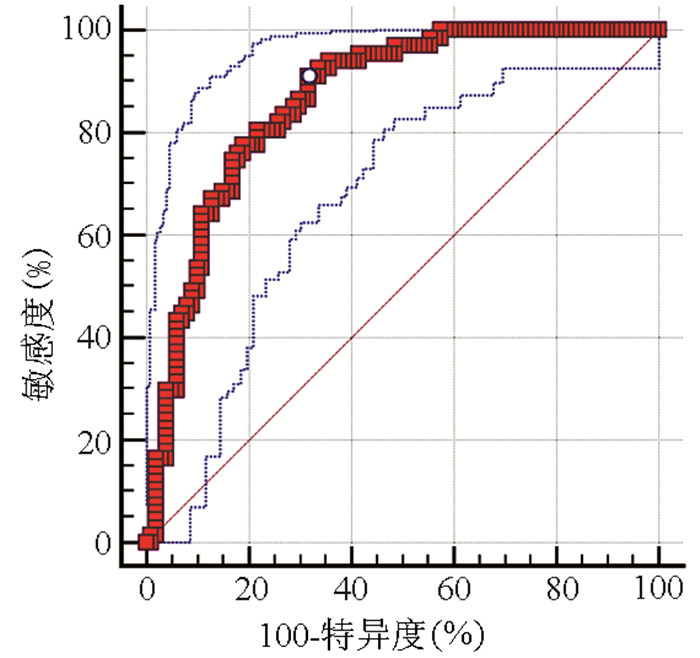
利用回归分析,将两组间有统计学差异的指标作为解释变量纳入回归方程,得到回归方程:Y=-0.682+0.068×脾硬度-0.225(PLT/脾直径)(表 4~5)。根据所建模型预测概率绘制ROC曲线如图 2,此模型AUC为0.860(95%CI:0.799~0.909),截断值为≥0.56,敏感度为79.10%,特异度为81.19%,准确度为79.1%。为了提高诊断模型在临床使用中的价值,选取了特异度为90%所对应的点代入诊断模型:当Y≥0.96时在判断乙型肝炎肝硬化患者中重度GEV有一定临床价值。
表 4 乙型肝炎肝硬化患者中重度GEV的诊断模型变量 B值 SE Wald P值 OR 95%CI 脾硬度 0.068 0.023 8.578 0.003 1.070 1.023~1.119 PLT/脾直径 -0.225 0.061 17.282 0.000 0.775 0.687~0.874 常量 -0.682 1.008 0.458 0.499 0.506 表 5 诊断乙型肝炎肝硬化患者中重度GEV不同参数的正确百分比参数 实测GEV 例数 预测GEV(例) 正确率(%) 无/轻度 中重度 PLT/脾直径 无/轻度 101 80 21 79.2 中重度 67 17 50 74.6 脾硬度 无/轻度 101 84 17 83.2 中重度 67 22 45 67.2 诊断模型 无/轻度 101 701) 21 76.9 中重度 67 12 55 82.1 注:PLT/脾直径、脾硬度和诊断模型的总体正确率分别为77.4%、76.8%和79.1%。1)10例患者因数据缺失,未使用诊断模型。 3. 讨论
GEV是肝硬化失代偿期PH常见并发症之一,PH进一步导致脾组织纤维化[14]。脾硬度在一定程度上能反映PH,预示GEV的存在。尽管胃镜可以检测GEV,但作为一种非入侵性检查:超声弹性成像有更大潜能。
实时组织弹性成像是将组织受压前后回声信号移动幅度变化转换为实时彩色图像,以不同色彩标识不同组织弹性[15]。目前有关超声弹性成像测量肝、脾硬度在临床的应用与研究,显示出超声弹性成像技术在临床应用的巨大潜力。有研究[16]发现,当肝硬度低于21 kPa时,预测门静脉高压性消化道出血的阴性预测价值为100%,即可排除GEV的存在。声波脉冲弹性成像测量的脾硬度可用于预测慢性肝病患者GEV的存在,且具有较高准确率[17];一项关于脾脏超声弹性成像的荟萃分析[18]表明,脾脏超声弹性成像可作为评估PH存在的准确无创性工具。然而,目前为止,不同的技术设备和截断值限制了其临床实践。
本研究采用2D-SWE测量肝硬化患者肝硬度和脾硬,联合血清学指标建立无创性诊断模型并对比评估其在GEV诊断中的价值。数据分析显示:2D-SWE测量的脾硬度相较于肝硬度更能准确预判GEV,但是脾硬度对于判断GEV的敏感度和特异度均未达到90%,尚不能取代胃镜检查。现有研究[19]表明,肝、脾硬度与肝静脉压力梯度相关,且脾硬度预测PH优于肝硬度。此外,对肝、脾硬度以及肝硬度×脾直径/PLT评分(LSPs)检测GEV和高危GEV诊断价值的荟萃分析[20]中发现,检测食管静脉曲张时,LSPs和脾硬度均优于肝硬度;然而LS、SS、LSPs敏感度和特异度适中不推荐用于高危GEV检测。本研究结果与上述2项研究发现相同,肝、脾硬度在一定程度上确能反映肝硬化程度及GEV,与肝脏相比,脾脏受到炎症、胆汁淤积、腹水、肥胖等混杂因素影响较小,脾脏相关数据更具有诊断价值。
除脾硬度外,本研究结果亦显示:在无/轻和中重度GEV组,两组间Alb、WBC、PLT、ALT以及PLT/脾直径存在统计学差异。肝硬化伴脾亢者可有PLT、GEV减少现象,肝硬化伴有中重度组GEV患者更易出现脾大、脾亢,PLT、GEV破坏增加。Chen等[21]回顾分析了1005例接受抗病毒治疗但没有明显临床肝硬化表现的慢性乙型肝炎患者发现,肝硬化相关检测指标如GPR(谷氨酰转肽酶-PLT比值)、FIB-4(基于4因素的纤维化指数)、eLIFT(简易肝纤维化指数)等受到ALT影响,以ALT分层能区分更多的肝硬化患者;相较于脾脏,肝脏更易受炎症活动的影响,出现ALT、AST的波动。本研究结果中PLT/ 脾直径AUC为0.821,PLT/脾直径用于判断GEV有较大诊断价值。在PH合并GEV临床表现的研究[22]中发现,PLT减少和脾大是GEV最重要的2个非侵袭性参数。有学者[23]分析了影响GEV发生的独立危险因素,发现脾直径以及肝、脾剪切波速度值为预测EV发生的独立危险因素,而PLT为EV发生的保护性因素。上述研究表明,PLT以及脾脏相关测量指标在诊断GEV中有临床应用价值。
联合应用各项检测指标能提高其临床应用价值。在Elalfy等[24]建立的HCV所致肝硬化大静脉曲张的无创性诊断模型中,单独使用PLT/脾直径诊断静脉曲张准确度只有73%,联合门静脉直径准确度提高到75.7%。Chen等[25]联合PLT、MRI测量的脾脏体积参数和右肝体积可用于预测肝硬化Child-Pugh分级,且能识别GEV的存在。上述研究提示了联合指标在诊断GEV的重要作用,但尚未联合应用2D-SWE测量脾硬度。本研究中,在联合了脾硬度和PLT/脾直径后,诊断价值和诊断准确率都较单独的脾硬度、PLT、以及脾直径有所提升。
综上所述,利用2D-SWE测量的脾硬度联合PLT/脾直径建立的预测乙型肝炎肝硬化患者中重度GEV模型:Y=-0.682+0.068×脾硬度值-0.225(PLT/脾直径)可有效判断中重度GEV,诊断价值和准确度较单独使用肝或脾硬度判断中重度GEV高。
-
表 1 患者基本特征
项目 结果 男/女(例) 118/50 年龄(岁) 53.42(46.17~61.06) 实验室检查 WBC(×109/L) 3.99(2.56~5.46) AST(U/L) 37.43(25.33~60.50) ALT(U/L) 30.71(20.14~58.50) Alb(g/L) 32.40(28.16~39.00) TBil(μmol/L) 21.65(13.00~39.95) DBil(μmol/L) 7.90(4.66~18.55) PLT(×109/L) 87.00(60.00~134.50) INR 1.19(1.05~1.41) 肌酐(μmol/L) 61.00(48.00~72.14) GEV(例) 无/轻 101 中重 67 弹性成像结果 门静脉直径(cm) 1.47(1.29~1.65) 肝硬度(kPa) 15.20(9.05~20.35) 脾硬度(kPa) 34.35(22.80~40.20) 脾直径(cm) 12.86(10.79~14.94) 表 2 无/轻度GEV与中重度GEV肝硬化患者临床特征比较
项目 无/轻度GEV(n=101) 中重度GEV(n=67) 统计值 P值 男/女(例) 72/29 46/21 χ2=0.133 0.716 年龄(岁) 53.00(44.50~61.00) 54.00(47.00~61.00) Z=-0.905 0.365 实验室指标 WBC(×109/L) 4.82(3.11~6.02) 3.19(2.02~4.04) Z=-4.510 <0.001 AST(U/L) 38.00(25.00~77.50) 33.00(25.00~55.00) Z=-1.115 0.265 ALT(U/L) 37.00(21.00~81.00) 29.00(18.00~42.00) Z=-2.132 0.033 Alb(g/L) 34.90(28.75~40.50) 30.30(27.60~35.40) Z=-2.470 0.014 TBil(μmol/L) 19.70(11.20~45.20) 23.00(15.20~35.10) Z=-1.095 0.274 DBil(μmol/L) 7.60(3.70~20.30) 8.70(5.70~18.20) Z=-1.545 0.122 PLT(109/L) 116.00(79.00~169.00) 64.00(51.00~83.00) Z=-6.508 <0.001 INR 1.07(1.00~1.29) 1.30(1.17~1.61) Z=-5.298 <0.001 肌酐(μmol/L) 61.00(49.00~74.00) 61.00(44.00~69.00) Z=-0.987 0.324 门静脉主干(cm) 1.45(1.20~1.62) 1.50(1.39~1.66) Z=-1.367 0.172 肝硬度(kPa) 14.00(8.45~20.20) 16.9(11.60~21.00) Z=-1.261 0.207 脾硬度(kPa) 26.60(20.55~35.70) 39.90(35.70~43.30) Z=-7.264 <0.001 脾直径(cm) 11.60(10.00~13.94) 14.45(12.80~16.30) Z=-5.942 <0.001 PLT/脾直径 10.15(6.54~16.98) 4.78(2.99~6.19) Z=-7.028 <0.001 表 3 肝硬度、脾硬度及PLT/脾直径对GEV诊断价值的ROC曲线比较
组别 AUC差异值 95%CI Z值 P值 PLT/脾直径vs脾硬度 0.011 -0.066~0.088 0.274 0.784 PLT/脾直径vs肝硬度 0.263 0.157~0.369 4.878 <0.001 脾硬度vs肝硬度 0.274 0.177~0.371 5.536 <0.001 表 4 乙型肝炎肝硬化患者中重度GEV的诊断模型
变量 B值 SE Wald P值 OR 95%CI 脾硬度 0.068 0.023 8.578 0.003 1.070 1.023~1.119 PLT/脾直径 -0.225 0.061 17.282 0.000 0.775 0.687~0.874 常量 -0.682 1.008 0.458 0.499 0.506 表 5 诊断乙型肝炎肝硬化患者中重度GEV不同参数的正确百分比
参数 实测GEV 例数 预测GEV(例) 正确率(%) 无/轻度 中重度 PLT/脾直径 无/轻度 101 80 21 79.2 中重度 67 17 50 74.6 脾硬度 无/轻度 101 84 17 83.2 中重度 67 22 45 67.2 诊断模型 无/轻度 101 701) 21 76.9 中重度 67 12 55 82.1 注:PLT/脾直径、脾硬度和诊断模型的总体正确率分别为77.4%、76.8%和79.1%。1)10例患者因数据缺失,未使用诊断模型。 -
[1] Chinese Society of Spleen and Portal Hypertension Surgery, Chinese Society of Surgery, Chinese Medical Association. Expert consensus on diagnosis and treatment of esophagogastric variceal bleeding in cirrhotic portal hypertension (2019 edition)[J]. Chin J Surg, 2019, 57(12): 885-892. DOI: 10.3760/cma.j.issn.0529-5815.2019.12.002.中华医学会外科学分会脾及门静脉高压外科学组. 肝硬化门静脉高压症食管、胃底静脉曲张破裂出血诊治专家共识(2019版)[J]. 中华外科杂志, 2019, 57(12): 885-892. DOI: 10.3760/cma.j.issn.0529-5815.2019.12.002. [2] de FRANCHIS R, Baveno VI Faculty. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension[J]. J Hepatol, 2015, 63(3): 743-752. DOI: 10.1016/j.jhep.2015.05.022. [3] Chinese Society of Hepatology, Chinese Medical Association; Chinese Society of Gastroenterology, Chinese Medical Association; Chinese Society of Endoscopy, Chinese Medical Association. Guidelines for the diagnosis and treatment of esophageal and gastric variceal bleeding in cirrhotic portal hypertension[J]. J Clin Hepatol, 2016, 32(2): 203-219. DOI: 10.3969/j.issn.1001-5256.2016.02.002.中华医学会肝病学分会, 中华医学会消化病学分会, 中华医学会内镜学分会. 肝硬化门静脉高压食管胃静脉曲张出血的防治指南[J]. 临床肝胆病杂志, 2016, 32(2): 203-219. DOI: 10.3969/j.issn.1001-5256.2016.02.002. [4] BUECHTER M, KAHRAMAN A, MANKA P, et al. Spleen and liver stiffness is positively correlated with the risk of esophageal variceal bleeding[J]. Digestion, 2016, 94(3): 138-144. DOI: 10.1159/000450704. [5] PU K, SHI JH, WANG X, et al. Diagnostic accuracy of transient elastography (FibroScan) in detection of esophageal varices in patients with cirrhosis: A meta-analysis[J]. World J Gastroenterol, 2017, 23(2): 345-356. DOI: 10.3748/wjg.v23.i2.345. [6] ZHU YL, DING H, FU TT, et al. Portal hypertension in hepatitis B-related cirrhosis: Diagnostic accuracy of liver and spleen stiffness by 2-D shear-wave elastography[J]. Hepatol Res, 2019, 49(5): 540-549. DOI: 10.1111/hepr.13306. [7] ZHANG XY, TANG SS. Real-time shear wave elastography in quantitative measurement of tissue elasticity on normal spleens[J]. Chin J Med Imaging Technol, 2016, 32(10): 1523-1526. DOI: 10.13929/j.1003-3289.2016.10.013.张潇月, 唐少珊. 实时剪切波弹性成像定量评价正常脾脏组织弹性[J]. 中国医学影像技术, 2016, 32(10): 1523-1526. DOI: 10.13929/j.1003-3289.2016.10.013. [8] Panel of Elastography Assessment of Liver Fibrosis, Study Group of Interventional Ultrasound, Society of Ultrasound in Medicine of Chinese Medical Association. Guidelines for clinical application of two-dimensional shear wave elastography in assessment of liver fibrosis in chronic hepatitis B[J]. J Clin Hepatol, 2018, 34(2): 255-261. DOI: 10.3969/j.issn.1001-5256.2018.02.008.中华医学会超声医学分会介入超声学组弹性成像评估肝纤维化专家组. 二维剪切波弹性成像评估慢性乙型肝炎肝纤维化临床应用指南[J]. 临床肝胆病杂志, 2018, 34(2): 255-261. DOI: 10.3969/j.issn.1001-5256.2018.02.008. [9] FERRAIOLI G, TINELLI C, DAL BELLO B, et al. Accuracy of real-time shear wave elastography for assessing liver fibrosis in chronic hepatitis C: A pilot study[J]. Hepatology, 2012, 56(6): 2125-2133. DOI: 10.1002/hep.25936. [10] GIANNINI E, BOTTA F, BORRO P, et al. Platelet count/spleen diameter ratio: Proposal and validation of a non-invasive parameter to predict the presence of oesophageal varices in patients with liver cirrhosis[J]. Gut, 2003, 52(8): 1200-1205. DOI: 10.1136/gut.52.8.1200. [11] Committee of esophageal varicosity, Society of Digestive Endoscopy of Chinese Medical Association. Tentative guidelines for endoscopic diagnosis and treatment of varicosity and variceal bleeding in digestive tract (2009)[J]. Chin J Dig Endosc, 2010, 27(1): 1-4. DOI: 10.3760/cma.j.issn.1007-5232.2010.01.001.中华医学会消化内镜学分会食管胃静脉曲张学组. 消化道静脉曲张及出血的内镜诊断和治疗规范试行方案(2009年)[J]. 中华消化内镜杂志, 2010, 27(1): 1-4. DOI: 10.3760/cma.j.issn.1007-5232.2010.01.001. [12] Chinese Society of Infectious Diseases, Chinese Medical Association; Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B (version 2019)[J]. J Clin Hepatol, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007.中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669. DOI: 10.3969/j.issn.1001-5256.2019.12.007. [13] DELONG ER, DELONG DM, CLARKE-PEARSON DL. Comparing the areas under two or more correlated receiver operating characteristic curves: A nonparametric approach[J]. Biometrics, 1988, 44(3): 837-845. https://pubmed.ncbi.nlm.nih.gov/3203132/ [14] WANG J, ZHENG GZ. Factors related to esophageal variceal bleeding in patients with liver cirrhosis[J/CD]. Chin J Liver Dis(Electronic Edition), 2019, 11(1): 42-46. DOI: 10.3969/j.issn.1674-7380.2019.01.008.王娟, 郑鸽之. 肝硬化食管静脉曲张破裂出血相关因素分析[J/CD]. 中国肝脏病杂志(电子版), 2019, 11(1): 42-46. DOI: 10.3969/j.issn.1674-7380.2019.01.008. [15] ZHAO ZZ, LUO BM. The Principle and techniques of ultrasonic elastography[J]. China Med Devices Information, 2008, 14(4): 6-8. DOI: 10.3969/j.issn.1006-6586.2008.04.003.赵子卓, 罗葆明. 超声弹性成像基本原理及技术[J]. 中国医疗器械信息, 2008, 14(4): 6-8. DOI: 10.3969/j.issn.1006-6586.2008.04.003. [16] MERCHANTE N, RIVERO-JUÁREZ A, TÉLLEZ F, et al. Liver stiffness predicts variceal bleeding in HIV/HCV-coinfected patients with compensated cirrhosis[J]. AIDS, 2017, 31(4): 493-500. DOI: 10.1097/QAD.0000000000001358. [17] COLECCHIA A, MONTRONE L, SCAIOLI E, et al. Measurement of spleen stiffness to evaluate portal hypertension and the presence of esophageal varices in patients with HCV-related cirrhosis[J]. Gastroenterology, 2012, 143(3): 646-654. DOI: 10.1053/j.gastro.2012.05.035. [18] GIBⅡNO G, GARCOVICH M, AINORA ME, et al. Spleen ultrasound elastography: State of the art and future directions-a systematic review[J]. Eur Rev Med Pharmacol Sci, 2019, 23(10): 4368-4381. DOI: 10.26355/eurrev_201905_17944. [19] TSENG Y, LI F, WANG J, et al. Spleen and liver stiffness for noninvasive assessment of portal hypertension in cirrhotic patients with large esophageal varices[J]. J Clin Ultrasound, 2018, 46(7): 442-449. DOI: 10.1002/jcu.22635. [20] MANATSATHIT W, SAMANT H, KAPUR S, et al. Accuracy of liver stiffness, spleen stiffness, and LS-spleen diameter to platelet ratio score in detection of esophageal varices: Systemic review and meta-analysis[J]. J Gastroenterol Hepatol, 2018, 33(10): 1696-1706. DOI: 10.1111/jgh.14271. [21] CHEN YP, HUANG LW, LIN XY, et al. Alanine aminotransferase influencing performances of routine available tests detecting hepatitis B-related cirrhosis[J]. J Viral Hepat, 2020, 27(8): 826-836. DOI: 10.1111/jvh.13293. [22] PATEL DM, NAIR S, PATEL PD. Clinical assessment of cases presented with esophageal varices and portal hypertension in a tertiary healthcare institute: An observational study[J]. Int J Contemporary Med Res, 2019, 6(5): e22-e44. DOI: 10.21276/ijcmr.2019.6.5.59. [23] XU XZ. The value of non-invasive test to predicting risk of esophageal varices in patients with hepatitis B cirrhosis[D]. Changchun: Jilin University China, 2018.许馨之. 无创性手段预测乙肝肝硬化食管静脉曲张发生风险的临床价值[D]. 长春: 吉林大学, 2018. [24] ELALFY H, ELSHERBINY W, ABDEL RAHMAN A, et al. Diagnostic non-invasive model of large risky esophageal varices in cirrhotic hepatitis C virus patients[J]. World J Hepatol, 2016, 8(24): 1028-1037. DOI: 10.4254/wjh.v8.i24.1028. [25] CHEN XL, CHEN TW, ZHANG XM, et al. Platelet count combined with right liver volume and spleen volume measured by magnetic resonance imaging for identifying cirrhosis and esophageal varices[J]. World J Gastroenterol, 2015, 21(35): 10184-10191. DOI: 10.3748/wjg.v21.i35.10184. 期刊类型引用(3)
1. 汪思远,雷淼,赵文. 病毒性肝炎肝硬化食管静脉曲张无创评估方法的预测价值比较. 齐齐哈尔医学院学报. 2024(02): 118-123 .  百度学术
百度学术2. 钟向阳,陈相猛,卢冬莹,李政,麦栩榆,陈美容. 3D动态增强磁共振血管成像在食道静脉曲张患者中的应用. 临床和实验医学杂志. 2023(11): 1207-1211 .  百度学术
百度学术3. 宋世超,王彬,李鹏,钱征华,马廷锋,鹿澳沣. 桩柱周期分布的平板中SH波的传播特性分析及其在聚焦透镜设计中的应用研究. 动力学与控制学报. 2022(05): 66-75 .  百度学术
百度学术其他类型引用(2)
-




 PDF下载 ( 2308 KB)
PDF下载 ( 2308 KB)

 下载:
下载:


 下载:
下载:
 百度学术
百度学术



