大鼠感染泡球蚴后外周血及脾脏中滤泡辅助T淋巴细胞的变化
DOI: 10.3969/j.issn.1001-5256.2021.07.035
Change in follicular helper T cells in the peripheral blood and spleen of rats after Echinococcus multilocularis infection
-
摘要:
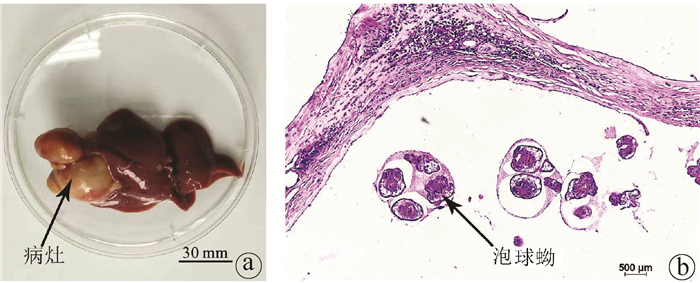
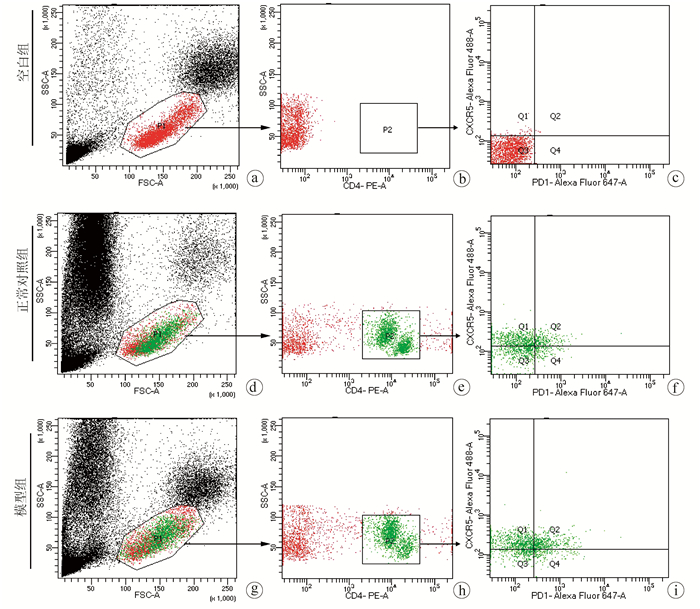
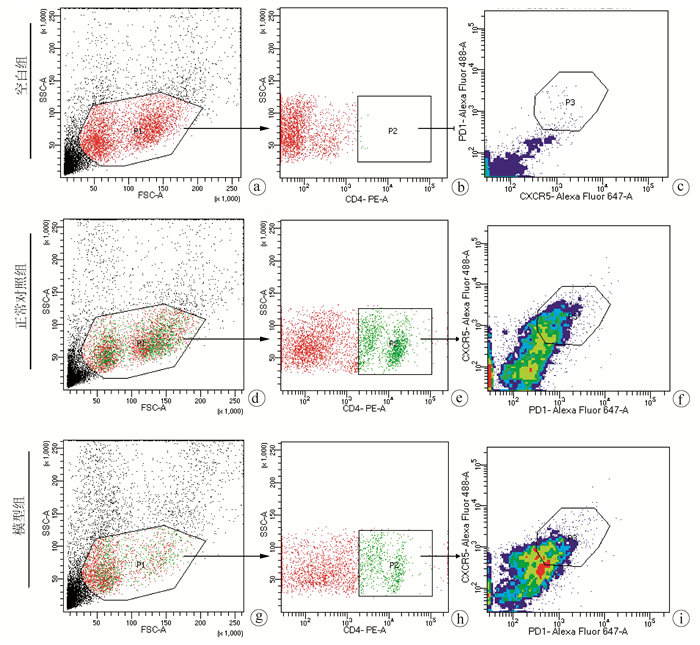
目的 分析泡球蚴感染宿主后外周血和脾脏中滤泡辅助T淋巴细胞(Tfh)水平与包虫病进展的关系。 方法 20只SD大鼠随机分为正常对照组和模型组,每组10只,模型组开腹直视下在右肝接种约2000个原头节,对照组不做任何处理,3个月后麻醉处死SD大鼠,取外周血和脾脏细胞,以CD4+CXCR5+PD1+为Tfh细胞的标记,使用流式细胞术检测外周血和脾脏中Tfh细胞的水平。使用t检验比较两组之间Tfh细胞的差异。 结果 大鼠感染泡球蚴3个月后,肝脏可见明显病灶,HE染色显示病灶中可见原头节。泡球蚴感染模型组外周血中CD4+CXCR5+PD1+Tfh细胞在CD4+细胞中的平均占比为25.63%±3.47%,正常对照组为11.12%±2.94%,2组比较差异有统计学意义(t=10.230,P<0.001),模型组CD4+CXCR5+PD1+Tfh细胞在所有细胞中所占的比例较正常对照组下降显著(0.08%±0.02% vs 0.18%±0.05%, t=5.520,P<0.001);在所有细胞中,模型组脾脏中CD4+CXCR5+PD1+Tfh细胞所占的比例(3.00%±0.42%)显著低于正常对照组(5.30%±1.40%)(t=4.769,P<0.001)。 结论 外周血中Tfh细胞与包虫病进展密切相关,有望成为反应泡球蚴感染的指标。 -
关键词:
- 棘球蚴病, 肝 /
- T淋巴细胞 /
- 大鼠, Sprague-Dawley
Abstract:Objective To investigate the level of follicular helper T (Tfh) cells in the peripheral blood and spleen of the host after Echinococcus multilocularis infection and its association with the progression of echinococcosis. Methods A total of 20 Sprague-Dawley rats were randomly divided into normal control group and model group, with 10 rats in each group. The rats in the model group were inoculated with about 2000 protoscoleces in the right liver under direct-view laparotomy, and those in the control group were not given any treatment. The rats were anesthetized and sacrificed after 3 months to collect peripheral blood and spleen cells, and with CD4+CXCR5+PD1+ as the marker of Tfh cells, flow cytometry was used to measure the level of Tfh cells in peripheral blood and spleen. The t-test was used for comparison of Tfh cells between the two groups. Results After 3 months of Echinococcus multilocularis infection, marked lesions were observed in the liver, and HE staining showed the presence of protoscoleces in the lesions. The proportion of CD4+CXCR5+PD1+Tfh cells in CD4+ cells in peripheral blood was 25.63%±3.47% in the model group and 11.12%±2.94% in the normal control group (t=10.230, P < 0.001), a nd the model group had a significantly lower proportion of CD4+CXCR5+PD1+Tfh cells in all cells than the normal control group (0.08%±0.02% vs 0.18%±0.05%, t=5.520, P < 0.001). For the model group, the proportion of CD4+CXCR5+PD1+Tfh cells in all cells in the spleen decreased to 3.00%±0.42%, which was significantly lower than the proportion of 5.30%±1.40% in the normal control group (t=4.769, P < 0.001). Conclusion Tfh cells in peripheral blood are closely associated with the progression of echinococcosis and are expected to become an indicator of Echinococcus multilocularis infection. -
Key words:
- Echinococcosis, Hepatic /
- T-Lymphocytes /
- Rats, Sprague-Dawley
-
目前经国家食品药品监督管理局批准用于治疗乙型肝炎的药物主要包括核苷酸类似物及IFNα两大类[1]。核酸类似物可减少HBV复制,但对共价闭合环状DNA(cccDNA)的影响很小,具有需要长期服药、停药后易反弹、患者依从性不佳等问题[2]。干扰素虽在一小部分受者中可能导致功能性治愈(HBsAg丢失),但副作用较大且抑制病毒复制作用有限[3-4]。
中药黄芪为豆科多年生草本植物膜夹黄芪和蒙古黄芪的干燥根[5]。黄芪的主要成分为黄芪皂苷、黄芪多糖、氨基酸以及微量元素等[6]。其临床常用于治疗肺心病、充血性心力衰竭、病毒性心肌炎、肾脏病和糖尿病等[7-8]。近年国内外对黄芪甲苷的研究越来越多[9],主要具有调节免疫、缺血保护、抗炎、抗病毒等作用,对HBV、人腺病毒等多种病毒具有抑制作用[10]。黄芪甲苷作为黄芪皂苷的重要一员,在已有的临床和基础研究中都表现出保护肝脏细胞和抗HBV活性,在体外细胞培养中,黄芪对HBsAg及HBeAg的分泌有较好的抑制作用[11];黄芪注射液联合或单独使用,抗病毒和免疫调节疗效均呈剂量依赖性,在联合恩替卡韦使用中具有很好的抗HBV感染作用,不仅可以很好的抑制HBV复制,而且可以在停药后延缓HBV反弹,其机制包括JAK-STAT通路和细胞因子的调控[12]。在抗HBV作用中黄芪最主要的单体活性成分是黄芪甲苷,然而其具体的护肝基础和抗病毒机制仍不明确[13]。
线粒体翻译起始因子2(mitochondrial translation initiation factor 2,MTIF2)和核糖体蛋白L10(ribosomal protein L10,RPL10)作为调控线粒体翻译步骤的明星分子,在诸多的病毒宿主翻译机制中扮演重要作用。MTIF2为翻译起始因子IF-2,多存在与线粒体和细胞质,是经典翻译因子GTPase家族中IF-2亚家族成员[14]。MTIF2是蛋白质合成起始的基本成分之一,能够保护甲硫酰-tRNA不被自发水解,并促进其结合到30S核糖体亚基[15]。同时也参与GTP在70S核糖体复合物的水解[16]。在宿主精子细胞中的研究[17]发现,当干扰翻译起始因子时,HBV和X基因的转录水平明显降低。RPL10为核糖体大亚基的组成单元,然而在核糖体构成中并非所有的核糖体蛋白成员均需参加[18]。在已有研究中,包括HIV在内的多种病毒复制的翻译调控均与RPL10有关,本课题组前期对临床高HBV和无HBV携带的肝癌组织样本进行TMT全蛋白组学定量分析发现, RPL10与HBV复制关系密切,且干扰其表达后能明显抑制HBV复制,因此推断宿主RPL10可能是特异性参与病毒翻译的核糖体蛋白。
基于以上研究,本研究拟用黄芪甲苷刺激人正常肝细胞L-02和携带HBV的Hep3B细胞,探讨其生物活性和抑制HBV复制的分子机制。
1. 材料与方法
1.1 材料
1.1.1 细胞株
人正常肝细胞L-02,人肝癌细胞系Hep3B(含HBV基因组),购于成都诺和生物科技有限公司。
1.1.2 药物及试剂
黄芪甲苷(美国Sigma-Aldrich);胎牛血清(纽西兰Gibco公司);DMEM培养基、PBS、青霉素链霉素双抗(美国Gbico公司);Cell Counting Kit(CCK-8)(日本同仁);细胞凋亡Annexin V-FITC Apoptosis Detection Kit购于上海碧云天;总RNA提取试剂盒、HBV核酸检测试剂盒(PCR-荧光探针法)购于中山大学达安基因股份有限公司。TransScript Green Two-Step qRT -PCR SuperMix试剂盒购于北京索莱宝科技有限公司;HBsAg诊断试剂盒(酶联免疫法)、HBeAg诊断试剂盒(酶联免疫法)购于北京万泰生物药业股份有限公司。肝细胞外泌相关蛋白生化检测试剂盒购于北京九强生物技术股份有限公司。
1.2 实验方法
1.2.1 细胞培养
将人正常肝细胞L-02分别接种于6孔板和96孔板中,接种浓度为每孔1×104 cell/mL,待18 h细胞贴壁后,分别加入含不同浓度黄芪甲苷的培养基(0、5、10和20 μg/mL,设复孔)培养24 h;将人肝癌细胞Hep3B置于T25培养瓶,细胞浓度为1×105 /mL,分别添加黄芪甲苷浓度为0、5、10和20 μg/mL的培养基孵育细胞24 h。按实验指标检测要求分别收获培养细胞和上清液备用。所用培养基为DMEM高糖培养基,含1%青链霉素双抗和10%胎牛血清;培养条件为CO2浓度5%,温度37 ℃和湿度36%。
1.2.2 CCK-8法检测细胞活性
L-02细胞96孔板培养24 h后吸出上清液,每孔加入10 μL CCK-8溶液,再加入90 μL培养基,放入CO2培养箱内孵育3 h,使用酶标仪测定450 nm处的吸光度。各浓度黄芪甲苷对L-02细胞的抑制率=(对照组OD值-用药组OD值)/(对照组OD值-调零孔OD值)[19]。
1.2.3 流式细胞仪检测细胞凋亡和死亡
将人正常肝细胞L-02 6孔板培养24 h后处理消化和洗涤细胞,再加入5 μL AnnexinV-FITC,室温,避光,轻轻混匀避光10 min;加入5 μL PI室温避光孵育5 min,加入PBS适量,轻轻混匀后应用流式细胞仪检测细胞凋亡;用70%的冰乙醇固定24 h,PI染色后流式细胞仪检测[20]。判断坏死细胞为(FITC+/PI+);而凋亡细胞为(FITC+/PI-)。
1.2.4 生物化学法检测L-02细胞外泌蛋白
将人正常肝细胞L-02 6孔板培养24 h后分别收集培养液,1500 r/min离心5 min,取上清进行AFP、AST、ALT和ALP的外泌蛋白检测。将各组待检培养液置于Beckman Coulter AU5800生化仪进行检测,分析各蛋白外泌水平。
1.2.5 生物信息学分析
调取TCGA数据库和GEO数据库资料集GSE65359、GSE84044和GSE58208,获得乙型肝炎患者的RNA测序数据原始计数和相应的临床信息。使用R套装软件ConsensusClusterPlus (v1.54.0)进行一致性分析,分析最佳聚类个数。重复100次抽取总样本的80%,clusterAlg =“hc”, innerLinkage=‘ward.D2’。聚类热图均由R套装软件pheatmap (v1.0.12)分析,基因表达热图保留方差在0.1以上的基因。通过R套装软件survival和survminer进行实现,以上所有分析方法均由R v4.0.3实现。
应用HCCDB数据库分别分析RPL10和MTIF2的生存曲线,应用TCGA数据库分析RPL10和MTIF2联合生存曲线。
1.2.6 HBV标志物检测
Hep3B在不同黄芪甲苷浓度作用下培养24 h后,收集上清液。酶联免疫吸附测定(ELISA)法检测上清液中的HBsAg和HBeAg水平;荧光定量PCR(qPCR)法检测上清液中HBV DNA水平。
1.2.7 逆转录荧光定量PCR(qRT -PCR)法基因检测
Hep3B在不同黄芪甲苷浓度作用下培养24 h后,分别收集上清液和细胞,并分别提取RNA,检测上清液中HBV RNA水平;检测细胞中MTIF2和RPL10基因转录水平。所用引物见表 1,由InvitrogenTM合成。采用2-△△ct法计算基因相对表达水平。
表 1 RT-PCR引物列表Table 1. List of RT-PCR primers基因名称 引物序列(5′-3′) Tm值(℃) MTIF2 F-MTIF2 CTATGATGCTTCACACGAGTG 53 R-MTIF2 TGCTCTTCCACAGCACAGG 53 RPL10 F-RPL10 CGGTATTGTAAGAACAAGCCGT 60 R-RPL10 GCCACAAAGCGGAAACTCAT 60 pgRNA F-pgRNA CTCAATCTCGGGAATCTCAATGT 53 R-pgRNA TGGATAAAACCTAGCAGGCATAAT 53 GAPDH F-GAPDH CAGGAGGCATTGCTGATGAT 52 R-GAPDH GAAGGCTGGGGCTCATTT 52 1.3 统计学方法
应用SPSS 24.0软件对资料结果进行统计分析。计量资料用x±s表示, 多组间比较和同一组内不同时间段比较均采用单因素方差分析,进一步分析两两组间比较采用Bonferroni方法。绘制Kaplan-Meier生存曲线,log-rank检验用于分析比较两组或多组之间的生存差异,进行了time ROC分析以比较RPL10和MTIF2基因的预测准确性和风险评分。最小绝对收缩和选择操作数(LASSO)回归算法进行特征选择,采用10倍交叉验证,以上分析采用v4.0.3版R软件的glmnet包。P<0.05为差异有统计学意义。
2. 结果
2.1 黄芪甲苷对细胞生长的影响
根据黄芪甲苷浓度的不同,分为0、5、10和20 μg/mL 4组。黄芪甲苷浓度20 μg/mL组处理24 h和48 h相较未处理组细胞生长活性均显著提高(P值均<0.05),黄芪甲苷浓度20 μg/mL组处理72 h相较10 μg/mL组生长活性提高(P<0.05),黄芪甲苷浓度5 μg/mL组处理72 h相较未处理组生长活性提高(P<0.05)(表 2)。4组内各时间段间比较差异均无统计学意义(P值均>0.05)。
表 2 黄芪甲苷对人正常肝细胞L-02细胞生长活性的影响Table 2. Effect of Astragaloside Ⅳ on L-02 cell growth activity组别 细胞活性(%) 24 h 48 h 72 h 0 μg/mL组 95.11±0.88 91.69±0.52 90.85±1.41 5 μg/mL组 94.40±6.05 92.35±3.81 91.13±3.371) 10 μg/mL组 94.31±7.44 94.47±4.60 91.64±1.84 20 μg/mL组 100.23±1.401) 97.35±0.671) 99.56±0.442) F值 0.682 1.433 8.301 P值 0.617 0.362 0.030 注:与0 μg/mL组比较,1)P<0.05;与10 μg/mL组,2)P<0.05。 2.2 黄芪甲苷对细胞死亡和凋亡的影响
在不同黄芪甲苷浓度0、5、10和20 μg/mL处理L-02细胞24 h后,4组间细胞死亡率、凋亡率及死亡率+凋亡率均无统计学意义(P值均>0.05)(表 3)。
表 3 黄芪甲苷对L-02细胞凋亡的影响Table 3. Effect of Astragaloside Ⅳ on L-02 cell apoptosis组别 死亡率(%) 凋亡率(%) 死亡+凋亡率(%) 0 μg/mL组 2.74±0.45 2.72±0.27 5.46±0.72 5 μg/mL组 3.07±0.68 3.27±0.43 6.34±0.92 10 μg/mL组 3.16±0.56 3.10±0.34 6.26±0.47 20 μg/mL组 3.35±0.69 2.96±0.76 6.31±0.96 F值 0.533 0.689 0.853 P值 0.672 0.584 0.503 2.3 黄芪甲苷对人正常肝细胞L-02外泌成分的影响
在不同黄芪甲苷浓度0、5、10和20 μg/mL处理L-02细胞24 h后,L-02细胞外泌AFP、ALT、AST和ALP水平变化各有不同(表 4,图 1)。5、10和20 μg/mL 3个处理组AFP、AST水平均较未处理组显著增高(P值均<0.05)。10和20 μg/mL 2个处理组ALT水平分别均较未处理和5 μg/mL两组显著降低(P值均<0.05);20 μg/mL组ALT水平较10 μg/mL组显著降低(P<0.05)。
表 4 不同浓度的黄芪甲苷处理对L-02外泌蛋白的影响Table 4. Effect of different concentrations of Astragaloside Ⅳ treatment on L-02 cell exoprotein组别 AFP(ng/mL) ALT(U/L) AST(U/L) ALP(U/L) 0 μg/mL组 13.25±0.20 6.46±0.67 5.68±0.21 40.68±0.61 5 μg/mL组 14.75±0.201) 6.27±0.16 7.63±0.221) 38.68±0.921) 10 μg/mL组 14.48±0.131) 3.09±0.081)2) 6.57±0.461) 40.37±0.37 20 μg/mL组 14.42±0.481) 1.80±0.131)2)3) 7.61±0.171) 43.77±0.341) F值 16.180 129.523 31.670 36.847 P值 0.001 0.001 0.001 0.001 注:与0 μg/mL组比较,1)P<0.05;与5 μg/mL组,2)P<0.05;与10 μg/mL组,3)P<0.05。 2.4 黄芪甲苷对HBV的影响
2.4.1 黄芪甲苷参与HBV复制机制的生物信息学分析
应用基因功能分析软件GeneMANIA分析黄芪甲苷调控基因RPL10和MTIF2参与的生物学功能[21]。结果表明, RPL10和MTIF2基因在生物学功能上高度连锁,主要参与3项重要生物功能:翻译起始(错误发现率FDR=2.01 ×10-12), 病毒基因表达(FDR=1.12×10-10), 核糖体亚基(FDR=1.47×10-11)。表明黄芪甲苷所调节的基因主要是通过核糖体翻译起始调控影响HBV复制(图 2a)。
基于上述研究及前人的基础[22],构建了黄芪甲苷参与HBV复制的可能作用机制(图 2b)。即专一性寄生于肝细胞核内的cccDNA提供pgRNA在内的所有病毒mRNA的转录模板,pgRNA和mRNA可借助宿主细胞翻译出多种用于病毒包装的蛋白,在胞质中组装形成核衣壳复合体用于形成新的病毒中间体。在该过程中,黄芪甲苷可调控RPL10和MRIF2分别参与核糖体大亚基的组成和翻译起始。影响中间体装配成成熟的病毒Dane颗粒释放入血或重新补充核内的cccDNA。
2.4.2 RPL10 & MTIF2调控HBV复制的生物信息学分析
调取TCGA和GEO数据库中HBV相关资料集GSE65359、GSE84044和GSE58208,对RPL10 & MTIF2调控HBV复制的相关基因(RPL10、RPS13、RPL28、RPL29、RPL24、RPL3、RPL10L、MTIF2、EIF4A3、MAGOH、MRPL16、RSL24D1、LRPPRC)进行富集分析。使用R套装软件Consensus Cluster Plus (v1.54.0) 进行一致性分析,聚类个数为4时,表现出理想的聚类效果(图 3a)。聚类热图均由R套装软件pheatmap (v1.0.12)分析,表明在功能上明显分为两类,且在基因表达水平的趋势一致(图 3b)。
调取肝癌数据库中HBV感染的肝癌患者资料351例,分析RPL10的表达差异对患者预后的影响:发现较低表达RPL10患者,RPL10表达水平高的患者预后较差(图 3c)。在对MTIF2的表达差异对患者预后的分析中,调取肝癌数据库资料212例:发现较低表达MTIF2患者,MTIF2表达水平高的患者预后较差(图 3d)。
分析145例TCGA资料集中HBV感染的肝癌患者资料(图 3e),RPL10和MTIF2同时高表达的患者预后较差(P=0.039 2,95%CI: 0.362~0.975。在不同样本风险分值对应的生存时间和生存状态散点图分布中可以看出,RPL10和MTIF2的表达水平越高,死亡病例数越高(图 3f)。而在无HBV感染的肝癌患者中,不存在上述现象,因此说明:RPL10和MTIF2主要是通过影响HBV发挥其效力。
2.4.3 黄芪甲苷对pgRNA、病毒抗原、RPL10、MTIF2表达的影响
在不同黄芪甲苷浓度0、5、10和20 μg/mL处理Hep3B细胞24 h后,Hep3B细胞HBV DNA和pgRNA水平变化各有不同(表 5、图 4)。3个处理组HBV DNA、pgRNA、HBsAg、HBeAg、RPL10和MTIF2水平与未处理组比较差异均有统计学意义(P值均<0.05)。
表 5 黄芪甲苷对HBV复制装配中相关基因及蛋白表达的影响Table 5. The effect of Astragaloside Ⅳ on the expression of related genes and proteins in HBV replication assembly组别 HBV DNA(IU/mL) pgRNA HBsAg HBeAg RPL10 MTIF2 0 μg/mL组 43 300.00±23 356.25 1.07±0.09 0.70±0.03 0.62±0.06 1.30±0.51 1.02±0.05 5 μg/mL组 7 420.00±955.981) 0.46±0.191) 0.58±0.041) 0.41±0.041) 0.79±0.041) 0.51±0.181) 10 μg/mL组 6 730.00±141.071) 0.63±0.131) 0.32±0.041) 0.46±0.011) 0.32±0.041) 0.63±0.081) 20 μg/mL组 4900.00±400.371) 0.74±0.031) 0.56±0.051) 0.34±0.021) 0.56±0.051) 0.56±0.221) F值 7.532 12.159 33.026 17.251 4.633 4.712 P值 0.010 0.002 0.003 0.009 0.037 0.035 注:与0 μg/mL组比较,1)P<0.05。 3. 讨论
为了快速的在宿主体内进行增殖和复制,HBV通过激活宿主细胞多种信号通路抢夺mRNA翻译资源[23]。同时,该抢夺过程又会受到各种约束,如翻译系统不兼容,翻译起始、延伸和终止受阻等等。因此明确HBV掠夺翻译系统的方式方法,阻断病毒对宿主信号通路的激活调控是阻断HBV复制的重要策略之一[24]。本研究首先对黄芪甲苷处理正常肝细胞所产生的影响进行了研究,发现其可促进正常肝细胞增殖,损伤较小。又进一步应用黄芪甲苷处理HBV细胞模型Hep3B,发现黄芪甲苷能够有效抑制MTIF2和RPL10的表达,一方面通过抑制翻译起始减少病毒组装所需蛋白的翻译;另一方面减少特异性核糖体大亚基的组装,降低用于合成病毒所需蛋白的核糖体形成,进而影响HBV复制。
黄芪甲苷处理正常肝细胞实验中,20 μg/mL黄芪甲苷在72 h内能促进L-02细胞生长,5、10和20 μg/mL黄芪甲苷处理24 h能促进L-02细胞AFP和AST分泌,降低ALT水平,但对细胞凋亡和ALP分泌影响较小。表现出促进正常肝细胞增殖的作用。这与胡雅梦等[25]的80 μg/ml以下黄芪甲苷对L-02细胞增殖无影响的报道不一致,但该报道也说明黄芪甲苷能够提高辐射损伤后L-02细胞的增殖能力, 抑制辐射所致的胞内ROS和MDA含量升高。刘丽等[26]在急性肝损伤小鼠模型的研究中发现黄芪甲苷能够有效降低血清ALT和AST的含量,具有促进肝细胞生长保护肝脏的功效。与本研究结果基本一致,部分结果的差异可能由于实验模型的差异导致。但总体的结论都证明黄芪甲苷具有促进肝细胞生长和保护肝脏的功效,表明其对正常肝细胞的刺激和损伤作用较小,具有良好的临床应用基础。
应用生物信息学调取数据库大样本临床资料分析发现:RPL10和MTIF2主要是作用HBV发挥其效力影响肝癌患者预后,且RPL10和MTIF2的表达水平越高,死亡病例数越高,预后越差。由于该研究仅基于HBV所致的肝癌数据库统计得出,因此对于单纯感染HBV的非肿瘤患者预后情况有待进一步研究。
乙型肝炎与肝实质细胞的增殖密切相关,HBV DNA随机整合频率增加能够引起遗传紊乱,进而导致细胞的恶性增殖[27]。而HBV的复制广泛依赖于宿主细胞的翻译系统[28]。本研究表明5~20 μg/mL黄芪甲苷在Hep3B细胞中能有效降低HBV DNA和pgRNA的相对表达水平,抑制HBsAg和HBeAg合成,抑制宿主RPL10和MTIF2基因mRNA表达。同时生物信息学分析表明关键基因RPL10和MTIF2的表达水平越高,死亡病例数越高,预后越差,提示高水平RPL10和MTIF2提示预后差的原因可能与HBV复制调控相关。
纵观整个抗病毒领域,HBV、HIV和呼吸道病毒是新药研发的主战场,虽然临床药物种类繁多,但是有效率仍然不容乐观。在近两年多发的大型公共卫生事件下更凸显出这一短板,因而阐明传统中草药对病毒基因宿主内翻译调控机制的作用,在未来开发或改进抗病毒药物以及在新发病原体的应对中具有重要意义。
-
表 1 AE模型鼠外周血中Tfh细胞表达情况
组别 动物数(只) Tfh细胞在CD4+细胞中百分比(%) Tfh细胞在所有细胞中百分比(%) 正常对照组 10 11.12±2.94 0.18±0.05 模型组 10 25.63±3.47 0.08±0.02 t值 10.230 5.520 P值 <0.001 <0.001 表 2 AE模型鼠脾脏中Tfh细胞表达情况
组别 动物数(只) Tfh细胞在CD4+细胞中百分比(%) Tfh细胞在所有细胞中百分比(%) 正常对照组 10 35.82±4.13 5.30±1.40 模型组 10 33.50±6.40 3.00±0.42 t值 0.974 4.769 P值 0.343 <0.001 -
[1] CASULLI A, BARTH T, TAMAROZZI F. Echinococcus multilocularis[J]. Trends Parasitol, 2019, 35(9): 738-739. DOI: 10.1016/j.pt.2019.05.005. [2] WEN H, VUITTON L, TUXUN T, et al. Echinococcosis: Advances in the 21st Century[J]. Clin Microbiol Rev, 2019, 32(2): e00075-18. DOI: 10.1128/CMR.00075-18. [3] CAI H, GUAN Y, MA X, et al. Epidemiology of echinococcosis among schoolchildren in golog tibetan autonomous prefecture, qinghai, China[J]. Am J Trop Med Hyg, 2017, 96(3): 674-679. DOI: 10.4269/ajtmh.16-0479. [4] WANG J, GOTTSTEIN B. Immunoregulation in larval Echinococcus multilocularis infection[J]. Parasite Immunol, 2016, 38(3): 182-192. DOI: 10.1111/pim.12292. [5] GLATMAN ZARETSKY A, TAYLOR JJ, KING IL, et al. T follicular helper cells differentiate from Th2 cells in response to helminth antigens[J]. J Exp Med, 2009, 206(5): 991-999. DOI: 10.1084/jem.20090303. [6] HE L, GU W, WANG M, et al. Extracellular matrix protein 1 promotes follicular helper T cell differentiation and antibody production[J]. Proc Natl Acad Sci U S A, 2018, 115(34): 8621-8626. DOI: 10.1073/pnas.1801196115. [7] CROTTY S. T follicular helper cell biology: A decade of discovery and diseases[J]. Immunity, 2019, 50(5): 1132-1148. DOI: 10.1016/j.immuni.2019.04.011. [8] CROTTY S. T follicular helper cell differentiation, function, and roles in disease[J]. Immunity, 2014, 41(4): 529-542. DOI: 10.1016/j.immuni.2014.10.004. [9] SONG W, CRAFT J. T follicular helper cell heterogeneity: Time, space, and function[J]. Immunol Rev, 2019, 288(1): 85-96. DOI: 10.1111/imr.12740. [10] VINUESA CG, LINTERMAN MA, YU D, et al. Follicular helper T cells[J]. Annu Rev Immunol, 2016, 34: 335-368. DOI: 10.1146/annurev-immunol-041015-055605. [11] HELMOLD HAIT S, VARGAS-INCHAUSTEGUI DA, MUSICH T, et al. Early T follicular helper cell responses and germinal center reactions are associated with viremia control in immunized rhesus macaques[J]. J Virol, 2019, 93(4). DOI: 10.1128/JVI.01687-18. [12] XU W, ZHAO X, WANG X, et al. The Transcription factor tox2 drives T follicular helper cell development via regulating chromatin accessibility[J]. Immunity, 2019, 51(5): 826-839.e5. DOI: 10.1016/j.immuni.2019.10.006. [13] WANG B, LI H, SA RL, et al. The expression of ICOS in Tfh cells and the effect of ICOS blocker on the expression of IL-21 in Tfh cells with liver fibrosis[J]. Int J Immunol, 2020, 43(5): 483-487. DOI: 10.3760/cma.j.issn.1673-4394.2020.05.001.王波, 李慧, 萨茹拉, 等. 四氯化碳诱导肝纤维化小鼠Tfh中ICOS的表达及ICOS阻断剂对IL-21表达的影响[J]. 国际免疫学杂志, 2020, 43(5): 483-487. DOI: 10.3760/cma.j.issn.1673-4394.2020.05.001. [14] LINDQVIST M, van LUNZEN J, SOGHOIAN DZ, et al. Expansion of HIV-specific T follicular helper cells in chronic HIV infection[J]. J Clin Invest, 2012, 122(9): 3271-3280. DOI: 10.1172/JCI64314. [15] VELU V, MYLVAGANAM G, IBEGBU C, et al. Tfh1 cells in germinal centers during chronic HIV/SIV infection[J]. Front Immunol, 2018, 9: 1272. DOI: 10.3389/fimmu.2018.01272. [16] GLATMAN ZA, TAYLOR JJ, KING IL, et al. T follicular helper cells differentiate from Th2 cells in response to helminth antigens[J]. J Exp Med, 2009, 206(5): 991-999. DOI: 10.1126/sciimmunol.aan8884. [17] KLEIN F, MOUQUET H, DOSENOVIC P, et al. Antibodies in HIV-1 vaccine development and therapy[J]. Science, 2013, 341(6151): 1199-1204. DOI: 10.1126/science.1241144. [18] HANSEN DS, OBENG-ADJEI N, LY A, et al. Emerging concepts in T follicular helper cell responses to malaria[J]. Int J Parasitol, 2017, 47(2-3): 105-110. DOI: 10.1016/j.ijpara.2016.09.004. [19] DÍAZ A, CASARAVILLA C, ALLEN JE, et al. Understanding the laminated layer of larval Echinococcus Ⅱ: Immunology[J]. Trends Parasitol, 2011, 27(6): 264-273. DOI: 10.1016/j.pt.2011.01.008. [20] HOU YJ, ZHANG LQ, FAN HN. Research advances in circulating free DNA in liver cancer and liver-related parasitic diseases[J]. J Clin Hepatol, 2020, 36(2): 430-432. DOI: 10.3969/j.issn.1001-5256.2020.02.043.后亚军, 张灵强, 樊海宁. 循环游离DNA在肝癌和肝相关性寄生虫病中的应用进展[J]. 临床肝胆病杂志, 2020, 36(2): 430-432. DOI: 10.3969/j.issn.1001-5256.2020.02.043. [21] WANG ZX, GOU P, YU WH, et al. Measurement and bioinformatics analysis of exosomes microRNAs in bile of hepatic alveolar echinococcosis patients with biliary tract invasion[J]. J Clin Hepatol, 2020, 36(9): 2045-2049. DOI: 10.3969/j.issn.1001-5256.2020.09.027.王志鑫, 苟平, 于文昊, 等. 肝泡型包虫病侵及胆道患者胆汁外泌体microRNA的检测及生物信息学分析[J]. 临床肝胆病杂志, 2020, 36(9): 2045-2049. DOI: 10.3969/j.issn.1001-5256.2020.09.027. [22] DING JB, LI YJ, ZHANG FB. Research progress of hydatidosis immunity and vaccine[J]. J Xinjiang Med Univ, 2019, 42(1): 24-28. DOI: 10.3969/j.issn.1009-5551.2019.01.005.丁剑冰, 李玉娇, 张峰波. 包虫病免疫及疫苗的研究进展[J]. 新疆医科大学学报, 2019, 42(1): 24-28. DOI: 10.3969/j.issn.1009-5551.2019.01.005. 期刊类型引用(4)
1. 张娟娟,王锦,张子境,杜玉莎,王丽娜,张佳丽,王云. 黄芪对氯化钾诱导的高钾血症家兔模型的影响. 医学信息. 2024(02): 111-114+119 .  百度学术
百度学术2. 李盼盼,张凯悦,呼欣怡,韩玉晓,吴昱铮,王涛,刘梦扬. 中药防治乙型病毒性肝炎作用机制研究进展. 中南药学. 2024(02): 466-472 .  百度学术
百度学术3. 张友福,罗来邦,杨锦然,杨华,李新长,罗文峰,龙成美. 黄芪甲苷对人外周血单个核细胞内HBV表达的影响. 江西中医药大学学报. 2024(03): 84-87 .  百度学术
百度学术4. 蔺婷,彭佳欣,陶阳阳,周芳亮,何迎春. 黄芪甲苷通过PI3K/Akt/mTOR通路诱导鼻咽癌细胞自噬和凋亡. 中国实验方剂学杂志. 2023(24): 113-121 .  百度学术
百度学术其他类型引用(1)
-




 PDF下载 ( 6477 KB)
PDF下载 ( 6477 KB)

 下载:
下载:




 下载:
下载:
 百度学术
百度学术





