白蛋白-胆红素评分联合腹水中性粒细胞计数及降钙素原对肝硬化腹水患者发生自发性细菌性腹膜炎的预测价值
DOI: 10.3969/j.issn.1001-5256.2021.09.019
Value of albumin-bilirubin score combined with neutrophil count and procalcitonin in ascites in predicting spontaneous bacterial peritonitis in patients with cirrhotic ascites
-
摘要:
目的 探讨影响肝硬化腹水患者发生自发性细菌性腹膜炎(SBP)的危险因素,并建立新的模型预测SBP的发生。 方法 选取河北省人民医院2016年9月—2020年9月确诊为肝硬化腹水患者215例,根据是否发生SBP,分为SBP组(n=55)与非SBP组(n=160)。收集患者临床资料并计算白蛋白-胆红素(ALBI)、MELD、MELD-Na、Child-Pugh等评分。计量资料两组间比较采用t检验或Mann-Whitney U检验; 计数资料两组间比较采用χ2检验; 经多因素logistic回归分析筛选出独立危险因素,绘制受试者工作特征曲线(ROC曲线),分析比较ALBI评分、降钙素原(PCT)、腹水中性粒细胞(PMN)计数及ALBI-PMN-PCT联合模型对SBP的诊断效能。 结果 非SBP组的Na+浓度(Z=-3.414,P=0.001)显著高于SBP组,TBil(Z=-2.720,P=0.007)、肌酐(Z=-1.994,P=0.046)、尿素氮(Z=-2.440,P=0.015)、CRP(Z=-9.137,P<0.001)、PCT(Z=-8.096,P<0.001)、PT(Z=-1.969,P=0.049)、INR(Z=-2.073,P=0.038)、PMN(Z=-8.292,P<0.001)、MELD评分(Z=-2.736,P=0.006)、MELD-Na评分(Z=-3.188,P=0.001)、Child-Pugh评分(Z=-3.419,P=0.001)、ALBI评分(t=-5.010,P<0.001)均明显低于SBP组; 两组是否伴有消化道出血、肝性脑病比较,差异均有统计学意义(χ2值分别为16.551、8.142,P值分别为<0.001、0.004)。多因素logistic回归分析结果显示,ALBI评分(OR=3.460,95%CI:1.296~9.240,P=0.013)、PMN(OR=1.012,95%CI:1.007~1.017,P<0.001)、PCT(OR=6.019,95%CI:2.821~12.843,P<0.001)是肝硬化腹水患者发生SBP的独立危险因素。ROC曲线结果显示,ALBI、PCT、PMN和ALBI-PMN-PCT诊断SBP的曲线下面积分别为0.711、0.866、0.875和0.934;灵敏度分别为50.91%、73.36%、72.73%和89.09%;特异度分别为86.87%、81.25%、100.00%和91.87%;ALBI-PMN-PCT>0.272时患者发生SBP的风险增加。 结论 ALBI-PMN-PCT联合模型对肝硬化腹水患者发生SBP具有较高的预测价值。 Abstract:Objective To investigate the risk factors for spontaneous bacterial peritonitis (SBP) in patients with cirrhotic ascites, and to establish a new model for predicting the development of SBP. Methods A total of 215 patients who were diagnosed with cirrhotic ascites in Hebei General Hospital from September 2016 to September 2020 were enrolled, and according to the presence or absence of SBP, they were divided into SBP group with 55 patients and non-SBP group with 160 patients. Related clinical data were collected and albumin-bilirubin (ALBI) score, Model for End-Stage Liver Disease (MELD) score, MELD combined with serum sodium concentration (MELD-Na) score, and Child-Pugh score were calculated. The t-test or the Mann-Whitney U test was used for comparison of continuous data between two groups, and the chi-square test was used for comparison of categorical data between two groups; a multivariate logistic regression analysis was used to screen out independent risk factors, and the receiver operating characteristic (ROC) curve was plotted to evaluate the performance of ALBI score, procalcitonin (PCT), polymorphonuclear neutrophil (PMN) count in ascites, and the ALBI-PMN-PCT combined model in the diagnosis of SBP. Results Compared with the SBP group, the non-SBP group had a significantly higher concentration of Na+ (Z=-3.414, P=0.001) and significantly lower total bilirubin (Z=-2.720, P=0.007), creatinine (Z=-1.994, P=0.046), urea nitrogen (Z=-2.440, P=0.015), C-reactive protein (Z=-9.137, P < 0.001), PCT (Z=-8.096, P < 0.001), prothrombin time (Z=-1.969, P=0.049), international normalized ratio (Z=-2.073, P=0.038), PMN (Z=-8.292, P < 0.001), MELD score (Z=-2.736, P=0.006), MELD-Na score (Z=-3.188, P=0.001), Child-Pugh score (Z=-3.419, P=0.001), and ALBI score (t=-5.010, P < 0.001), and there were also significant differences between the two groups in the presence or absence of gastrointestinal bleeding or hepatic encephalopathy (χ2=16.551 and 8.142, P < 0.001 and P=0.004). The multivariate logistic regression analysis showed that ALBI score (odds ratio [OR]=3.460, 95% confidence interval [CI]: 1.296-9.240, P=0.013), PMN (OR=1.012, 95%CI: 1.007-1.017, P < 0.001), and PCT (OR=6.019, 95%CI: 2.821-12.843, P < 0.001) were independent risk factors for SBP in patients with cirrhotic ascites. The ROC curve showed that ALBI, PCT, PMN, and ALBI-PMN-PCT had areas under the ROC curve of 0.711, 0.866, 0.875, and 0.934, respectively, in the diagnosis of SBP, with sensitivities of 50.91%, 73.36%, 72.73%, and 89.09%, respectively, and specificities of 86.87%, 81.25%, 100.00%, and 91.87%, respectively. The patients with ALBI-PMN-PCT > 0.272 had an increased risk of developing SBP. Conclusion The ALBI-PMN-PCT combined model has a high value in predicting the onset of SBP in patients with cirrhotic ascites. -
Key words:
- Liver Cirrhosis /
- Peritonitis /
- Ascites /
- Calcitonin /
- Albumin-Bilirubin Score
-
自发性细菌性腹膜炎(spontaneous bacterial peritonitis, SBP)是肝硬化腹水患者常见的并发症之一,也是肝功能失代偿的重要标志。其发病率因研究样本不同而有差异,在失代偿期肝硬化门诊患者中,1年内发病率达3.5%,而在住院肝硬化腹水患者中,发病率为7%~30%[1]。随着抗生素的应用,SBP的病死率由70年代的90%降至目前的20%[2],但其1年内复发率仍高达70%[3]。虽然关于SBP诊断与治疗已有较多的研究,但尚无准确的生物标志物用于SBP的早期诊断,目前临床上对其早期识别和预防仍存在一定的困难,其发病率、病死率、复发率较高,预后较差。因此,如何更准确的诊断SBP仍是目前研究的重点。本研究旨在探讨终末期肝病模型(MELD)、MELD-Na、年龄-胆红素-国际标准化比值-肌酐(ABIC)、白蛋白-胆红素(ALBI)、Child-Pugh评分系统及腹水中性粒细胞(polymorphonuclear leucocytes,PMN)、降钙素原(PCT)等常规实验室检查指标对肝硬化腹水患者发生SBP的预测价值,以期建立一种更准确的预测模型,筛选出SBP的高危患者,为临床医师早期预防、及时诊断和治疗SBP提供指导意义。
1. 资料与方法
1.1 研究对象
选取2016年9月—2020年9月河北省人民医院收治的肝硬化腹水患者,根据是否发生SBP分为SBP组和非SBP组。肝硬化腹水及SBP的诊断参考《肝硬化腹水及相关并发症的诊疗指南》[4]。纳入标准:(1)确诊为肝硬化腹水; (2)治疗前具有完整的腹水及生化全项、凝血五项、PCT等常规实验室检查结果。排除标准:(1)因消化道穿孔、腹腔原发病灶感染等原因导致的继发性腹膜炎; (2)癌性腹水、结核性腹水; (3)就诊前1个月内应用抗生素治疗; (4)患者依从性差。
1.2 临床资料
收集并分析患者的基本资料,包括性别、年龄、肝硬化病因; 实验室检查指标包括生化全项、凝血五项、腹水常规及腹水细菌培养等,依据上述指标计算评分:(1)ALBI=-0.085×Alb(g/L)+0.66×lgTBil (μmol/L)[5]; (2)ABIC=0.1×年龄+0.08×TBil(mg/dl) +0.3×肌酐(mg/dl)+0.8×INR[6]; (3)Child-Pugh涉及Alb、TBil、INR、腹水及肝性脑病[7]; (4)MELD=11.2×lnINR+3.8×lnTBil(mg/dl)+9.6×ln肌酐(mg/dl)+6.4×病因(胆汁性及酒精性为0,其他为1)[8]; (5)MELD-Na=MELD+1.59×[135-Na+(mmol/L)],其中Na+>135 mmol/L者按照135 mmol/L计算,Na+<120 mmol/L者按照120 mmol/L计算,Na+浓度在120~135 mmol/L者按照具体数值计算[9]。
1.3 伦理学审查
本研究经由河北省人民医院伦理委员会审批,批号:202102。
1.4 统计学方法
使用SPSS 25.0和MedCalc 16.8.4.0统计软件进行分析。正态分布的计量资料以x±s表示,两组间比较采用t检验; 偏态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。计数资料两组间比较采用χ2检验。单因素和多因素分析使用logistic回归分析。绘制受试者工作特征曲线(ROC曲线),并通过计算ROC曲线下面积(AUC)比较各指标及联合模型对肝硬化腹水患者发生SBP的诊断效能。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
共纳入肝硬化腹水患者215例,其中SBP组55例,男41例,女14例,年龄(62.82±13.79)岁; 非SBP组160例,男107例,女53例,年龄(63.25±13.04)岁。病因学类型:病毒性肝炎140例,酒精性肝病42例,自身免疫性肝病18例,隐源性肝病15例。
SBP组与非SBP组比较,Na+、TBil、肌酐、尿素氮、CRP、PCT、PT、INR、PMN及是否伴有消化道出血、肝性脑病差异均有统计学意义(P值均<0.05);相关评分系统:MELD、MELD-Na、Child-Pugh、ALBI评分两组间比较差异均有统计学意义(P值均<0.05)。两组肝硬化病因及ABIC评分差异均无统计学意义(P值均>0.05)(表 1)。
表 1 肝硬化腹水患者一般资料比较变量 非SBP组(n=160) SBP组(n=55) 统计值 P值 年龄(岁) 63.25±13.04 62.82±13.79 t=0.209 0.835 Alb(g/L) 28.00±5.10 26.76±5.55 t=1.532 0.127 Na+(mmol/L) 137(134~140) 135(132~139) Z=-3.414 0.001 尿素氮(mmol/L) 5.30(3.76~8.74) 6.87(5.00~10.30) Z=-2.440 0.015 TBil(μmol/L) 32.1(22.1~59.4) 45.3(27.9~87.4) Z=-2.720 0.007 肌酐(μmol/L) 67.7(59.2~79.1) 72.7(61.7~95.0) Z=-1.994 0.046 PT(s) 14.3(13.0~16.4) 15.1(13.3~17.9) Z=-1.969 0.049 INR 1.25(1.13~1.41) 1.32(1.16~1.58) Z=-2.073 0.038 CRP(mg/L) 6.76(4.21~9.86) 30.56(17.63~48.00) Z=-9.137 <0.001 PCT(ng/ml) 0.09(0.03~0.24) 1.46(0.38~2.67) Z=-8.096 <0.001 PMN(×106/L) 48.5(27.3~131.3) 321.0(124.0~802.0) Z=-8.292 <0.001 ABIC评分 7.89±1.33 8.20±1.52 t=-1.415 0.158 ALBI评分 -1.45±0.52 -1.03±0.56 t=-5.010 <0.001 Child-Pugh评分 8.0(7.0~10.0) 10.0(8.0~11.0) Z=-3.419 0.001 MELD评分 7.91(4.78~11.07) 10.11(6.41~17.88) Z=-2.736 0.006 MELD-Na评分 9.01(5.04~13.16) 11.92(8.50~20.75) Z=-3.188 0.001 性别[例(%)] χ2=1.123 0.289 男 107(66.9) 41(74.5) 女 53(33.1) 14(25.5) 消化道出血[例(%)] χ2=16.551 <0.001 是 42(26.25) 31(56.36) 否 118(73.75) 24(43.64) 肝性脑病[例(%)] χ2=8.142 0.004 是 16(10.0) 14(25.5) 否 144(90.0) 41(74.5) 病因[例(%)] χ2=2.995 0.386 病毒性肝炎 109(68.1) 31(56.4) 酒精性肝病 28(17.5) 14(25.5) 自身免性肝病 13(8.1) 5(9.1) 隐源性肝病 10(6.3) 5(9.1) 2.2 单因素及多因素logistic回归分析
单因素logistic回归分析结果显示,Child-Pugh评分、MELD评分、ALBI评分、PCT、PMN、是否发生消化道出血及肝性脑病均是肝硬化腹水患者发生SBP的影响因素(P值均<0.05)(表 2)。多因素logistic回归分析结果显示,PCT、PMN及ALBI评分是发生SBP的独立危险因素(P值均<0.05)(表 3)。通过系数法合成为联合模型ALBI-PMN-PCT,其计算公式为0.012×PMN+1.241×ALBI+1.795×PCT-2.777。
表 2 单因素logistic回归分析指标 OR 95%CI P值 ALBI评分 4.310 2.283~8.138 <0.001 Child-Pugh评分 1.290 1.093~1.521 0.003 MELD评分 1.064 1.019~1.111 0.005 PMN 1.012 1.008~1.016 <0.001 PCT 6.203 3.436~11.198 <0.001 肝性脑病 3.073 1.385~6.817 0.006 消化道出血 3.629 1.916~6.874 <0.001 表 3 多因素logistic回归分析指标 回归系数 OR 95%CI P值 PMN 0.012 1.012 1.007~1.017 <0.001 ALBI评分 1.241 3.460 1.296~9.240 0.013 PCT 1.795 6.019 2.821~12.843 <0.001 2.3 ALBI评分、PCT、PMN及ALBI-PMN-PCT对SBP的预测价值
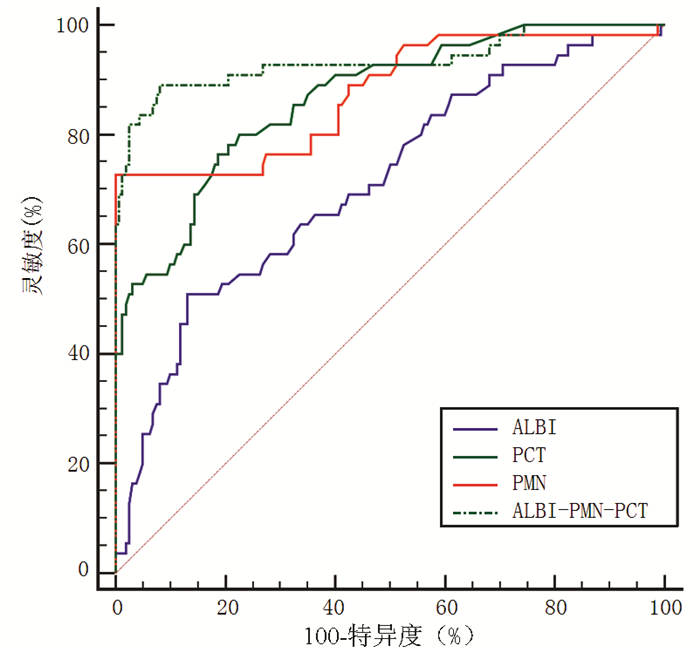
ALBI、PCT、PMN及ALBI-PMN-PCT的AUC分别为0.711、0.866、0.875、0.934,ALBI-PMN-PCT的预测价值更高。ALBI-PMN-PCT的约登指数为0.810,最佳临界值为0.272,其灵敏度及特异度分别为89.09%和91.87%(表 4,图 1)。ALBI-PMN-PCT与ALBI评分、PCT、PMN单一因素的ROC曲线进行比较,差异均有统计学意义(Z值分别为5.271、3.183、2.148,P值分别为<0.001、0.002、0.032)。
表 4 PMN、ALBI评分、PCT及ALBI-PMN-PCT对SBP的预测价值指标 最佳临界点 AUC(95%CI) 灵敏度(%) 特异度(%) 约登指数 PMN 242×106/L 0.875(0.823~0.916) 72.73 100.00 0.727 ALBI评分 -0.92 0.711(0.646~0.771) 50.91 86.87 0.378 PCT 0.35 ng/ml 0.866(0.814~0.909) 73.36 81.25 0.576 ALBI-PMN-PCT 0.272 0.934(0.892~0.963) 89.09 91.87 0.810 3. 讨论
肝硬化腹水患者的住院细菌感染率高达44.6%[10]。SBP是肝硬化患者最常见的感染类型之一,约占23%[11]。肝硬化患者一旦发生SBP,会导致患者病情快速恶化,是终末期肝病患者死亡的主要原因之一。目前腹水培养是确诊SBP的常用手段,然而腹水培养耗时较长,阳性率仅为35%~65%,对确诊SBP价值有限[12]。因此临床上迫切需要预测价值更高的指标用于早期识别SBP。
国内外学者[13-14]研究发现,低钠血症、Child-Pugh评分、腹水Alb、消化道出血、肝肾综合征、腹水PMN计数是SBP发生的独立危险因素。还有研究[15]表明MELD评分与肝硬化腹水患者SBP发病率呈线性正相关,高MELD评分提示发生SBP风险增加。除此之外,Chen等[16]研究表明,MELD、MELD-Na、iMELD、ALBI、Child-Pugh评分均可预测肝硬化并发SBP院内、3个月和6个月的病死率。本研究单因素回归分析发现患者的Child-Pugh评分、MELD评分、ALBI评分、PCT、PMN、是否发生消化道出血、肝性脑病与肝硬化腹水并发SBP有关。进一步通过多因素回归分析排除混杂因素的影响,结果显示ALBI评分、PMN、PCT是发生SBP的独立危险因素。本研究发现PMN>242×106/L是发生SBP的独立危险因素,AUC为0.875,约登指数为0.727,灵敏度和特异度分别为72.73%和100%。由此可见,PMN对诊断SBP有较高的预测价值,这与国内外文献报道的结果一致。在本研究中,SBP组Child-Pugh、MELD评分较非SBP组高,但在多因素回归分析中二者并不是发生SBP的独立危险因素,考虑Child-Pugh评分受到腹水及肝性脑病分级的主观因素影响,MELD评分易受到患者非肝脏因素的影响,且MELD是基于酒精性肝病为主的研究群体[17],而本研究群体主要以病毒性肝炎(65.1%)为主,因此对疾病的预测可能会有所偏倚。
大量研究[18-19]表明,PCT是SBP发生的独立危险因素,这与本研究得出的结果一致,当PCT>0.35 ng/ml时,肝硬化腹水患者发生SBP的风险显著升高,其预测肝硬化并发SBP的AUC为0.866,约登指数为0.576,灵敏度为73.36%,特异度为81.25%。PCT>0.5 ng/ml且排除其他部位感染是诊断SBP的标准之一[4],但当PCT在0.35~0.5 ng/ml且排除其他部位感染时,需警惕早期SBP发生,可将抗感染时机前移。
本研究还发现ALBI评分是失代偿期肝硬化腹水患者并发SBP的独立危险因素。ALBI评分是Johnson等[5]在2015年提出的肝功能评估模型,包括胆红素和血清Alb两项指标,评分分为3级:1级,≤-2.6分; 2级,>-2.6分~≤-1.39分; 3级,>-1.39分,随着评分数值的增加,患者的肝功能情况也就越差。ALBI评分计算简单,临床易获取,其在自身免疫性肝炎[20]、乙型肝炎肝硬化[21]、原发性胆汁性胆管炎[22]、首次发生SBP[16]的患者中具有良好的预后预测能力。但ALBI评分用于预测SBP发生的研究尚少,本研究发现,当ALBI>-0.92时,其AUC为0.711,提示该评分对SBP的发生具有一定预测能力,但相比PCT和PMN,预测效能较低。本研究中联合模型ALBI-PMN-PCT预测发生SBP的AUC为0.934,约登指数为0.810,其与ALBI评分、PCT、PMN单一指标的ROC曲线比较差异均有统计学意义(P值均<0.05),提示ALBI-PMN-PCT对于肝硬化腹水患者并发SBP具有更好的预测价值。ALBI-PMN-PCT的最佳临界点为0.272,灵敏度为89.09%,特异度为91.87%,当ALBI-PMN-PCT>0.272时,提示肝硬化腹水患者发生SBP的概率大大增加。ALBI-PMN-PCT包含TBil、Alb、PMN和PCT,不仅反映疾病的感染程度,还反映了肝脏的损伤及合成功能。
综上所述,肝硬化腹水合并SBP的危险因素较多,PMN、PCT、ALBI评分是肝硬化腹水患者发生SBP的独立危险因素,三者联合可以更准确地预测SBP的发生。临床中应关注高危患者,及时有效的制订抗菌方案,积极预防和控制SBP的发生,提高患者生存率。
-
表 1 肝硬化腹水患者一般资料比较
变量 非SBP组(n=160) SBP组(n=55) 统计值 P值 年龄(岁) 63.25±13.04 62.82±13.79 t=0.209 0.835 Alb(g/L) 28.00±5.10 26.76±5.55 t=1.532 0.127 Na+(mmol/L) 137(134~140) 135(132~139) Z=-3.414 0.001 尿素氮(mmol/L) 5.30(3.76~8.74) 6.87(5.00~10.30) Z=-2.440 0.015 TBil(μmol/L) 32.1(22.1~59.4) 45.3(27.9~87.4) Z=-2.720 0.007 肌酐(μmol/L) 67.7(59.2~79.1) 72.7(61.7~95.0) Z=-1.994 0.046 PT(s) 14.3(13.0~16.4) 15.1(13.3~17.9) Z=-1.969 0.049 INR 1.25(1.13~1.41) 1.32(1.16~1.58) Z=-2.073 0.038 CRP(mg/L) 6.76(4.21~9.86) 30.56(17.63~48.00) Z=-9.137 <0.001 PCT(ng/ml) 0.09(0.03~0.24) 1.46(0.38~2.67) Z=-8.096 <0.001 PMN(×106/L) 48.5(27.3~131.3) 321.0(124.0~802.0) Z=-8.292 <0.001 ABIC评分 7.89±1.33 8.20±1.52 t=-1.415 0.158 ALBI评分 -1.45±0.52 -1.03±0.56 t=-5.010 <0.001 Child-Pugh评分 8.0(7.0~10.0) 10.0(8.0~11.0) Z=-3.419 0.001 MELD评分 7.91(4.78~11.07) 10.11(6.41~17.88) Z=-2.736 0.006 MELD-Na评分 9.01(5.04~13.16) 11.92(8.50~20.75) Z=-3.188 0.001 性别[例(%)] χ2=1.123 0.289 男 107(66.9) 41(74.5) 女 53(33.1) 14(25.5) 消化道出血[例(%)] χ2=16.551 <0.001 是 42(26.25) 31(56.36) 否 118(73.75) 24(43.64) 肝性脑病[例(%)] χ2=8.142 0.004 是 16(10.0) 14(25.5) 否 144(90.0) 41(74.5) 病因[例(%)] χ2=2.995 0.386 病毒性肝炎 109(68.1) 31(56.4) 酒精性肝病 28(17.5) 14(25.5) 自身免性肝病 13(8.1) 5(9.1) 隐源性肝病 10(6.3) 5(9.1) 表 2 单因素logistic回归分析
指标 OR 95%CI P值 ALBI评分 4.310 2.283~8.138 <0.001 Child-Pugh评分 1.290 1.093~1.521 0.003 MELD评分 1.064 1.019~1.111 0.005 PMN 1.012 1.008~1.016 <0.001 PCT 6.203 3.436~11.198 <0.001 肝性脑病 3.073 1.385~6.817 0.006 消化道出血 3.629 1.916~6.874 <0.001 表 3 多因素logistic回归分析
指标 回归系数 OR 95%CI P值 PMN 0.012 1.012 1.007~1.017 <0.001 ALBI评分 1.241 3.460 1.296~9.240 0.013 PCT 1.795 6.019 2.821~12.843 <0.001 表 4 PMN、ALBI评分、PCT及ALBI-PMN-PCT对SBP的预测价值
指标 最佳临界点 AUC(95%CI) 灵敏度(%) 特异度(%) 约登指数 PMN 242×106/L 0.875(0.823~0.916) 72.73 100.00 0.727 ALBI评分 -0.92 0.711(0.646~0.771) 50.91 86.87 0.378 PCT 0.35 ng/ml 0.866(0.814~0.909) 73.36 81.25 0.576 ALBI-PMN-PCT 0.272 0.934(0.892~0.963) 89.09 91.87 0.810 -
[1] MARCIANO S, DÍAZ JM, DIRCHWOLF M, et al. Spontaneous bacterial peritonitis in patients with cirrhosis: Incidence, outcomes, and treatment strategies[J]. Hepat Med, 2019, 11: 13-22. DOI: 10.2147/HMER.S164250. [2] PIANO S, FASOLATO S, SALINAS F, et al. The empirical antibiotic treatment of nosocomial spontaneous bacterial peritonitis: Results of a randomized, controlled clinical trial[J]. Hepatology, 2016, 63(4): 1299-1309. DOI: 10.1002/hep.27941. [3] TANDON P, GARCIA-TSAO G. Bacterial infections, sepsis, and multiorgan failure in cirrhosis[J]. Semin Liver Dis, 2008, 28(1): 26-42. DOI: 10.1055/s-2008-1040319. [4] Chinese Society of Hepatology, Chinese Medical Association. Guidelines on the management of ascites and complications in cirrhosis[J]. J Clin Hepatol, 2017, 33(10): 1847-1863. DOI: 10.3969/j.issn.1001-5256.2017.10.003.中华医学会肝病学分会. 肝硬化腹水及相关并发症的诊疗指南[J]. 临床肝胆病杂志, 2017, 33(10): 1847-1863. DOI: 10.3969/j.issn.1001-5256.2017.10.003. [5] JOHNSON PJ, BERHANE S, KAGEBAYASHI C, et al. Assessment of liver function in patients with hepatocellular carcinoma: A new evidence-based approach-the ALBI grade[J]. J Clin Oncol, 2015, 33(6): 550-558. DOI: 10.1200/JCO.2014.57.9151. [6] DOMINGUEZ M, RINCÓN D, ABRALDES JG, et al. A new scoring system for prognostic stratification of patients with alcoholic hepatitis[J]. Am J Gastroenterol, 2008, 103(11): 2747-2756. DOI: 10.1111/j.1572-0241.2008.02104.x. [7] PUGH RN, MURRAY-LYON IM, DAWSON JL, et al. Transection of the oesophagus for bleeding oesophageal varices[J]. Br J Surg, 1973, 60(8): 646-649. DOI: 10.1002/bjs.1800600817. [8] KAMATH PS, WIESNER RH, MALINCHOC M, et al. A model to predict survival in patients with end-stage liver disease[J]. Hepatology, 2001, 33(2): 464-470. DOI: 10.1053/jhep.2001.22172. [9] RUF AE, KREMERS WK, CHAVEZ LL, et al. Addition of serum sodium into the MELD score predicts waiting list mortality better than MELD alone[J]. Liver Transpl, 2005, 11(3): 336-343. DOI: 10.1002/lt.20329. [10] FASOLATO S, ANGELI P, DALLAGNESE L, et al. Renal failure and bacterial infections in patients with cirrhosis: Epidemiology and clinical features[J]. Hepatology, 2007, 45(1): 223-229. DOI: 10.1002/hep.21443. [11] PIANO S, BARTOLETTI M, TONON M, et al. Assessment of Sepsis-3 criteria and quick SOFA in patients with cirrhosis and bacterial infections[J]. Gut, 2018, 67(10): 1892-1899. DOI: 10.1136/gutjnl-2017-314324. [12] SHIZUMA T. Spontaneous bacterial and fungal peritonitis in patients with liver cirrhosis: A literature review[J]. World J Hepatol, 2018, 10(2): 254-266. DOI: 10.4254/wjh.v10.i2.254. [13] SCHWABL P, BUCSICS T, SOUCEK K, et al. Risk factors for development of spontaneous bacterial peritonitis and subsequent mortality in cirrhotic patients with ascites[J]. Liver Int, 2015, 35(9): 2121-2128. DOI: 10.1111/liv.12795. [14] WANG Y, ZHANG Q. Analysis of risk factors for patients with liver cirrhosis complicated with spontaneous bacterial peritonitis[J]. Iran J Public Health, 2018, 47(12): 1883-1890. [15] WANG X, WANG BM, JIANG K, et al. The predictive value of end-stage liver disease model for spontaneous bacterial peritonitis in cirrhotic patients with ascites[J]. Chin J Intern Med, 2009, 48(8): 629-632. DOI: 10.3760/cma.j.issn.0578-1426.2009.08.005.王鑫, 王邦茂, 姜葵, 等. 终末期肝病模型对肝硬化腹水患者并发自发性腹膜炎的预测价值[J]. 中华内科杂志, 2009, 48(8): 629-632. DOI: 10.3760/cma.j.issn.0578-1426.2009.08.005. [16] CHEN PC, CHEN BH, HUANG CH, et al. Integrated model for end-stage liver disease maybe superior to some other model for end-stage liver disease-based systems in addition to Child-Turcotte-Pugh and albumin-bilirubin scores in patients with hepatitis B virus-related liver cirrhosis and spontaneous bacterial peritonitis[J]. Eur J Gastroenterol Hepatol, 2019, 31(10): 1256-1263. DOI: 10.1097/MEG.0000000000001481. [17] GOYAL SK, DIXIT VK, JAIN AK, et al. Assessment of the model for end-stage liver disease (MELD) score in predicting prognosis of patients with alcoholic hepatitis[J]. J Clin Exp Hepatol, 2014, 4(1): 19-24. DOI: 10.1016/j.jceh.2014.02.006. [18] ABU RAHMA MZ, MAHRAN ZG, SHAFIK EA, et al. The role of serum procalcitonin level as an early marker of ascitic fluid infection in post hepatitic cirrhotic patients[J]. Antiinflamm Antiallergy Agents Med Chem, 2021, 20(1): 61-67. DOI: 10.2174/1871523019666200303104932. [19] HU DC, DU L, CAO CH, et al. Serum procalcitonin and C-reactive protein levels in predicting spontaneous bacterial peritonitis in patients with decompensated liver cirrhosis[J]. J Prac Hepatol, 2020, 23(5): 699-702. DOI: 10.3969/j.issn.1672-5069.2020.05.024.扈登财, 杜莉, 曹成红, 等. 血清降钙素原和C-反应蛋白水平预测肝硬化患者发生自发性细菌性腹膜炎的价值分析[J]. 实用肝脏病杂志, 2020, 23(5): 699-702. DOI: 10.3969/j.issn.1672-5069.2020.05.024. [20] CHEN SS, YAN HX, DU JP, et al. Association between Albumin-Bilirubin (ALBI) score and the relapse of autoimmune hepatitis[J]. J Med Res, 2019, 48(3): 70-76. DOI: 10.11969/j.issn.1673-548X.2019.03.017.陈帅帅, 颜海希, 杜菊萍, 等. 白蛋白-胆红素(ALBI)评分与自身免疫性肝炎复发的相关性[J]. 医学研究杂志, 2019, 48(3): 70-76. DOI: 10.11969/j.issn.1673-548X.2019.03.017. [21] CHEN RC, CAI YJ, WU JM, et al. Usefulness of albumin-bilirubin grade for evaluation of long-term prognosis for hepatitis B-related cirrhosis[J]. J Viral Hepat, 2017, 24(3): 238-245. DOI: 10.1111/jvh.12638. [22] CHAN AW, CHAN RC, WONG GL, et al. New simple prognostic score for primary biliary cirrhosis: Albumin-bilirubin score[J]. J Gastroenterol Hepatol, 2015, 30(9): 1391-1396. DOI: 10.1111/jgh.12938. 期刊类型引用(19)
1. 赵敏,李慧,郝丽,谭风雷. 微生态制剂治疗肝硬化并发细菌性腹膜炎疗效观察. 新乡医学院学报. 2025(03): 219-224 .  百度学术
百度学术2. 何艳婷,苏有盛,叶宇龙. ALBI联合NLR预测肝硬化合并食管胃底静脉曲张破裂出血的作用. 广州医药. 2025(03): 387-392 .  百度学术
百度学术3. 周嘉敏,唐源,李红纳. ALBI、NLR、CRP联合诊断肝硬化合并细菌性腹膜炎的临床价值. 云南医药. 2024(01): 65-68 .  百度学术
百度学术4. 李贝贝,李红. 肝硬化合并自发性细菌性腹膜炎病原学及危险因素分析. 胃肠病学和肝病学杂志. 2024(02): 223-227+232 .  百度学术
百度学术5. 谭人杰,徐佳丽,孙长峰,吴刚. 肝硬化腹水并发自发性细菌性腹膜炎的临床危险因素分析及诊断模型构建. 重庆医学. 2024(06): 872-876+882 .  百度学术
百度学术6. 谢锐,尹源,滕俊,梁红亮. 腹水中免疫细胞变化特征对肝硬化腹水患者发生自发性细菌性腹膜炎的预测价值. 中西医结合肝病杂志. 2024(03): 219-224 .  百度学术
百度学术7. 汤亚君,单亚林. 乙型肝炎肝硬化并发自发性肠球菌性腹膜炎的临床特征及其影响因素. 肝脏. 2024(05): 508-511 .  百度学术
百度学术8. 刘志慧,牛兴杰,张建华. 血清IL-12、IL-18、CRP联合检测对肝硬化并发自发性细菌性腹膜炎患者预后的评估价值. 中国肝脏病杂志(电子版). 2024(02): 1-6 .  百度学术
百度学术9. 钟汉,黄海华,詹先峰. 托拉塞米与呋塞米对肝硬化腹水患者利尿引起的低钾血症风险对比研究. 医学信息. 2024(22): 22-25 .  百度学术
百度学术10. 徐双双,刘美霞. 肝硬化并腹水患者血清胆红素、转氨酶表达水平的临床意义分析. 现代诊断与治疗. 2024(22): 3419-3421 .  百度学术
百度学术11. 许娟,闫涛涛,李严锋,侯静涛,樊研. ALBI评分联合PCT在肝硬化腹水患者自发性细菌性腹膜炎的预测作用. 胃肠病学和肝病学杂志. 2023(01): 85-89 .  百度学术
百度学术12. 范依静,楼晓军,吴雨林. 白蛋白-胆红素评分在肝硬化中的研究进展. 中国现代医生. 2023(07): 112-116 .  百度学术
百度学术13. 朱敏,王燕,赵冉,章瑶,谭学明. 肝硬化伴医院感染碳青霉烯类耐药肠杆菌目细菌自发性细菌性腹膜炎病情转归预测模型及预测效能. 中国感染与化疗杂志. 2023(04): 449-454 .  百度学术
百度学术14. 李虤,徐华栋,易清平,胡小雄. 血小板压积、血清白细胞、血小板计数水平联合检测对肝硬化合并自发性腹膜炎早期诊断的价值. 中国医学创新. 2023(33): 63-66 .  百度学术
百度学术15. 贾冬青,时秀云. 血清降钙素原、凝血因子联合C-反应蛋白检验诊断肝硬化并发自发性细菌性腹膜炎的价值分析. 系统医学. 2023(24): 52-55 .  百度学术
百度学术16. 吴雪,张依恋,李萍,宓余强. 2型糖尿病及空腹胰岛素水平对肝硬化腹水患者发生自发性细菌性腹膜炎的影响. 临床肝胆病杂志. 2022(07): 1548-1553 .  本站查看
本站查看17. 项志雄,宁国强,邓辉球,舒宏春,杨静. PCT、hs-CRP、IL-4诊断及评估肝硬化失代偿期自发性细菌性腹膜炎的效能. 中华医院感染学杂志. 2022(15): 2254-2258 .  百度学术
百度学术18. 赵红霞. HBV感染肝硬化220例患者疾病转归的相关影响因素研究. 医药论坛杂志. 2022(24): 68-71 .  百度学术
百度学术19. 崔小玲,黄义泽,蔡文婕,袁园,谭祝利. 腹水降钙素原及乳铁蛋白在肝硬化合并自发性腹膜炎中的临床价值研究. 系统医学. 2022(24): 59-62+71 .  百度学术
百度学术其他类型引用(3)
-




 PDF下载 ( 2106 KB)
PDF下载 ( 2106 KB)

 下载:
下载:

 下载:
下载:
 百度学术
百度学术


