Association of inosine triphosphate pyrophosphatase gene polymorphisms with ribavirin combined with direct-acting antiviral agent in treatment of hepatitis C patients with hemolytic anemia
-
摘要:
目的 探讨慢性丙型肝炎治疗过程中利巴韦林(RBV)引起溶血性贫血的影响因素,为临床早期预测利巴韦林相关溶血性贫血发生提供借鉴。 方法 选取2018年1月—2019年7月于河北中石油中心医院门诊及住院就诊的丙型肝炎且应用直接抗病毒药物(DAA)联合RBV方案抗病毒治疗患者。三磷酸次黄嘌呤肌苷(ITPA)基因rs1127354位点主要等位基因是C等位基因,次要等位基因为A等位基因,将AA与AC合并与CC基因型进行比较。在治疗过程中,当Hb水平<100 g/L时,RBV减量至600 mg;当Hb<85 g/L时停用RBV治疗。在抗病毒治疗前进行血常规、肝功能、肝脏硬度值、HCV RNA、HCV病毒基因型及ITPA基因型检测,在2、4、8、12周对患者进行血常规检测。不符合正态分布的计量资料组间比较采用Mann-Whitney U检验。 结果 本研究共纳入病例49例,慢性丙型肝炎患者22例,肝硬化27例,持续病毒学应答率为95.9%。因贫血RBV减量者3例(其中AA/AC组2例,CC组1例),停药3例(其中AA/AC组1例,CC组2例),均为肝硬化患者,6例患者最终均达到持续病毒学应答。DAA+RBV抗HCV治疗过程中,RBV相关溶血的发生较轻微,AA/AC型与CC型两组患者Hb较基线下降最大值比较差异无明显统计学意义(Z=-0.18,P=0.87)。 结论 本研究在RBV联合DAA治疗过程中,因为贫血RBV停药和减量的均为肝硬化患者,ITPA基因型与患者Hb较基线下降最大值无明显统计学关系,故在应用RBV前进行ITPA基线检测未能增加治疗过程中的安全性,因此不建议进行常规的ITPA基因多态性检测。 Abstract:Objective To investigate the influencing factors for ribavirin (RBV)-induced hemolytic anemia in the treatment of chronic hepatitis C, and to provide a reference for the early prediction of ribavirin-related hemolytic anemia in clinical practice. Methods A total of 49 patients with chronic hepatitis C who attended or were hospitalized in Hebei Petrochina Central Hospital from January 2018 to July 2019 and received antiviral therapy with direct-acting antiviral agent (DAA) and RBV were enrolled, with a major allele of C allele and a minor allele of A allele at the rs1127354 locus of the inosine triphosphate pyrophosphatase (ITPA) gene, and the patients with AA and AC genotypes were compared with those with CC genotype. During treatment, RBV was reduced to 600 mg when hemoglobin (Hb) level was < 100 g/L and was withdrawn when Hb level was < 85 g/L. Routine blood test, liver function, liver stiffness measurement, HCV RNA, HCV genotype, and ITPA genotype were measured before antiviral therapy, and the routine blood test was performed at weeks 2, 4, 8, and 12 of treatment. The Mann-Whitney U test was used for comparison of non-normally distributed continuous data between groups. Results A total of 49 patients were enrolled in this study, among whom 22 had chronic hepatitis C and 27 had liver cirrhosis, with a sustained virologic response (SVR) rate of 95.9%. The dose of RBV was reduced in 3 patients (2 in the AA/AC group and 1 in the CC group) due to anemia, and RBV was withdrawn in 3 patients (1 in the AA/AC group and 2 in the CC group); all these 6 patients had liver cirrhosis and finally achieved SVR. During the anti-HCV therapy with DAA+RBV, there was relatively mild RBV-related hemolysis, and the maximum reduction in Hb from baseline was compared between the patients with AA/AC genotype at ITPA rs1127354 and those with CC genotype, which showed no significant difference between the two groups (Z=-0.18, P=0.87). Conclusion During the treatment with RBV+DAA, RBV is withdrawn or reduced for liver cirrhosis patients due to anemia, and no obvious statistical relation is observed between ITPA genotype and the maximum reduction in Hb from baseline. Therefore, detection of ITPA genotype before the application of RBV does not improve safety during treatment, and it is not recommended to perform conventional detection of ITPA gene polymorphisms. -
Key words:
- Hepatitis C, Chronic /
- Anemia, Hemolytic /
- Ribavirin /
- Risk Factors
-
近几年,慢性丙型肝炎的抗病毒治疗已经从干扰素+利巴韦林(RBV)时代跃进到全口服直接抗病毒药物(DAA)时代。在某些特殊丙型肝炎人群,全口服抗病毒方案仍然需要加用RBV以提高疗效或缩短疗程,例如失代偿期肝硬化、基因3型、全口服药物治疗失败,以及预期治疗效果不佳的患者[1]。RBV在成功清除HCV治疗中发挥重要作用。然而应用RBV的部分患者可引起溶血性贫血,从而被迫减量或停用,导致疗效降低或疗程延长及费用增加。已经明确,在以干扰素联合RBV为基础的丙型肝炎治疗中三磷酸次黄嘌呤肌苷(inosine triphosphate pyrophosphatase,ITPA)rs1127354位点基因多态性与贫血发生密切相关,CC基因型较非CC基因型(CA/AA)更易发生贫血[2]。RBV引起贫血的机制目前不是完全清楚,可能的机制是RBV被摄入红细胞并被活化为RBV三磷酸盐,由于红细胞缺乏脱磷酸化的酶,从而不能水解三磷酸盐,导致RBV三磷酸盐在红细胞内浓度不断累积,损害抗氧化剂的防御作用,造成可逆性溶血性贫血。但是由于DAA应用时间较短,尚无更多经验,基于DAA治疗的高昂花费,在治疗前明确DAA+RBV治疗中贫血发生的危险因素有助于提高疗效和节约经费,制订更加安全有效的治疗方案。
1. 资料与方法
1.1 研究对象
选取2018年1月—2019年7月于河北中石油中心医院门诊及住院就诊的慢性丙型肝炎(CHC)及丙型肝炎肝硬化且应用DAA联合RBV方案抗病毒治疗的患者,其诊断及治疗适应证根据《丙型肝炎防治指南(2015年更新版)》[3]。入选标准:HCV感染超过6个月,或有6个月以上的流行病学史,或发病日期不明;抗HCV及HCV RNA阳性;代偿期或失代偿期肝硬化;采用DAA+RBV方案治疗,至少12周。排除标准:未遵嘱服药及更换治疗方案患者;随访缺失患者。
1.2 治疗方案
采用RBV联合DAA抗病毒治疗,DAA治疗方案:索磷布韦/维帕他韦(含索磷布韦400 mg、维帕他韦100 mg)1片,1次/d,口服(早晨);或索磷布韦/雷迪帕韦(含索磷布韦400 mg、雷迪帕韦90 mg)1片,1次/d,口服(早晨),疗程均为12周。RBV治疗方案:体质量<75 kg,RBV 1000 mg/d(早晨服用5粒,傍晚服用5粒);体质量≥75 kg,RBV 1200 mg/d(早晨服用6粒,傍晚服用6粒)。所有患者均于抗病毒开始前及治疗2、4、8、12周清晨抽取空腹静脉血进行检测。在治疗过程中,当Hb水平<100 g/L时,RBV减量至600 mg;当Hb<85 g/L时停用RBV治疗。
1.3 主要材料及仪器
应用西安天隆科技有限公司荧光检测仪RT-Cycler TM 436/TL998A(V2.0.711软件系统)检测ITPA rs1127354位点基因型,检测方法按说明书进行;HCV RNA检测试剂盒(罗氏分子系统,美国);血球为日本SYSMEX(希森美康)XN系列;应用TL998A基因扩增荧光检测仪检测HCV基因型,检测方法按说明书进行。
1.4 伦理学审查
本研究通过河北中石油中心医院医学伦理委员会审批,批号:KYLL-2019-11,患者及家属均签署知情同意书。
1.5 统计学方法
应用SPSS 16.0软件进行统计分析。符合正态分布的计量资料以x±s表示;不符合正态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
共入选符合标准病例55例,其中未能完成抗病毒治疗及未按要求随访者6例,从本研究中剔除,本组共纳入49例患者,一般资料详见表 1。CHC患者22例(44.9%),肝硬化27例(55.1%),其中代偿期肝硬化17例(34.7%),失代偿期肝硬化10例(20.4%)。
表 1 DAA+RBV治疗的丙型肝炎患者基线临床资料指标 数值 男性[例(%)] 22(44.9) 年龄(岁) 58.6±8.1 ITPA基因型[例(%)] AA 1(2.0) AC 9(18.4) CC 39(79.6) HCV RNA基因分型[例(%)] 1b 35(71.4) 2a 6(12.2) 分型失败 8(16.3) WBC(×109/L) 3.7(2.9~5.4) NEU(×109/L) 2.3(1.5~2.9) RBC(×1012/L) 4.7±0.4 Hb(g/L) 126.9±19.8 PLT(×109/L) 96.0(63.3~137.8) ALT(U/L) 27.7(20.6~37.8) AST(U/L) 40.7(29.4~61.2) GGT(U/L) 44.9(28.1~71.7) 白蛋白(g/L) 38.4±4.6 PT(s) 14.1±1.4 INR 1.1±0.1 HCV RNA log值 5.7±1.5 MELD评分 3.8(1.9~5.2) Child分级[例(%)] A级(5~6) 17(34.7) B级(7~10) 10(20.4) SVR12[例(%)] 47(95.9) CHC 22/22(100.0) 代偿期肝硬化 16/17(94.1) 失代偿期肝硬化 9/10(90.0) 本组均应用DAA+RBV方案抗病毒治疗,其中索磷布韦/维帕他韦38例(77.6%),索磷布韦/雷迪帕韦11例(224%),1例患者因肝细胞癌未完成DAA疗程,于治疗12周退出研究,RBV减量患者抗病毒治疗不变仍为12周,停药患者延长抗病毒治疗至24周。总体12周持续病毒学应答(SVR12)率为95.9%(表 1),其中1例失代偿期肝硬化患者因并发肝细胞癌未完成抗病毒治疗,未实现SVR12;1例代偿期肝硬化患者于治疗8周开始HCV RNA持续未检测到,治疗12周停药,停药后12周再次检测到HCV RNA。
因贫血RBV减量者3例(其中AA/AC组2例,CC组1例),停药3例(其中AA/AC组1例,CC组2例),以上RBV停药、减量病例均为肝硬化患者,停药/减量共6例患者最终均达到SVR。
2.2 RBV停药、减量患者的Hb情况
在治疗过程中2例Hb<100 g/L且≥85 g/L给予RBV减量至600 mg/d,Hb没有回升且<85 g/L时RBV停用,1例因明显的头晕、心悸于治疗4周停用RBV,停用RBV后抗病毒治疗疗程延长至24周(表 2)。
表 2 3例RBV停药患者的ITPA基因型及Hb变化情况ITPA基因型 基线 2周 4周 8周 12周 CC 110 80 81 93 109 CC 64 95 92 88 91 AC 116 125 84 100 98 在治疗过程中3例出现Hb<100 g/L且≥ 85 g/L,给予RBV减量至600 mg/d,Hb保持≥85 g/L,RBV继续应用600 mg/d至疗程结束(表 3)。
表 3 3例RBV减量药患者的ITPA基因型及Hb变化情况ITPA基因型 基线 2周 4周 8周 12周 CC 129 - 91 95 114 AC 120 - 91 95 114 AC 98 162 105 97 104 2.3 ITPA(rs1127354)基因型与Hb下降的关系
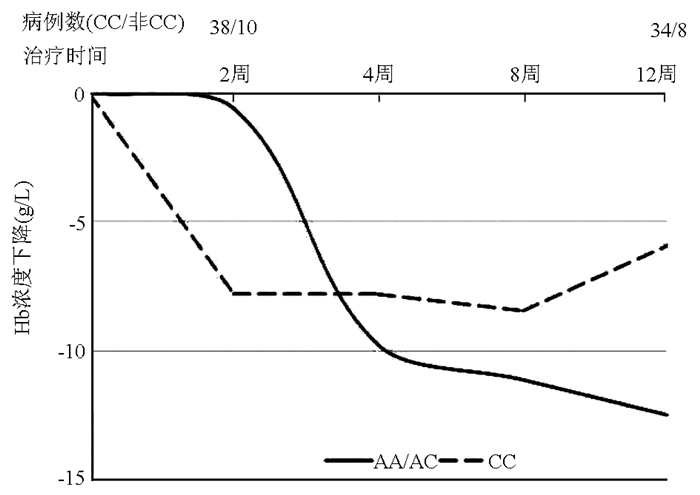
ITPA基因rs1127354位点主要等位基因是C等位基因,次要等位基因为A等位基因,将AA与AC合并与CC基因型进行比较,2、4、8、12周分别有1、4、8、7例患者未进行随访(图 1)。比较AA/AC型与CC型两组患者Hb较基线下降最大值的关系,结果显示两组差异无明显统计学意义(Z=-0.18,P=0.87)。
3. 讨论
丙型肝炎是由HCV引起的肝脏急、慢性炎症。丙型肝炎呈全球性流行,不同性别、年龄、种族、民族人群均对HCV易感。目前,全球有超过1.85亿HCV慢性感染者,感染者可能在20~30年内发展为肝硬化和肝细胞癌,每年有超过35万人死于HCV相关疾病[1]。有效的抗病毒治疗可改善肝组织学,清除或减轻HCV相关肝损伤,逆转肝纤维化,阻止进展为肝硬化、失代偿期肝硬化、肝衰竭或肝细胞癌,提高患者的长期生存率与生活质量,预防HCV传播。丙型肝炎抗病毒治疗的目标是清除HCV,实现SVR,获得治愈,清除或减轻HCV相关肝损伤,阻止其进展,改善患者的长期生存率,提高患者的生活质量[2]。
近10年来,丙型肝炎的治疗依赖于干扰素联合RBV,近2年DAA的出现提高了SVR率,然而在非常难治型患者(失代偿期肝硬化及DAA经两次经治复发者)、基因3型或某些代偿期肝硬化患者的DAA方案中仍然需要加用RBV以缩短疗程或提高疗效[3-4]。RBV在丙型肝炎抗病毒治疗中不可或缺,但是由于其副作用限制了其临床应用,特别是诱发溶血性贫血的副作用。10%~14%的患者因严重贫血需要减少RBV的剂量和/或缩短疗程,从而影响抗病毒治疗效果。
在干扰素联合RBV抗HCV治疗过程中, 主要的血液系统副反应为RBV引起的溶血性贫血和干扰素诱导的骨髓毒性[5-6],需要在早期调整RBV的剂量,影响病毒学应答。2010年,美国Fellay等[7]在全基因组关联研究中发现, 在干扰素联合RBV抗HCV治疗中,RBV诱发贫血与否及严重程度与患者ITPA基因功能性单核苷酸多态性有关。近几年多项研究[8-11]表明,ITPA基因rs1127354位点基因多态性与治疗中的溶血性贫血的发生相关。可见,在丙型肝炎PR方案抗病毒治疗过程中,ITPA基因rs1127354位点基因多态性可用来预测丙型肝炎患者PR治疗后引起的溶血性贫血。
DAA刚刚于我国上市不久,DAA+RBV治疗的患者出现贫血的风险尚不明确,有研究表明,即使是部分肝硬化患者在治疗前已经存在贫血,接受索拉非尼+RBV治疗后的ITPA基因AA/AC患者较少需要RBV剂量减低。Murakawa等[12]入选90例CHC基因2型的患者进行索拉非尼+RBV抗病毒治疗,发现具有ITPA基因rs1127354位点AA/AC基因型的患者在整个治疗期间贫血程度比CC基因型轻,AA/ AC基因型患者较CC基因型患者需要RBV剂量减少的患者百分比显著降低[38.5%(25/65)vs 8%(2/25),P=0.004 5]。Suzuki等[13]在基于61例CHC基因1型的患者的三联疗法治疗(telaprevir+干扰素+RBV) 中研究发现,ITPA基因rs1127354位点基因多态性影响抗病毒治疗期间的Hb水平。Morio等[14]在对212例基因1型CHC患者的研究中发现,在接受DAA加聚乙二醇干扰素/RBV三联疗法治疗时,Hb水平的降低更快且更大,并且ITPA基因型CC患者中RBV剂量减少的患者的累积比例显著高于AA/AC患者(84.7% vs 100%, P=0.018)。而Urabe等[15]的研究表明RBV相关溶血同时与ITPA基因型及肾小球过滤共同相关,肾小球滤过率≥75 ml·min-1·1.73 m-2病例组较肾小球滤过率<75 ml·min-1·1.73 m-2的病例组抗病毒治疗12周过程中更容易出现Hb水平显著下降(P<0.05)。
本研究结果提示,在RBV联合DAA治疗过程中,因为贫血停药和减量RBV的患者仍然存在。但是由于在CC型和非CC型均存在,并且80%以上的患者是CC型,因此在应用RBV前进行ITPA基线检测未能增加治疗过程中的安全性,仍需要进行Hb的监测。因此,不建议进行常规的ITPA基因多态性检测。
-
表 1 DAA+RBV治疗的丙型肝炎患者基线临床资料
指标 数值 男性[例(%)] 22(44.9) 年龄(岁) 58.6±8.1 ITPA基因型[例(%)] AA 1(2.0) AC 9(18.4) CC 39(79.6) HCV RNA基因分型[例(%)] 1b 35(71.4) 2a 6(12.2) 分型失败 8(16.3) WBC(×109/L) 3.7(2.9~5.4) NEU(×109/L) 2.3(1.5~2.9) RBC(×1012/L) 4.7±0.4 Hb(g/L) 126.9±19.8 PLT(×109/L) 96.0(63.3~137.8) ALT(U/L) 27.7(20.6~37.8) AST(U/L) 40.7(29.4~61.2) GGT(U/L) 44.9(28.1~71.7) 白蛋白(g/L) 38.4±4.6 PT(s) 14.1±1.4 INR 1.1±0.1 HCV RNA log值 5.7±1.5 MELD评分 3.8(1.9~5.2) Child分级[例(%)] A级(5~6) 17(34.7) B级(7~10) 10(20.4) SVR12[例(%)] 47(95.9) CHC 22/22(100.0) 代偿期肝硬化 16/17(94.1) 失代偿期肝硬化 9/10(90.0) 表 2 3例RBV停药患者的ITPA基因型及Hb变化情况
ITPA基因型 基线 2周 4周 8周 12周 CC 110 80 81 93 109 CC 64 95 92 88 91 AC 116 125 84 100 98 表 3 3例RBV减量药患者的ITPA基因型及Hb变化情况
ITPA基因型 基线 2周 4周 8周 12周 CC 129 - 91 95 114 AC 120 - 91 95 114 AC 98 162 105 97 104 -
[1] LAVANCHY D. The global burden of hepatitis C[J]. Liver Int, 2009, 29 Suppl 1: 74-81. DOI: 10.1111/j.1478-3231.2008.01934.x. [2] BUNCHORNTAVAKUL C, MANEERATTANAPORN M, CHAVALITDHAMRONG D. Management of patients with hepatitis C infection and renal disease[J]. World J Hepatol, 2015, 7(2): 213-225. [3] Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for hepatitis C: A 2015 update[J]. J Clin Hepatol, 2015, 31(12): 1961-1979. DOI: 10.3969/j.issn.1001-5256.2015.12.003.中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015, 31(12): 1961-1979. DOI: 10.3969/j.issn.1001-5256.2015.12.003. [4] RAO HY, WEI L. EASL recommendations on treatment of Hepatitis C 2015[J]. J Clin Hepatol, 2015, 31(7): 1008-1017. DOI: 10.3969/j.issn.1001-5256.2015.07.004.饶慧瑛, 魏来. 2015年欧洲肝病学会丙型肝炎治疗推荐意见[J]. 临床肝胆病杂志, 2015, 31(7): 1008-1017. DOI: 10.3969/j.issn.1001-5256.2015.07.004. [5] XU JF, ZHANG XH, LIU YL, et al. Influencing factors for hemolytic anemia in patients with chronic hepatitis C treated by ribavirin combined with pegylated interferon-α[J]. J Clin Hepatol, 2019, 35(2): 319-322. DOI: 10.3969/j.issn.1001-5256.2019.02.015.徐金凤, 张晓慧, 柳雅立, 等. 利巴韦林联合聚乙二醇干扰素α治疗慢性丙型肝炎发生相关溶血性贫血的影响因素分析[J]. 临床肝胆病杂志, 2019, 35(2): 319-322. DOI: 10.3969/j.issn.1001-5256.2019.02.015. [6] CHENG YQ, ZHAO P, WANG XF. Research advances in the anti-HCV mechanism of ribavirin[J]. Foreign Med Sci(Epidemiol Loimol), 2003, 30(3): 156-160. https://www.cnki.com.cn/Article/CJFDTOTAL-GWLX200303010.htm程勇前, 赵平, 王晓峰. 利巴韦林抗HCV作用机制研究进展[J]. 国外医学(流行病学传染病学分册), 2003, 30(3): 156-160. https://www.cnki.com.cn/Article/CJFDTOTAL-GWLX200303010.htm [7] FELLAY J, THOMPSON AJ, GE D, et al. ITPA gene variants protect against anaemia in patients treated for chronic hepatitis C[J]. Nature, 2010, 464(7287): 405-408. DOI: 10.1038/nature08825. [8] OCHI H, MAEKAWA T, ABE H, et al. ITPA polymorphism affects ribavirin-induced anemia and outcomes of therapy-a genome-wide study of Japanese HCV virus patients[J]. Gastroenterology, 2010, 139(4): 1190-1197. DOI: 10.1053/j.gastro.2010.06.071. [9] MATSUURA K, TANAKA Y, WATANABE T, et al. ITPA genetic variants influence efficacy of PEG-IFN/RBV therapy in older patients infected with HCV genotype 1 and favourable IL28B type[J]. J Viral Hepat, 2014, 21(7): 466-474. DOI: 10.1111/jvh.12171. [10] RAU M, STICKEL F, RUSSMANN S, et al. Impact of genetic SLC28 transporter and ITPA variants on ribavirin serum level, hemoglobin drop and therapeutic response in patients with HCV infection[J]. J Hepatol, 2013, 58(4): 669-675. DOI: 10.1016/j.jhep.2012.11.027. [11] CLARK PJ, AGHEMO A, DEGASPERI E, et al. Inosine triphosphatase deficiency helps predict anaemia, anaemia management and response in chronic hepatitis C therapy[J]. J Viral Hepat, 2013, 20(12): 858-866. DOI: 10.1111/jvh.12113. [12] MURAKAWA M, ASAHINA Y, NAGATA H, et al. ITPA gene variation and ribavirin-induced anemia in patients with genotype 2 chronic hepatitis C treated with sofosbuvir plus ribavirin[J]. Hepatol Res, 2017, 47(11): 1212-1218. DOI: 10.1111/hepr.12867.URABEA. [13] SUZUKI F, SUZUKI Y, AKUTA N, et al. Influence of ITPA polymorphisms on decreases of hemoglobin during treatment with pegylated interferon, ribavirin, and telaprevir[J]. Hepatology, 2011, 53(2): 415-421. DOI: 10.1002/hep.24058. [14] MORIO K, IMAMURA M, KAWAKAMI Y, et al. ITPA polymorphism effects on decrease of hemoglobin during sofosbuvir and ribavirin combination treatment for chronic hepatitis C[J]. J Gastroenterol, 2017, 52(6): 746-753. DOI: 10.1007/s00535-016-1279-9. [15] URABE A, SAKAMORI R, TAHATA Y, et al. Predictive factors of anemia during sofosbuvir and ribavirin therapy for genotype 2 chronic hepatitis C patients[J]. Hepatol Res, 2019, 49(8): 853-859. DOI: 10.1111/hepr.13354. 期刊类型引用(1)
1. 郑玲玲,孟银梅,刘南南,叶小欣,马珺珺,李铭,李卫. 阜阳市丙型病毒性肝炎流行病学特点及疾病进展影响因素. 实用临床医药杂志. 2022(12): 61-64 .  百度学术
百度学术其他类型引用(0)
-




 PDF下载 ( 1925 KB)
PDF下载 ( 1925 KB)

 下载:
下载:


 下载:
下载:
 百度学术
百度学术