Mechanism of action of Fuzheng Huayu prescription in treatment of liver cancer based on network pharmacology
-
摘要:
目的 运用网络药理学方法,探讨扶正化瘀(FZHY)方治疗肝癌的作用机制。 方法 从TCMSP、BATMAN、Drugbank数据库检索该方各味药的主要化学成分及相应靶标信息,采用STRING数据库进行PPI网络分析,Cytoscape软件构建药物-疾病网络模型并进行网络分析,R语言进行靶标功能GO和KEGG富集分析。 结果 研究筛选得到FZHY与肝癌交集基因192个,潜在化合物95种,其中槲皮素、木犀草素等是起到重要调控作用的活性成分; INS、IL-6、EGFR等是FZHY潜在作用的关键靶点; GO富集分析主要涉及药物反应、氧化反应等多个生物过程,KEGG富集分析主要涉及细胞凋亡、肿瘤坏死因子等信号通路。 结论 基于网络药理学的方法揭示了FZHY多成分、多靶标治疗肝癌的初步作用机制,为临床和基础科研提供理论依据。 Abstract:Objective To investigate the mechanism of Fuzheng Huayu(FZHY) decoction in the treatment of liver cancer based on network pharmacology. Methods TCMSP, BATMAN, and Drugbank databases were searched for the main chemical components and corresponding targets of FZHY, and STRING database was used to perform a PPI network analysis. Cytoscape software was used to establish a drug-disease network model and perform a network analysis, and R language was used to perform GO and KEGG enrichment analysis of targets. Results A total of 192 intersection genes between FZHY and liver cancer and 95 potential compounds were screened out, among which quercetin and luteolin were the active components with an important regulatory role. INS, IL-6, and EGFR were the key targets for the potential effect of FZHY. The GO enrichment analysis showed the involvement in various biological processes such as response to drug and response to oxygen level, and the KEGG enrichment analysis showed the involvement in the signaling pathways including apoptosis and tumor necrosis factor signaling pathways. Conclusion Based on the method of network pharmacology, this study reveals the mechanism of action of multiple targets and targets of FZHY in the treatment of liver cancer, which provides a theoretical basis for clinical and basic scientific research. -
Key words:
- Liver Neoplasms /
- Fuzheng Huayu Decoction /
- Network Pharmacology
-
原发性肝癌(简称肝癌)包括肝细胞癌和肝内胆管细胞癌[1],其病死率居全世界恶性肿瘤第三位[2],我国每年肝癌死亡人数占全球肝癌死亡的51%[3]。肝癌往往起病隐匿、进展迅速、复发快、预后差[4],是危害人类健康的重大疾病。因此,对肝癌的防治是临床研究的重点。
扶正化瘀方(fuzheng huayu,FZHY)由丹参、冬虫夏草、桃仁、松花粉、绞股蓝、五味子6味药组成,适用于乙型肝炎肝纤维化属瘀血阻络,肝肾不足证者。本课题组前期工作[5]表明,该方可有效改善肝炎后肝硬化患者肝功能、改善肝组织炎症,并逆转肝纤维化;方中多味药及其不同化学成分在肝纤维化各个病理环节融对抗、保护、调节于一体,标本兼治。已有临床和基础研究表明,FZHY可以降低肝癌的恶性程度[6],防治实验性肝癌的发生率[7-9],然而其防治肝癌的活性成分以及潜在的作用机制尚不清楚。因此,基于中药复方多成分、多靶点、多途径发挥药理机制的作用特点,本研究以FZHY为载体,运用网络药理学方法,从分子网络水平系统探索该方多成分、多靶点与肝癌疾病间复杂网状关系,为后续实验研究提供线索。通过整合多个数据库信息收集整理FZHY的主要化学成分及其靶标信息、肝癌相关基因信息,构建FZHY治疗肝癌的成分-靶标网络,旨在通过网络分析解析FZHY治疗肝癌的作用机制,为临床和基础科研提供理论依据。
1. 材料与方法
1.1 搜索FZHY主要活性成分的作用靶点
FZHY中各味药的成分信息从TCMSP(https://tcmspw.com/tcmsp.php,数据更新至2020-12-20)、BATMAN(http://bionet.ncpsb.org/batman-tcm/,数据更新至2020-12-20)、Drugbank(https://go.drugbank.com/,数据更新至2020-12-20)等数据库中检索获得;各成分的靶标信息从TCMSP、Drugbank中获取,构建FZHY有效成分潜在的靶标群。方中各味药的归经信息从《中国药典》(2015年版)中获取。TCMSP数据库筛选过滤标准为:口服生物利用度(oral bioavailable, OB)≥30%且类药性(drug likeness, DL)≥0.18,获得FZHY多成分靶标基因。
1.2 提取肝癌相关基因
通过检索“Liver cancer”“Hepatic carcinoma”“Hepatoma”“Hepatocellular carcinoma”等关键词,从GeneCards人类基因数据库(https://www.genecards.org,数据更新至2020-12-20)、OMIM在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man, OMIM, https://omim.org,数据更新至2020-12-20)中搜索肝癌相关的基因,构建肝癌致病基因的靶点数据集,获得肝癌疾病靶标基因。
1.3 FZHY抗肝癌靶标网络的构建与分析
对FZHY多成分靶标基因和肝癌疾病靶标基因进行基因去重,绘制韦恩图,获得FZHY靶标群与肝癌的共有基因,并在STRING数据库(http://sring-db.org/)构建蛋白-蛋白互作关系(protein-protein interaction,PPI)分析。PPI分析模式限定为“Multiple proteins”,物种设定为“Homo Sapiens”,设置可信度≥0.7,隐藏孤立的蛋白,对数据进行分析后导出PPI网络图,再利用Cytoscape软件建立多成分-基因-疾病网络模型。
1.4 GO功能富集分析和KEGG通路富集分析
利用R语言中的“colorspace”“stringi”“ggplot2”“clusterProfiler”“enrichplot”“org.Hs.EG.db”包对FZHY有效成分潜在作用靶点进行功能注释(gene ontology, GO),即主要进行分子功能(molecular function,MF)、生物过程(biological process,BP)和细胞组成(cellular component,CC)3个部分的富集分析,并对相关基因进行KEGG通路富集分析,设定显著性为P<0.05。
1.5 成分-靶点-通路网络
结合FZHY抗肝癌的主要成分、核心靶点与KEGG分析所得通路,运用Cytoscape软件绘制成分-靶点-通路网络图,分析其整体关联。
2. 结果
2.1 FZHY包含的成分及对应靶标
FZHY由6味中药组成,根据OB≥30%和DL≥0.18筛选出中药包含的主要成分共142个。合并各成分的靶标基因,除去被多个成分共同调控的重复基因,获得197个药物靶标基因(表 1)。
表 1 FZHY包含化学成分的对应靶标数中药 数据库中名称 药材拉丁名 成分数 靶标数 丹参 丹参 Radix Salviae 65 2566 桃仁 桃仁 Persicae Semen 23 139 虫草菌丝 冬虫夏草 Corayceps 7 84 五味子 南五味子/北五味子 Schisandrae Sphenantherae Fructus/Schisandrae Chinensis Fructus 21 37 绞股蓝 绞股蓝 Gynostemmae Pentaphylli Herba 24 189 松花粉 松花粉 Pine Pollen 2 66 2.2 FZHY的靶标网络分析
分别以检索词“Liver cancer”“Hepatic carcinoma”“Hepatoma”“Hepatocellular carcinoma”在GeneCards和OMIM数据库中检索肝癌靶标基因,分别获得相应疾病相关基因数(表 2)。合并去除重复基因,共获得疾病相关基因17 869个。
表 2 在线数据库检索关键词及疾病相关基因数数据库检索关键词 疾病相关基因数 Liver cancer 16 815 Hepatic carcinoma 8971 Hepatoma 3729 Hepatocellular carcinoma 7543 2.3 FZHY成分-基因-肝癌疾病靶标基因网络分析
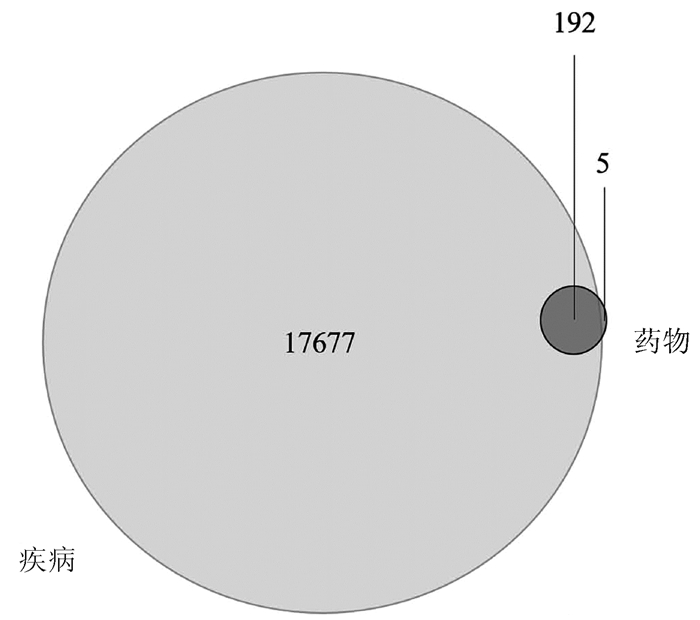
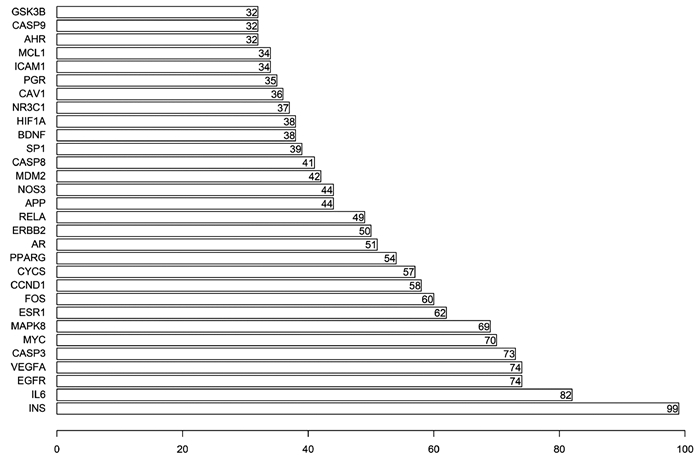
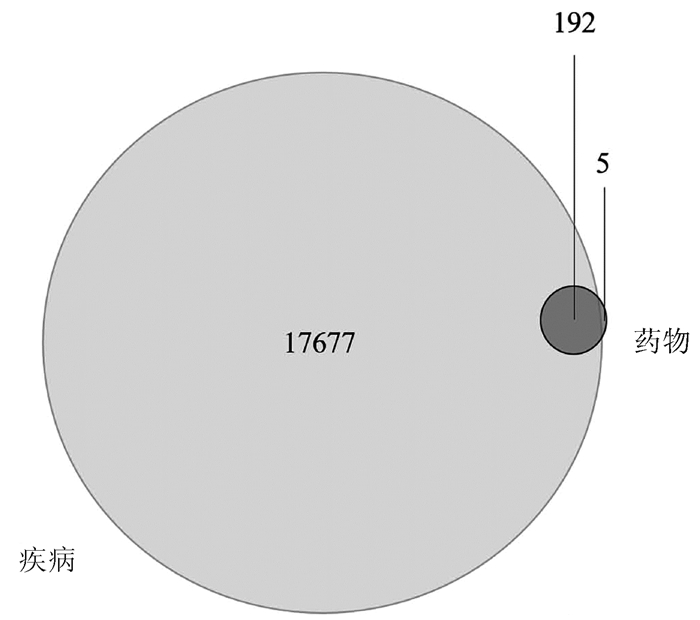
对FZHY多成分靶标基因和肝癌疾病靶标基因进行基因去重,绘制韦恩图,获得FZHY靶标群与肝癌靶标群的共有基因192个(药物-疾病靶标基因)(图 1)。利用Cytoscape软件构建FZHY有效成分-肝癌靶标基因网络图(附录1),得到FZHY治疗肝癌的潜在化合物有95种,其中与肝癌靶标基因连线最多为槲皮素和木犀草素(Mol ID: MOL000098、MOL000006),提示槲皮素和木犀草素是FZHY调控肝癌的重要活性成分。PPI网络分析药物- 疾病靶标基因间的关系(附录2),根据基因-基因连线数分析PPI网络核心基因,显示主要为INS、IL-6、EGFR等基因(图 2),提示这些靶标能被FZHY多味中药和多个成分共同调控,因此在靶标网络中可能具有更重要的影响。
2.4 网络模型中重要靶标生物功能分析
针对核心靶点进行GO-BP分析,确定靶蛋白具有显著性意义(P<0.05)的生物学过程主要涉及:对药物的反应、对氧水平的反应、对类固醇激素的反应、对缺氧的反应、对金属离子的反应、对氧水平降低的反应、对氧化应激的反应、细胞对化学应激的反应、对酮的反应、对营养物质的反应。GO-CC分析结果提示涉及的细胞组分主要有:突触后膜、膜筏、膜微域、膜区、突触膜、囊腔、分泌颗粒腔、细胞质囊腔、突触膜整体成分、突触后膜整体成分等。GO-MF分析结果提示涉及的分子功能主要有:DNA-结合转录因子结合、羧酸结合、有机酸结合、类固醇结合、神经递质受体活性、核受体活性、配体-激活转录因子活性、突触后神经递质受体活性、半胱氨酸-类型内肽酶活性参与凋亡过程、半胱氨酸-类型内肽酶活性参与凋亡信号通路等(附录3)。
对FZHY靶标网络中的关键基因进行KEGG信号通路富集分析,发现前50位信号通路有22条与肝癌密切相关,具体见表 3和附录4。
表 3 FZHY治疗肝癌关键靶标的KEGG富集通路通路ID 通路名称 靶标基因数 通路基因总数 调整后P值 hsa04210 细胞凋亡 20 174 2.14×10-9 hsa04668 肿瘤坏死因子信号通路 17 174 1.12×10-8 hsa05161 乙型肝炎 20 174 1.12×10-8 hsa04151 PI3K-AKT信号通路 27 174 2.24×10-7 hsa04215 细胞凋亡-多物种 9 174 4.02×10-7 hsa05160 丙型肝炎 17 174 7.72×10-7 hsa04115 53信号通路 12 174 7.72×10-7 hsa04066 HIF-1信号通路 14 174 1.25×10-6 hsa04010 MAPK信号通路 22 174 4.04×10-6 hsa05205 癌症中的蛋白聚糖 18 174 4.63×10-6 hsa01524 铂耐药 11 174 4.63×10-6 hsa05225 肝细胞癌 15 174 2.81×10-5 hsa04926 松弛素信号传导途径 13 174 3.04×10-5 hsa04657 IL-17信号通路 11 174 3.71×10-5 hsa01521 EGFR酪氨酸激酶抑制剂抵抗 10 174 4.84×10-5 hsa05206 癌症中的microRNA 20 174 7.15×10-5 hsa04064 NF-kappa B信号通路 11 174 8.53×10-5 hsa04625 C型凝集素受体信号通路 11 174 8.53×10-5 hsa04920 脂肪细胞因子信号通路 9 174 9.52×10-5 hsa05230 在癌症中的中枢碳代谢 9 174 1.05×10-4 hsa04932 非酒精性脂肪性肝病 13 174 1.16×10-4 hsa04068 FoxO信号通路 12 174 1.32×10-4 用Cytoscape软件构建FZHY治疗肝癌关键靶标与关键信号通路的网络图(附录5),发现肝癌22条关键信号通路与FZHY治疗肝癌的80个潜在靶点关系密切。
3. 讨论
在我国,肝癌是肝炎后肝硬化最常见的并发症[10],给患者和社会带来沉重的负担。尽管外科手术切除及肝移植、射频消融、介入治疗以及个性化化疗方案和靶向药物的应用使得肝癌患者获益良多,但复发仍是临床所面临的重大难题。对于难以手术切除肝癌的综合治疗方案,中西结合治疗是提高肝癌疗效的一个重要途径[11-12]。FZHY(制剂为胶囊或片剂)由丹参、桃仁、虫草菌丝、松花粉、五味子、绞股蓝组成,对肝炎后肝硬化具有良好的治疗效果[13],已有国内同行发表FZHY抗肝癌的相关临床与基础研究,但对于其抗肝癌的活性成分、作用靶点以及分子机制尚不完全明确。
本研究采用网络药理学方法从分子网络角度系统分析了FZHY对肝癌的潜在治疗机制,通过TCMSP平台,筛选得到FZHY活性成分142种,药物靶点基因197个;将FZHY对应的靶点与肝癌的疾病靶点基因取交集,获得交集基因192个,筛选得到潜在化合物95种,其中部分化合物抗肝癌的有效性及其药理机制已被证实,起到重要调控作用的活性成分有:槲皮素、木犀草素等。据报道,槲皮素抗肝癌的作用可能与其灭活caspase/Cyto-c通路、抑制AP-2β/hTERT、NF-κB/COX-2、阻断Akt/ERK1/2信号通路及竞争性抑制葡萄糖转运蛋白(GLUT-1)密切相关[14-15]; 木犀草素可通过TGFβ1、p53和Fas/FasL三条信号通路抑制肝癌细胞生长[16]。上述化合物位于FZHY治疗肝癌疾病-活性成分-靶基因网络的核心,可能在FZHY抗肝癌过程中起到重要作用。
进一步对活性成分靶点-信号通路网络进行分析,得到80个抗肝癌靶点,涉及22条信号通路。FZHY潜在作用的关键靶点有INS、IL-6、EGFR等;主要通过调控细胞凋亡、TNF等信号通路而抑制肝癌的发生和发展,并促进肝癌细胞凋亡等多途径、多靶点发挥作用。研究显示,胰岛素可促进肝癌细胞增殖和侵袭,抑制细胞的凋亡,其功能与Cleaved caspase 3、MMP-2、MMP-9蛋白表达及PI3K/AKT信号通路密切相关[17];IL-6在人肝细胞癌中的表达显著上调,与肝癌恶性进展呈正相关[18],其对肝癌的正向调节作用可能与其抑制miRNA-197的表达来调节STAT3总蛋白质的表达,继而促进p-STAT3的表达关系密切[19];文献报道,在29%~85%的肝癌组织中有EGFR过表达的现象[20],甚至有专家建议将EGFR作为肝癌治疗的靶点[21],其机制可能为EGF/EGFR通过PI3K/AKT信号通路磷酸化p300 Ser1834位点,促进组蛋白H3K9位点乙酰化,使DKK1的转录增加,进而导致肝癌细胞的转移[22]。
通过GO功能富集分析发现,FZHY对于肝癌的调控主要集中在DNA-结合转录因子结合、核受体结合等过程,提示FZHY可能通过抑制癌细胞增殖,诱导癌细胞凋亡而发挥作用。通过KEGG通路富集分析追踪FZHY治疗肝癌的代谢通路,并作FZHY治疗肝癌关键靶标的关键信号通路-基因网络图分析整体联系。结果发现,FZHY主要作用于细胞凋亡、TNF等信号通路。其中凋亡信号通路可以影响胰岛素的产生和释放[23-24],从而抑制肿瘤细胞增殖和侵袭能力,促进其凋亡。由此可知,FZHY可能可以通过上述途径发挥对肝癌的调控作用。
综上所述,本研究运用网络药理学技术手段探讨了FZHY活性成分与肝癌疾病及其相关基因的网状关联,通过研究该方多成分、多靶点、多途径作用机制,为进一步深入开展的实验研究提供了参考和线索。本课题组研究将围绕其抗肝癌药效物质及作用机制开展进一步基础与临床转化研究,以期开发出更适用于临床治疗肝癌的中药制剂。

-
表 1 FZHY包含化学成分的对应靶标数
中药 数据库中名称 药材拉丁名 成分数 靶标数 丹参 丹参 Radix Salviae 65 2566 桃仁 桃仁 Persicae Semen 23 139 虫草菌丝 冬虫夏草 Corayceps 7 84 五味子 南五味子/北五味子 Schisandrae Sphenantherae Fructus/Schisandrae Chinensis Fructus 21 37 绞股蓝 绞股蓝 Gynostemmae Pentaphylli Herba 24 189 松花粉 松花粉 Pine Pollen 2 66 表 2 在线数据库检索关键词及疾病相关基因数
数据库检索关键词 疾病相关基因数 Liver cancer 16 815 Hepatic carcinoma 8971 Hepatoma 3729 Hepatocellular carcinoma 7543 表 3 FZHY治疗肝癌关键靶标的KEGG富集通路
通路ID 通路名称 靶标基因数 通路基因总数 调整后P值 hsa04210 细胞凋亡 20 174 2.14×10-9 hsa04668 肿瘤坏死因子信号通路 17 174 1.12×10-8 hsa05161 乙型肝炎 20 174 1.12×10-8 hsa04151 PI3K-AKT信号通路 27 174 2.24×10-7 hsa04215 细胞凋亡-多物种 9 174 4.02×10-7 hsa05160 丙型肝炎 17 174 7.72×10-7 hsa04115 53信号通路 12 174 7.72×10-7 hsa04066 HIF-1信号通路 14 174 1.25×10-6 hsa04010 MAPK信号通路 22 174 4.04×10-6 hsa05205 癌症中的蛋白聚糖 18 174 4.63×10-6 hsa01524 铂耐药 11 174 4.63×10-6 hsa05225 肝细胞癌 15 174 2.81×10-5 hsa04926 松弛素信号传导途径 13 174 3.04×10-5 hsa04657 IL-17信号通路 11 174 3.71×10-5 hsa01521 EGFR酪氨酸激酶抑制剂抵抗 10 174 4.84×10-5 hsa05206 癌症中的microRNA 20 174 7.15×10-5 hsa04064 NF-kappa B信号通路 11 174 8.53×10-5 hsa04625 C型凝集素受体信号通路 11 174 8.53×10-5 hsa04920 脂肪细胞因子信号通路 9 174 9.52×10-5 hsa05230 在癌症中的中枢碳代谢 9 174 1.05×10-4 hsa04932 非酒精性脂肪性肝病 13 174 1.16×10-4 hsa04068 FoxO信号通路 12 174 1.32×10-4 -
[1] GE JB, XU YJ. Internal medicine[M]. 9th ed. Beijing: People's Medical Publishing House, 2018.葛均波, 徐永健. 内科学[M]. 第9版. 北京: 人民卫生出版社, 2018. [2] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): e359-e386. DOI: 10.1002/ijc.29210. [3] BERTUCCIO P, TURATI F, CARIOLI G, et al. Global trends and predictions in hepatocellular carcinoma mortality[J]. J Hepatol, 2017, 67(2): 302-309. DOI: 10.1016/j.jhep.2017.03.011. [4] National Health and Family Planning Commission of the People's Republic of China. Diagnosis, management, and treatment of hepatocellular carcinoma (V2017)[J]. J Clin Hepatol, 2017, 33(8): 1419-1431. DOI: 10.3969/j.issn.1001-5256.2017.08.003.中华人民共和国国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017年版)[J]. 临床肝胆病杂志, 2017, 33(8): 1419-1431. DOI: 10.3969/j.issn.1001-5256.2017.08.003. [5] LIU C, HU Y, XU L, et al. Effect of Fuzheng Huayu formula and its actions against liver fibrosis[J]. Chin Med, 2009, 4: 12. DOI: 10.1186/1749-8546-4-12. [6] LIU L, ZHANG HX, CHEN L, et al. Effect of Fuzheng Huayu decoction on the expression of MMP-3 and ESM-1 in patients with hepatocellular carcinoma[J]. China J Chin Med, 2019, 34(5): 1065-1069. DOI: 10.16368/j.issn.1674-8999.2019.05.252.刘莲, 张红霞, 陈蕾, 等. 扶正化瘀方对肝癌患者MMP-3和ESM-1表达的影响[J]. 中医学报, 2019, 34(5): 1065-1069. DOI: 10.16368/j.issn.1674-8999.2019.05.252. [7] JI G, CAO CL, LIU P, et al. Pathology and immunohistochemistry research on effects of Fuzheng-Huayu prescription on hepatocyte proliferation of cirrhosis rats[J]. Chin J Basic Med Tradit Chin Med, 2001, 7(2): 29-32. DOI: 10.3969/j.issn.1006-3250.2001.02.015.季光, 曹承楼, 刘平, 等. 扶正化瘀方影响肝硬化大鼠肝细胞增殖的病理及免疫组化研究[J]. 中国中医基础医学杂志, 2001, 7(2): 29-32. DOI: 10.3969/j.issn.1006-3250.2001.02.015. [8] JI G, CAO CL, LIU P, et al. The study on inhibiting effect of Fuzhenghuayufang on hepatocarcinoma induced by DMN in rat[J]. Chin J Integr Trad West Med Digestion, 2001, 9(1): 20-22. DOI: 10.3969/j.issn.1671-038X.2001.01.007.季光, 曹承楼, 刘平, 等. 扶正化瘀方预防大鼠肝癌形成机制的研究[J]. 中国中西医结合消化杂志, 2001, 9(1): 20-22. DOI: 10.3969/j.issn.1671-038X.2001.01.007. [9] LIU P, LIU C, WANG XS, et al. Fuzheng Hua yu Recipe and Yangyin Rou gan Recipe in preven ting hepatocarcinoma of rats[J]. Chin J Exp Tradit Med Form, 1996, 2(3): 35-40. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX603.010.htm刘平, 刘成, 王晓素, 等. 扶正化瘀方与养阴柔肝方预防大鼠实验性肝癌的研究[J]. 中国实验方剂学杂志, 1996, 2(3): 35-40. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSFX603.010.htm [10] ZHOU J, SUN HC, WANG Z, et al. Guidelines for diagnosis and treatment of primary liver cancer in China (2017 edition)[J]. Liver Cancer, 2018, 7(3): 235-260. DOI: 10.1159/000488035. [11] GAO YR, CHEN SJ, HOU YW, et al. Clinical effect of Huaier Granule sequential with radiofrequency ablation and TACE in treating primary hepatic carcinoma[J]. J Changchun Univ Chin Med, 2020, 36(4): 684-687. DOI: 10.13463/j.cnki.cczyy.2020.04.021.高远韧, 陈思佳, 侯英文, 等. TACE联合射频消融术序贯槐耳颗粒治疗原发性肝癌[J]. 长春中医药大学学报, 2020, 36(4): 684-687. DOI: 10.13463/j.cnki.cczyy.2020.04.021. [12] WANG H, SHAN L, WU XX, et al. Clinical efficacy of Qinggan Quai recipe combined with hepatic artery chemoembolization in the treatment of advanced heat stasis liver cancer[J]. Clin J Med Offic, 2021, 49(3): 306-308. DOI: 10.16680/j.1671-3826.2021.03.23.王昊, 单良, 吴孝雄, 等. 清肝祛癌方联合肝动脉化疗栓塞术治疗晚期热瘀型肝癌临床疗效[J]. 临床军医杂志, 2021, 49(3): 306-308. DOI: 10.16680/j.1671-3826.2021.03.23. [13] LIU CH. Change of understanding of liver cirrhosis and some key points of research[J]. Chin J Integr Tradit West Med Liver Dis, 2014, 24(1): 1-6. DOI: 10.3969/j.issn.1005-0264.2014.01.001.刘成海. 对肝硬化认识的改变与部分研究重点[J]. 中西医结合肝病杂志, 2014, 24(1): 1-6. DOI: 10.3969/j.issn.1005-0264.2014.01.001. [14] REN KW, LI YH, WU G, et al. Quercetin nanoparticles display antitumor activity via proliferation inhibition and apoptosis induction in liver cancer cells[J]. Int J Oncol, 2017, 50(4): 1299-1311. DOI: 10.3892/ijo.2017.3886. [15] BRITO AF, RIBEIRO M, ABRANTES AM, et al. New approach for treatment of primary liver tumors: The role of quercetin[J]. Nutr Cancer, 2016, 68(2): 250-266. DOI: 10.1080/01635581.2016.1145245. [16] YEE SB, CHOI HJ, CHUNG SW, et al. Growth inhibition of luteolin on HepG2 cells is induced via p53 and Fas/Fas-ligand besides the TGF-β pathway[J]. Int J Oncol, 2015, 47(2): 747-754. DOI: 10.3892/ijo.2015.3053. [17] LI Y, WANG WM, CAO M, et al. Effects of insulin on proliferation, invasion and apoptosis of hepatocellular carcinoma cells[J]. Chin J Integr Tradit West Med Liver Dis, 2018, 28(5): 297-299, 306. DOI: 10.3969/j.issn.1005-0264.2018.05.012.李燕, 王卫民, 曹萌, 等. 胰岛素对肝癌细胞增殖、侵袭、凋亡的影响及机制[J]. 中西医结合肝病杂志, 2018, 28(5): 297-299, 306. DOI: 10.3969/j.issn.1005-0264.2018.05.012. [18] HE G, DHAR D, NAKAGAWA H, et al. Identification of liver cancer progenitors whose malignant progression depends on autocrine IL-6 signaling[J]. Cell, 2013, 155(2): 384-396. DOI: 10.1016/j.cell.2013.09.031. [19] WANG HM. Reciprocal control of miR-197 and IL-6/STAT3 pathway in hepatocellular carcinoma[D]. Hangzhou: Zhejiang University, 2015.王华敏. miR-197与IL6/STAT3信号通路相互调控在肝癌生长的作用及机制研究[D]. 杭州: 浙江大学, 2015. [20] PANVICHIAN R, TANTIWETRUEANGDET A, SORNMAYURA P, et al. Missense mutations in exons 18-24 of EGFR in hepatocellular carcinoma tissues[J]. Biomed Res Int, 2015, 2015: 171845. DOI: 10.1155/2015/171845. [21] ALTIMARI A, FIORENTINO M, GABUSI E, et al. Investigation of ErbB1 and ErbB2 expression for therapeutic targeting in primary liver tumours[J]. Dig Liver Dis, 2003, 35(5): 332-338. DOI: 10.1016/s1590-8658(03)00077-x. [22] NIU J. Mechanism of P300-dependent acetylation of H3 contributes to EGF-mediated DKK1 transcription and hepatocellular carcinoma metastasis[D]. Kaifeng: Henan University, 2020.牛杰. P300乙酰化H3促进EGF介导的DKK1转录及肝癌转移的机制研究[D]. 开封: 河南大学, 2020. [23] SCHUMANN DM, MAEDLER K, FRANKLIN I, et al. The Fas pathway is involved in pancreatic beta cell secretory function[J]. Proc Natl Acad Sci U S A, 2007, 104(8): 2861-2866. DOI: 10.1073/pnas.0611487104. [24] CHOI D, RADZISZEWSKA A, SCHROER SA, et al. Deletion of Fas in the pancreatic beta-cells leads to enhanced insulin secretion[J]. Am J Physiol Endocrinol Metab, 2009, 297(6): e1304-e1312. DOI: 10.1152/ajpendo.00217.2009. 期刊类型引用(2)
1. 何平,徐婧怡,张雪雪,陈晓龙. 丙酚替诺福韦联合扶正化淤片对乙肝肝硬化代偿期肝纤维化的影响. 中国实用医刊. 2024(02): 118-120 .  百度学术
百度学术2. 蒋式骊,范海纳,刘平,刘成海. 肝硬化并发肝癌的中西医结合诊治现状与评述. 上海中医药杂志. 2023(08): 21-26 .  百度学术
百度学术其他类型引用(0)
-




 PDF下载 ( 2138 KB)
PDF下载 ( 2138 KB)

 下载:
下载:


 下载:
下载:

 百度学术
百度学术