免疫检查点TIGIT/CD155对原发性肝癌免疫微环境的调控作用及应用展望
DOI: 10.3969/j.issn.1001-5256.2022.11.039
Regulatory effect of immune checkpoint TIGIT/CD155 on the immune microenvironment of primary liver cancer and its application prospects
-
摘要: 随着免疫检查点抑制剂在各种实体瘤中得到了应用,耐药性和疗效不佳等问题随之而来,所以为了更好地改善患者的预后,探索更佳的免疫治疗方案刻不容缓。本文介绍了一种新兴的免疫检查点TIGIT及其高亲和力配体CD155,总结了TIGIT/CD155通路对肝癌免疫微环境的调控作用,并归纳了针对TIGIT的抑制剂在肝癌免疫治疗中的应用。认为TIGIT/CD155可以通过免疫细胞和基质细胞等改变肝癌的免疫微环境,从而造成免疫逃逸使病情恶化。分析表明,针对TIGIT的靶向治疗会成为将来肝癌治疗发展的新方向,并在免疫联合治疗中发挥重要作用。Abstract: With the application of immune checkpoint inhibitors in various solid tumors, problems such as drug resistance and poor response gradually occur, and therefore, in order to better improve the prognosis of patients, it is urgent to explore better immunotherapy regimens. This article introduces an emerging immune checkpoint TIGIT and its high-affinity ligand CD155 and summarizes the regulatory effect of the TIGIT/CD155 pathway on the immune microenvironment of liver cancer and the application of inhibitors targeting TIGIT in immunotherapy for liver cancer. It is believed that TIGIT/CD155 can change the immune microenvironment of liver cancer through immune cells and stromal cells, thereby causing immune escape and worsening of disease conditions. The analysis shows that the targeted therapy for TIGIT will become a new direction for the development of liver cancer therapy and play an important role in combined immunotherapy.
-
Key words:
- Liver Neoplasms /
- Immunosuppressive Agents /
- Tumor Microenvironment
-
原发性肝癌是起源于肝细胞或肝内胆管上皮细胞的恶性肿瘤,包括肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)和混合型肝癌(combined hepatocellular carcinoma and cholangiocarcinoma, cHCC-CC)三种病理类型,其中HCC为最常见的肝脏恶性肿瘤,常与HBV或HCV引起的慢性肝炎和肝硬化有关。全球统计数据[1]表明,肝癌是全球第六大最常见的癌症,并与胃癌并列为第四大癌症死亡原因,给生活、经济、社会医疗造成了严重的负担。
HCC对化疗和放疗并不敏感,手术切除、肝移植等治疗方法适用于早期肝癌患者,但由于供体、受体或其他原因使其有一定的局限性,并且术后复发风险比较高[2]。实际上,大多数肝癌患者在诊断时已经处于晚期,治疗选择有限,虽然分子靶向药物索拉非尼和仑伐替尼被批准为不可切除HCC的一线系统治疗方法,但总体生存获益并不令人满意[3]。在过去的十几年中,癌症的系统治疗经历了从广泛使用化疗药物,靶向药物到免疫治疗的转变[4]。免疫治疗药物主要是靶向肿瘤免疫微环境并调控肿瘤的免疫稳定平衡[5],是一种不同于传统方式的治疗手段。第一代免疫检查点抑制剂(immune checkpoint-blockade, ICB)选择性阻断免疫检查点如细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte associated protein,CTLA-4)、程序性细胞死亡蛋白1(programmed cell death protein,PD-1)和程序性死亡蛋白1配体(programmed cell death protein ligand, PD-L1),通过阻断这些检查点的免疫抑制作用,上调宿主免疫杀伤功能从而达到抗肿瘤的目的[6]。
纳武利尤单抗是第一个美国食品药品监督管理局(FDA)批准的免疫检查点抑制剂,虽然在一定程度上改善了晚期肝癌患者的生存情况[7],但单药运用疗效并不理想。所以近年来,免疫联合治疗受到了研究者们的重视,尤其是PD-L1检查点抑制剂阿替利珠单抗联合贝伐珠单抗即“T+A”疗法在一线治疗晚期HCC中表现惊艳[3]。然而,临床中仍然有很大一部分患者免疫治疗效果不佳,出现原发性耐药或者发生药物相关不良事件,寻找更安全有效的免疫联合治疗是未来肝癌免疫治疗需要进一步攻克的难题。
Yu等[8]对人类活化T淋巴细胞进行了基因组分析,发现了具有免疫球蛋白和免疫受体蛋白酪氨酸抑制基序结构域的T淋巴细胞免疫受体(T cell immunoreceptor with immunoglobulin and ITIM domain, TIGIT)。TIGIT作为一个新兴的免疫检查点,为目前的免疫治疗提供了新的靶点。TIGIT通常在肿瘤浸润细胞中高表达并在正常情况下发挥自我保护作用防止自身免疫损伤,例如自然杀伤细胞(NK细胞)、效应T淋巴细胞、调节性T淋巴细胞(regulatory T cell, Treg)、抗原递呈细胞等[8-9]。CD155是TIGIT的高亲和力配体,是一种细胞表面受体,在抗原递呈细胞如树突状细胞(dendritic cell, DC)表面、多种肿瘤细胞以及其他肿瘤浸润性髓系细胞中得到表达[10-12],而在正常人体组织中不表达或低表达,在抗肿瘤反应中发挥了重要作用。在肿瘤患者中,CD155的表达上调促进肿瘤细胞的扩散及增殖,并且与肿瘤的不良预后有关[12]。TIGIT与CD155结合后通过多种机制改变HCC的肿瘤微环境,而肿瘤微环境在癌症发生、生存及转移过程中发挥重要的作用。本文就TIGIT/CD155通路对HCC肿瘤免疫微环境的作用以及该检查点抑制剂治疗HCC的前景进行阐述。
1. TIGIT/CD155的分子结构
TIGIT属于脊髓灰质炎病毒受体样家族,具有一个胞外免疫球蛋白可变(IgV)结构域、一个跨膜结构域以及一个免疫受体酪氨酸抑制基序结构域(ITIM)[8]。Yu等[8]在竞争性试验中发现,TIGIT与CD155的结合力最强并且该通路的激活能够阻止CD155与CD96、DNAM-1等其他分子的结合。作为TIGIT高亲和力配体,CD155具有一个IgV结构域、一个C1样结构域以及C2结构域[13]。TIGIT的IgV段在与CD155 IgV段结合过程中起到关键作用,两者之间的连接像是“锁”和“钥匙”的结合[13],使得结合更加紧密。
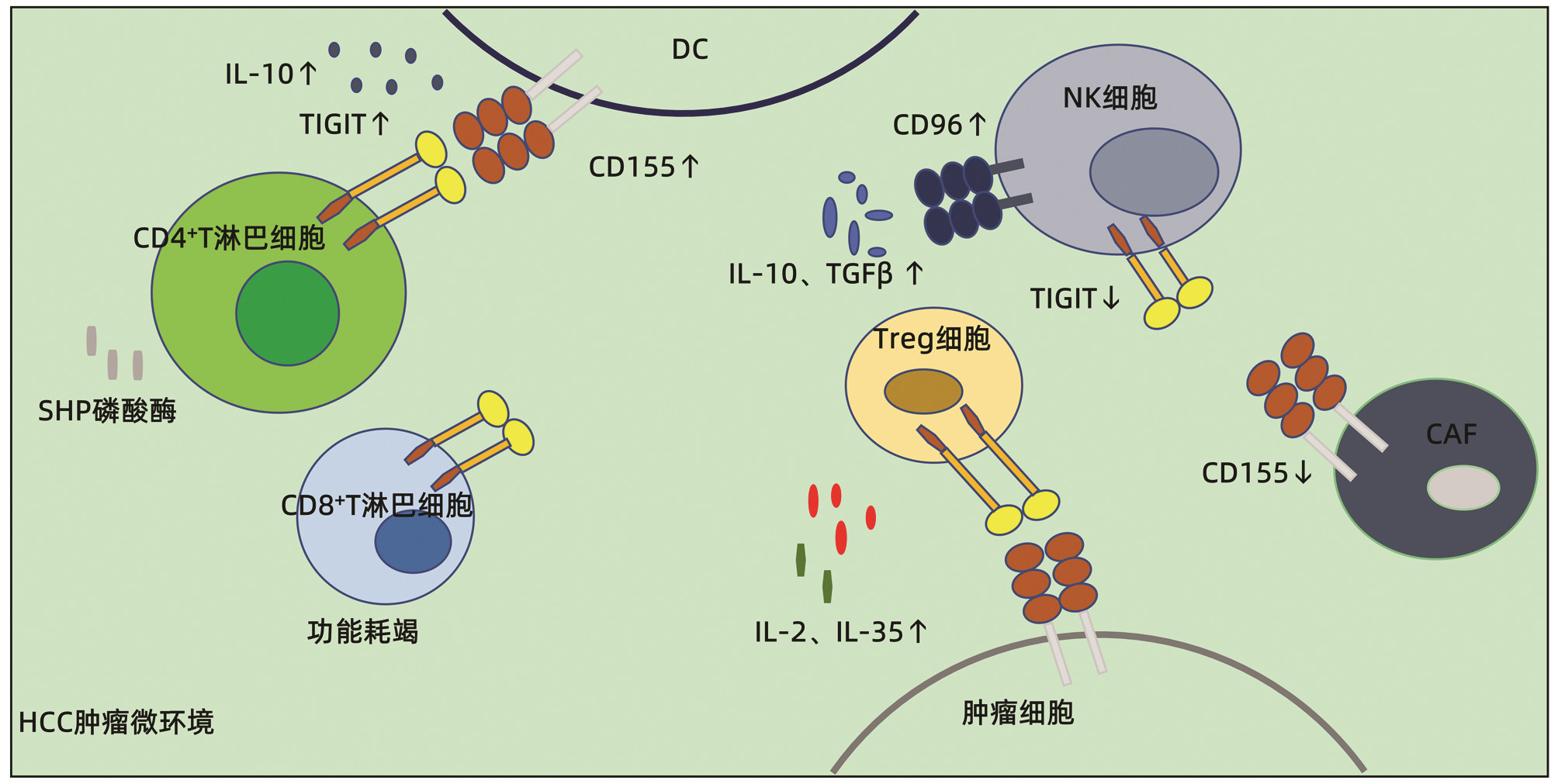
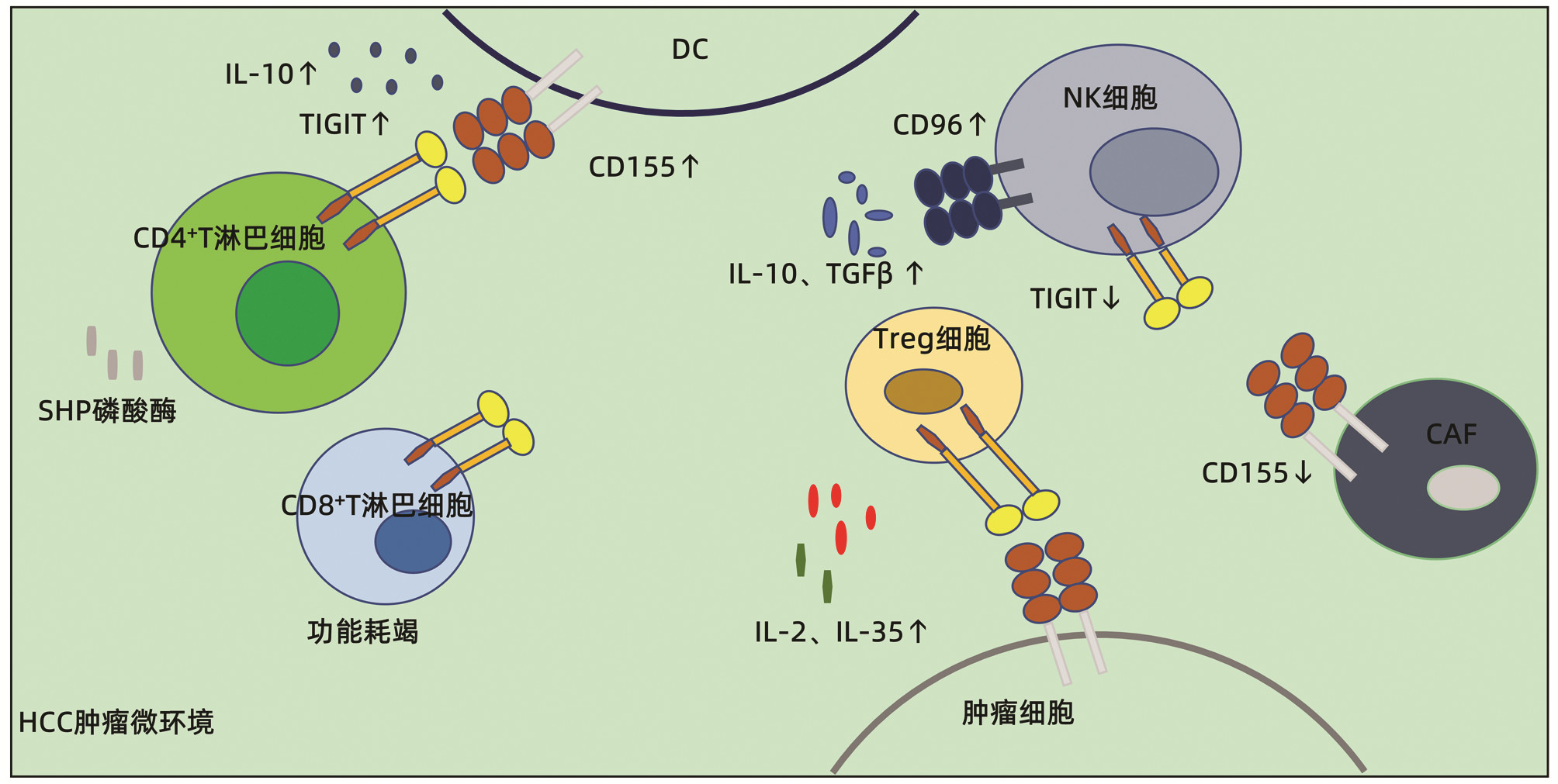
2. TIGIT/CD155通路对肝癌免疫微环境的调控作用
免疫微环境由肿瘤细胞、免疫细胞和肿瘤间质组成[9],三者之间的相互作用,决定了肿瘤的转归。针对免疫微环境的研究可以对肿瘤免疫逃逸的机制有更深刻的理解。为此,下文将针对TIGIT/CD155如何改变肝癌免疫微环境作出阐述。
2.1 调节T淋巴细胞功能
有研究[9, 14]表明,与健康对照组相比,HCC患者外周血TIGIT+CD4+T淋巴细胞、TIGIT+Treg细胞、TIGIT+CD8+T淋巴细胞以及肿瘤细胞上的CD155显著增加并与肿瘤的恶性程度呈正相关,这说明了肿瘤细胞和效应细胞共同决定了肿瘤的预后,而在细胞中表达上调的TIGIT和CD155可能参与了HCC的发生和发展。Yu等[8]发现,在HCC中,TIGIT/CD155通路可能通过诱导DC分泌抗炎细胞因子IL-10发挥其免疫抑制作用,从而抑制CD4+T淋巴细胞的增殖和功能。此外,CD4+T淋巴细胞上的TIGIT还通过招募Scr同源区2蛋白酪氨酸(SHP)磷酸酶来抑制自身的功能,而SHP磷酸酶具有抑制细胞因子产生和增殖的功能[14]。也有研究[15]表明,TIGIT在CD8+T淋巴细胞表达上调与HBV相关HCC预后不良相关。实际上,基础研究[16]发现,TIGIT通过介导CD8+T淋巴细胞的功能耗竭达到免疫抑制的作用,从而促进肿瘤免疫逃逸。
Treg细胞对肿瘤免疫耐受起到非常关键的作用,活化的Treg细胞在肿瘤微环境的聚集是导致HCC免疫逃逸的机制之一[17]。聚集的Treg细胞通过直接识别肿瘤细胞和释放抗炎细胞因子如IL-2、IL-10、IL-35以及TGFβ发挥免疫抑制作用[18]。TIGIT+ Treg细胞还抑制促炎辅助性T淋巴细胞1(T helper 1, Th1)和Th17调节抗肿瘤反应[19]。
综上所述,TIGIT/CD155结合后可以通过直接或间接的作用导致效应T淋巴细胞功能被抑制、功能耗竭甚至可以通过Treg细胞间接调节抗肿瘤反应,从而造成免疫逃逸。
2.2 调节NK细胞功能
作为一个自然免疫的重要器官,肝脏含有大量NK细胞。NK细胞在免疫应答中可以发挥两种效应,一种是直接发挥细胞毒性对抗肿瘤细胞;另一种是通过产生免疫调节和抗肿瘤活性的细胞因子来发挥抗肿瘤作用,比如分泌IFNγ。NK细胞表面重要的共抑制受体有TIGIT和CD96,共刺激受体主要有DNAM-1,三者在正常情况下达到平衡状态。然而在HCC肿瘤组织内,NK细胞表面的CD96有所增加而TIGIT减少,这说明了CD96+NK细胞可能在HCC肿瘤微环境里NK细胞的功能抑制过程中发挥着更加重要的作用。由CD96+NK细胞产生的抗肿瘤相关因子如IFNγ、TNFα、穿孔素及颗粒酶等有所减少,但促肿瘤相关因子IL-10和TGFβ增多[12, 20-21],而且在TGFβ增多的情况下,TIGIT+NK细胞可以向CD96+NK细胞转化,从而更加削弱了NK细胞的抗肿瘤活性。除了转化成CD96+NK细胞的间接作用,TIGIT的ITIM结构可以直接抑制NK细胞的免疫杀伤功能。
2.3 与癌症相关成纤维细胞(cancer-associated fibroblasts,CAF)的联系
大多数HCC病例是在由成纤维细胞的激活、增殖和积累引起的肝硬化的背景下发生的[22],所以HCC肿瘤微环境中富含CAF。CAF是肿瘤微环境中重要的基质细胞并通过分泌各种生长因子、细胞因子等促进肿瘤的增殖、侵袭。有研究[23]表明,CAF通过下调其表面CD155的表达从而减少与NK细胞表面的共刺激受体DNAM-1结合,导致NK细胞的杀伤活性降低,但由于TIGIT与CD155的高结合力,即使是CAF表面CD155的低表达, 也有可能和NK细胞表面的TIGIT结合从而抑制其免疫功能(图 1)。
3. TIGIT免疫检查点抑制剂在原发性肝癌免疫治疗中的应用
作为第一个得到重大进展的TIGIT抑制剂,替瑞利尤单抗联合PD-1抑制剂阿特珠单抗在晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)治疗中已经取得巨大进展,并获得FDA批准。实际上,对于晚期NSCLC,针对PD-1或PD-L1的单药免疫疗法耐药性是最大的难题,所以靶向PD-1和TIGIT的联合疗法的效果被临床研究重点评估。Ⅱ期CITYSCAPE试验对比了在135例晚期PD-L1阳性患者中,替瑞利尤单抗联合阿特珠单抗与安慰剂联合阿特珠单抗的疗效,结果显示免疫联合治疗的客观缓解率(37% vs 21%)和无进展生存期(5.6月vs 3.9月)显著改善,并且毒性没有加强[24]。基于先前研究的进展,目前,TIGIT抑制剂在包括肝癌在内的各种实体瘤中进行临床研究(表 1)。
表 1 TIGIT免疫检查点抑制剂在实体瘤免疫治疗中的应用Table 1. Application of TIGIT immune checkpoint inhibitors in immunotherapy of solid tumorTIGIT抑制剂 试验号 研究年份 研究疾病 试验内容 试验阶段 试验方式 BGB-A1217 NCT04948697 2021年 晚期HCC 与贝伐珠单抗(BAT1706)或替雷利珠单抗(BGB-A317)联合治疗 Ⅱ期 对照试验 AB154 NCT03628677 2018年 晚期恶性实体肿瘤 单药治疗或与塞帕利单抗(AB122)联合治疗 Ⅰ期 对照试验 IBI-939 NCT04353830 2020年 晚期恶性肿瘤 单药治疗或与信迪利单抗联合治疗 Ⅰ期 对照试验 M-6223 NCT04457778 2020年 转移性或局部晚期不可切除实体肿瘤 单药治疗或与M7824(PD-1/TGFβ双靶向药物)联合治疗 Ⅰ期 对照试验 AGEN1777 NCT05025085 2020年 晚期实体肿瘤 单药治疗或与一种PD-1抑制剂联合治疗 Ⅰ期 对照试验 IBI-321 NCT04911894 NCT04911881 2021年 晚期实体肿瘤 单药治疗 Ⅰ期 单臂试验 MK-7684 NCT05007106 2021年 包括HCC在内的8种晚期实体肿瘤 与PD-1抑制剂或分子靶向药物等联合治疗 Ⅱ期 对照试验 ASP8374 NCT03945253 2019年 晚期实体肿瘤 单药治疗 Ⅰ期 对照试验 BAT6005 NCT05116709 2021年 局部或转移性晚期实体肿瘤 单药治疗 Ⅰ期 单臂试验 在上述列出临床研究中,NCT03945253是唯一一项达到研究终点的临床研究。研究结果发现ASP8374作为抗癌剂其安全性和耐受性较好,然而,由于初步的研究数据表明药物客观缓解率较低,其抗肿瘤疗效还需要进一步进行验证。除了上述研究,笔者研究团队正在进行一项2期多中心临床研究,即探索抗TIGIT的BGB-A1217加抗PD-1的雷利珠单抗和贝伐珠单抗对比贝伐珠单抗加雷利珠单抗的疗效。无论如何,TIGIT抑制剂在包括肝癌在内的各种晚期实体肿瘤中已经成为了免疫治疗的新方向,免疫联合治疗将成为未来临床研究的新热点。
4. 小结与展望
以免疫检查点抑制剂(PD-1或PD-L1抗体)为代表的HCC的免疫治疗,单药应用临床有效率通常不足20%,大部分患者会出现免疫治疗原发或者继发耐药。就肿瘤细胞本身而言,特定的通路缺失或激活以及基因表达的改变,或者在免疫应答的环节中出现抗原递呈缺陷等问题都会导致抗PD-1/PD-L1免疫治疗难以发挥作用,从而产生耐药现象。对于肿瘤外部因素,其他的免疫检查点、免疫抑制细胞、免疫抑制分子等也会影响PD-1/PD-L1抑制剂的应答率[25]。此时,免疫联合治疗就受到了研究者们的关注,也是未来免疫治疗新的发展方向。综述总结发现,TIGIT/CD155通路在不同免疫浸润细胞的激活,可能通过各种免疫调控机制改变肿瘤的免疫微环境,促进肿瘤细胞逃避免疫监视并诱导HCC进展转移。因此,靶向TIGIT/CD155通路在今后的肝癌治疗中可能是一个有潜力的靶点。
多项研究[26-27]表明,抗TIGIT和抗PD-1/PD-L1联合治疗更能提高患者的生存率。两者联合作用后增加了免疫细胞在肿瘤免疫微环境的浸润以及细胞因子如IFNγ、TNFα的产生, 除此之外,联合治疗还能降低DC的浸润从而增强T淋巴细胞的免疫作用[26]。除了PD-1/PD-L1,根据上述提到的机制,阻断CD96或者与小分子靶向药物如索拉非尼、仑伐替尼等联合都可能增强抗TIGIT的治疗效果。另外,关于免疫微环境中浸润的其他免疫细胞或基质细胞如髓源性抑制细胞、肿瘤相关巨噬细胞以及CAF与TIGIT/CD155的相关基础及临床研究较少,但其涉及的免疫调控机制多样且存在交互作用,未来靶向免疫浸润细胞的免疫检查点也会成为HCC免疫联合治疗中新的发展方向。
综上,阻断TIGIT/CD155通路可能通过多种途径调控肝癌肿瘤微环境发挥抗肿瘤作用。针对TIGIT/CD155通路的免疫治疗,不但丰富了临床治疗手段,提高肿瘤患者免疫治疗效果,扩大了免疫治疗的优势人群,也为靶向治疗或者PD-1/PD-L1抗体耐药的肝癌患者提供了新的治疗选择。而TIGIT与其他免疫检查点或者与靶向治疗的联合治疗,必将成为未来肝癌系统治疗发展的新方向,更好地改善晚期肝癌患者的预后。
-
表 1 TIGIT免疫检查点抑制剂在实体瘤免疫治疗中的应用
Table 1. Application of TIGIT immune checkpoint inhibitors in immunotherapy of solid tumor
TIGIT抑制剂 试验号 研究年份 研究疾病 试验内容 试验阶段 试验方式 BGB-A1217 NCT04948697 2021年 晚期HCC 与贝伐珠单抗(BAT1706)或替雷利珠单抗(BGB-A317)联合治疗 Ⅱ期 对照试验 AB154 NCT03628677 2018年 晚期恶性实体肿瘤 单药治疗或与塞帕利单抗(AB122)联合治疗 Ⅰ期 对照试验 IBI-939 NCT04353830 2020年 晚期恶性肿瘤 单药治疗或与信迪利单抗联合治疗 Ⅰ期 对照试验 M-6223 NCT04457778 2020年 转移性或局部晚期不可切除实体肿瘤 单药治疗或与M7824(PD-1/TGFβ双靶向药物)联合治疗 Ⅰ期 对照试验 AGEN1777 NCT05025085 2020年 晚期实体肿瘤 单药治疗或与一种PD-1抑制剂联合治疗 Ⅰ期 对照试验 IBI-321 NCT04911894 NCT04911881 2021年 晚期实体肿瘤 单药治疗 Ⅰ期 单臂试验 MK-7684 NCT05007106 2021年 包括HCC在内的8种晚期实体肿瘤 与PD-1抑制剂或分子靶向药物等联合治疗 Ⅱ期 对照试验 ASP8374 NCT03945253 2019年 晚期实体肿瘤 单药治疗 Ⅰ期 对照试验 BAT6005 NCT05116709 2021年 局部或转移性晚期实体肿瘤 单药治疗 Ⅰ期 单臂试验 -
[1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492. [2] YUAN SX, ZHOU WP. Progress and hot spots of comprehensive treatment for primary liver cancer[J]. Chin J Dig Surg, 2021, 20(2): 163-170. DOI: 10.3760/cma.j.cn115610-20201211-00776.袁声贤, 周伟平. 原发性肝癌综合治疗的进展和热点[J]. 中华消化外科杂志, 2021, 20(2): 163-170. DOI: 10.3760/cma.j.cn115610-20201211-00776. [3] WEI JY, SUN W, LIU XM, et al. Advances in targeted therapy and immunotherapy for hepatocelluar carcinoma[J]. J Clin Hepatol, 2020, 36(10): 2320-2324. DOI: 10.3969/j.issn.1001-5256.2020.10.035.魏建莹, 孙巍, 刘晓民, 等. 肝细胞癌的靶向及免疫治疗进展[J]. 临床肝胆病杂志, 2020, 36(10): 2320-2324. DOI: 10.3969/j.issn.1001-5256.2020.10.035. [4] QIN XY, LIU YY, KANG Q. Prevention and therapeutic strategies and targeted immunotherapy for hepatocellular carcinoma recurrence and metastasis after liver transplantation[J]. Ogran Transplant, 2022, 13(2): 271-276. DOI: 10.3969/j.issn.1674-7445.2022.02.018.秦小琰, 刘彦尧, 康权. 肝癌肝移植术后复发转移的防治策略和靶向免疫治疗[J]. 器官移植, 2022, 13(2): 271-276. DOI: 10.3969/j.issn.1674-7445.2022.02.018. [5] ZONGYI Y, XIAOWU L. Immunotherapy for hepatocellular carcinoma[J]. Cancer Lett, 2020, 470: 8-17. DOI: 10.1016/j.canlet.2019.12.002. [6] SADEGHI RAD H, MONKMAN J, WARKIANI ME, et al. Understanding the tumor microenvironment for effective immunotherapy[J]. Med Res Rev, 2021, 41(3): 1474-1498. DOI: 10.1002/med.21765. [7] GUAN QT, HAN MW, XI D. Research progress of immune checkpoint inhibitors in the treatment of hepatocellular carcinoma[J]. J Inter Intens Med, 2021, 27(3): 187-192. DOI: 10.11768/nkjwzzzz20210303.关倩婷, 韩美文, 习东. 免疫检查点抑制剂治疗肝细胞癌的研究进展[J]. 内科急危重症杂志, 2021, 27(3): 187-192. DOI: 10.11768/nkjwzzzz20210303. [8] YU X, HARDEN K, GONZALEZ LC, et al. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells[J]. Nat Immunol, 2009, 10(1): 48-57. DOI: 10.1038/ni.1674. [9] DUAN X, LIU J, CUI J, et al. Expression of TIGIT/CD155 and correlations with clinical pathological features in human hepatocellular carcinoma[J]. Mol Med Rep, 2019, 20(4): 3773-3781. DOI: 10.3892/mmr.2019.10641. [10] LUPO KB, MATOSEVIC S. CD155 immunoregulation as a target for natural killer cell immunotherapy in glioblastoma[J]. J Hematol Oncol, 2020, 13(1): 76. DOI: 10.1186/s13045-020-00913-2. [11] ZHANG J, ZHU Y, WANG Q, et al. Poliovirus receptor CD155 is up-regulated in muscle-invasive bladder cancer and predicts poor prognosis[J]. Urol Oncol, 2020, 38(2): 41. DOI: 10.1016/j.urolonc.2019.07.006. [12] SUN H, HUANG Q, HUANG M, et al. Human CD96 correlates to natural killer cell exhaustion and predicts the prognosis of human hepatocellular carcinoma[J]. Hepatology, 2019, 70(1): 168-183. DOI: 10.1002/hep.30347. [13] DEUSS FA, WATSON GM, FU Z, et al. Structural basis for CD96 immune receptor recognition of nectin-like protein-5, CD155[J]. Structure, 2019, 27(2): 219-228. e3. DOI: 10.1016/j.str.2018.10.023. [14] ZHANG C, WANG Y, XUN X, et al. TIGIT can exert immunosuppressive effects on CD8+ T cells by the CD155/TIGIT signaling pathway for hepatocellular carcinoma in vitro[J]. J Immunother, 2020, 43(8): 236-243. DOI: 10.1097/CJI.0000000000000330. [15] LIU X, LI M, WANG X, et al. PD-1+ TIGIT+ CD8+ T cells are associated with pathogenesis and progression of patients with hepatitis B virus-related hepatocellular carcinoma[J]. Cancer Immunol Immunother, 2019, 68(12): 2041-2054. DOI: 10.1007/s00262-019-02426-5. [16] ZONG L, PENG H, SUN C, et al. Breakdown of adaptive immunotolerance induces hepatocellular carcinoma in HBsAg-tg mice[J]. Nat Commun, 2019, 10(1): 221. DOI: 10.1038/s41467-018-08096-8. [17] SHI H, CHI H. Metabolic control of treg cell stability, plasticity, and tissue-specific heterogeneity[J]. Front Immunol, 2019, 10: 2716. DOI: 10.3389/fimmu.2019.02716. [18] TREHANPATI N, VYAS AK. Immune regulation by T regulatory cells in hepatitis B virus-related inflammation and cancer[J]. Scand J Immunol, 2017, 85(3): 175-181. DOI: 10.1111/sji.12524. [19] JOLLER N, LOZANO E, BURKETT PR, et al. Treg cells expressing the coinhibitory molecule TIGIT selectively inhibit proinflammatory Th1 and Th17 cell responses[J]. Immunity, 2014, 40(4): 569-581. DOI: 10.1016/j.immuni.2014.02.012. [20] SUN C, XU J, HUANG Q, et al. High NKG2A expression contributes to NK cell exhaustion and predicts a poor prognosis of patients with liver cancer[J]. Oncoimmunology, 2017, 6(1): e1264562. DOI: 10.1080/2162402X.2016.1264562. [21] YU L, LIU X, WANG X, et al. TIGIT+ TIM-3+ NK cells are correlated with NK cell exhaustion and disease progression in patients with hepatitis B virus-related hepatocellular carcinoma[J]. Oncoimmunology, 2021, 10(1): 1942673. DOI: 10.1080/2162402X.2021.1942673. [22] YIN Z, DONG C, JIANG K, et al. Heterogeneity of cancer-associated fibroblasts and roles in the progression, prognosis, and therapy of hepatocellular carcinoma[J]. J Hematol Oncol, 2019, 12(1): 101. DOI: 10.1186/s13045-019-0782-x. [23] INOUE T, ADACHI K, KAWANA K, et al. Cancer-associated fibroblast suppresses killing activity of natural killer cells through downregulation of poliovirus receptor (PVR/CD155), a ligand of activating NK receptor[J]. Int J Oncol, 2016, 49 (4) : 1297-1304. DOI: 10.3892/ijo.2016.3631. [24] HORVATH L, PIRCHER A. ASCO 2020 non-small lung cancer (NSCLC) personal highlights[J]. Memo, 2021, 14(1): 66-69. DOI: 10.1007/s12254-020-00673-2. [25] LI D. Research progress of immune checkpoint PD-1/PD-L1 inhibitor resistance mechanism and treatment strategy[J]. China & Foreign Medical Treatment, 2021, 40(17): 195-198. DOI: 10.16662/j.cnki.1674-0742.2021.17.195.李典. 免疫检查点PD-1/PD-L1抑制剂耐药机制与治疗策略的研究进展[J]. 中外医疗, 2021, 40(17): 195-198. DOI: 10.16662/j.cnki.1674-0742.2021.17.195. [26] HUNG AL, MAXWELL R, THEODROS D, et al. TIGIT and PD-1 dual checkpoint blockade enhances antitumor immunity and survival in GBM[J]. Oncoimmunology, 2018, 7(8): e1466769. DOI: 10.1080/2162402X.2018.1466769. [27] HAN HS, JEONG S, KIM H, et al. TOX-expressing terminally exhausted tumor-infiltrating CD8+ T cells are reinvigorated by co-blockade of PD-1 and TIGIT in bladder cancer[J]. Cancer Lett, 2021, 499: 137-147. DOI: 10.1016/j.canlet.2020.11.035. 期刊类型引用(1)
1. 黄俊,邵慧娟,马学锋,于晓辉,郑晓凤,张久聪. 免疫检查点对慢性HBV感染者自然杀伤细胞功能的影响. 临床肝胆病杂志. 2023(08): 1932-1938 .  本站查看
本站查看其他类型引用(1)
-




 PDF下载 ( 2121 KB)
PDF下载 ( 2121 KB)


 下载:
下载:
 下载:
下载: