查尔森共病指数对慢加急性肝衰竭患者预后的评估价值
DOI: 10.3969/j.issn.1001-5256.2023.05.015
Value of Charlson comorbidity index in predicting the prognosis of patients with acute-on-chronic liver failure
-
摘要:
目的 评估查尔森共病指数(CCI)对慢加急性肝衰竭(ACLF)患者短期和长期死亡风险的预测价值。 方法 纳入2016年12月1日—2021年12月1日就诊于兰州大学第一医院的ACLF患者317例。按照患者预后结局分为死亡组(n=169)和存活组(n=148),分析基线临床资料及随访数据。计量资料两组间比较采用成组t检验或Mann-Whitney U检验。计数资料两组间比较采用χ2检验。使用单因素和多因素Cox风险比例模型分析ACLF患者预后的影响因素。通过Kaplan-Meier法绘制生存曲线,Log-rank检验比较不同CCI评分患者的生存时间差异,并采用受试者工作特征曲线(ROC曲线)评估CCI等指标对ACLF患者预后的评价效能。 结果 317例ACLF患者中,男225例(71.0%)。死亡组和存活组患者基线资料比较,年龄、Hb、WBC、TBil、Alb、MELD评分、PTA、CCI、年龄校正的查尔森共病指数(ACCI)以及随访时间差异均有统计学意义(P值均<0.05)。多因素Cox回归分析结果显示,CCI(HR=1.351,95%CI:1.112~1.641,P=0.002)、ACCI(HR=1.200,95%CI:1.011~1.423,P=0.037)和MELD评分(HR=1.076,95%CI:1.054~1.099,P<0.001)是ACLF患者预后的独立危险因素。根据CCI评分将ACLF患者分为3组:CCI≤4分组(n=167)、CCI=5分组(n=64)、CCI≥6分组(n=86),3组ACLF患者3年病死率分别为26.5%、83.2%和96.9%。随访3年和随访至2022年9月时,3组患者生存时间两两比较,差异均有统计学意义(P值均<0.001)。CCI、ACCI和MELD评分预测ACLF患者预后的ROC曲线下面积分别为0.845、0.811、0.790。 结论 CCI和ACCI评分作为常用的共病评价指标,对评估ACLF患者短期及长期预后具有一定价值。 Abstract:Objective To investigate the value of Charlson comorbidity index (CCI) in predicting the short- and long-term risks of death in patients with acute-on-chronic liver failure (ACLF). Methods A total of 317 patients with ACLF who attended The First Hospital of Lanzhou University from December 1, 2016 to December 1, 2021 were enrolled, and according to their prognosis, they were divided into death group with 169 patients and survival group with 148 patients. The two groups were analyzed in terms of clinical data and follow-up data. The group t-test or the Mann-Whitney U test was used for comparison of continuous data between two groups, and the chi-square test was used for comparison of categorical data between two groups. The univariate and multivariate Cox proportional-hazards regression model analyses were used to investigate the influencing factors for the prognosis of ACLF patients. The Kaplan-Meier method was used to plot survival curves, and the Log-rank test was used for comparison of survival time between patients with different CCI scores. The receiver operating characteristic (ROC) curve was used to evaluate the performance of CCI and other indices in assessing the prognosis of ACLF patients. Results Among the 317 patients, there were 225 (71.0%) male patients. There were significant differences between the death group and the survival group in age, hemoglobin, white blood cell count, total bilirubin, albumin, Model for End-Stage Liver Disease (MELD) score, prothrombin time activity, CCI, age-adjusted Charlson co-morbidity index (ACCI), and follow-up time (all P < 0.05). The multivariate Cox regression analysis showed that the CCI (hazard ratio [HR]=1.351, 95% confidence interval [CI]: 1.112-1.641, P=0.002), ACCI (HR=1.200, 95%CI: 1.011-1.423, P=0.037), and MELD score (HR=1.076, 95%CI: 1.054-1.099, P < 0.001) were independent risk factors for the prognosis of ACLF patients. Based on CCI score, the patients were divided into CCI ≤4 group with 167 patients, CCI=5 group with 64 patients, and CCI ≥6 group with 86 patients, with a 3-year mortality rate of 26.5%, 83.2%, and 96.9%, respectively, and there was a significant difference in survival time between any two groups after 3 years of follow-up and at the time of follow-up till September 2022 (all P < 0.001). CCI, ACCI, and MELD scores had an area under the ROC curve of 0.845, 0.811, and 0.790, respectively, in predicting the prognosis of ACLF patients. Conclusion As commonly used comorbidity assessment indices, CCI and ACCI scores have certain value in evaluating the short- and long-term prognosis of ACLF patients. -
Key words:
- Acute-On-Chronic Liver Failure /
- Prognosis /
- Charlson Comorbidity Index
-
慢加急性肝衰竭(ACLF)正成为全球慢性肝病患者死亡的主要原因[1],28 d内病死率接近40%[2]。Charlson提出的查尔森共病指数(Charlson comorbidity index, CCI)[3]及此后衍生出的年龄校正的查尔森共病指数(age-adjusted Charlson comorbidity index, ACCI)[4]均用于计算患者的共病负担。CCI和ACCI已在诸多疾病中得到验证,例如咽喉癌、结肠癌、胰腺癌、骨髓增生异常综合征等[5-8]。此外,还发现CCI可预测药物性肝损伤、肝内胆管癌、肝细胞癌等患者的生存率[9-11]。然而,CCI在ACLF中的作用尚未得到评估。因此,本研究在诊断明确的ACLF人群中,探讨CCI和ACCI对ACLF患者预后的判断价值。
1. 资料与方法
1.1 研究对象
选取2016年12月1日—2021年12月1日就诊于兰州大学第一医院的ACLF患者。ACLF的诊断标准参考《肝衰竭诊治指南(2018年版)》[12]。纳入标准:(1)初次诊断为ACLF的患者;(2)随访时间≥9个月或已明确死亡。排除标准:(1)恶性肿瘤术后患者;(2)年龄<18周岁;(3)处于妊娠或哺乳期患者;(4)器官移植术后患者;(5)病历资料不全者;(6)失访患者。所有研究对象均进行9个月以上随访观察(已明确死亡者除外),中位随访时间为13个月。根据患者的预后结局分为死亡组和存活组。
1.2 观察指标及检测方法
收集ACLF患者的临床资料,包括性别、年龄、所患共病、预后情况等一般资料,计算患者入院时的终末期肝病模型(MELD)评分、CCI及ACCI[3-4],评分量表见表 1。收集患者入院相关实验室检查结果,采用全自动血细胞分析仪(BC5390CRP,深圳迈瑞生物医疗电子股份有限公司)检测血常规指标,全自动生化分析仪(Olympus AU400,日本奥林巴斯光学株式会社)检测生物化学指标,全自动凝血分析仪(PrecilC3510,深圳迈瑞生物医疗电子股份有限公司)检测凝血指标。
表 1 CCI中的共病加权指数Table 1. Comorbidity weighting index in Charlson comorbidity index共病 共病权重(分) 共病 共病权重(分) 心肌梗死 1 偏瘫 2 充血性心力衰竭 1 中重度肾病 2 外周血管疾病 1 糖尿病(伴有并发症) 2 脑血管疾病 1 实体瘤 2 痴呆 1 白血病 2 慢性肺病 1 淋巴瘤 2 结缔组织病 1 中/重度肝病 3 消化性溃疡病 1 转移性实体瘤 6 轻度肝病 1 获得性免疫缺陷综合征 6 糖尿病(无并发症) 1 注:计算ACCI时,年龄大于40岁者,每增加10岁加1分。 1.3 统计学方法
应用SPSS 25.0和GraphPad Prism 7.0软件进行统计学分析。正态分布的计量资料以x±s表示,两组间比较采用成组t检验;偏态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验。计数资料两组间比较采用χ2检验。使用单因素和多因素Cox风险比例模型分析ACLF患者预后的影响因素。通过Kaplan-Meier法绘制生存曲线,Log-rank检验比较不同CCI评分患者的生存时间差异,并采用受试者工作特征曲线(ROC曲线)评估CCI等指标对ACLF患者预后的评价效能。P<0.05为差异有统计学意义。
2. 结果
2.1 人口学特点和基线资料
共选取ACLF患者422例,按照入组和排除标准,最终纳入患者317例(图 1)。其中男225例(71.0%),平均年龄(50.2±12.7)岁,死亡组169例,存活组148例。两组患者基线资料比较,年龄、Hb、WBC、TBil、Alb、MELD评分、PTA、CCI、ACCI以及随访时间差异均有统计学意义(P值均<0.05)(表 2)。
表 2 患者的基线资料Table 2. Baseline data of the patients指标 死亡组(n=169) 存活组(n=148) 统计值 P值 男[例(%)] 120(71.0) 105(70.9) χ2=0.000 0.991 年龄(岁) 52.1±11.9 48.1±13.2 t=2.821 0.005 BMI(kg/m2) 23.1±3.9 23.5±3.5 t=-0.920 0.385 Hb(g/L) 120.8±30.5 128.7±31.0 t=-2.291 0.023 WBC(×109/L) 6.4(4.4~9.4) 5.2(3.5~7.1) Z=-3.461 0.001 PLT(×109/L) 79.0(48.0~111.0) 91.5(52.0~135.5) Z=-1.869 0.062 ALT(U/L) 94.0(39.0~281.0) 127.5(42.3~507.8) Z=-1.614 0.107 TBil(μmol/L) 251.4(77.9~471.0) 164.0(60.4~334.9) Z=-3.201 0.001 Alb(g/L) 29.9±4.6 32.1±4.9 t=-4.008 <0.001 ALP(U/L) 148.1(104.2~183.5) 132.8(101.8~172.3) Z=-1.848 0.065 MELD评分 37.0±7.5 34.5±6.3 t=3.191 0.002 PTA(%) 37.1±11.9 43.6±16.8 t=-3.948 <0.001 AFP(IU/mL) 20.2(3.3~234.4) 36.0(4.2~167.2) Z=-0.264 0.792 CCI[例(%)] χ2=114.333 <0.001 ≤4分 43(25.4) 124(83.8) 5分 46(27.2) 18(12.2) ≥6分 80(47.3) 6(4.1) ACCI[例(%)] χ2=155.072 <0.001 ≤4分 24(14.2) 97(65.5) 5~6分 68(40.2) 39(26.4) ≥7分 77(45.6) 12(8.1) 随访时间(月) 7.0(3.5~12.0) 25.0(16.0~40.0) Z=-11.264 <0.001 注:PTA,凝血酶原活动度。 2.2 ACLF患者生存时间的影响因素分析
单因素Cox回归分析结果显示,年龄、Hb、WBC、ALT、Alb、ALP、MELD评分、PTA、CCI以及ACCI对ACLF患者生存时间的影响差异均有统计学意义(P值均<0.05);将这些指标纳入多因素Cox风险比例模型,发现CCI、ACCI、MELD评分、PTA及Hb是ACLF患者生存时间的独立影响因素(P值均<0.05)(表 3)。
表 3 ACLF患者生存时间的影响因素分析Table 3. Univariate and multivariate analysis of influencing survival time of patients指标 单因素分析 多因素分析 HR 95%CI P值 HR 95%CI P值 性别 1.012 0.726~1.411 0.944 年龄(岁) 1.023 1.011~1.035 <0.001 BMI(kg/m2) 0.970 0.930~1.011 0.153 Hb(g/L) 0.994 0.989~0.999 0.011 0.995 0.990~1.000 0.033 WBC(×109/L) 1.054 1.032~1.076 <0.001 PLT(×109/L) 0.998 0.995~1.001 0.210 ALT(U/L) 1.000 0.999~1.000 0.019 Alb(g/L) 0.946 0.917~0.976 <0.001 ALP(U/L) 1.002 1.001~1.004 0.006 MELD评分(分) 1.115 1.095~1.136 <0.001 1.076 1.054~1.099 <0.001 PTA(%) 0.969 0.959~0.980 <0.001 0.976 0.963~0.989 <0.001 AFP(IU/mL) 1.000 1.000~1.001 0.088 CCI(分) 1.764 1.635~1.903 <0.001 1.351 1.112~1.641 0.002 ACCI(分) 1.640 1.523~1.763 <0.001 1.200 1.011~1.423 0.037 注:性别以男性为对照组。 2.3 ACLF患者不同时间的病死率
将ACLF患者根据CCI评分分为3组:CCI≤4分组、CCI=5分组、CCI≥6分组,3组患者在1个月、3个月、6个月、1年、3年的病死率如表 4所示。随着CCI评分增加,ACLF患者病死率呈现增长趋势。
表 4 ACLF患者不同时间的病死率Table 4. Mortality in patients with ACLF at different timesCCI分组 例数 1个月 3个月 6个月 1年 3年 CCI≤4分组 167 0 1.8% 6.0% 9.6% 26.5% CCI=5分组 64 3.1% 4.7% 21.0% 63.9% 83.2% CCI≥6分组 86 4.9% 36.6% 61.0% 90.2% 96.9% 2.4 不同CCI评分的ACLF患者生存时间比较
随访3个月时,3组患者存活率均>50%,CCI≥6分组与其他两组相比,生存时间差异均有统计学意义(χ2值分别为63.330、20.080,P值均<0.001)(图 2a)。随访3年和随访至2022年9月时,3组患者生存时间进行两两比较,并对显著性水平进行Bonferroni校正,校正后的显著性水平为α=0.016 7,结果显示生存时间的差异均有统计学意义(随访3年:χ2值分别为17.380、211.100、25.070,P值均<0.001;随访至2022年9月:χ2值分别为73.320、206.600、26.360,P值均<0.001)(图 2b、c)。CCI=5分组、CCI≥6分组患者的中位生存时间估计值分别为10.0个月(95%CI:7.6~12.4)、5.0个月(95%CI:3.7~6.3),CCI≤4分组患者的中位生存时间远大于其他两组。
2.5 CCI、ACCI、MELD评分、PTA及Hb对总生存期的预测价值
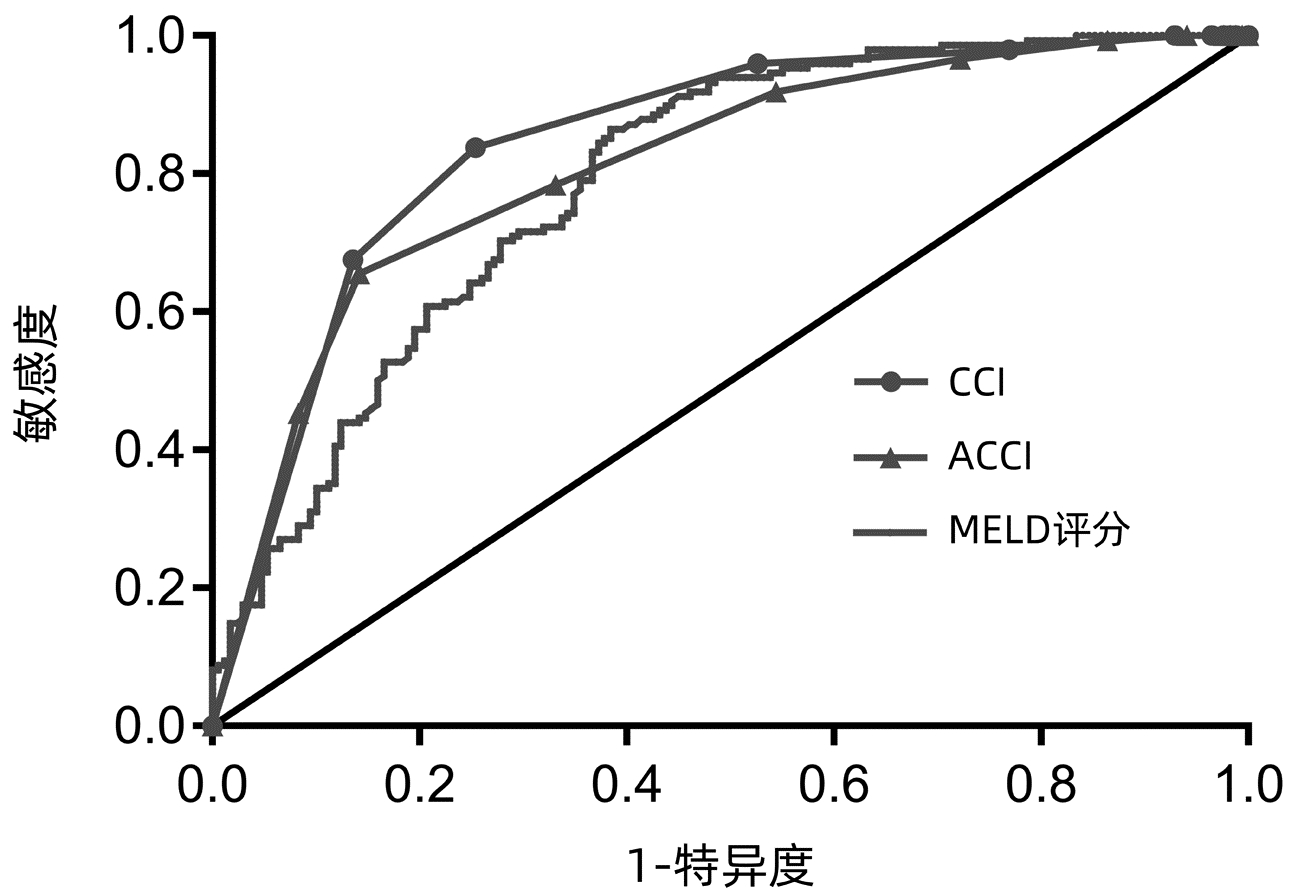
ROC曲线结果显示,CCI曲线下面积(AUC)最大(0.845),阴性预测值为0.84,敏感度为83.78%,特异度为74.56%;ACCI的AUC为0.811,但阳性预测值较大(0.80)(图 3,表 5)。
表 5 CCI、ACCI、MELD评分、PTA及Hb预测ACLF患者总生存期的效能分析Table 5. Efficacy analysis of CCI, ACCI, MELD score, PTA and Hb in predicting overall survival in patients with ACLF指标 AUC 95%CI P值 敏感度(%) 特异度(%) 阳性预测值 阴性预测值 CCI 0.845 0.801~0.888 <0.001 83.78 74.56 0.74 0.84 ACCI 0.811 0.764~0.859 <0.001 65.54 85.80 0.80 0.74 MELD评分 0.790 0.741~0.839 <0.001 86.49 61.54 0.66 0.84 PTA 0.626 0.562~0.689 <0.001 37.84 86.39 0.72 0.61 Hb 0.580 0.517~0.643 <0.001 44.59 71.01 0.57 0.59 3. 讨论
CCI最初用于评估重症患者的1年病死率,随后其应用范围逐渐扩大至预测各种疾病的预后[13-14]。但CCI或ACCI对ACLF患者预后评估价值国内外鲜有报道,故本研究采用CCI和ACCI预测ACLF患者的短期和长期预后。本研究基于真实世界的数据,通过严格的入组和排除指标,最大程度控制了选择和信息偏倚,最终纳入符合本研究的ACLF患者,在此基础上探讨CCI对其预后的影响。通过分析,发现CCI和ACCI与ACLF患者的生存时间相关,二者对评估ACLF患者短期及长期预后具有一定价值。
CCI包括16种以器官或系统分类的疾病,部分疾病因严重程度不同,所占权重不同。Charlson明确指出:轻度肝病包括无门静脉高压或慢性肝炎的肝硬化;中度肝病包括肝硬化伴门静脉高压,但无出血;重度肝病包括伴有门静脉高压和静脉曲张出血史的肝硬化[3]。回顾患者病史资料发现,本研究纳入的病例均有肝硬化(门静脉高压伴或不伴食管胃底静脉曲张破裂出血),根据以上标准,无轻度肝病患者,遂权重均为3分。
在一般人群研究和急性心力衰竭患者中,发现CCI>2分与病死率风险相关[15-16]。另有探索CCI预测病死率的研究[17]中,基于CCI的第三四分位数,使用的阈值为CCI>3分。本研究中患者CCI评分的中位数和第三四分位数分别是4分、6分,故以CCI≤4分和CCI≥6分为阈值展开研究。对研究对象进行随访,最长时间为67个月,中位随访时间为13个月,约20%的患者随访时间超过3年,故选择3年病死率作为长期预后的终点。
本研究中死亡组患者年龄更大、Alb水平更低。一方面,由于纳入的患者均伴有不同程度肝硬化,肝功能差,肝脏合成功能降低;另一方面,高龄患者器官功能减退,所患共病更多,营养状况更差,死亡风险增加。Ghabril等[10]发现由CCI、MELD评分和Alb建立的模型能够预测疑似药物性肝损伤患者的6个月病死率。一项涉及529例HBV相关ACLF(HBV-ACLF)患者的研究[18]发现,MELD评分是患者预后的独立预测因子,可较准确地预测HBV-ALCF患者的30 d和90 d病死率(30 d:HR=1.073;90 d:HR=1.082),且苏州大学的研究团队[19]也发现MELD评分是HBV-ALCF预后的独立危险因素(OR=1.588)。本研究单因素Cox回归分析显示,年龄、Hb、WBC、ALT、Alb、ALP、MELD评分、PTA、CCI以及ACCI均影响ACLF患者的预后,进一步行多因素分析后发现,CCI、ACCI、MELD评分、PTA和Hb是ACLF患者预后的独立影响因素。与上述结果一致,MELD评分是ACLF患者预后的独立危险因素(HR=1.076),不同之处在于本研究纳入患者的病因不止HBV感染一种。Xu等[20]研究结果显示,TBil和年龄是HBV-ACLF患者高病死率的独立危险因素。本研究中,死亡组患者的TBil水平较高,但由于MELD评分中已包含TBil,ACCI中年龄已占相应权重,故多因素分析时未将TBil和年龄纳入。此外,Xu等[20]研究还发现血清AFP水平低是HBV-ACLF患者预后的独立危险因素,这与本研究结果不一致,原因可能是本研究纳入了部分肝癌患者,且基础疾病不仅限于HBV,从而导致结果有差异。
随着CCI评分增加,ACLF患者在1个月、3个月、6个月、1年、3年的病死率呈现增加趋势;随访3年和随访至2022年9月时,不同CCI评分的3组患者生存时间比较,差异均有统计学意义(P值均<0.001)。CCI≤4分组患者无法估计其中位生存时间,原因在于该组患者截至随访日期病死率小于50%。一项关于鼻窦癌的研究[14]发现,ACCI是鼻窦癌患者总生存期和无病生存期的独立危险因素,且贫血与总生存期较短有关。虽然本研究未涉及无病生存期,但同样发现Hb水平是ACLF患者预后的独立保护因素(HR=0.995)。Ghabril等[10]研究验证了CCI>2分是疑似药物性肝损伤患者预后的独立危险因素(OR=5.4,95%CI:2.1~13.8),该研究终点为短期(6个月)预后。本研究结果亦显示CCI是患者预后的独立危险因素(HR=1.351),CCI>5分对评估ACLF患者短期及长期预后均具有一定价值。
本研究中ROC曲线分析显示,CCI、ACCI和MELD评分对ACLF患者3年病死率的判别能力均大于0.70,提示三者对评估ACLF患者的预后具有一定价值。而部分研究[15, 21]中得出的AUC小于0.70,可能与该研究纳入的患者均为高龄有关。
本研究的不足之处在于,该研究基于单中心数据,且共病是通过询问患者病史或通过医院管理信息系统调取既往临床资料,因此可能存在信息偏倚;部分患者随访时间较短,也可能影响结果的准确性。因此还需进行多中心研究,且适当延长随访时间,深入探讨CCI与ACLF患者生存时间的关系。
综上,本研究发现ACLF患者的共病负担与总生存时间和病死率有关,且CCI和ACCI能够预测ACLF患者的生存结局,根据CCI评分对ACLF患者进行分层管理,可能对指导个体化治疗有重要意义。
-
表 1 CCI中的共病加权指数
Table 1. Comorbidity weighting index in Charlson comorbidity index
共病 共病权重(分) 共病 共病权重(分) 心肌梗死 1 偏瘫 2 充血性心力衰竭 1 中重度肾病 2 外周血管疾病 1 糖尿病(伴有并发症) 2 脑血管疾病 1 实体瘤 2 痴呆 1 白血病 2 慢性肺病 1 淋巴瘤 2 结缔组织病 1 中/重度肝病 3 消化性溃疡病 1 转移性实体瘤 6 轻度肝病 1 获得性免疫缺陷综合征 6 糖尿病(无并发症) 1 注:计算ACCI时,年龄大于40岁者,每增加10岁加1分。 表 2 患者的基线资料
Table 2. Baseline data of the patients
指标 死亡组(n=169) 存活组(n=148) 统计值 P值 男[例(%)] 120(71.0) 105(70.9) χ2=0.000 0.991 年龄(岁) 52.1±11.9 48.1±13.2 t=2.821 0.005 BMI(kg/m2) 23.1±3.9 23.5±3.5 t=-0.920 0.385 Hb(g/L) 120.8±30.5 128.7±31.0 t=-2.291 0.023 WBC(×109/L) 6.4(4.4~9.4) 5.2(3.5~7.1) Z=-3.461 0.001 PLT(×109/L) 79.0(48.0~111.0) 91.5(52.0~135.5) Z=-1.869 0.062 ALT(U/L) 94.0(39.0~281.0) 127.5(42.3~507.8) Z=-1.614 0.107 TBil(μmol/L) 251.4(77.9~471.0) 164.0(60.4~334.9) Z=-3.201 0.001 Alb(g/L) 29.9±4.6 32.1±4.9 t=-4.008 <0.001 ALP(U/L) 148.1(104.2~183.5) 132.8(101.8~172.3) Z=-1.848 0.065 MELD评分 37.0±7.5 34.5±6.3 t=3.191 0.002 PTA(%) 37.1±11.9 43.6±16.8 t=-3.948 <0.001 AFP(IU/mL) 20.2(3.3~234.4) 36.0(4.2~167.2) Z=-0.264 0.792 CCI[例(%)] χ2=114.333 <0.001 ≤4分 43(25.4) 124(83.8) 5分 46(27.2) 18(12.2) ≥6分 80(47.3) 6(4.1) ACCI[例(%)] χ2=155.072 <0.001 ≤4分 24(14.2) 97(65.5) 5~6分 68(40.2) 39(26.4) ≥7分 77(45.6) 12(8.1) 随访时间(月) 7.0(3.5~12.0) 25.0(16.0~40.0) Z=-11.264 <0.001 注:PTA,凝血酶原活动度。 表 3 ACLF患者生存时间的影响因素分析
Table 3. Univariate and multivariate analysis of influencing survival time of patients
指标 单因素分析 多因素分析 HR 95%CI P值 HR 95%CI P值 性别 1.012 0.726~1.411 0.944 年龄(岁) 1.023 1.011~1.035 <0.001 BMI(kg/m2) 0.970 0.930~1.011 0.153 Hb(g/L) 0.994 0.989~0.999 0.011 0.995 0.990~1.000 0.033 WBC(×109/L) 1.054 1.032~1.076 <0.001 PLT(×109/L) 0.998 0.995~1.001 0.210 ALT(U/L) 1.000 0.999~1.000 0.019 Alb(g/L) 0.946 0.917~0.976 <0.001 ALP(U/L) 1.002 1.001~1.004 0.006 MELD评分(分) 1.115 1.095~1.136 <0.001 1.076 1.054~1.099 <0.001 PTA(%) 0.969 0.959~0.980 <0.001 0.976 0.963~0.989 <0.001 AFP(IU/mL) 1.000 1.000~1.001 0.088 CCI(分) 1.764 1.635~1.903 <0.001 1.351 1.112~1.641 0.002 ACCI(分) 1.640 1.523~1.763 <0.001 1.200 1.011~1.423 0.037 注:性别以男性为对照组。 表 4 ACLF患者不同时间的病死率
Table 4. Mortality in patients with ACLF at different times
CCI分组 例数 1个月 3个月 6个月 1年 3年 CCI≤4分组 167 0 1.8% 6.0% 9.6% 26.5% CCI=5分组 64 3.1% 4.7% 21.0% 63.9% 83.2% CCI≥6分组 86 4.9% 36.6% 61.0% 90.2% 96.9% 表 5 CCI、ACCI、MELD评分、PTA及Hb预测ACLF患者总生存期的效能分析
Table 5. Efficacy analysis of CCI, ACCI, MELD score, PTA and Hb in predicting overall survival in patients with ACLF
指标 AUC 95%CI P值 敏感度(%) 特异度(%) 阳性预测值 阴性预测值 CCI 0.845 0.801~0.888 <0.001 83.78 74.56 0.74 0.84 ACCI 0.811 0.764~0.859 <0.001 65.54 85.80 0.80 0.74 MELD评分 0.790 0.741~0.839 <0.001 86.49 61.54 0.66 0.84 PTA 0.626 0.562~0.689 <0.001 37.84 86.39 0.72 0.61 Hb 0.580 0.517~0.643 <0.001 44.59 71.01 0.57 0.59 -
[1] BAJAJ JS, O'LEARY JG, LAI JC, et al. Acute-on-chronic liver failure clinical guidelines[J]. Am J Gastroenterol, 2022, 117(2): 225-252. DOI: 10.14309/ajg.0000000000001595. [2] ARROYO V, MOREAU R, JALAN R. Acute-on-chronic liver failure[J]. N Engl J Med, 2020, 382(22): 2137-2145. DOI: 10.1056/NEJMra1914900. [3] CHARLSON ME, POMPEI P, ALES KL, et al. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation[J]. J Chronic Dis, 1987, 40(5): 373-383. DOI: 10.1016/0021-9681(87)90171-8. [4] CHARLSON M, SZATROWSKI TP, PETERSON J, et al. Validation of a combined comorbidity index[J]. J Clin Epidemiol, 1994, 47(11): 1245-1251. DOI: 10.1016/0895-4356(94)90129-5. [5] TAKEMURA K, TAKENAKA Y, ASHIDA N, et al. Age-adjusted Charlson Comorbidity Index predicts prognosis of laryngopharyngeal cancer treated with radiation therapy[J]. Acta Otolaryngol, 2017, 137(12): 1307-1312. DOI: 10.1080/00016489.2017.1362112. [6] BOAKYE D, WALTER V, JANSEN L, et al. Magnitude of the age-advancement effect of comorbidities in colorectal cancer prognosis[J]. J Natl Compr Canc Netw, 2020, 18(1): 59-68. DOI: 10.6004/jnccn.2019.7346. [7] BAGNI K, CHEN IM, JOHANSEN AZ, et al. Prognostic impact of Charlson's Age-Comorbidity Index and other risk factors in patients with pancreatic cancer[J]. Eur J Cancer Care (Engl), 2020, 29(3): e13219. DOI: 10.1111/ecc.13219. [8] SARICI A, AR MC, YOKUS O, et al. The impact of transfusion burden and comorbidities on the prognosis of patients with myelodysplastic syndromes[J]. Transfus Apher Sci, 2020, 59(5): 102845. DOI: 10.1016/j.transci.2020.102845. [9] QU WF, ZHOU PY, LIU WR, et al. Age-adjusted Charlson Comorbidity Index predicts survival in intrahepatic cholangiocarcinoma patients after curative resection[J]. Ann Transl Med, 2020, 8(7): 487. DOI: 10.21037/atm.2020.03.23. [10] GHABRIL M, GU J, YODER L, et al. Development and validation of a model consisting of comorbidity burden to calculate risk of death within 6 months for patients with suspected drug-induced liver injury[J]. Gastroenterology, 2019, 157(5): 1245-1252. DOI: 10.1053/j.gastro.2019.07.006. [11] SHINKAWA H, TANAKA S, TAKEMURA S, et al. Predictive value of the age-adjusted Charlson comorbidity index for outcomes after hepatic resection of hepatocellular carcinoma[J]. World J Surg, 2020, 44(11): 3901-3914. DOI: 10.1007/s00268-020-05686-w. [12] Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, Chinese Medical Association; Severe Liver Disease and Artificial Liver Group, Chinese Society of Hepatology, Chinese Medical Association. Guideline for diagnosis and treatment of liver failure(2018)[J]. J Clin Hepatol, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007.中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2018年版)[J]. 临床肝胆病杂志, 2019, 35(1): 38-44. DOI: 10.3969/j.issn.1001-5256.2019.01.007. [13] KAHL A, DU BOIS A, HARTER P, et al. Prognostic value of the age-adjusted Charlson comorbidity index (ACCI) on short- and long-term outcome in patients with advanced primary epithelial ovarian cancer[J]. Ann Surg Oncol, 2017, 24(12): 3692-3699. DOI: 10.1245/s10434-017-6079-9. [14] BECKER C, DAHLEM K, LANGE K, et al. Predictive value of comorbidity and anemia on outcome in patients with sinonasal carcinoma[J]. J Craniomaxillofac Surg, 2018, 46(8): 1373-1378. DOI: 10.1016/j.jcms.2018.05.009. [15] FORMIGA F, MORENO-GONZALEZ R, CHIVITE D, et al. High comorbidity, measured by the Charlson Comorbidity Index, associates with higher 1-year mortality risks in elderly patients experiencing a first acute heart failure hospitalization[J]. Aging Clin Exp Res, 2018, 30(8): 927-933. DOI: 10.1007/s40520-017-0853-1. [16] FRACCARO P, KONTOPANTELIS E, SPERRIN M, et al. Predicting mortality from change-over-time in the Charlson Comorbidity Index: A retrospective cohort study in a data-intensive UK health system[J]. Medicine (Baltimore), 2016, 95(43): e4973. DOI: 10.1097/MD.0000000000004973. [17] RATTANASOMPATTIKUL M, FEROZE U, MOLNAR MZ, et al. Charlson comorbidity score is a strong predictor of mortality in hemodialysis patients[J]. Int Urol Nephrol, 2012, 44(6): 1813-1823. DOI: 10.1007/s11255-011-0085-9. [18] LI H, ZHENG J, CHEN L, et al. The scoring systems in predicting short-term outcomes in patients with hepatitis B virus-related acute-on-chronic liver failure[J]. Ann Palliat Med, 2020, 9(5): 3048-3058. DOI: 10.21037/apm-20-608. [19] XU Y, HUANG XP, CHEN L, et al. Value of high-density lipoprotein cholesterol in evaluating the severity and prognosis of hepatitis B virus-associated acute-on-chronic liver failure[J]. J Clin Hepatol, 2021, 37(7): 1632-1635. DOI: 10.3969/j.issn.1001-5256.2021.07.030.徐英, 黄小平, 陈丽, 等. 高密度脂蛋白胆固醇对HBV相关慢加急性肝衰竭严重程度及预后的预测价值[J]. 临床肝胆病杂志, 2021, 37(7): 1632-1635. DOI: 10.3969/j.issn.1001-5256.2021.07.030. [20] XU X, HOU Z, XU Y, et al. The dynamic of platelet count as a novel and valuable predictor for 90-day survival of hepatitis B virus-related acute-on-chronic liver failure patients[J]. Clin Res Hepatol Gastroenterol, 2021, 45(2): 101482. DOI: 10.1016/j.clinre.2020.06.008. [21] CHAN TC, LUK JK, CHU LW, et al. Validation study of Charlson Comorbidity Index in predicting mortality in Chinese older adults[J]. Geriatr Gerontol Int, 2014, 14(2): 452-457. DOI: 10.1111/ggi.12129. 期刊类型引用(2)
1. 赵颖颖,徐秋艳. 基于ROC曲线评价CCI对慢加急性肝衰竭预后的评估价值. 罕少疾病杂志. 2025(03): 100-102 .  百度学术
百度学术2. 徐大洲,张树贤,王坤,左晨艳,曾毅,袁青文,张志梅. 血清簇集蛋白、1-磷酸鞘氨醇水平对脓毒症急性肝损伤患者的预后价值. 临床肝胆病杂志. 2023(12): 2867-2872 .  本站查看
本站查看其他类型引用(4)
-




 PDF下载 ( 2205 KB)
PDF下载 ( 2205 KB)

 下载:
下载:




 下载:
下载:


 百度学术
百度学术