基于HALP评分的列线图模型对肝细胞癌患者肝切除术后预后的预测价值
DOI: 10.3969/j.issn.1001-5256.2023.07.014
Value of the nomogram based on HALP score in predicting the prognosis of patients with hepatocellular carcinoma after hepatectomy
-
摘要:
目的 探讨HALP评分在肝细胞癌(HCC)患者肝切除术后预后评估中的应用价值,分析基于HALP评分的列线图模型能否有效预测患者术后生存情况。 方法 回顾性分析2013年7月—2020年3月在西南医科大学附属医院肝胆外科手术治疗的253例HCC患者临床资料。通过绘制ROC曲线,计算出HALP和其他有关指标的最佳截断值。采用χ2检验分析HALP与临床病理特征之间的关系。使用Kaplan-Meier方法绘制生存曲线,并采用Log-rank检验进行比较。进行单因素分析和多因素Cox回归模型,分析HALP及其他临床参数与患者预后的关系。通过R 3.6软件构建列线图,使用C指数及校准图评价列线图的预测能力,通过净重新分类指数(NRI)、综合判别改善指数(IDI)比较列线图模型和传统模型的预测能力。 结果 Kaplan-Meier分析显示高HALP组患者OS、RFS优于低HALP组,差异均有统计学意义(P值均<0.001)。单因素Cox回归分析显示WBC、GGT、ALP、AFP、手术方式、微血管侵犯、TNM分期、分化程度、HALP、AST/ALT、NLR、MLR均与总生存期(OS)显著相关(P值均<0.05),将单因素Cox回归分析中有统计学意义的变量纳入多因素Cox回归分析,结果显示HALP、AST/ALT、ALP、AFP、分化程度、TNM分期是HCC患者术后OS的独立影响因素(P值均<0.05)。单因素Cox回归分析显示GGT、ALP、AFP、微血管侵犯、TNM分期、分化程度、HALP、AST/ALT、NLR、MLR均与无复发生存期(RFS)显著相关(P值均<0.05);多因素Cox回归分析,结果显示HALP、AST/ALT、NLR、ALP、AFP、TNM分期是HCC患者术后RFS的独立影响因素(P值均<0.05)。根据多因素分析结果分别构建HCC患者OS、RFS的列线图,计算预测OS列线图的C指数为0.732(0.691~0.774),预测1、3、5年生存率的AUC分别为0.795、0.791、0.775。预测RFS列线图的C指数为0.677(0.637~0.717),预测1、3、5年生存率的AUC分别为0.742、0.733、0.716;并且1、3、5年OS、RFS校准图表现出了较好的拟合度。 结论 术前低水平HALP是接受手术治疗的HCC患者长期预后不佳的预测因素,基于HALP评分的列线图模型优于BCLC分期模型,可以更好地预测HCC的预后情况。 Abstract:Objective To investigate the value of HALP score in evaluating the prognosis of patients with hepatocellular carcinoma (HCC) after hepatectomy and whether the nomogram based on HALP score could effectively predict the postoperative survival of patients. Methods A retrospective study was performed for the clinical data of 253 HCC patients who underwent surgical treatment in Department of Hepatobiliary Surgery, The Affiliated Hospital of Southwest Medical University, from July 2013 to March 2020. The receiver operating characteristic (ROC) curve was plotted to calculate the optimal cut-off values of HALP score and other related indicators; the chi-square test was used to investigate the association between HALP score and clinicopathological features; the Kaplan-Meier method was used to plot survival curves, and the Log-rank test method was used for comparison. The univariate and multivariate Cox regression analyses were used to investigate the association of HALP score and other clinical parameters with the prognosis of patients. R3.6 was used to establish a nomogram; C-index and calibration curve were used to evaluate the predictive ability of the nomogram, and net reclassification index (NRI) and integrated discrimination improvement (IDI) were used to compare predictive ability between the nomogram model and the conventional model. Results The Kaplan-Meier analysis showed that the high HALP group had significantly better overall survival (OS) and recurrence-free survival (RFS) than the low HALP group (P < 0.001). The univariate Cox regression analysis showed that white blood cell count, gamma-glutamyl transpeptidase (GGT), alkaline phosphatase (ALP), alpha-fetoprotein (AFP), surgical approach, microvascular invasion, TNM stage, degree of tumor differentiation, HALP, aspartate aminotransferase (AST)/alanine aminotransferase (ALT) ratio, neutrophil-to-lymphocyte ratio (NLR), and monocyte-to-lymphocyte ratio (MLR) were significantly associated with OS (all P < 0.05). The variables with statistical significance in the univariate Cox regression analysis were included in the multivariate Cox regression analysis, and the results showed that ALP, AST/ALT ratio, ALP, AFP, degree of tumor differentiation, and TNM stage were independent influencing factors for OS after surgery in HCC patients (all P < 0.05). The univariate Cox regression analysis showed that GGT, ALP, AFP, microvascular invasion, TNM stage, degree of tumor differentiation, HALP, AST/ALT ratio, NLR, and MLR were significantly associated with RFS (all P < 0.05), and the multivariate Cox regression analysis showed that HALP, AST/ALT ratio, NLR, ALP, AFP, and TNM stage were independent influencing factors for RFS after surgery in HCC patients (all P < 0.05). The nomograms for OS and RFS of HCC patients were established based on the multivariate analysis. The nomogram for OS had a C-index of 0.732 (95% confidence interval [CI]: 0.691-0.774) and an area under the ROC curve of 0.795, 0.791, and 0.775, respectively, in predicting 1-, 3-, and 5-year survival rates, and the nomogram for RFS had a C-index of 0.677 (95%CI: 0.637-0.717) and an area under the ROC curve of 0.742, 0.733, and 0.716, respectively, in predicting 1-, 3-, and 5-year survival rates. The calibration curves of 1-, 3-, and 5-year OS were well fitted to those of 1-, 3-, and 5-year RFS. Conclusion A low level of HALP before surgery is a predictive factor for poor long-term prognosis in HCC patients undergoing surgical treatment, and the nomogram model based on HALP score is superior to the BCLC staging model and can better predict the prognosis of HCC. -
Key words:
- Carcinoma, Hepatocellular /
- Prognosis /
- Risk Factors /
- Nomograms
-
原发性肝癌是目前我国第4位常见恶性肿瘤[1]。2020年,我国约有41万人新诊断肝癌,39.1万人死于该病[2]。尽管手术仍然是肝癌最有效的治疗方法,但其疗效仍不理想,肝癌患者术后5年生存率仅为37%~65%[3]。由于肝癌患者的传统预后指数,包括肿瘤大小、血管侵犯、TNM分期等在日常临床使用中有一定的局限性。因此,有必要寻找新的指标来帮助预测肝细胞癌(HCC)患者的预后。
研究[4]表明,营养和免疫在癌症进展过程中发挥着重要的作用。反映机体炎症或营养状态的一系列血液学指标,包括Alb[5]、Hb[6]、淋巴细胞(lymphocyte, LYM)[7]、PLT[8]都与HCC预后相关。但是这些单一指标的缺点是每种指标只能反映疾病的炎症或营养方面,不能全面反映疾病状况。因此,基于这些研究,学者们构建了炎症指数的许多组合,例如NLR[9]、MLR[10]、AST/ALT[11]都已被用于预测HCC患者的预后,并且比单项指标具有更高的准确性。HALP评分作为一项评价患者营养和免疫健康状况的综合指标,近年来已被证明具有较好的预测多种恶性肿瘤预后的能力,在食管癌[12]、胰腺癌[13]、胃癌[14]等疾病中陆续被报道。然而,该评分对接受手术切除病灶的HCC患者预后的价值尚未有相关研究。因此,本回顾性研究旨在探讨术前HALP对于HCC患者预后的评估价值,并将HALP评分与其他临床病理指标联合构建列线图模型,评估HCC患者术后的生存时间。
1. 资料与方法
1.1 研究对象
回顾性分析2013年7月—2020年3月在本院肝胆外科手术治疗的253例原发性肝癌患者临床资料。纳入标准:(1)组织病理学证实为HCC;(2)接受肝切除术;(3)无其他恶性肿瘤病史;(4)完整的临床和随访资料;(5)术前未接受任何新辅助化疗或放疗者。排除标准:(1)有其他恶性肿瘤;(2) 有全身感染、自身免疫性疾病或炎症;(3)术前接受过免疫增强治疗或近期有输血史;(4)术后1个月内死亡;(5)因其他原因死亡者。
1.2 数据收集
所有术前临床病理数据均来自电子病历系统;患者完整的临床资料包括年龄、性别、手术方式、组织病理类型、肿瘤分化程度、TNM分期等临床及病理资料;Hb、Alb、LYM、PLT、AFP、活化部分凝血酶原时间(activated partial thromboplastin time, APTT)水平、TBil等实验室检查结果。手术前1周采集血样并通过检查结果计算HALP和NLR、MLR、AST/ALT。HALP=Hb(g/L)×Alb(g/L)×LYM(×109/L)/PLT(×109/L),NLR=中性粒细胞计数(×109/L)/LYM(×109/L),MLR=单核细胞计数(×109/L)/LYM(×109/L)。
1.3 随访
所有患者术后随访检查包括腹部超声、胸部X线片、血常规、血液生化(肝功能、肾功能)。如检测到可疑病变且无法确定病变性质,则根据情况使用增强CT、MRI和其他检查方式。患者在术后第1年每3个月复查1次,接下来的2~3年每3~6个月复查1次。3年后,随访期改为6个月。随访生存数据通过患者门诊就诊和电话随访获得。计算手术完成与死亡或最后1次随访之间的时间间隔,以总生存期(OS)表示。无复发生存期(RFS)定义为术后到患者发现肿瘤复发/转移或最后1次随访之间的时间间隔,随访截止时间为2022年9月。
1.4 统计学方法
使用SPSS 26.0软件分析处理数据。绘制ROC曲线,并计算出HALP和其他有关指标的最佳截断值。采用χ2检验分析HALP与临床病理特征之间的关系。使用Kaplan-Meier方法绘制生存曲线,并采用Log-rank检验进行比较。采用单因素分析和多因素Cox回归模型分析HALP及其他临床参数与患者预后的关系。通过R 3.6软件构建列线图,使用C指数及校准图评价列线图的预测能力,通过净重新分类指数(net reclassification index, NRI)、综合判别改善指数(integrated discrimination improvement, IDI) 比较列线图模型和传统模型的预测能力。P<0.05为差异有统计学意义。
2. 结果
2.1 ROC曲线分析和截断值确定
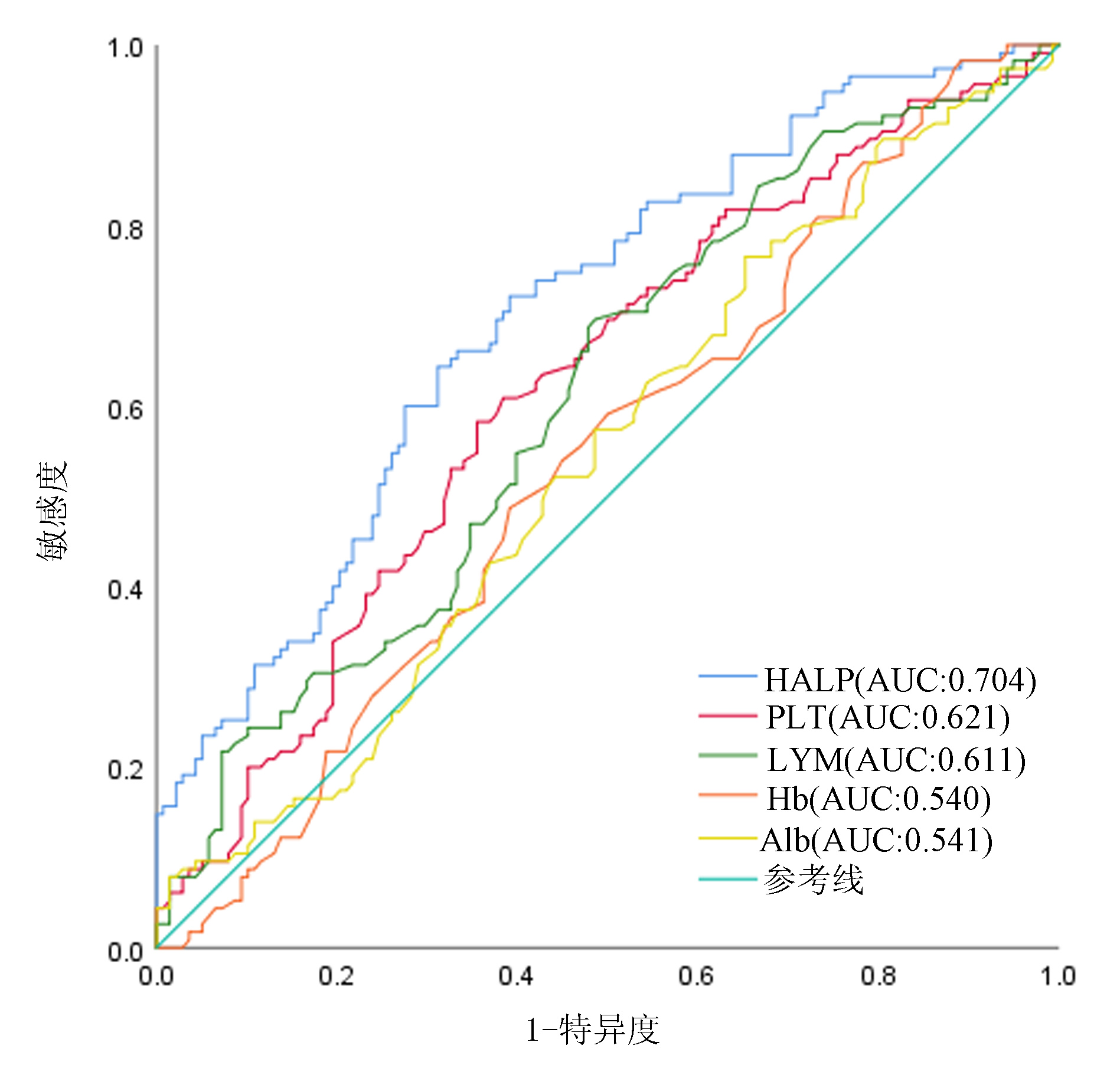
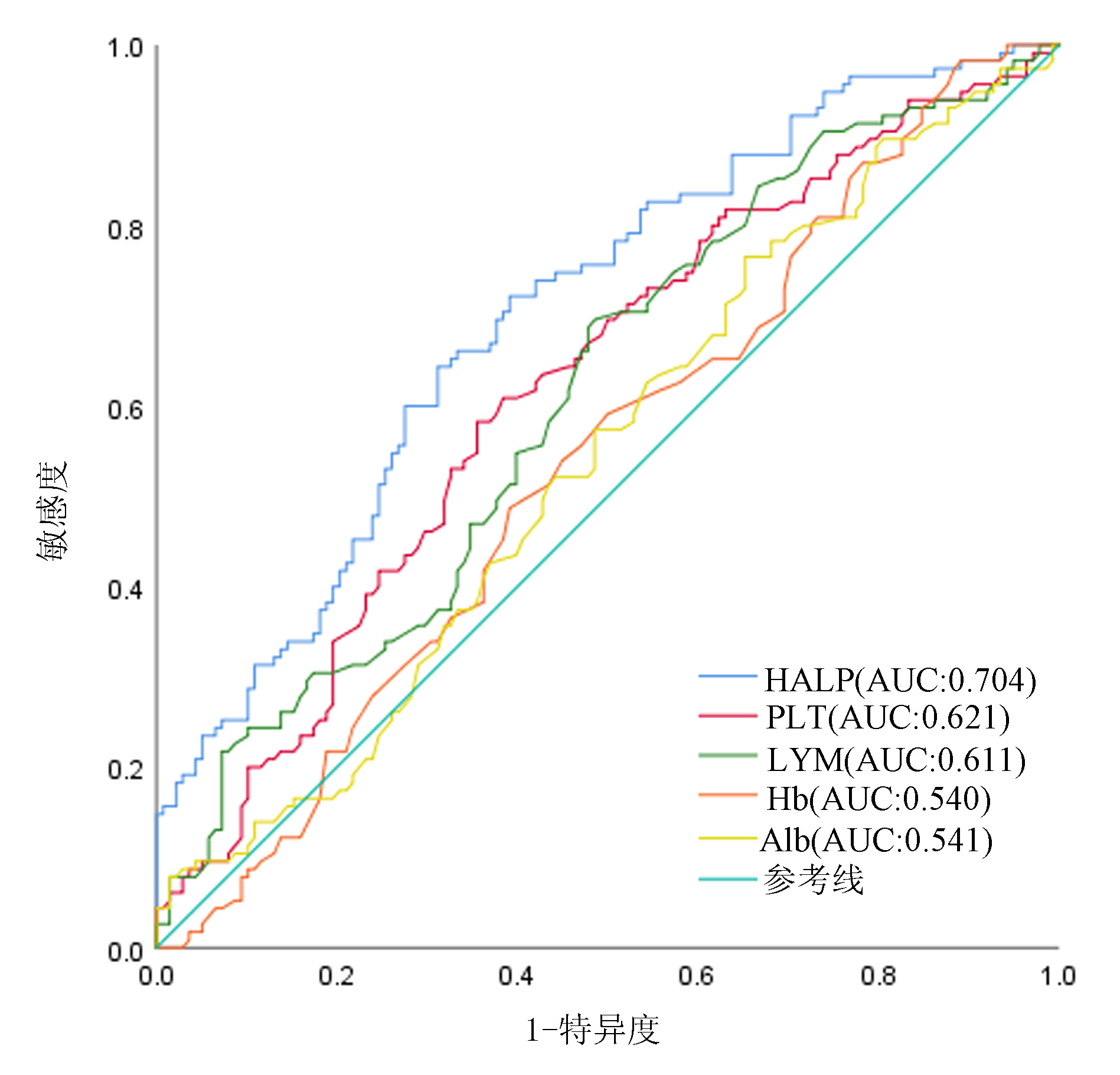
基于术前HALP及其单项指标Alb、LYM、Hb、PLT预测OS绘制ROC曲线(图 1),HALP的ROC曲线下面积(AUC)大于各单项指标,差异均有统计学意义(HALP vs Alb: Z=3.788, P=0.000 2; HALP vs LYM: Z=2.388, P=0.016 9; HALP vs Hb: Z=4.099, P<0.000 1; HALP vs PLT: Z=2.501, P=0.012 4)。根据ROC曲线确定的HALP、NLR、MLR和AST/ALT的最佳截断值见表 1。
表 1 MLR、NLR、AST/ALT、HALP的诊断指标Table 1. Diagnostic indicators for MLR, NLR, AST/ALT, HALP变量 约登指数 截断值 AUC(95%CI) 特异度 敏感度 MLR 0.283 0.39 0.663(0.597~0.729) 0.457 0.826 NLR 0.325 2.92 0.681(0.616~0.746) 0.551 0.774 AST/ALT 0.279 1.02 0.664(0.597~0.730) 0.670 0.609 HALP 0.331 53.22 0.704(0.640~0.767) 0.688 0.643 2.2 HALP与临床特征的关系
本研究共纳入253例患者,其中女37例(14.6%),男216例(85.4%),平均年龄为(51.11±10.81)岁。接受开腹手术的有215例(85.0%),接受腹腔镜手术38例(15.0%)。低分化41例(16.2%),中分化148例(58.5%),高分化64例(25.3%)。253例患者全部获得随访,中位随访时间为37个月,其中115例(45.5%)患者存活,138例(54.5%)患者死亡。
根据最佳截断值将253例肝癌患者分为低HALP组(HALP<53.22)和高HALP组(HALP≥53.22),临床病理特征与HALP之间的关系见表 2。低HALP组患者的肿瘤大小(P<0.001)、分化程度(P=0.041)、手术方式(P=0.003)与高HALP组比较,差异均有统计学意义。
表 2 HCC患者的临床病理特征和HALP评分的关系Table 2. Relationship between clinicopathological characteristics and HALP score of HCC patients临床特征 低HALP组
(n=136)高HALP组
(n=117)χ2值 P值 性别(例) 3.326 0.068 男 111 105 女 25 12 年龄(例) 0.656 0.418 <60岁 107 87 ≥60岁 29 30 TBil(例) 0.168 0.682 <23 μmol/L 112 94 ≥23 μmol/L 24 23 WBC(例) 0.731 0.393 <10×109/L 124 110 ≥10×109/L 12 7 APTT(例) 0.380 0.538 <35 s 48 37 ≥35 s 88 80 GGT(例) 3.132 0.077 <60 U/L 49 55 ≥60 U/L 87 62 ALP(例) 2.925 0.087 <125 U/L 94 92 ≥125 U/L 42 25 AFP(例) 2.308 0.129 <400 ng/mL 78 78 ≥400 ng/mL 58 39 肿瘤大小(例) 19.834 <0.001 ≤5 cm 49 75 >5 cm 87 42 TNM分期(例) 2.878 0.090 Ⅰ+Ⅱ 121 111 Ⅲ+Ⅳ 15 6 分化程度(例) 4.160 0.041 低 28 13 中+高 108 104 手术方式(例) 8.846 0.003 开腹 124 91 腹腔镜 12 26 微血管侵犯(例) 0.127 0.721 无 102 90 有 34 27 HBsAg(例) 2.027 0.155 阴性 18 9 阳性 118 108 BCLC分期(例) 1.301 0.254 0+A 91 86 B+C 45 31 2.3 Kaplan-Meier分析
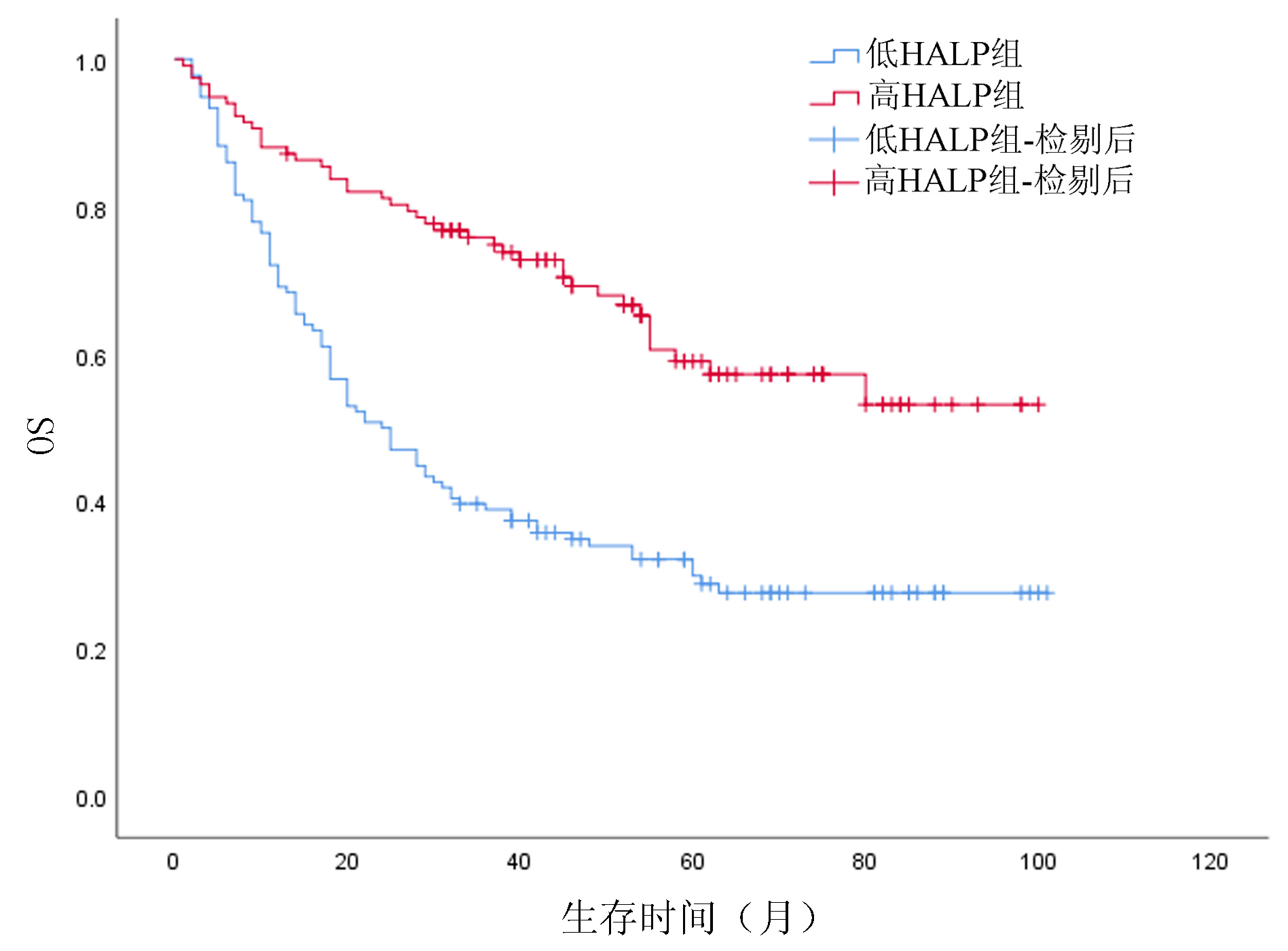
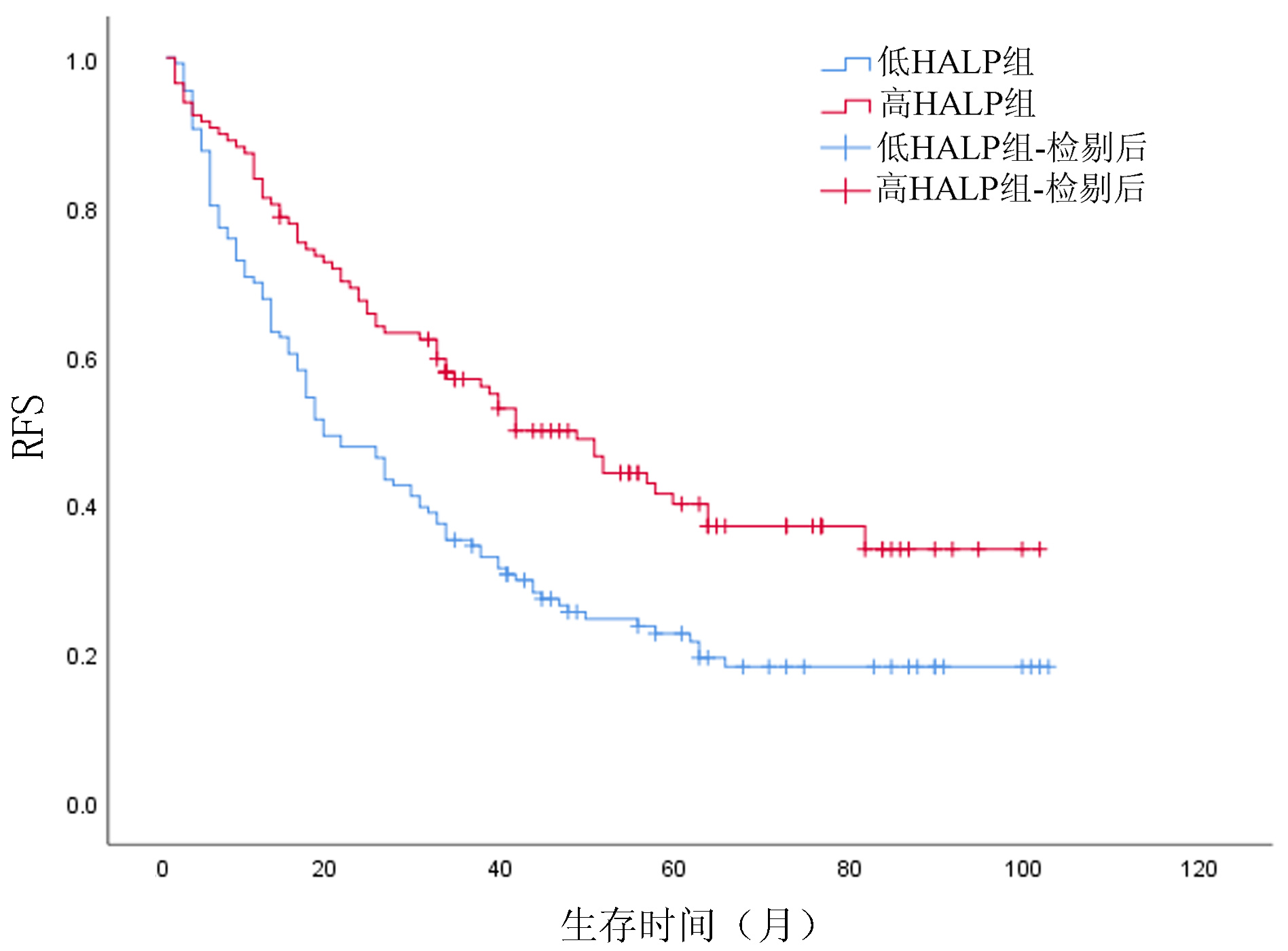
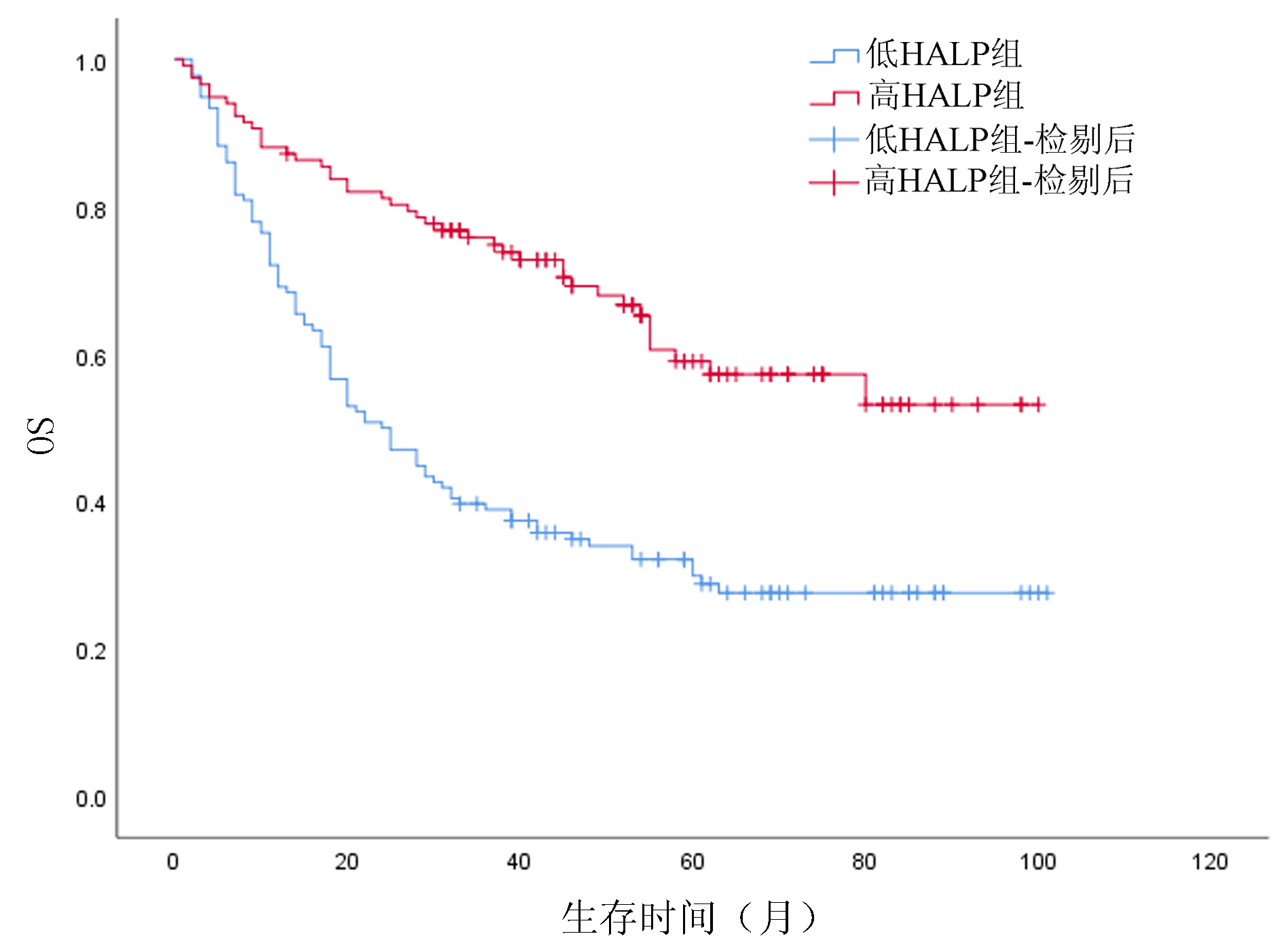
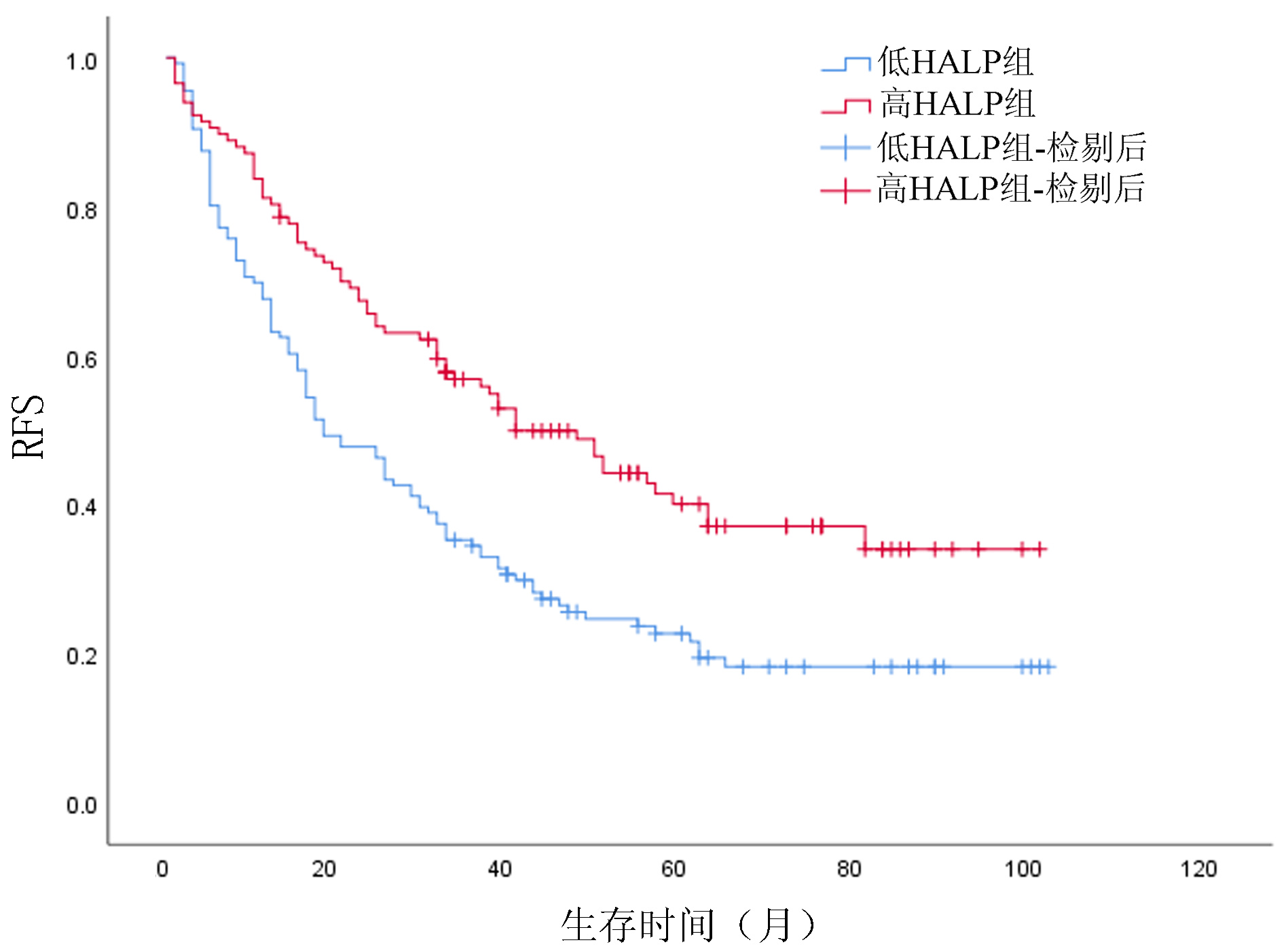
低HALP组患者术后1、3、5年OS分别为69.1%、38.9%、29.9%,高HALP组患者术后1、3、5年OS分别为88.0%、75.8%、59.0%;低HALP组患者术后1、3、5年RFS分别为67.6%、33.0%、21.7%,高HALP组患者术后1、3、5年RFS分别为80.3%、55.9%、40.1%;高HALP组患者OS、RFS优于低HALP组,差异均有统计学意义(χ2值分别为27.699、13.833,P值均<0.001)(图 2、3)。
2.4 HCC患者OS、RFS的单变量和多变量Cox回归分析
单变量Cox回归分析显示WBC、GGT、ALP、AFP、手术方式、微血管侵犯、TNM分期、分化程度、HALP、AST/ALT、NLR、MLR均与OS显著相关(P值均<0.05),将单因素Cox回归分析中有统计学意义的变量纳入多因素Cox回归分析,结果显示HALP、AST/ALT、ALP、AFP、分化程度、TNM分期是HCC患者术后OS的独立影响因素(P值均<0.05)(表 3)。
表 3 HCC患者OS的单因素和多因素分析Table 3. Univariate and multivariate analysis of OS in HCC patients临床特征 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 性别(男/女) 1.125(0.713~1.775) 0.612 年龄(<60岁/≥60岁) 0.809(0.537~1.219) 0.312 TBil(23 μmol/L/≥23 μmol/L) 1.247(0.832~1.869) 0.286 WBC(<10×109/L/≥10×109/L) 1.801(1.052~3.084) 0.032 APTT(<35 s/≥35 s) 1.047(0.733~1.495) 0.800 GGT(<60 U/L/≥60 U/L) 1.552(1.095~2.201) 0.014 ALP(<125 U/L/≥125 U/L) 2.015(1.421~2.857) <0.001 1.502(1.017~2.221) 0.041 AFP(<400 ng/mL/≥400 ng/mL) 2.328(1.665~3.253) <0.001 2.128(1.499~3.020) <0.001 手术方式(开腹/腔镜) 0.519(0.299~0.902) 0.020 术后住院时间(<12 d/≥12 d) 1.374(0.976~1.934) 0.069 HBsAg(阴性/阳性) 1.020(0.597~1.745) 0.941 微血管侵犯(无/有) 1.479(1.010~2.167) 0.045 TNM分期(Ⅰ+Ⅱ/Ⅲ+Ⅳ) 3.745(2.256~6.217) <0.001 2.346(1.318~4.175) 0.004 分化程度(低/中+高) 0.525(0.349~0.787) 0.002 0.643(0.418~0.990) 0.045 HALP(<53.22/≥53.22) 0.395(0.275~0.567) <0.001 0.555(0.373~0.827) 0.004 AST/ALT(<1.02/≥1.02) 1.827(1.297~2.572) 0.001 1.585(1.101~2.282) 0.013 NLR(<2.92/≥2.92) 2.561(1.827~3.590) <0.001 MLR(<0.39/≥0.39) 2.148(1.535~3.005) <0.001 单变量Cox回归分析显示GGT、ALP、AFP、微血管侵犯、TNM分期、分化程度、HALP、AST/ALT、NLR、MLR均与RFS显著相关(P值均<0.05)。将单因素Cox回归分析中有统计学意义的变量纳入多因素Cox回归分析,结果显示HALP、AST/ALT、NLR、ALP、AFP、TNM分期是HCC患者术后RFS的独立影响因素(P值均<0.05)(表 4)。
表 4 HCC患者RFS的单因素和多因素分析Table 4. Univariate and multivariate analysis of RFS in HCC patients临床特征 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 性别(男/女) 0.830(0.535~1.287) 0.404 年龄(<60岁/≥60岁) 0.896(0.627~1.279) 0.544 TBil(23 μmol/L/≥23 μmol/L) 1.140(0.787~1.651) 0.489 WBC(<10×109/L/≥10×109/L) 1.601(0.955~2.683) 0.074 APTT(<35 s/≥35 s) 1.242(0.899~1.716) 0.189 GGT(<60 U/L/≥60 U/L) 1.433(1.054~1.947) 0.022 ALP(<125 U/L /≥125 U/L) 1.930(1.403~2.653) <0.001 1.535(1.070~2.202) 0.020 AFP(<400 ng/mL/≥400 ng/mL) 1.630(1.207~2.201) 0.001 1.498(1.101~2.038) 0.010 手术方式(开腹/腔镜) 0.672(0.426~1.060) 0.087 术后住院时间(<12 d/≥12 d) 1.105(0.819~1.492) 0.513 HBsAg(阴性/阳性) 0.955(0.605~1.507) 0.842 微血管侵犯(无/有) 1.510(1.074~2.121) 0.018 TNM分期(Ⅰ+Ⅱ/Ⅲ+Ⅳ) 2.839(1.732~4.656) <0.001 1.919(1.107~3.325) 0.020 分化程度(低/中+高) 0.652(0.446~0.953) 0.027 HALP(<53.22/≥53.22) 0.568(0.419~0.771) <0.001 0.704(0.503~0.985) 0.041 AST/ALT(<1.02/≥1.02) 1.465(1.087~1.974) 0.012 1.378(1.004~1.891) 0.047 NLR(<2.92/≥2.92) 1.955(1.451~2.634) <0.001 1.476(1.014~2.150) 0.042 MLR(<0.39/≥0.39) 1.696(1.253~2.296) 0.001 2.5 基于HALP评分的列线图模型
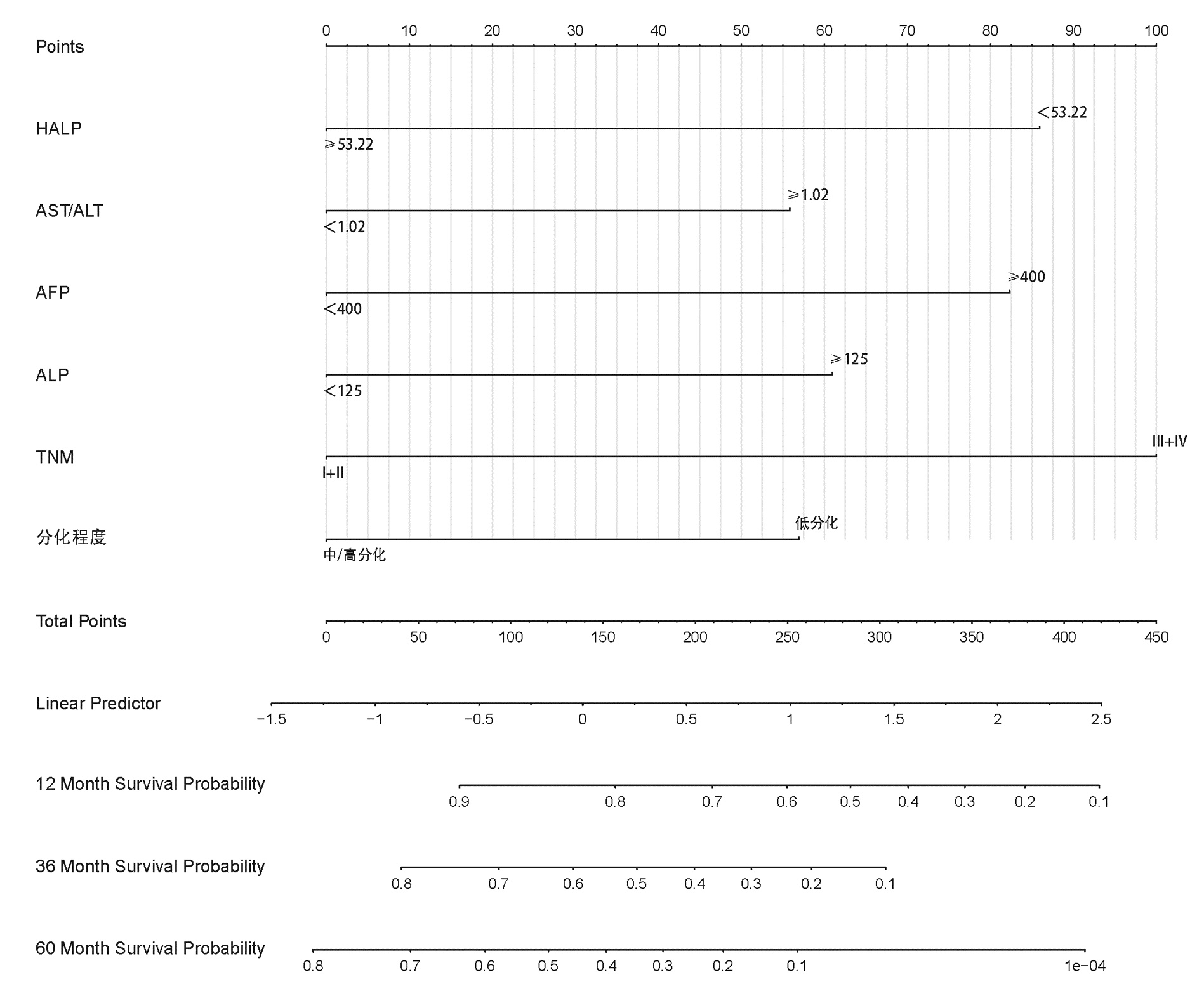
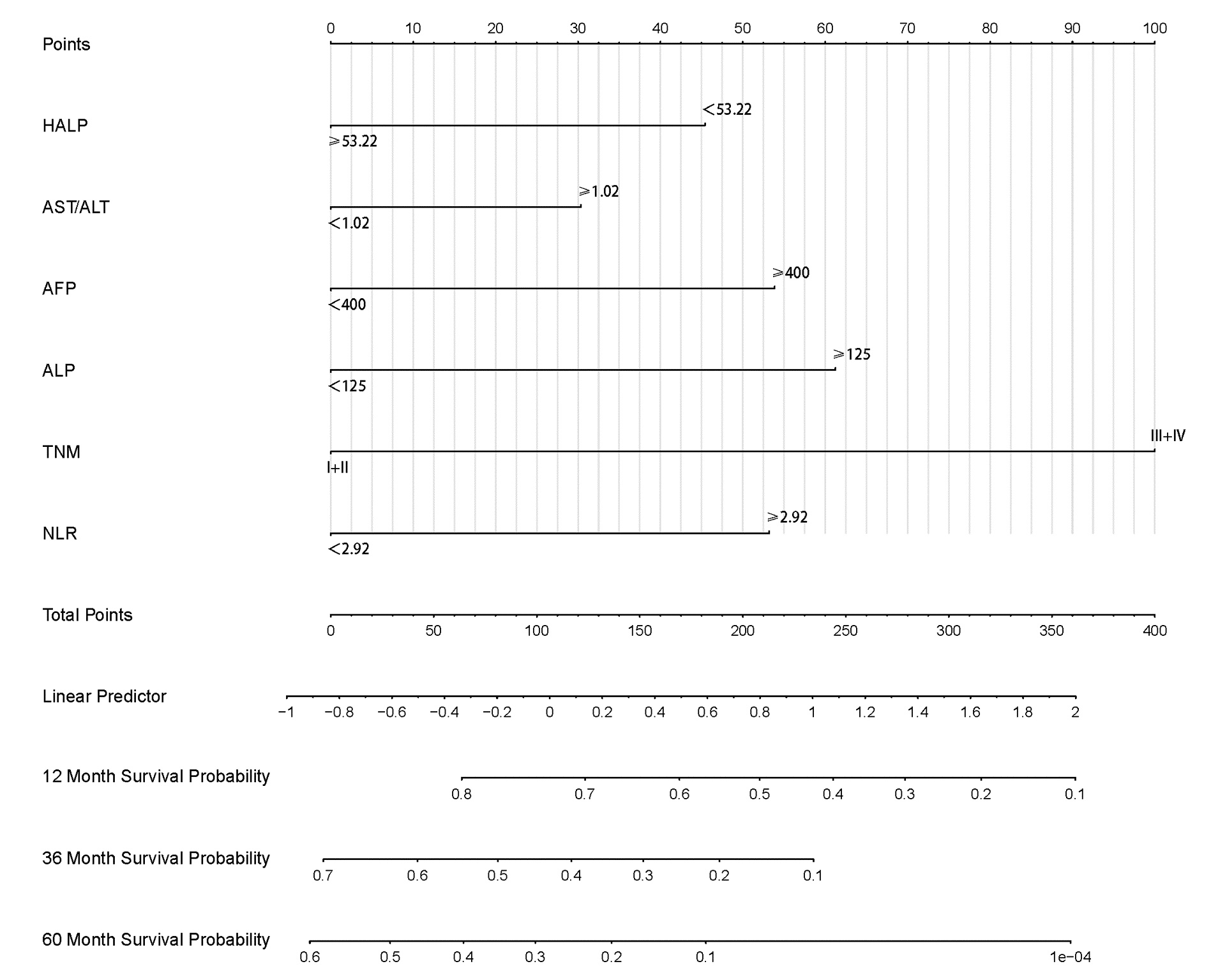
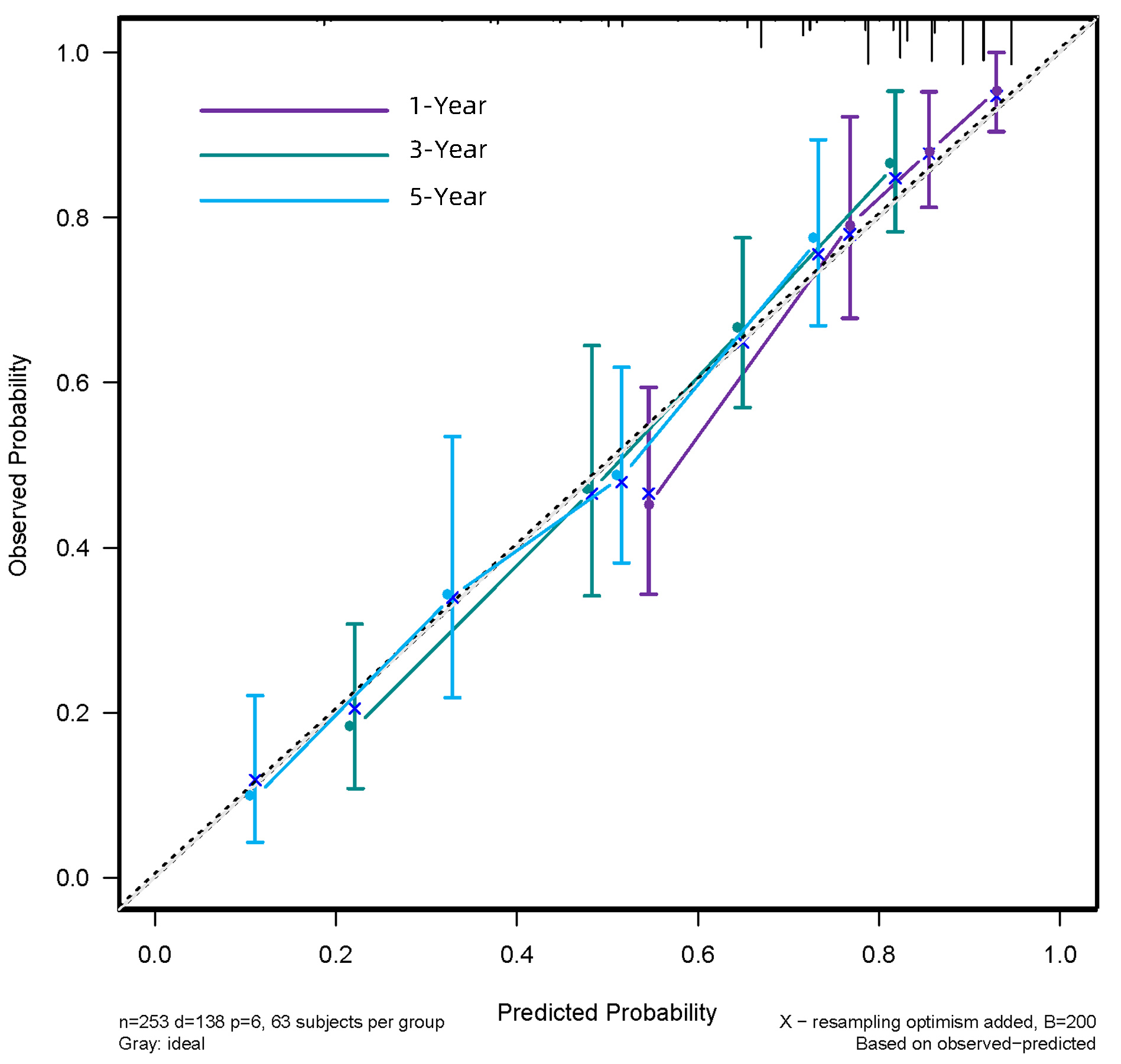
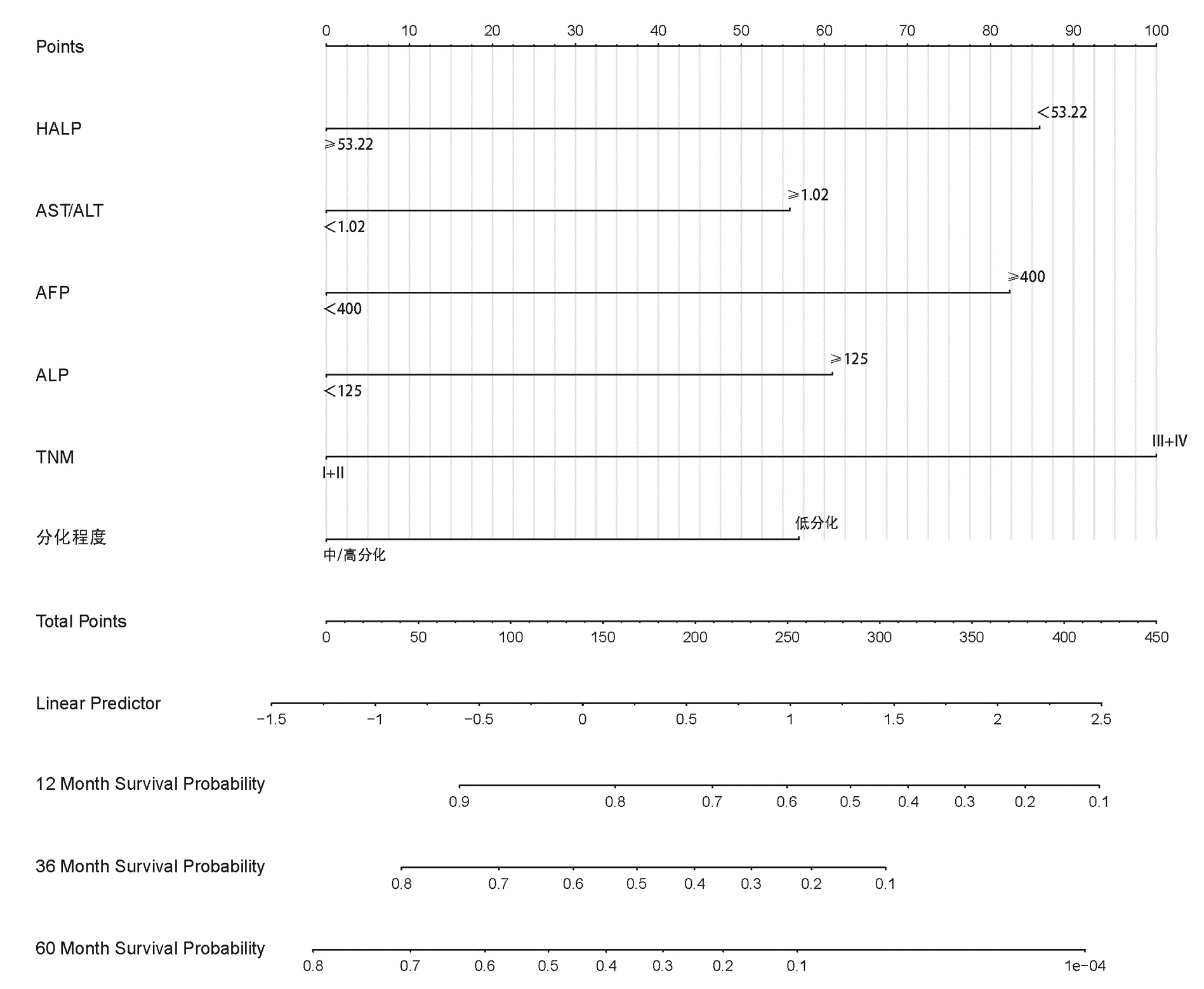
根据多因素分析结果分别构建HCC患者OS、RFS的列线图(图 4、5),计算预测OS列线图的C指数为0.732(0.691~0.774),预测1、3、5年生存率的AUC分别为0.795、0.791、0.775。
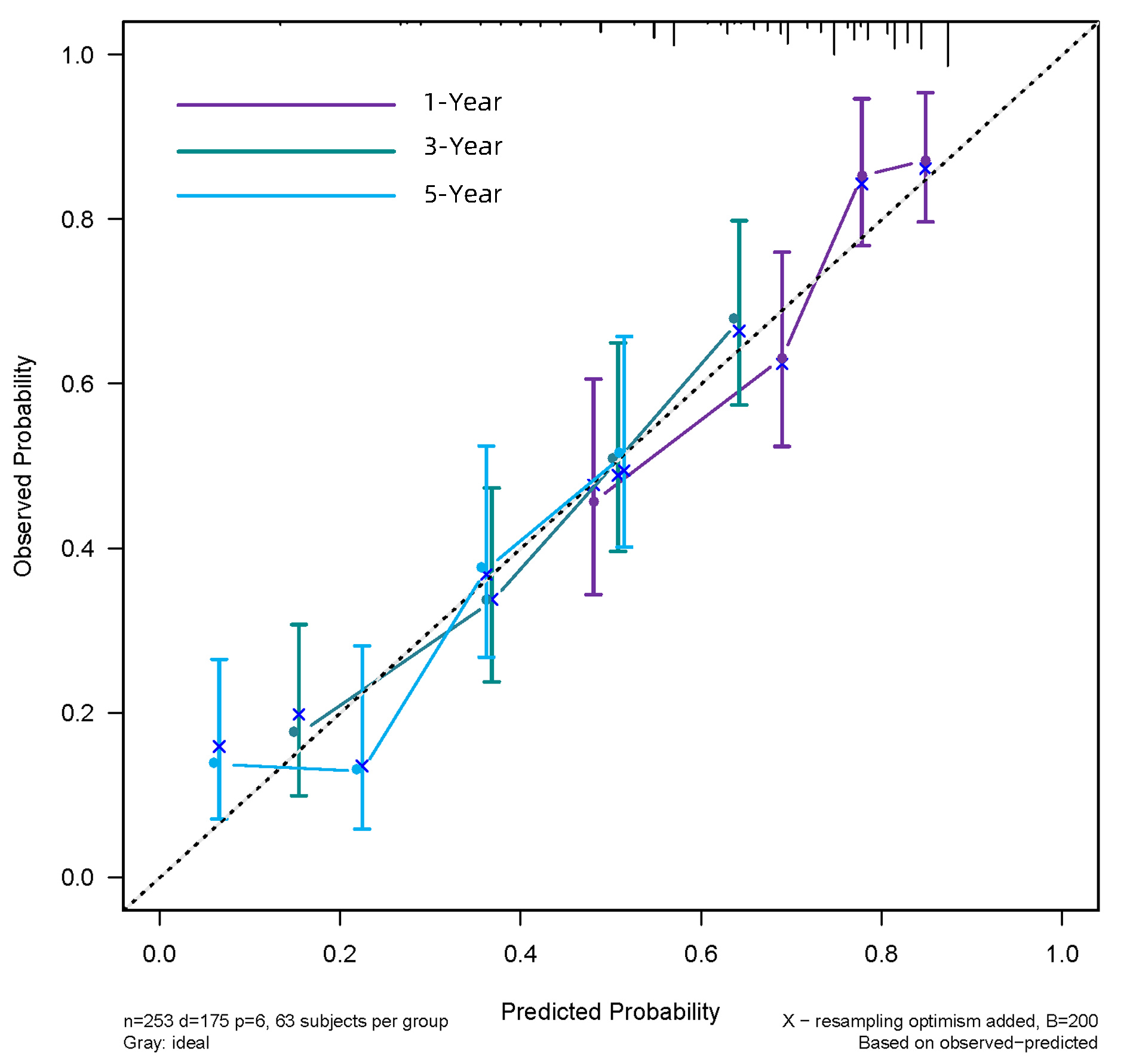
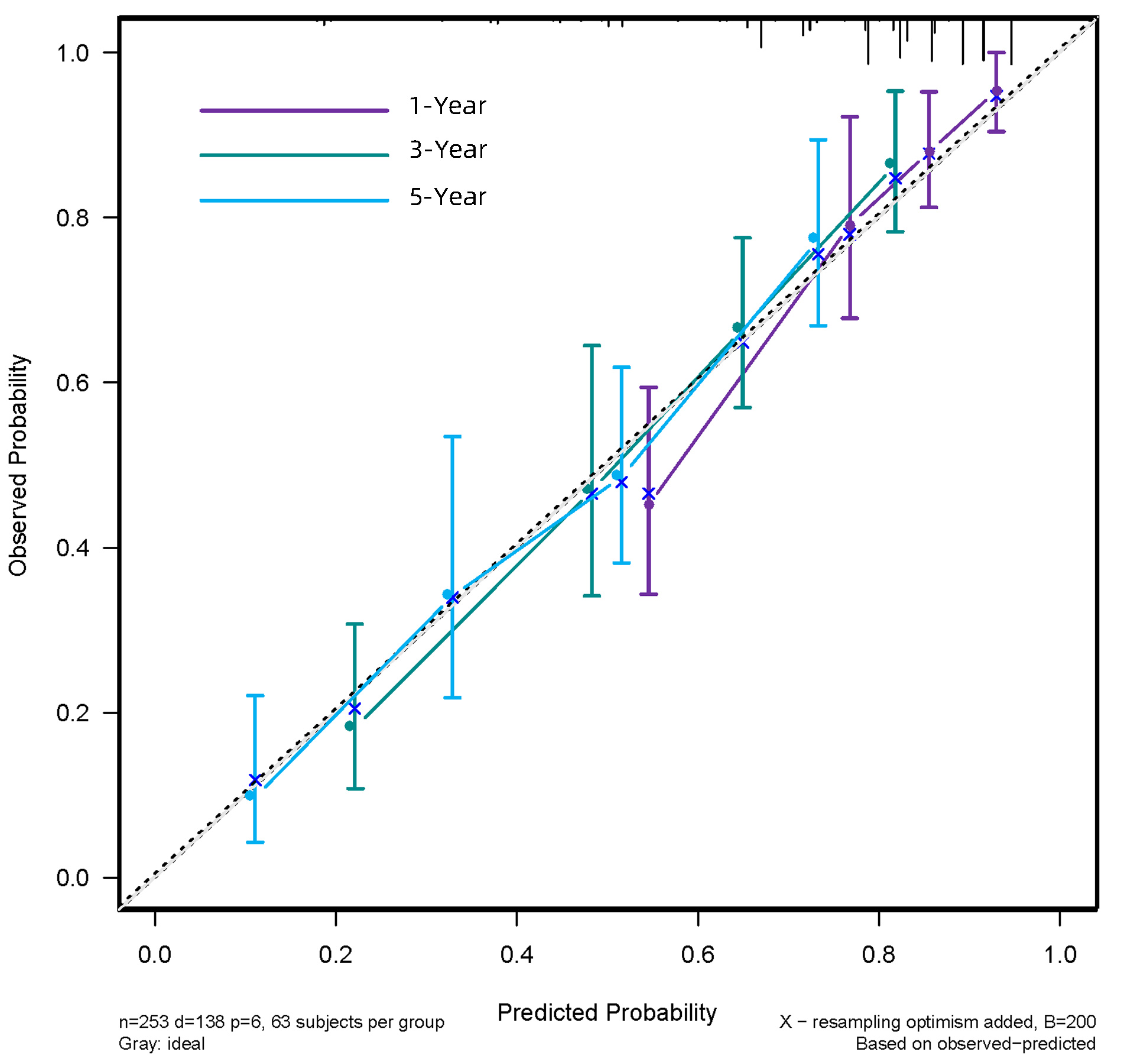
预测RFS列线图的C指数为0.677(0.637~0.717),预测1、3、5年生存率的AUC分别为0.742、0.733、0.716。列线图预测1、3、5年OS及RFS的校准曲线在模型内验证表现良好(图 6、7);通过NRI和IDI可说明列线图模型与传统的BCLC分期模型相比,具有较好的预测能力(表 5)。
表 5 列线图与BCLC分期的预测价值比较Table 5. Comparison of the predictive value of nomograms with BCLC staging模型 NRI(95%CI) P值 IDI(95%CI) P值 BCLC分期 Reference Reference OS列线图 0.307(0.101~0.515) <0.000 1 0.307(0.139~0.415) <0.000 1 RFS列线图 0.754(0.557~0.885) <0.000 1 0.700(0.548~0.788) <0.000 1 3. 讨论
本研究首次证明了低HALP评分(<53.22)是HCC患者较差OS、RFS的独立影响因素。随后开发了基于HALP评分的列线图模型,并以C指数为0.732、0.677的准确度预测HCC患者的OS及RFS。HALP作为一种既反映机体炎症状态,又反应营养状况的综合指标,HALP评分的预测作用将有助于临床医生更准确地及时识别高危患者,并在术后提供合理的治疗选择。
早在19世纪,Virchow等[15-16]发现癌细胞基质中浸润着大量炎症细胞,肿瘤的发展可能与炎症反应有关。近年来,关于癌症进展和炎症反应、营养状况之间关系的证据越来越多[17]。Hb、Alb水平反映了全身营养状况,由于恶性肿瘤是一种慢性消耗疾病,超过30%的患者在诊断时会出现癌症相关性贫血[18],并且许多研究表明Hb下降与恶性肿瘤的预后密切相关[19-20]。有研究提出,肿瘤细胞分泌的肿瘤坏死因子-α和IL- 6可以通过改变造血环境来降低Hb水平[21],并且贫血造成的缺氧可能增强肿瘤的恶性进展和侵袭性,最终导致肿瘤对治疗的抵抗力增加和长期预后不良[22]。低水平的Alb表明肝脏中蛋白质合成功能障碍,这最终可能会损害机体免疫力[23]。并且,Güç等[24]研究表明低Alb血症可能导致机体对癌细胞的免疫反应较弱,从而促进肿瘤的发展。LYM和PLT是全身炎症反应的基本组成部分,LYM是杀伤肿瘤最重要的细胞,当LYM相对或绝对减少时,其抗肿瘤作用也会降低。LYM包括CD4+细胞、CD8+细胞等,CD4+细胞通过促进B淋巴细胞产生抗体、诱导CD8+分化而发挥增强抗肿瘤免疫反应的作用,LYM还可转化为CD8+细胞识别肿瘤抗原并直接清除肿瘤细胞,从而显示出抗肿瘤作用[25-26]。此外,血浆PLT水平与肿瘤侵袭和转移有关,其中的机制可能是PLT可通过形成肿瘤血栓促进肿瘤细胞与血管内皮的黏附,并且肿瘤血栓作为屏障保护肿瘤细胞免受自然杀伤细胞介导的裂解[27],肿瘤细胞还通过PLT介导的TGF-β/Smad途径获得侵袭和转移能力[28],从而加速癌症发展的进程。
AST和ALT是广泛存在于肝脏中的酶,当肝细胞受损时,AST和ALT被释放到血液中,因此检测转氨酶水平可以反应肝癌的进展。Zhang等[11]研究发现,血清AST/ALT水平是肝癌术后重要的预后因素,高AST/ALT组原发性肝癌患者的生存时间较短,这与本研究结论一致。由于AST/ALT是非酒精性脂肪肝患者纤维化的危险因素[29],并且严重的肝纤维化会导致肝硬化进而发展成肝癌,因此推测AST/ALT比值可能与肝癌的进展相关。此外,ALP水平已被广泛用于评估肝癌患者的预后,Xu等[30]和Wu等[31]研究表明升高的ALP水平是HCC患者的风险预测因子,高水平的ALP可以反映肿瘤的负担过重,提示肝癌预后不良。在本研究中,TNM分期及AFP水平也是HCC患者预后的独立危险因素,相关研究[32]表明,AFP水平不仅可以反映肿瘤细胞的增殖和迁移,还可以反映潜在的肝坏死和再生,可作为HCC预后的重要指标。目前,预测HCC预后尚无统一的标准,AJCC分期、BCLC分期作为常用的肿瘤分期系统,两者互有优劣,AJCC分期被证实对HCC患者的预后具有较好的预测价值[33];BCLC分期系统通常用于将HCC患者分为不同的阶段,以提供更佳的临床管理,但较AJCC分期而言却忽略了与HCC预后相关的重要因素,如远处转移、淋巴结转移等,本研究列线图纳入了肿瘤分化程度、TNM分期、炎症相关标志物,可被视为一个相对完善的预测系统。本研究结果显示列线图模型优于BCLC分期,具有更好的预测HCC患者预后的能力。
既往有研究报道了高NLR和MLR值与HCC患者的不良预后相关。然而,本研究通过多变量分析发现MLR与HCC患者预后没有统计学上的显著关联,这与Mai等[34]研究结果相同,并且笔者发现NLR仅与HCC患者的RFS显著相关,而与OS无关,造成这样的结果可能是因为患者个体化的差异,使用了不同的截断值所导致。
总之,HALP评分是预测接受肝切除术的HCC患者预后的可靠、简单、易于获取且价格低廉的指标。HALP评分可用于指导不同HCC患者的风险分级和治疗策略的选择。基于HALP的列线图可以较为客观、准确地预测HCC患者肝切除术后的生存情况。但本研究样本量较小,且为单中心回顾性,尽管本研究纳入的患者具有完整数据和长期随访的结果,但未来仍需要多中心、大型前瞻性研究来证实这些结论。
-
表 1 MLR、NLR、AST/ALT、HALP的诊断指标
Table 1. Diagnostic indicators for MLR, NLR, AST/ALT, HALP
变量 约登指数 截断值 AUC(95%CI) 特异度 敏感度 MLR 0.283 0.39 0.663(0.597~0.729) 0.457 0.826 NLR 0.325 2.92 0.681(0.616~0.746) 0.551 0.774 AST/ALT 0.279 1.02 0.664(0.597~0.730) 0.670 0.609 HALP 0.331 53.22 0.704(0.640~0.767) 0.688 0.643 表 2 HCC患者的临床病理特征和HALP评分的关系
Table 2. Relationship between clinicopathological characteristics and HALP score of HCC patients
临床特征 低HALP组
(n=136)高HALP组
(n=117)χ2值 P值 性别(例) 3.326 0.068 男 111 105 女 25 12 年龄(例) 0.656 0.418 <60岁 107 87 ≥60岁 29 30 TBil(例) 0.168 0.682 <23 μmol/L 112 94 ≥23 μmol/L 24 23 WBC(例) 0.731 0.393 <10×109/L 124 110 ≥10×109/L 12 7 APTT(例) 0.380 0.538 <35 s 48 37 ≥35 s 88 80 GGT(例) 3.132 0.077 <60 U/L 49 55 ≥60 U/L 87 62 ALP(例) 2.925 0.087 <125 U/L 94 92 ≥125 U/L 42 25 AFP(例) 2.308 0.129 <400 ng/mL 78 78 ≥400 ng/mL 58 39 肿瘤大小(例) 19.834 <0.001 ≤5 cm 49 75 >5 cm 87 42 TNM分期(例) 2.878 0.090 Ⅰ+Ⅱ 121 111 Ⅲ+Ⅳ 15 6 分化程度(例) 4.160 0.041 低 28 13 中+高 108 104 手术方式(例) 8.846 0.003 开腹 124 91 腹腔镜 12 26 微血管侵犯(例) 0.127 0.721 无 102 90 有 34 27 HBsAg(例) 2.027 0.155 阴性 18 9 阳性 118 108 BCLC分期(例) 1.301 0.254 0+A 91 86 B+C 45 31 表 3 HCC患者OS的单因素和多因素分析
Table 3. Univariate and multivariate analysis of OS in HCC patients
临床特征 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 性别(男/女) 1.125(0.713~1.775) 0.612 年龄(<60岁/≥60岁) 0.809(0.537~1.219) 0.312 TBil(23 μmol/L/≥23 μmol/L) 1.247(0.832~1.869) 0.286 WBC(<10×109/L/≥10×109/L) 1.801(1.052~3.084) 0.032 APTT(<35 s/≥35 s) 1.047(0.733~1.495) 0.800 GGT(<60 U/L/≥60 U/L) 1.552(1.095~2.201) 0.014 ALP(<125 U/L/≥125 U/L) 2.015(1.421~2.857) <0.001 1.502(1.017~2.221) 0.041 AFP(<400 ng/mL/≥400 ng/mL) 2.328(1.665~3.253) <0.001 2.128(1.499~3.020) <0.001 手术方式(开腹/腔镜) 0.519(0.299~0.902) 0.020 术后住院时间(<12 d/≥12 d) 1.374(0.976~1.934) 0.069 HBsAg(阴性/阳性) 1.020(0.597~1.745) 0.941 微血管侵犯(无/有) 1.479(1.010~2.167) 0.045 TNM分期(Ⅰ+Ⅱ/Ⅲ+Ⅳ) 3.745(2.256~6.217) <0.001 2.346(1.318~4.175) 0.004 分化程度(低/中+高) 0.525(0.349~0.787) 0.002 0.643(0.418~0.990) 0.045 HALP(<53.22/≥53.22) 0.395(0.275~0.567) <0.001 0.555(0.373~0.827) 0.004 AST/ALT(<1.02/≥1.02) 1.827(1.297~2.572) 0.001 1.585(1.101~2.282) 0.013 NLR(<2.92/≥2.92) 2.561(1.827~3.590) <0.001 MLR(<0.39/≥0.39) 2.148(1.535~3.005) <0.001 表 4 HCC患者RFS的单因素和多因素分析
Table 4. Univariate and multivariate analysis of RFS in HCC patients
临床特征 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 性别(男/女) 0.830(0.535~1.287) 0.404 年龄(<60岁/≥60岁) 0.896(0.627~1.279) 0.544 TBil(23 μmol/L/≥23 μmol/L) 1.140(0.787~1.651) 0.489 WBC(<10×109/L/≥10×109/L) 1.601(0.955~2.683) 0.074 APTT(<35 s/≥35 s) 1.242(0.899~1.716) 0.189 GGT(<60 U/L/≥60 U/L) 1.433(1.054~1.947) 0.022 ALP(<125 U/L /≥125 U/L) 1.930(1.403~2.653) <0.001 1.535(1.070~2.202) 0.020 AFP(<400 ng/mL/≥400 ng/mL) 1.630(1.207~2.201) 0.001 1.498(1.101~2.038) 0.010 手术方式(开腹/腔镜) 0.672(0.426~1.060) 0.087 术后住院时间(<12 d/≥12 d) 1.105(0.819~1.492) 0.513 HBsAg(阴性/阳性) 0.955(0.605~1.507) 0.842 微血管侵犯(无/有) 1.510(1.074~2.121) 0.018 TNM分期(Ⅰ+Ⅱ/Ⅲ+Ⅳ) 2.839(1.732~4.656) <0.001 1.919(1.107~3.325) 0.020 分化程度(低/中+高) 0.652(0.446~0.953) 0.027 HALP(<53.22/≥53.22) 0.568(0.419~0.771) <0.001 0.704(0.503~0.985) 0.041 AST/ALT(<1.02/≥1.02) 1.465(1.087~1.974) 0.012 1.378(1.004~1.891) 0.047 NLR(<2.92/≥2.92) 1.955(1.451~2.634) <0.001 1.476(1.014~2.150) 0.042 MLR(<0.39/≥0.39) 1.696(1.253~2.296) 0.001 表 5 列线图与BCLC分期的预测价值比较
Table 5. Comparison of the predictive value of nomograms with BCLC staging
模型 NRI(95%CI) P值 IDI(95%CI) P值 BCLC分期 Reference Reference OS列线图 0.307(0.101~0.515) <0.000 1 0.307(0.139~0.415) <0.000 1 RFS列线图 0.754(0.557~0.885) <0.000 1 0.700(0.548~0.788) <0.000 1 -
[1] General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer (2022 edition)[J]. J Clin Hepatol, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.国家卫生健康委办公厅. 原发性肝癌诊疗指南(2022年版)[J]. 临床肝胆病杂志, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009. [2] XIAN LF, FANG LT, LIU WB, et al. Epidemic status, main pathogenesis, and prevention and control strategies of primary liver cancer[J]. Chin J Oncol Prev Treat, 2022, 14(3): 320-328. DOI: 10.3969/j.issn.1674-5671.2022.03.13.鲜林峰, 方乐天, 刘文斌, 等. 原发性肝癌流行现状、主要发病机制及防控策略[J]. 中国癌症防治杂志, 2022, 14(3): 320-328. DOI: 10.3969/j.issn.1674-5671.2022.03.13. [3] YUAN Y, YANG F, WANG Y, et al. Factors associated with liver cancer prognosis after hepatectomy: A retrospective cohort study[J]. Medicine (Baltimore), 2021, 100(42): e27378. DOI: 10.1097/MD.0000000000027378. [4] MCMILLAN DC. Systemic inflammation, nutritional status and survival in patients with cancer[J]. Curr Opin Clin Nutr Metab Care, 2009, 12(3): 223-226. DOI: 10.1097/MCO.0b013e32832a7902. [5] CHOI J, KIM SH, HAN S, et al. A simple and clinically applicable model to predict liver-related morbidity after hepatic resection for hepatocellular carcinoma[J]. PLoS One, 2020, 15(11): e0241808. DOI: 10.1371/journal.pone.0241808. [6] WAN S, LAI Y, MYERS RE, et al. Post-diagnosis hemoglobin change associates with overall survival of multiple malignancies - results from a 14-year hospital-based cohort of lung, breast, colorectal, and liver cancers[J]. BMC Cancer, 2013, 13: 340. DOI: 10.1186/1471-2407-13-340. [7] HONG YM, YOON KT, HWANG TH, et al. Pretreatment peripheral neutrophils, lymphocytes and monocytes predict long-term survival in hepatocellular carcinoma[J]. BMC Cancer, 2020, 20(1): 937. DOI: 10.1186/s12885-020-07105-8. [8] LU L, SU Z, ZHENG P, et al. Association between platelet count and hepatocellular carcinoma overall survival: a large retrospective cohort study[J]. BMJ Open, 2020, 10(11): e038172. DOI: 10.1136/bmjopen-2020-038172. [9] JOHNSON PJ, DHANARAJ S, BERHANE S, et al. The prognostic and diagnostic significance of the neutrophil-to-lymphocyte ratio in hepatocellular carcinoma: a prospective controlled study[J]. Br J Cancer, 2021, 125(5): 714-716. DOI: 10.1038/s41416-021-01445-3. [10] WU Y, TU C, SHAO C. Inflammatory indexes in preoperative blood routine to predict early recurrence of hepatocellular carcinoma after curative hepatectomy[J]. BMC Surg, 2021, 21(1): 178. DOI: 10.1186/s12893-021-01180-9. [11] ZHANG LX, LV Y, XU AM, et al. The prognostic significance of serum gamma-glutamyltransferase levels and AST/ALT in primary hepatic carcinoma[J]. BMC Cancer, 2019, 19(1): 841. DOI: 10.1186/s12885-019-6011-8. [12] FENG JF, WANG L, YANG X. The preoperative hemoglobin, albumin, lymphocyte and platelet (HALP) score is a useful predictor in patients with resectable esophageal squamous cell carcinoma[J]. Bosn J Basic Med Sci, 2021, 21(6): 773-781. DOI: 10.17305/bjbms.2021.5666. [13] XU SS, LI S, XU HX, et al. Haemoglobin, albumin, lymphocyte and platelet predicts postoperative survival in pancreatic cancer[J]. World J Gastroenterol, 2020, 26(8): 828-838. DOI: 10.3748/wjg.v26.i8.828. [14] CHEN XL, XUE L, WANG W, et al. Prognostic significance of the combination of preoperative hemoglobin, albumin, lymphocyte and platelet in patients with gastric carcinoma: a retrospective cohort study[J]. Oncotarget, 2015, 6(38): 41370-41382. DOI: 10.18632/oncotarget.5629. [15] VIRCHOW R. An address on the value of pathological experiments[J]. Br Med J, 1881, 2(1075): 198-203. DOI: 10.1136/bmj.2.1075.198. [16] QIAN S, GOLUBNITSCHAJA O, ZHAN X. Chronic inflammation: key player and biomarker-set to predict and prevent cancer development and progression based on individualized patient profiles[J]. EPMA J, 2019, 10(4): 365-381. DOI: 10.1007/s13167-019-00194-x. [17] GRIVENNIKOV SI, GRETEN FR, KARIN M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883-899. DOI: 10.1016/j.cell.2010.01.025. [18] MADEDDU C, GRAMIGNANO G, ASTARA G, et al. Pathogenesis and treatment options of cancer related anemia: perspective for a targeted mechanism-based approach[J]. Front Physiol, 2018, 9: 1294. DOI: 10.3389/fphys.2018.01294. [19] PERGIALIOTIS V, DASKALAKIS G, THOMAKOS N, et al. Prechemotherapy hemoglobin levels as a predictive factor of ovarian cancer survival: a systematic review and meta-analysis[J]. Am J Clin Oncol, 2019, 42(9): 725-731. DOI: 10.1097/COC.0000000000000570. [20] HUANG XZ, YANG YC, CHEN Y, et al. Preoperative anemia or low hemoglobin predicts poor prognosis in gastric cancer patients: a meta-analysis[J]. Dis Markers, 2019, 2019: 7606128. DOI: 10.1155/2019/7606128. [21] BANZET S, SANCHEZ H, CHAPOT R, et al. Interleukin-6 contributes to hepcidin mRNA increase in response to exercise[J]. Cytokine, 2012, 58(2): 158-161. DOI: 10.1016/j.cyto.2012.01.006. [22] VAUPEL P. The role of hypoxia-induced factors in tumor progression[J]. Oncologist, 2004, 9(Suppl 5): 10-17. DOI: 10.1634/theoncologist.9-90005-10. [23] WANG L, LI Q, ZHANG J, et al. A novel prognostic scoring model based on albumin and γ-glutamyltransferase for hepatocellular carcinoma prognosis[J]. Cancer Manag Res, 2019, 11: 10685-10694. DOI: 10.2147/CMAR.S232073. [24] GÜÇ ZG, ALACACıOǦLU A, KALENDER ME, et al. HALP score and GNRI: Simple and easily accessible indexes for predicting prognosis in advanced stage NSCLC patients. The İzmir oncology group (IZOG) study[J]. Front Nutr, 2022, 9: 905292. DOI: 10.3389/fnut.2022.905292. [25] JANSSEN EM, LEMMENS EE, WOLFE T, et al. CD4+ T cells are required for secondary expansion and memory in CD8+ T lymphocytes[J]. Nature, 2003, 421(6925): 852-856. DOI: 10.1038/nature01441. [26] KENNEDY R, CELIS E. Multiple roles for CD4+ T cells in anti-tumor immune responses[J]. Immunol Rev, 2008, 222: 129-144. DOI: 10.1111/j.1600-065X.2008.00616.x. [27] GAY LJ, FELDING-HABERMANN B. Contribution of platelets to tumour metastasis[J]. Nat Rev Cancer, 2011, 11(2): 123-134. DOI: 10.1038/nrc3004. [28] LABELLE M, BEGUM S, HYNES RO. Direct signaling between platelets and cancer cells induces an epithelial-mesenchymal-like transition and promotes metastasis[J]. Cancer Cell, 2011, 20(5): 576-590. DOI: 10.1016/j.ccr.2011.09.009. [29] CICHOŻ -LACH H, CELŃSKI K, PROZOROW-KRÓL B, et al. The BARD score and the NAFLD fibrosis score in the assessment of advanced liver fibrosis in nonalcoholic fatty liver disease[J]. Med Sci Monit, 2012, 18(12): CR735-740. DOI: 10.12659/msm.883601. [30] XU XS, WAN Y, SONG SD, et al. Model based on γ-glutamyltransferase and alkaline phosphatase for hepatocellular carcinoma prognosis[J]. World J Gastroenterol, 2014, 20(31): 10944-10952. DOI: 10.3748/wjg.v20.i31.10944. [31] WU SJ, LIN YX, YE H, et al. Prognostic value of alkaline phosphatase, gamma-glutamyl transpeptidase and lactate dehydrogenase in hepatocellular carcinoma patients treated with liver resection[J]. Int J Surg, 2016, 36(Pt A): 143-151. DOI: 10.1016/j.ijsu.2016.10.033. [32] GUO C, LIANG H, YUAN W, et al. Analysis on the value of soluble intercellular adhesion molecule-1 (sICAM-1), alpha fetoprotein (AFP), and aspartate aminotransferase/platelet ratio index (APRI) in predicting the prognostic survival of patients with primary liver cancer after radiofrequency ablation[J]. Ann Palliat Med, 2021, 10(4): 4760-4767. DOI: 10.21037/apm-21-749. [33] CHUN YH, KIM SU, PARK JY, et al. Prognostic value of the 7th edition of the AJCC staging system as a clinical staging system in patients with hepatocellular carcinoma[J]. Eur J Cancer, 2011, 47(17): 2568-2575. DOI: 10.1016/j.ejca.2011.07.002. [34] MAI RY, BAI T, LUO XL, et al. Preoperative fibrinogen-to-albumin ratio predicts the prognosis of patients with hepatocellular carcinoma subjected to hepatectomy[J]. BMC Gastroenterol, 2022, 22(1): 261. DOI: 10.1186/s12876-022-02328-4. 期刊类型引用(6)
1. 高婧婧,高永霞. 暴发性心肌炎体外膜肺氧合延迟拔管的危险因素及预测模型. 临床心血管病杂志. 2025(01): 44-49 .  百度学术
百度学术2. 张强,王广才,杨方波,李存彪,刘娜,杨波. 术前CT定量参数与肝动脉化疗栓塞术后肝癌患者预后的相关性及预后预测列线图模型的构建. 新乡医学院学报. 2024(04): 343-347 .  百度学术
百度学术3. 曹英武,陆海涛,陈盈君,赵乐. 基于骨密度和临床特征分析的老年髋部骨折CT影像特征及危险因素预测. 分子影像学杂志. 2024(06): 632-637 .  百度学术
百度学术4. 付相玉,江致贤,严芝强,左石. 术前SII联合FAR构建的列线图模型对Child-Pugh A级HCC患者术后生存期的预测价值. 贵州医科大学学报. 2024(07): 1026-1034 .  百度学术
百度学术5. 孔丽丽,李翠. 术前HALP评分对老年结直肠癌患者根治术后肠梗阻发生的预测价值. 国际老年医学杂志. 2024(05): 566-570 .  百度学术
百度学术6. 任秀芹,秦素萍,吴贤翠,俞颖. 治疗前HALP评分和NLR对食管癌放化疗患者预后的预测价值. 临床肿瘤学杂志. 2024(07): 671-675 .  百度学术
百度学术其他类型引用(0)
-




 PDF下载 ( 2967 KB)
PDF下载 ( 2967 KB)


 下载:
下载:






 下载:
下载:


 百度学术
百度学术