聚乙二醇干扰素α-2b治疗HBeAg阴性慢性乙型肝炎患者实现HBsAg清除的预测因素及列线图构建
DOI: 10.3969/j.issn.1001-5256.2023.12.010
Predictors of HBsAg clearance in HBeAg-negative chronic hepatitis B patients treated with pegylated interferon α-2b and the construction of a nomogram model
-
摘要:
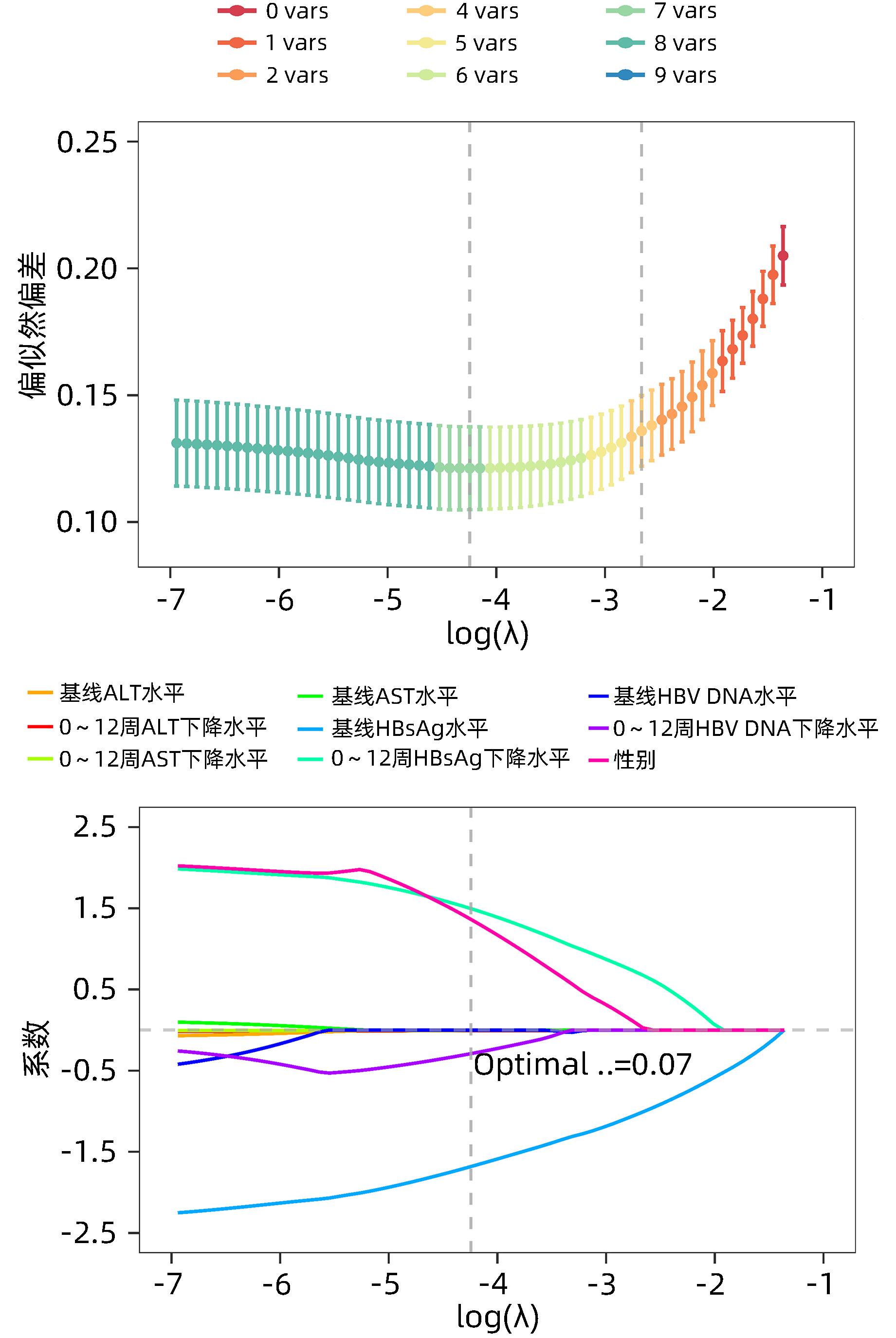
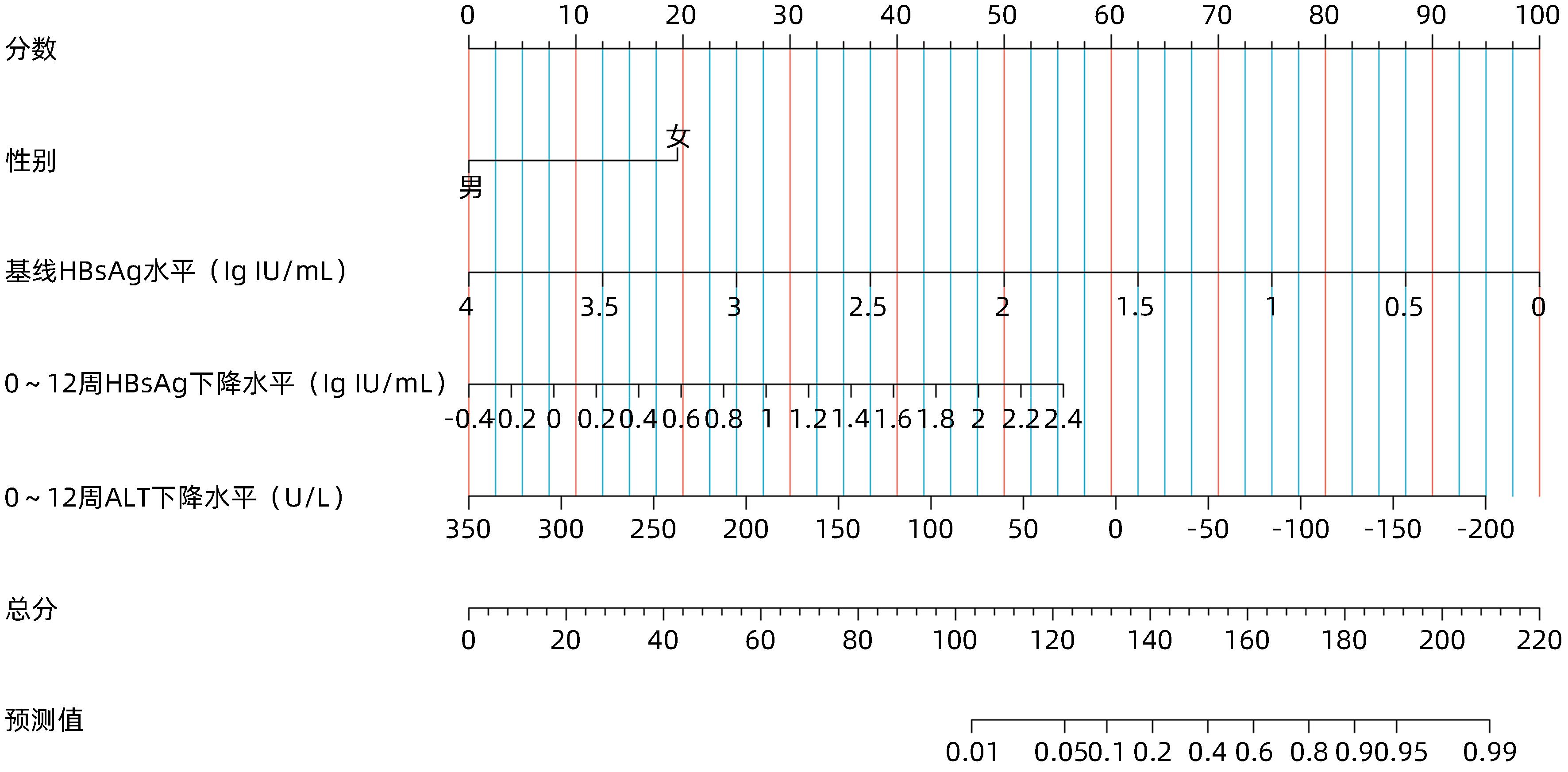
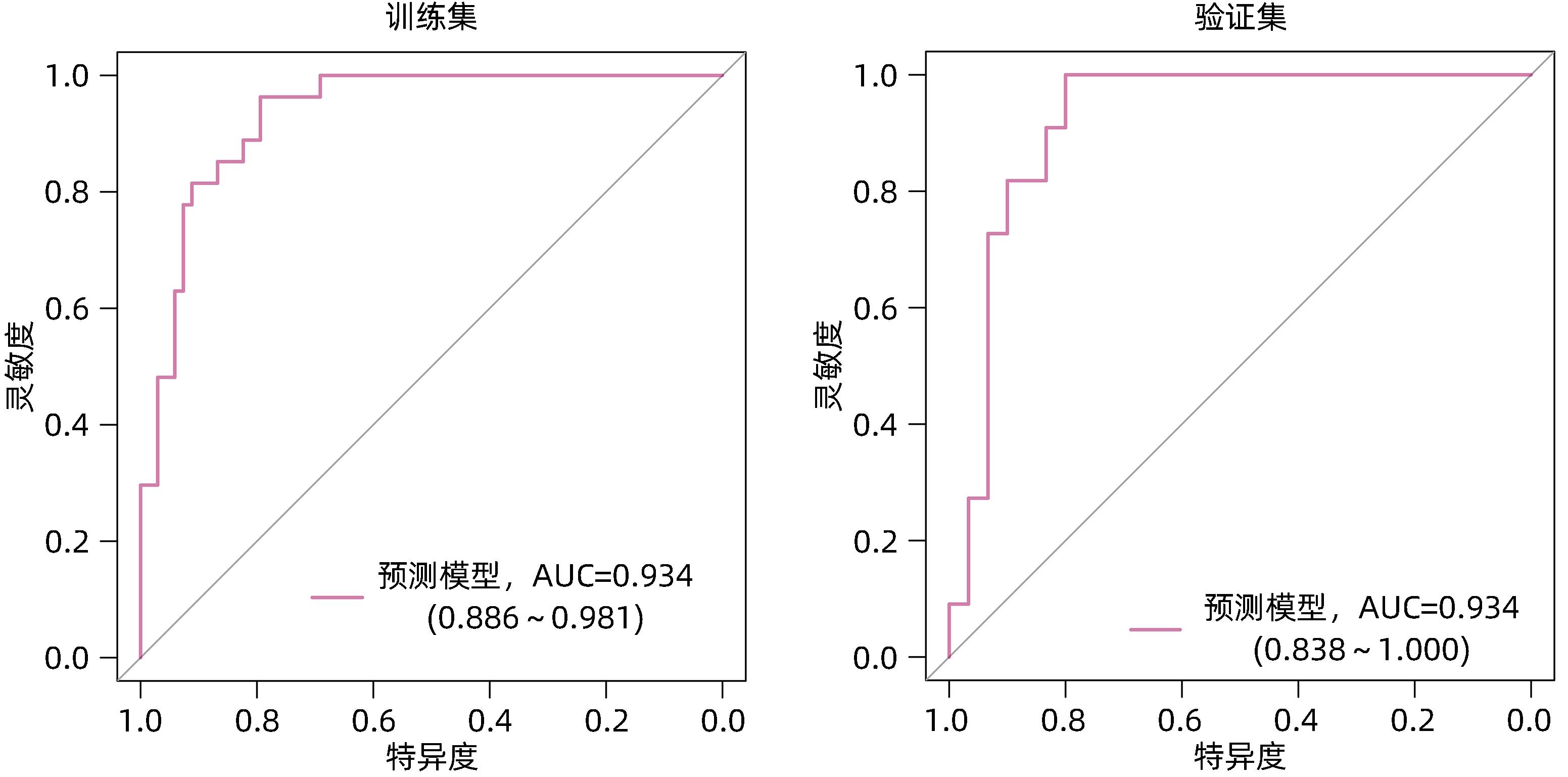
目的 利用血清学指标,基于LASSO回归建立HBeAg阴性的慢性乙型肝炎(CHB)患者在接受聚乙二醇干扰素α-2b(PEG-IFNα-2b)治疗后实现HBsAg清除的早期预测模型,并评估模型的预测价值。 方法 选取2020年4月—2021年10月在徐州医科大学附属医院接受PEG-IFNα-2b治疗的136例HBeAg阴性CHB患者,其中47例为PEG-IFNα-2b初次治疗患者(初始治疗),89例为经核苷(酸)类似物治疗48周后接受PEG-IFNα-2b治疗患者(经治治疗)。将患者按照7∶3的比例随机分为训练集(95例)和验证集(41例),收集训练集和验证集患者基线和治疗12周时的病毒学指标、血常规和肝功能等指标的检测结果。以治疗48周时患者HBsAg状态为变量,将患者分为阴转组(38例)和未阴转组(98例)。符合正态分布的计量资料两组间比较采用成组t检验,不符合正态分布的计量资料两组间比较采用Wilcoxon秩和检验。分类变量两组间比较采用χ2检验。采用LASSO回归、单因素和多因素Logistic回归分析构建列线图模型,并利用ROC曲线分析评估其预测能力,根据ROC曲线下面积(AUC)比较预测价值。 结果 在训练集中,95例HBeAg阴性CHB患者经过PEG-IFNα-2b治疗48周后,HBsAg阴转组有27例,未阴转组有68例。根据单因素Logistic回归结果,以P<0.2为筛选条件,将性别、基线HBV DNA水平、0~12周HBV DNA下降水平、基线HBsAg水平、0~12周HBsAg下降水平、基线AST水平、0~12周AST下降水平、基线ALT水平和0~12周ALT下降水平,共9个指标纳入LASSO回归。根据LASSO回归结果,性别、基线HBsAg水平、0~12周HBsAg下降水平和0~12周ALT下降水平是非零变量,纳入多因素logistic回归。根据多因素Logistic回归分析结果,筛选出4个独立预测因素,分别是性别(OR=5.38,95%CI:1.11~34.21,P=0.049)、基线HBsAg水平(OR=0.12,95%CI:0.04~0.26,P<0.001)、0~12周HBsAg下降水平(OR=5.54,95%CI:1.97~19.18,P=0.003)、0~12周ALT下降水平(OR=0.99,95%CI:0.97~1.00,P=0.039)。最终,基于多因素Logistic回归结果,构建列线图模型,并通过ROC曲线分析列线图模型的预测价值。在训练集中,列线图模型的AUC为0.934(95%CI:0.886~0.981)。在验证集中,列线图模型的AUC为0.921(95%CI:0.838~1.000)。同时,校准曲线和决策曲线结果表明模型具有较好一致性和精准度。 结论 根据患者基本信息和血清学指标,基于LASSO回归,利用性别、基线HBsAg水平、0~12周HBsAg下降水平和0~12周ALT下降水平构建了列线图,可以预测PEG-IFNα-2b治疗HBeAg阴性CHB患者实现HBsAg清除的概率,可为患者的临床治疗提供重要的参考。 Abstract:Objective To establish an early predictive model using serological markers based on LASSO regression for predicting the possibility of HBsAg clearance in HBeAg-negative chronic hepatitis B (CHB) patients treated with pegylated interferon α-2b (PEG-IFNα-2b), and to investigate the diagnostic value of the model. Methods A total of 136 HBeAg-negative CHB patients who received PEG-IFNα-2b treatment in the Affiliated Hospital of Xuzhou Medical University from April 2020 to October 2021 were enrolled, among whom 47 received PEG-IFNα-2b for the first time (previously untreated) and 89 received PEG-IFNα-2b after 48 weeks of treatment with nucleos(t)ide analogues (treatment-experienced). The patients were randomly assigned to a training set with 95 patients and a validation set with 41 patients at a ratio of 7∶3, and related data were collected for both groups, including virological markers, routine blood test results, and liver function at baseline and week 12 of treatment. According to HBsAg status at week 48 of treatment, the patients were divided into seroconversion group with 38 patients and non-seroconversion group with 98 patients. The independent-samples t test was used for comparison of normally distributed continuous data between two groups, and the Wilcoxon rank-sum test was used for comparison of non-normally distributed continuous data between two groups; the chi-square test was used for comparison of categorical variables between two groups. The LASSO regression analysis and univariate and multivariate logistic regression analyses were used to establish a nomogram model; the receiver operating characteristic (ROC) curve was used to assess its predictive ability, and the area under the ROC curve (AUC) was used for comparison of predictive value. Results In the training set, 95 HBeAg-negative CHB patients were treated with PEG-IFNα-2b for 48 weeks, among whom there were 27 patients in the seroconversion group and 68 in the non-seroconversion group. The univariate Logistic regression analysis, with P<0.2 as the criterion for screening, showed that 9 indicators were included in the LASSO regression analysis, i.e., sex, baseline HBV DNA level, the reduction in HBV DNA in 0 — 12 weeks, baseline HBsAg level, the reduction in HBsAg in 0 — 12 weeks, baseline aspartate aminotransferase (AST) level, the reduction in AST in 0 — 12 weeks, baseline alanine aminotransferase (ALT) level, and the reduction in ALT in 0 — 12 weeks. The LASSO regression analysis showed that sex, baseline HBsAg level, the reduction in HBsAg in 0 — 12 weeks, and the reduction in ALT in 0 — 12 weeks were non-zero variables and were included in the multivariate Logistic regression analysis. The multivariate Logistic regression analysis obtained 4 independent predictive factors, i.e., sex (odds ratio [OR]=5.38, 95% confidence interval [CI]: 1.11 — 34.21, P=0.049), baseline HBsAg level (OR=0.12, 95%CI: 0.04 — 0.26, P<0.001), the reduction in HBsAg in 0 — 12 weeks (OR=5.54, 95%CI: 1.97 — 19.18, P=0.003), and the reduction in ALT in 0 — 12 weeks (OR=0.99, 95%CI: 0.97 — 1.00, P=0.039). A nomogram model was established based on the results of the multivariate Logistic regression analysis, and the ROC curve was used to assess the predictive value of this nomogram model. This nomogram model had an AUC of 0.934 (95%CI: 0.886 — 0.981) in the training set and an AUC of 0.921 (95%CI: 0.838 — 1.000) in the validation set. In addition, the results of calibration curve and decision curve analyses showed that the model had good consistency and accuracy. Conclusion Based on general information and serological markers, the LASSO regression analysis is used to establish a nomogram model using sex, baseline HBsAg level, the reduction in HBsAg in 0 — 12 weeks, and the reduction in ALT in 0 — 12 weeks, and this model can be used to predict the probability of achieving HBsAg clearance in HBeAg-negative CHB patients treated with PEG-IFNα-2b, which provides important reference and theoretical support for the clinical treatment of patients. -
Key words:
- Hepatitis B, Chronic /
- Pegylated Interferon /
- Nomograms /
- Machine Learning
-
表 1 CHB患者HBsAg是否阴转患者一般资料比较
Table 1. Comparison of general information between CHB patients with and without HBsAg clearance
指标 未阴转组(n=98) 阴转组(n=38) 统计值 P值 性别[例(%)] χ2=2.47 0.175 男 75(76.5) 24(63.2) 女 23(23.5) 14(36.8) 年龄(岁) 39.0(33.2~45.8) 38.0(31.0~46.0) U=2 643.00 0.380 治疗类型[例(%)] χ2=0.21 0.799 初始 35(35.7) 12(31.6) 经治 63(64.3) 26(68.4) 基线水平 HBV DNA(lg IU/mL) 1.5(0.0~3.2) 0.0(0.0~1.7) U=2 309.00 0.019 HBsAg(lg IU/mL) 2.9(2.2~3.1) 1.2(0.3~2.0) U=3 228.00 <0.001 AST(U/L) 25.0(20.0~37.0) 19.0(16.0~28.5) U=2 387.00 0.011 ALT(U/L) 32.5(21.0~64.5) 21.0(15.0~39.0) U=2 499.00 0.002 PLT(×109/L) 181.0±58.1 180.0±51.6 t=0.08 0.938 0~12周下降水平 HBV DNA (lg IU/mL) 0.0(0.0~2.8) 0.0(0.0~1.6) U=2 134.00 0.158 HBsAg(lg IU/mL) 0.2(0.0~0.6) 0.6(0.2~1.3) U=1 173.00 0.001 AST(U/L) -16.5(-32.8~-3.3) -24.5(-48.8~-13.3) U=2 244.00 0.064 ALT(U/L) -15.0(-50.0~8.8) -31.5(-62.8~-16.0) U=2 304.00 0.032 PLT(×109/L) 61.8±48.2 60.8±52.4 t=0.10 0.919 表 2 训练集和验证集CHB患者的一般资料比较
Table 2. Comparison of general information of CHB patients in training set and validation set
指标 训练集 验证集 未阴转组(n=68) 阴转组(n=27) 未阴转组(n=30) 阴转组(n=11) 性别[例(%)] 男 51(75.0) 16(59.3) 24(80.0) 8(72.7) 女 17(25.0) 11(40.7) 6(20.0) 3(27.3) 年龄(岁) 37.0(33.0~44.2) 38.0(31.0~46.0) 42.0(34.0~46.0) 38.0(34.0~45.5) 治疗类型[例(%)] 初始 26(38.2) 9(33.3) 9(30.0) 3(27.3) 经治 42(61.8) 18(66.7) 21(70.0) 8(72.7) 基线水平 HBV DNA(lg IU/mL) 1.5(0.0~3.3) 0.0(0.0~1.6) 0.8(0.0~2.9) 0.0(0.0~1.8) HBsAg(lg IU/mL) 2.8(2.2~3.1) 1.4(0.4~2.1) 2.7(2.3~3.1) 0.8(0.3~1.8) AST(U/L) 25.0(18.0~37.0) 19.0(16.0~26.0) 27.5(20.2~37.2) 22.0(17.0~32.5) ALT(U/L) 32.0(19.0~62.6) 18.0(14.5~38.0) 33.5(24.0~64.5) 24.0(17.0~36.5) PLT(×109/L) 186.0±60.3 182.0±55.8 169.0±52.1 175.0±41.3 0~12周下降水平 HBV DNA(lg IU/mL) 0.0(0.0~2.6) 0.0(0.0~1.5) 0.6(0.0~2.9) 0.0(0.0~1.8) HBsAg(lg IU/mL) 0.2(0.0~0.6) 0.6(0.2~1.3) 0.2(0.0~0.6) 0.4(0.2~1.1) AST(U/L) -16.0(-40.6~-4.0) -31.0(-53.0~-16.5) -17.0(-28.5~-1.3) -14.0(-32.5~-4.0) ALT(U/L) -15.0(-52.0~9.0) -34.0(-80.0~-21.0) -16.0(-42.0~-0.3) -24.0(-32.5~-12.5) PLT(×109/L) 61.2±50.8 60.1±56.2 63.3±42.5 62.5±44.2 表 3 CHB患者HBsAg阴转的单因素Logistic回归
Table 3. Univariate logistic regression for HBsAg clearance in CHB patients
因素 OR 95%CI P值 性别 2.06 0.80~5.30 0.133 年龄 0.97 0.92~1.02 0.217 治疗类型 1.24 0.48~3.16 0.655 基线水平 HBV DNA(lg IU/mL) 0.71 0.52~0.96 0.024 HBsAg(lg IU/mL) 0.23 0.12~0.43 <0.001 AST(U/L) 0.98 0.96~1.00 0.111 ALT(U/L) 0.98 0.96~1.00 0.037 PLT(×109/L) 1.00 0.99~1.01 0.787 0~12周下降水平 HBV DNA(lg IU/mL) 0.80 0.58~1.11 0.185 HBsAg(lg IU/mL) 2.73 1.36~5.50 0.005 AST(U/L) 0.99 0.98~1.00 0.110 ALT(U/L) 0.99 0.98~1.00 0.043 PLT(×109/L) 1.00 0.99~1.01 0.929 表 4 CHB患者HBsAg阴转的多因素Logistic回归分析
Table 4. Multivariate logistic regression for HBsAg clearance in CHB patients
因素 OR 95%CI P值 性别 5.38 1.11~34.21 0.049 基线HBsAg水平 0.12 0.04~0.26 <0.001 0~12周HBsAg下降水平 5.54 1.97~19.18 0.003 0~12周ALT下降水平 0.99 0.97~1.00 0.039 -
[1] JENG WJ, PAPATHEODORIDIS GV, LOK ASF. Hepatitis B[J]. Lancet, 2023, 401( 10381): 1039- 1052. DOI: 10.1016/S0140-6736(22)01468-4. [2] ASPINALL EJ, HAWKINS G, FRASER A, et al. Hepatitis B prevention, diagnosis, treatment and care: A review[J]. Occup Med, 2011, 61( 8): 531- 540. DOI: 10.1093/occmed/kqr136. [3] Chinese Society of Infectious Disease, Chinese Society of Hepatology, Chinese Medical Association. The expert consensus on functional cure of chronic hepatitis B[J]. J Clin Hepatol, 2022, 30( 12): 1309- 1331. DOI: 10.3760/cma.j.cn501113-20221204-00607.中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎临床治愈(功能性治愈)专家共识[J]. 临床肝胆病杂志, 2022, 30( 12): 1309- 1331. DOI: 10.3760/cma.j.cn501113-20221204-00607. [4] NGUYEN MH, WONG G, GANE E, et al. Hepatitis B virus: Advances in prevention, diagnosis, and therapy[J]. Clin Microbiol Rev, 2020, 33( 2): e00046- e00019. DOI: 10.1128/CMR.00046-19. [5] TSENG TC, KAO JH, CHEN DS. Peginterferon α in the treatment of chronic hepatitis B[J]. Expert Opin Biol Ther, 2014, 14( 7): 995- 1006. DOI: 10.1517/14712598.2014.907784. [6] MIMURA S, FUJITA K, TAKUMA K, et al. Effect of pegylated interferon alfa-2a in HBeAg-negative chronic hepatitis B during and 48 weeks after off-treatment follow-up: The limitation of pre-treatment HBsAg load for the seroclearance of HBsAg[J]. Intern Emerg Med, 2021, 16( 6): 1559- 1565. DOI: 10.1007/s11739-020-02622-7. [7] KWON H, LOK AS. Hepatitis B therapy[J]. Nat Rev Gastroenterol Hepatol, 2011, 8( 5): 275- 284. DOI: 10.1038/nrgastro.2011.33. [8] ALHAMZAWI R, ALI HTM. The Bayesian adaptive lasso regression[J]. Math Biosci, 2018, 303: 75- 82. DOI: 10.1016/j.mbs.2018.06.004. [9] VLACHOGIANNAKOS J, PAPATHEODORIDIS GV. HBeAg-negative chronic hepatitis B: Why do I treat my patients with pegylated interferon-alfa?[J]. Liver Int, 2014, 34( Suppl 1): 127- 132. DOI: 10.1111/liv.12404. [10] SHEPHERD J, JONES J, TAKEDA A, et al. Adefovir dipivoxil and pegylated interferon alfa-2a for the treatment of chronic hepatitis B: A systematic review and economic evaluation[J]. Health Technol Assess, 2006, 10( 28): ⅲ-ⅳ, ⅺ-xiv, 1- 183. DOI: 10.3310/hta10280. [11] YE JY, CHEN JL. Interferon and hepatitis B: Current and future perspectives[J]. Front Immunol, 2021, 12: 733364. DOI: 10.3389/fimmu.2021.733364. [12] QIAN JD, ZHAO H, WANG GQ. Current status of the treatment of chronic hepatitis B-related liver fibrosis/cirrhosis[J]. J Clin Hepatol, 2021, 37( 12): 2909- 2913. DOI: 10.3969/j.issn.1001-5256.2021.12.036.钱建丹, 赵鸿, 王贵强. 慢性乙型肝炎肝纤维化/肝硬化的治疗现状[J]. 临床肝胆病杂志, 2021, 37( 12): 2909- 2913. DOI: 10.3969/j.issn.1001-5256.2021.12.036. [13] LI H, XU WT, DENG BC, et al. Progress in the functional treatment of chronic hepatitis B with nucleos(t)ide analogues and pegylated interferon[J]. Clin J Med Offic, 2022, 50( 9): 890- 893. DOI: 10.16680/j.1671-3826.2022.09.04.李卉, 许文涛, 邓宝成, 等. 核苷(酸)类似物联合聚乙二醇干扰素功能性治愈慢性乙型肝炎研究进展[J]. 临床军医杂志, 2022, 50( 9): 890- 893. DOI: 10.16680/j.1671-3826.2022.09.04. [14] ZHANG WH, ZHANG DZ, DOU XG, et al. Consensus on pegylated interferon alpha in treatment of chronic hepatitis B[J]. Chin J Hepatol, 2017, 25( 9): 678- 686. DOI: 10.3760/cma.j.issn.1007-3418.2017.09.007.张文宏, 张大志, 窦晓光, 等. 聚乙二醇干扰素α治疗慢性乙型肝炎专家共识[J]. 中华肝脏病杂志, 2017, 25( 9): 678- 686. DOI: 10.3760/cma.j.issn.1007-3418.2017.09.007. [15] GUO YF, ZHANG JM. Influencing factors for the functional cure of chronic hepatitis B and related mechanism[J]. J Clin Hepatol, 2022, 38( 8): 1721- 1725. DOI: 10.3969/j.issn.1001-5256.2022.08.004.郭艺飞, 张继明. 影响慢性乙型肝炎功能性治愈的因素及其机制[J]. 临床肝胆病杂志, 2022, 38( 8): 1721- 1725. DOI: 10.3969/j.issn.1001-5256.2022.08.004. [16] OMATA M, CHENG AL, KOKUDO N, et al. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: A 2017 update[J]. Hepatol Int, 2017, 11( 4): 317- 370. DOI: 10.1007/s12072-017-9799-9. [17] European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67( 2): 370- 398. DOI: 10.1016/j.jhep.2017.03.021. [18] LIANG TJ, BLOCK TM, MCMAHON BJ, et al. Present and future therapies of hepatitis B: From discovery to cure[J]. Hepatology, 2015, 62( 6): 1893- 1908. DOI: 10.1002/hep.28025. [19] CHEN XF, ZHANG DJ, LUO XD, et al. Current status of the treatment of chronic hepatitis B[J]. J Clin Hepatol, 2021, 37( 5): 1011- 1015. DOI: 10.3969/j.issn.1001-5256.2021.05.004.陈学福, 张东敬, 罗晓丹, 等. 慢性乙型肝炎的治疗现状[J]. 临床肝胆病杂志, 2021, 37( 5): 1011- 1015. DOI: 10.3969/j.issn.1001-5256.2021.05.004. [20] XIE F, XIONG X, YAO CX, et al. Clinical efficacy and influencing factors of pegylated interferon alfa-2b and nucleos(t)ide analogue in chronic hepatitis B patients with low level of hepatitis B virus surface antigen[J/CD]. Chin J Exp Clin Infect Dis(Electronic Edition), 2022, 16( 4): 247- 253. DOI: 10.3877/cma.j.issn.1674-1358.2022.04.005.谢芳, 熊熙, 姚传霞, 等. 聚乙二醇化干扰素α-2b联合核苷(酸)类似物治疗低水平乙型肝炎病毒表面抗原慢性乙型肝炎患者的临床疗效及影响因素[J/CD]. 中华实验和临床感染病杂志(电子版), 2022, 16( 4): 247- 253. DOI: 10.3877/cma.j.issn.1674-1358.2022.04.005. [21] CHU JH, HUANG Y, XIE DY, et al. Real-world study on HBsAg loss of combination therapy in HBeAg-negative chronic hepatitis B patients[J]. J Viral Hepat, 2022, 29( 9): 765- 776. DOI: 10.1111/jvh.13722. [22] LI MH, ZHANG L, LU Y, et al. Early serum HBsAg kinetics as predictor of HBsAg loss in patients with HBeAg-negative chronic hepatitis B after treatment with pegylated interferonα-2a[J]. Virol Sin, 2021, 36( 2): 311- 320. DOI: 10.1007/s12250-020-00290-7. [23] HU P, SHANG J, ZHANG WH, et al. HBsAg loss with peg-interferon alfa-2a in hepatitis B patients with partial response to nucleos(t)ide analog: New switch study[J]. J Clin Transl Hepatol, 2018, 6( 1): 25- 34. DOI: 10.14218/JCTH.2017.00072. -



 PDF下载 ( 1393 KB)
PDF下载 ( 1393 KB)


 下载:
下载: