《临床肝胆病杂志》常见异形词
-
-
自发性细菌性腹膜炎(SBP)是在肝硬化基础上发生的无明确腹腔内病变来源的腹腔感染[1]。在门诊肝硬化患者中,SBP的发生率为1.5%~3.5%,而在住院肝硬化患者中的发生率为10%~30%,是失代偿期肝硬化患者最常见的严重并发症之一。肝硬化患者并发SBP,可迅速进展为肝肾功能衰竭,致使病情进一步恶化,为肝硬化患者死亡的主要原因[1]。既往的临床研究[1-3]表明,肝硬化合并SBP患者发生急性肾损伤的概率为54%,而发生慢加亚急性肝衰竭的概率为35%~36%,未经治疗的SBP患者或院内感染SBP患者病死率高达60%。然而,约有1/3的肝硬化合并SBP患者未表现典型的临床症状[4],经常导致诊治的延误。因此,对肝硬化合并SBP的及时诊断和防治,是临床工作中的关键,关于并发SBP相关危险因素的研究,一直备受关注[3]。
肝硬化患者普遍存在营养不良,其中包括营养缺乏(肌减少、脂减少)和营养过剩(肥胖)[5]。严重的营养不良可能影响肝硬化患者的免疫调节和肠道菌群功能,是肝硬化患者并发SBP的发病机制之一[6]。肝硬化患者发生营养不良与细菌感染关系密切。一项前瞻性研究[7]表明,肝硬化合并肌减少患者的感染相关病死率,显著高于无合并肌减少患者(22%vs 8%, P=0.02)。此外,肝硬化合并皮下脂肪与内脏脂肪减少与肝静脉压力梯度呈负相关[8],而静脉压力升高是肝硬化患者产生腹水的病因之一,提示肝硬化的脂肪代谢异常与SBP可能存在关联。
通过床旁间接能量检测仪检测患者的能量代谢指标,包括呼吸熵(respiratory quotient, RQ)、静息能量消耗(rest energy expenditure, REE)和三大营养底物(碳水化合物、脂肪和蛋白质)的氧化率等,是目前推荐的营养评估方法[5, 9]。本研究旨在探讨乙型肝炎肝硬化(HBV-LC)患者的能量代谢指标与短期内发生SBP风险的相关性。
1. 资料与方法
1.1 研究对象
回顾性分析2017年11月—2019年11月在本院住院的HBV-LC患者资料。诊断标准:HBV-LC符合《慢性乙型肝炎防治指南(2019年版)》[10]中的临床诊断标准,其中合并腹水、食管静脉曲张破裂出血或肝性脑病等严重并发症者,为失代偿期肝硬化。肝衰竭患者的诊断符合《肝衰竭诊治指南(2018年版)》[11]中的诊断标准。SBP符合《肝硬化腹水及相关并发症的诊疗指南》[1]中的诊断标准。排除标准:(1)其他病因所致肝硬化,如慢性丙型肝炎、酒精性肝病、自身免疫性肝病和药物性肝损伤;(2)入院前即合并感染;(3)恶性肿瘤;(4)就诊前有肾上腺皮质激素药物服用史;(5)合并慢性呼吸系统疾病,如哮喘、支气管肺炎等。本研究筛选出100例HBV-LC患者,其中失代偿期HBV-LC患者93例,排除合并恶性肿瘤、酒精性肝病、2型糖尿病患者(n=38),排除未进行能量代谢检测患者(n=5),最终纳入50例患者进行后续分析。
1.2 资料收集
收集患者的一般特征资料(年龄、身高和体质量等)、相关实验室检查指标、能量代谢检测结果等,记录患者住院2周内发生SBP的情况。
1.3 能量代谢检测
使用Quark RMR间接能量代谢检测仪(意大利COSMED公司),检测患者的能量代谢情况(住院后3天内完成),并严格遵守标准流程:(1)要求患者检测前一天22∶ 00后开始禁食,并尽量保持静卧状态至检测结束,期间确保睡眠质量同平常,且无肠外营养;检测时间安排在6∶ 00-7∶ 00,于患者床边进行。(2)能量代谢检测仪按照说明书操作,并使用厂家提供的标准气体(11.5%O2、4.81%CO2、83.69% N2)进行矫正,每次检测时间持续20~25 min。(3)收集检测前一日24 h尿液,记录尿量和测定尿氮浓度,计算24 h尿氮(尿氮浓度×24 h尿量),用于计算蛋白质氧化率(protein oxidation rate, PRO) 和非蛋白呼吸熵(non protein RQ, npRQ)。npRQ的计算公式为:npRQ=(1.44×每分钟CO2产生量-4.89×24 h尿氮)÷(1.44×每分钟O2消耗量-6.04×24 h尿氮)[12]。
1.4 统计学方法
采用开源统计软件R语言(版本:4.0.3)进行数据分析。符合正态分布的计量资料采用x±s表示,两组间比较采用t检验;非正态分布的计量资料采用M(P25~P75)表示,两组间比较采用Kruskal-Wallis H秩和检验。计数资料组间比较采用χ2检验或Fisher精确检验。将单因素分析中有显著差异的变量(P<0.05) 纳入多因素logistic回归分析,采用逐步回归法筛选变量,方差膨胀因子(variance inflation factor, VIF)评估变量间的共线性,并最终构建模型;绘制受试者工作特征曲线(ROC曲线)分析模型的诊断效应,以最大Youden指数对应的点为模型的截断值,采用DeLong检验比较ROC曲线下面积(AUC)。P<0.05为差异有统计学意义。
2. 结果
2.1 基线特征的比较
研究最终纳入失代偿期HBV-LC患者50例,住院后2周发生SBP患者23例(46%),其中诊断为肝衰竭患者13例(57%);无SBP患者27例(54%),其中诊断为肝衰竭患者8例(30%);女性7例(14%),男性43例(86%),平均年龄49.98岁,平均体质量62.10 kg。依据BMI将患者划分为体质量减少(BMI<18.50 kg/m2),正常体质量(18.50 kg/m2≤BMI<25 kg/m2),超重(25 kg/m2≤BMI<30 kg/m2)和肥胖(BMI≥30 kg/m2)。并发SBP与无SBP两组患者基线的性别、年龄、身高、体质量、体表面积及BMI均无统计学差异(P值均>0.05)(表 1)。
表 1 基线特征比较Table 1. Comparison of baseline characteristics指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 性别[例(%)] 0.689 女 7(14) 4(17) 3(11) 男 43(86) 19(83) 24(89) 肝衰竭[例(%)] χ2=2.7 0.103 是 21(42) 13(57) 8(30) 否 29(58) 10(43) 19(70) 年龄(岁) 49.98±11.61 53.13±11.62 47.30±11.11 t=1.8 0.078 身高(cm) 168(165~170) 165(163~170) 168(165~170) H=230.5 0.117 体质量(kg) 62.1(55.2~72.0) 63.0(53.7~71.0) 61.0(55.9~71.9) H=304.5 0.915 体表面积(m2) 1.73±0.17 1.71±0.16 1.74±0.18 H=-0.7 0.517 BMI[例(%)] 0.793 下降 5(10) 2(9) 3(11) 正常 32(64) 14(61) 18(67) 超重 10(20) 6(26) 4(15) 肥胖 3(6) 1(4) 2(7) 2.2 实验室指标的比较
失代偿期HBV-LC合并SBP患者的甘油三酯、前白蛋白以及凝血酶原活动度(PTA)均显著低于无SBP患者(P值均<0.05);而SBP患者的国际标准化比值(INR)、C反应蛋白(CRP)和终末期肝病模型(MELD)评分则显著高于无SBP患者(P值均<0.05)(表 2)。
表 2 实验室指标比较Table 2. Comparison of laboratory parameters指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 总胆红素(μmol/L) 124.95(43.75~274.40) 185.80(83.40~280.60) 77.70(29.30~245.45) H=403.0 0.073 白蛋白(g/L) 33.2±5.8 31.6±5.4 34.6±5.9 t=-1.8 0.071 前白蛋白(g/L) 55(45~88) 50(38~65) 78(51~126) H=177.5 0.010 胆碱酯酶(U/L) 3401(2230~5029) 3120(2094~4299) 4111(2367~5396) H=256.5 0.298 血糖(mmol/L) 5.27(4.74~7.18) 5.50(4.68~6.58) 5.22(4.84~7.28) H=311.0 0.992 甘油三酯(mmol/L) 0.88(0.71~1.20) 0.81(0.69~0.94) 1.09(0.76~1.27) H=208.5 0.048 总胆固醇(mmol/L) 2.94±1.19 2.69±1.15 3.15±1.20 t=-1.4 0.179 低密度脂蛋白(mmol/L) 1.57±0.70 1.52±0.73 1.62±0.68 t=-0.5 0.600 高密度脂蛋白(mmol/L) 0.56(0.21~0.90) 0.46(0.17~0.65) 0.74(0.29~1.04) H=216.5 0.069 血肌酐(μmol/L) 73(63~87) 70(65~85) 73(61~88) H=306.5 0.946 PTA(%) 0.56±0.22 0.45±0.16 0.66±0.21 t= -4.0 <0.001 INR 1.55(1.20~2.04) 1.99(1.50~2.46) 1.25(1.12~1.67) H= 482.0 <0.001 血红蛋白(g/L) 124.12±21.03 118.78±17.31 128.67±23.10 t=-1.7 0.091 血小板(×109/L) 81.0(53.5~110.3) 74.0(51.5~95.0) 92.0(57.5~124.5) H=234.5 0.142 MELD评分 16.81±6.84 19.83±6.22 14.25±6.37 t=3.1 0.003 CRP(mg/L) 8.37(3.32~14.79) 13.42(6.82~21.44) 6.79(2.05~9.42) H=462.5 0.003 PCT(ng/mL) 0.36(0.11~0.71) 0.55(0.08~0.76) 0.35(0.15~0.60) H=350.5 0.442 注:PCT,降钙素原。 2.3 能量代谢指标的比较
失代偿期HBV-LC合并SBP患者的RQ值、碳水化合物氧化率(carbohydrate oxidation, CHO)及CHO/RQ均显著低于无SBP患者(P值均<0.05)(表 3)。
表 3 能量代谢指标比较Table 3. Comparison of energy metabolism indices指标 所有患者(n=50) SBP组(n=23) 无SBP组(n=27) 统计值 P值 REE(kcal) 1 513.30±323.65 1 493.78±266.95 1 529.93±369.44 t=-0.4 0.691 pREE((kcal) 1396(1312~1565) 1383(1259~1504) 1401(1327~1594) H=266.0 0.392 RQ 0.82(0.78~0.89) 0.79(0.76~0.86) 0.85(0.79~0.91) H=205.0 0.041 npRQ 0.82(0.78~0.90) 0.79(0.76~0.86) 0.85(0.79~0.91) H=210.0 0.051 FAT(%) 49.70(28.15~65.33) 55.80(40.85~69.30) 43.80(15.35~61.40) H=385.0 0.149 CHO(%) 31.55(18.15~52.83) 20.50(15.25~41.05) 41.60(22.25~68.05) H=205.0 0.041 PRO(%) 15.2(8.0~22.1) 15.1(5.1~24.4) 15.5(8.4~19.3) H=302.5 0.884 CHO/RQ 0.38(0.23~0.59) 0.26(0.20~0.48) 0.49(0.28~0.62) H=202.5 0.036 注:pREE,预测静息能量消耗;FAT,脂肪氧化率。 2.4 logistic回归分析与模型构建
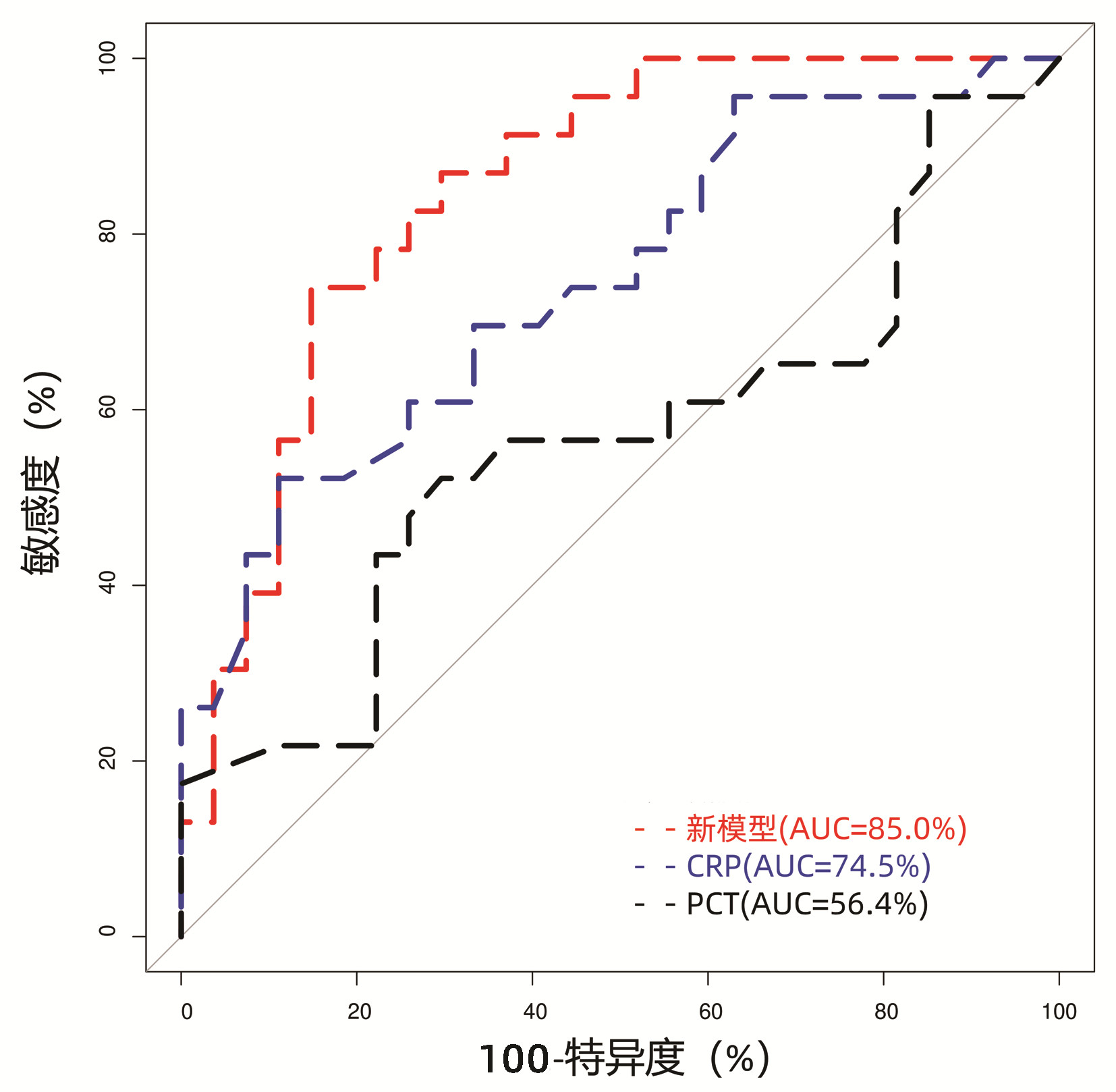
将两组患者上述指标比较中的差异变量(P<0.05),包括前白蛋白、甘油三酯、PTA、INR、CRP、MELD评分、RQ及CHO等,纳入多因素logistic回归分析中。由于PTA(VIF=10.61)和INR(VIF=8.06)存在变量间共线性,且均为反映凝血酶原时间的指标,而RQ(VIF=12.77)和CHO(VIF=11.07)也存在变量间共线性,且均为反应碳水化合物代谢的指标,故将PTA和CHO/RQ比值纳入模型构建。最终构建回归模型参数见表 4,其中PTA为独立危险因素(比值比=0.004, P=0.008),所构建回归模型:Logit(P)=2.18-5.43×PTA-0.93(CHO/RQ)+0.08×CRP。模型的AUC为85.0%,当曲线的Youden指数为最大值时,模型截断值为0.60,特异度为85.19%,敏感度为73.91%,模型的区分度优于CRP(AUC=74.5%, P=0.049)和PCT(AUC=56.4%, P<0.01)(图 1)。
表 4 logistic回归模型参数Table 4. The parameters of logistic regression model参数 系数 比值比 95%置信区间 Z值 P值 截距 2.18 0.611~163.911 1.559 0.119 PTA -5.43 0.004 0.000~0.179 -2.634 0.008 CHO/RQ -0.93 0.396 0.011~13.843 -0.517 0.605 CRP 0.08 1.086 1.012~1.204 1.899 0.058 3. 讨论
肝脏是代谢的重要器官,肝硬化患者的肝功能受损,可直接影响机体的能量代谢,导致糖异生增加、肌肉减少、脂肪氧化增加及脂肪减少,最终导致患者营养状况的恶化;此外,肝硬化患者由于饮食摄入不足,致使营养不良也成为一种常见并发症[9]。
REE、RQ和三大营养物质的氧化率是反应能量代谢的主要指标。既往研究表明与健康对照组相比,肝硬化患者的REE值升高,提示能量消耗升高[13-14],但高REE的肝硬化患者生存预后较好,这可能与REE水平随Child-Pugh分级升高而下降有关,而Child-Pugh C级的肝硬化患者往往预后不良[15]。REE还与感染相关,研究发现脓毒症患者REE较入院时基线值逐渐升高,并于入院2周后达到最高值(约1.7倍)[16]。但在本研究中失代偿期HBV-LC患者入院2周内发生SBP与未发生SBP患者的基线REE和pREE均无统计学差异,可能与并发感染的患者同时存在高代谢与低代谢有关[17]。RQ值反映了三大营养物质代谢的情况,而npRQ则仅体现碳水化合物和脂肪的代谢情况。肝硬化患者的RQ值、npRQ值较健康对照组均显著下降,并与疾病的严重程度和生存预后相关[15, 18-20]。肝硬化患者的npRQ下降,机体供能底物从碳水化合物转化为脂肪酸氧化和氨基酸糖异生,蛋白质合成下降,导致患者的肌肉含量减少[18]。具体到三大营养物质的氧化率,肝硬化患者表现为CHO显著下降,FAT则显著升高,而PRO在肝硬化患者与健康人之间并未体现出差异[19]。在脓毒症患者的早期,能量代谢表现RQ值下降(<0.8),营养底物消耗从碳水化合物转化为脂肪,存活患者的RQ值升高(>0.8),而死亡患者的RQ值仍维持低水平[21]。本研究中,失代偿期HBV-LC患者并发SBP与未发生SBP患者相比较,RQ和CHO均显著下降,提示两者与并发SBP风险相关。
CRP和PCT是目前临床上常用的反映急性炎症状态的指标,作为诊断感染的重要参考依据[22-23]。既往对肝硬化患者的相关研究中,Metwally等[24]通过回顾性分析300例肝硬化患者的临床资料,认为CRP水平是患者发生SBP的独立危险因素(比值比=1.228, P<0.001);Abdel-Razik等[25]通过比较肝硬化合并SBP(n=52)和无合并SBP(n=27)的PCT水平,结果显示PCT水平为0.94 ng/mL时,对SBP具有较高的敏感度(94.3%)和特异度(91.8%)。而Mikuła等[26]回顾性分析63例肝硬化合并腹水患者的临床资料,结果则显示CRP和PCT与患者腹水多核细胞数呈弱相关,认为两者对于肝硬化并发SBP的预测作用低。CRP和PCT的研究结果出现上述矛盾的原因可能是CRP和PCT主要在肝细胞中表达,而肝脏疾病的严重程度影响了二者的表达水平[22]。结合本研究结果,CRP和PCT预测失代偿期HBV-LC并发SBP的AUC值分别为74.5%和56.4%,提示CRP与失代偿期HBV-LC短期发生SBP的风险相关,而由CRP、PTA和CHO/RQ构建的模型,其AUC值为85.0%,区分度优于CRP和PCT。
PTA是反映凝血酶原时间的指标之一,PTA下降提示肝细胞合成功能下降,患者病情严重。一项荟萃分析[27]显示,凝血酶原时间延长是肝硬化患者合并SBP的危险因素。本研究中,PTA是失代偿期肝硬化患者合并SBP的独立危险因素(比值比=0.004,P=0.008),与既往研究结论一致。
本研究存在以下不足:(1)本研究为回顾性单中心的研究,且样本量相对较少,可能导致样本选择偏倚;(2)本研究中失代偿期肝硬化患者的SBP发生率较高(46%),这与笔者将肝衰竭患者纳入分析有关,但两组患者的肝衰竭比例无显著差异;(3)RQ和CHO作为失代偿期HBV-LC患者合并SBP的特征性指标,其临床诊断价值还需后续通过严格筛选患者,设计前瞻性、多中心、大样本的临床研究一步明确。
总之,本研究初步对失代偿期HBV-LC患者的能量代谢指标与住院后2周内发生SBP的相关性进行探讨,结果提示失代期HBV-LC患者RQ和CHO水平下降与SBP风险相关,结合PTA、CRP和CHO/RQ比值,有助于对失代期HBV-LC短期发生SBP高风险患者进行筛查,并及时采取措施,加强营养支持,改善患者临床预后。
期刊类型引用(4)
1. 谭梅傲,黄祎,刘姝婉,王雅楠,刘华宝. 基于“肝为气之治”理论探讨肝硬化全病程中医防治机理及实践. 中西医结合肝病杂志. 2024(04): 292-295+300 .  百度学术
百度学术2. 林占崇,彭云娟,蒋小艳. 甲型肝炎并发自发性腹膜炎的病原菌及耐药性特征分析. 医疗装备. 2024(15): 105-107+109 .  百度学术
百度学术3. 赵娟,苏璇,徐斌. 合并自发性细菌性腹膜炎对男性酒精性肝硬化患者能量代谢的影响. 北京医学. 2024(10): 815-819 .  百度学术
百度学术4. 施静,陈佩,万楚楚,赵疃. COX健康行为互动模式在乙型肝炎肝硬化患者护理中的应用. 国际护理学杂志. 2023(10): 1792-1795 .  百度学术
百度学术其他类型引用(0)
-




 PDF下载 ( 1217 KB)
PDF下载 ( 1217 KB)

 下载:
下载:

 百度学术
百度学术
 下载:
下载: