The trend and value of18F-FDG PET/CT included in the criteria for liver transplantation in hepatocellular carcinoma
-
摘要:
肝移植是治疗肝细胞癌(HCC)的有效方法,为降低HCC肝移植术后可能出现较高肿瘤复发率,有学者率先提出著名的Milan标准。但该标准过于严格,部分患者因其肿瘤病变较大或多个结节,虽其生物行为相对"温良",也被排除在等待肝移植名单之外,随之世界各地出现了众多的"扩大Milan版标准"。HCC组织病理学的微血管侵犯(MVI)、肿瘤组织低分化与HCC肝移植术后较高复发率有显著相关性。复习总结了近年来国内外18氟-脱氧葡萄糖(18F-FDG) PET/CT在HCC肝移植方面的应用文献,发现18F-FDG在HCC病变部位不同的摄取程度,反映了肿瘤组织生物学行为特征即侵袭性的差异;18F-FDG高摄取与HCC病变的MVI、低分化呈正相关;18F-FDG还能敏感、准确地发现HCC肝外转移灶。认为术前18F-FDG PET/CT结果对HCC肝移植预后评估有巨大价值,将其结果纳入HCC肝移植标准是趋势所归,也有望统一"扩大Milan版标准"。建议新的肝移植标准可定义为,原则上遵循Milan标准;...
-
关键词:
- 癌,肝细胞 /
- 肝移植 /
- 正电子发射断层显像计算机体层摄影术 /
- 氟脱氧葡萄糖F18
Abstract:Liver transplantation is an effective method for the treatment of hepatocellular carcinoma( HCC). In order to reduce the high recurrence rate of tumor after liver transplantation for HCC,some scholars put forward the famous Milan criteria. Since the Milan criteria are too strict,some HCC patients with relatively“good biological behavior”and large lesions or multiple nodules are excluded from the waiting list for liver transplantation,and thus a large number of“expanded versions of the Milan criteria”appeared around the world. As for the histopathology of HCC,microvascular invasion( MVI) and poorly differentiated tumor tissue are significantly associated with the high recurrence rate after liver transplantation for HCC. This article reviews and summarizes the articles on the application of18F-FDG PET/CT in liver transplantation for HCC in China and foreign countries and points out that the uptake of18F-FDG in HCC lesions reflects the difference in the biological behavior( i. e.,invasion) of tumor tissue. The intense uptake of18F-FDG is positively correlated with MVI and poor differentiation of HCC. In addition,18F-FDG can detect extrahepatic metastatic lesions sensitively and accurately. Preoperative18F-FDG PET/CT findings have a high value in predicting the prognosis of liver transplantation for HCC,and it is a trend to incorporate such findings into the criteria for liver transplantation in HCC. It is also expected to unify the various expanded versions of the Milan criteria. The new criteria for liver transplantation may be defined as follows: the Milan criteria should be followed in general; as for the patients who do not meet the Milan criteria,liver transplantation can be performed for those who have lesions with negative18F-FDG PET/CT results,without the involvement of major blood vessels or extrahepatic metastasis.
-
肝移植是治疗终末期肝病的最终手段,成功的肝移植将延长患者生存期。但由于肝移植受者术前普遍基础条件差,且手术过程复杂,导致术后并发症复杂多样,从而影响术后效果。目前,国内鲜有直接预测肝移植受者术后早期并发症发生的相关研究。研究[1-3]发现,肌肉减少症与肝移植术后并发症相关,腰大肌厚度/身高值(psoas muscle thickness per height,PMTH)可以通过脐平面的腰大肌横向厚度与患者的身高比值来诊断肌肉减少症,其计算方法简便,可用于预测肝移植等待名单中的患者死亡率[4]。控制营养状态(controlling nutritional status,CONUT)评分是一种评估患者术前营养状态的工具,其由血清白蛋白、血清总胆固醇、总淋巴细胞计数计算得出[5]。研究[6-8]表明,CONUT评分与原发性肝癌(以下简称为肝癌)肝切除患者的预后相关。本文旨在通过肝移植受者术前PMTH、CONUT评分结合术前、术中相关危险因素建立肝移植术后早期并发症发生的风险预测模型,用于指导肝移植围手术期治疗。
1. 资料与方法
1.1 研究对象
回顾性收集2016年1月—2018年12月于天津市第一中心医院肝移植科接受原位肝移植患者的临床资料。纳入标准:(1)受者年龄18~65岁;(2)供者为公民逝世后器官捐献;(3)肝癌肝移植受者符合米兰标准;(4) 受者术前2个月内行腹部CT检查;(5)受者术前1周内行血清总胆固醇检查。排除标准:(1)2次、多次或者挽救性肝移植受者;(2)术前合并严重肺炎受者;(3)术前合并心脑血管疾病受者;(4)边缘供肝(包括高龄供肝、脂肪肝供肝、劈离式肝移植供肝、病毒性肝炎供肝、高钠血症供肝、血流动力学不稳定,以及术前存在潜在供者来源性感染供肝等);(5)联合其他器官移植受者。
1.2 分组标准
按照Clavien-Dindo分级[9]将肝移植术后并发症分为5级,仅统计3级及以上并发症。3级并发症为需要行手术、内镜或介入干预的并发症,包括血管并发症(如门静脉狭窄、门静脉血栓、肝动脉血栓、脾肾分流、脾动脉盗血综合征等)、胆道并发症(如胆漏、胆汁引流不畅、胆管狭窄)以及其他并发症(如需要行穿刺的胸腹腔积液、腹腔出血,需要放置微导管引流的T管出口漏、鼻肠管置入等);4级并发症以单一器官或多器官衰竭为主,包括呼吸衰竭、心力衰竭、肝衰竭、肾衰竭并需要予以气管切开、体外肺膜氧合、人工肝、透析等治疗;5级并发症包括因感染性或失血性休克、重症肺炎、心力衰竭、肝衰竭、肾衰竭、颅内出血等原因导致受者死亡。随访受者术后90 d内并发症发生情况,根据是否发生3级以上并发症分为并发症组和无并发症组。
1.3 相关变量的测定与计算
1.3.1 PMTH测定与二分类变量划分
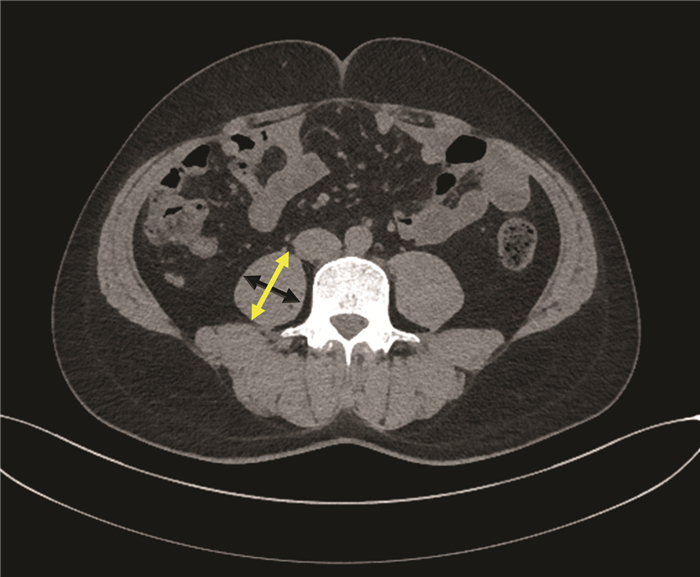
肝移植受者术前2个月内,采用美国GE Revolution 64排CT仪行腹部CT平扫或者增强CT,在CT图像上手动测量脐平面右侧腰大肌轴向和横向厚度。轴向腰大肌厚度为腰大肌在轴向视图上的最大直径,横向腰大肌厚度为在横向视图上垂直于轴向的直径(图 1),横向腰大肌厚度/患者身高=PMTH。PMTH与性别相关,且低PMTH与肝硬化患者的病死率相关[4]。根据男性患者术后90 d内死亡情况绘制受试者工作特征(ROC)曲线,曲线下面积(AUC)为0.699(P=0.003),95%CI: 0.625~0.766,敏感度为0.692,特异度为0.701,根据最佳约登指数0.394,选取截点值为17.9cm/m2,以PMTH≥17.9 cm/m2为高PMTH,以PMTH<17.9 cm/m2为低PMTH。根据女性患者术后90 d内死亡情况绘制ROC曲线,AUC为0.750(P=0.012),95%CI: 0.621~0.853,敏感度为0.833,特异度为0.778,根据最佳约登指数0.611 1,选取截点值为14.1 cm/m2,以PMTH≥14.1 cm/m2为高PMTH,以PMTH<14.1 cm/m2为低PMTH。因此,通过截点值将连续变量PMTH划分为二分类变量。
1.3.2 CONUT评分
采用受者术前最近一次血清白蛋白、血清总胆固醇、总淋巴细胞数检测结果计算CONUT评分,计算方法:血清白蛋白≥35.0 g/L计0分,30.0~34.9 g/L计2分,25.0~29.9 g/L计4分,<25.0 g/L计6分;血清总胆固醇≥180 mg/dL计0分,140~179 mg/dL计1分,100~139 mg/dL计2分,<100 mg/dL计3分;总淋巴细胞计数≥1.60×109/L计0分,1.20~1.59×109/L计1分,0.80~1.19×109/L计2分,<0.80×109/L计3分。
1.3.3 其他相关指标
收集受者年龄、性别、体质量指数(BMI)、血型、MELD评分[MELD评分=9.57×ln血肌酐(mg/dL)+3.78×ln血清总胆红素(mg/dL)+11.2×ln国际标准化比值+6.4×病因(胆汁淤积性和酒精性肝硬化为0,其他为1)]、血清总胆红素、血肌酐、凝血酶原时间国际标准化比值(PT-INR)、血尿素氮、血红蛋白、白细胞计数、血小板计数、术中输注红细胞量、输注冰冻血浆量、失血量、无肝期、手术时间以及供体年龄、BMI、供肝冷缺血时间(cold ischemia time,CIT)和供肝热缺血时间(warm ischemia time,WIT)等资料。
1.4 伦理学审查
本研究方案经由天津市第一中心医院伦理委员会审批,批号:2019N179KY,所纳入患者均签署知情同意书。
1.5 统计学方法
采用SPSS 20.0软件进行统计学分析。数据正态性检验采用Shapiro-Wilk检验。正态分布的计量资料以x±s表示,2组间比较采用独立样本t检验。非正态分布的计量资料以M(P25~P75)表示,2组间比较采用Mann-Whitney U检验。计数资料2组间比较采用χ2检验或Fisher确切概率法。采用AUC以及最佳约登指数选取PMTH的截点值。单因素分析时,以P<0.1为差异有统计学意义,将其纳入二元logistic回归,采用逐步法进行分析。采用bootstrap法(抽样1000次)进行内部验证,采用一致性指数、AUC检验模型的区分度,校正曲线及Hosmer-Lemeshow检验显示模型的拟合度,临床决策曲线检验模型的临床实用性。并发症发生率比较采用Kaplan-Meier法,以P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
共纳入肝移植受者234例,其中并发症组97例,无并发症组137例。并发症组中,男73例,女24例,年龄(50±9)岁,原发病包括乙型肝炎肝硬化24例,自身免疫性肝硬化8例,酒精性肝硬化14例,非酒精性脂肪性肝病2例,隐源性肝硬化1例,肝癌合并肝硬化25例(合并乙型或丙型肝炎),肝衰竭20例,其他3例;无并发症组中,男101例,女36例,年龄(49±10)岁,原发病包括乙型肝炎肝硬化43例,丙型肝炎肝硬化2例,自身免疫性肝硬化18例,酒精性肝硬化10例,非酒精性脂肪性肝病4例,隐源性肝硬化2例,肝癌合并肝硬化36例(合并乙型或丙型肝炎),肝衰竭19例,其他3例。两组原发病分布差异比较,差异无统计学意义(P=0.403)。根据PMTH测定结果,男性患者中高PMTH 117例,低PMTH 57例;女性患者中高PMTH 43例,低PMTH 17例。
2.2 建立预测模型
2.2.1 单因素分析
并发症组患者MELD评分、低PMTH比例、血清总胆红素、血肌酐、血尿素氮、CONUT评分、术中输注红细胞量、术中输注冰冻血浆量均明显高于无并发症组,血红蛋白水平明显低于无并发症组(P值均<0.1)。其他差异均无统计学意义(P值均>0.1)(表 1)。
表 1 肝移植术后早期并发症危险因素单因素分析指标 并发症组(n=97) 无并发症组(n=137) 统计值 P值 受者信息 年龄(岁) 50±9 49±10 t=0.780 0.354 性别[例(%)] χ2=0.070 0.791 男 73(75) 101(74) 女 24(25) 36(26) BMI (kg/m2) 24.0(21.7~27.0) 23.5(21.2~26.0) Z=-0.944 0.345 血型不相容[例(%)] 5(5.2) 8(5.8) χ2=0.051 1.000 MELD评分 20(16~24) 13(10~20) Z=5.499 <0.001 PMTH[例(%)] χ2=14.381 <0.001 低 44(45) 30(22) 高 53(55) 107(78) 血清总胆红素(μmol/L) 123.0(72.1~379.2) 29.9(18.0~115.6) Z=6.792 <0.001 血肌酐(μmol/L) 68.0(51.0~118.5) 61.0(50.0~69.5) Z=2.371 0.018 PT-INR 1.50(1.18~2.03) 1.45(1.19~1.97) Z=0.228 0.820 血尿素氮(mmol/L) 5.3(3.7~11.8) 4.7(3.5~5.8) Z=2.560 0.010 血红蛋白(g/L) 100±25 107±29 t=-2.097 0.044 白细胞计数(×109/L) 4.9(3.4~6.8) 4.6(3.1~6.8) Z=0.985 0.324 血小板计数(×109/L) 93(47~152) 117(54~170) Z=-1.441 0.150 ConUT评分(分) 7(6~8) 5(3~7) Z=6.308 0.004 手术情况 术中输注红细胞量(U) 10(8~12) 8(6~10) Z=2.456 0.014 术中输注冰冻血浆量(mL) 2000(1600~2350) 2000(1400~2000) Z=2.171 0.030 术中失血量(mL) 2000(1500~2450) 1800(1500~2400) Z=1.365 0.172 无肝期(min) 45(35~50) 45(40~50) Z=-0.051 0.959 手术时间(h) 8.0±1.6 7.8±1.5 t=1.144 0.200 供者信息 年龄(岁) 41±9 42±10 t=-0.904 0.939 BMI(kg/m2) 24.1(21.4~27.4) 23.8(22.1~26.4) Z=-0.255 0.799 CIT(h) 7.3(6.4~7.9) 6.8(6.2~7.8) Z=1.138 0.255 WIT(min) 5.8±1.7 5.7±1.5 t=0.237 0.182 2.2.2 预测模型的推导与建立
二元logistc多因素分析(采用逐步法分析,由于有报道[10]称CIT、WIT为肝移植术后胆道并发症的危险因素,遂将二者均纳入)结果显示,MELD评分、低PMTH比例、CONUT评分为肝移植术后3级及以上并发症发生的独立危险因素(P值均<0.05) (表 2)。笔者根据Framingham研究中心提供的logistic模型建立积分系统的方法[11],以0.393为常量,将此常量设定为1分,设定变量CONUT评分截距为1,基于MELD评分,PMTH、血清白蛋白、血清总胆固醇以及总淋巴细胞计数建立了一个简单的肝移植术后并发症风险预测模型(表 3),该预测模型最高分为24分。
表 2 肝移植术后早期并发症危险因素多因素分析危险因素 β值 P值 OR 95%CI MELD评分 0.099 0.002 1.104 1.057~1.154 PMTH 1.050 <0.001 2.858 1.451~5.626 ConUT评分 0.393 <0.001 1.481 1.287~1.703 表 3 肝移植术后早期并发症风险预测模型危险因素 得分 MELD评分 <10分 0 10~19分 3 20~29分 6 ≥30分 9 PMTH 高 0 低 3 血清白蛋白 ≥35.0 g/L 0 30.0~34.9 g/L 2 25.0~29.9 g/L 4 <25.0 g/L 6 血清总胆固醇 ≥180 g/L 0 140~179 g/L 1 100~139 g/L 2 <100 g/L 3 总淋巴细胞计数 ≥1.60×109/L 0 1.20×109/L~1.59 ×109/L 1 0.80×109/L~1.19×109/L 2 <0.8×109/L 3 2.3 预测模型的内部验证与评价
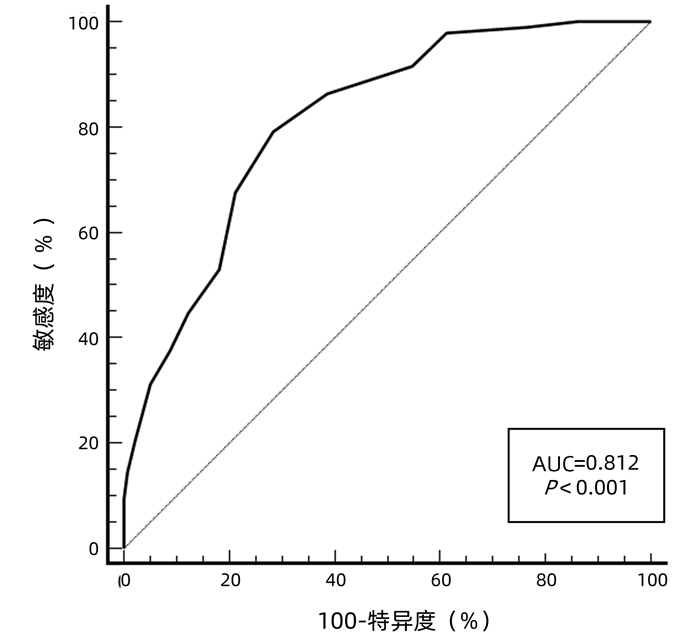
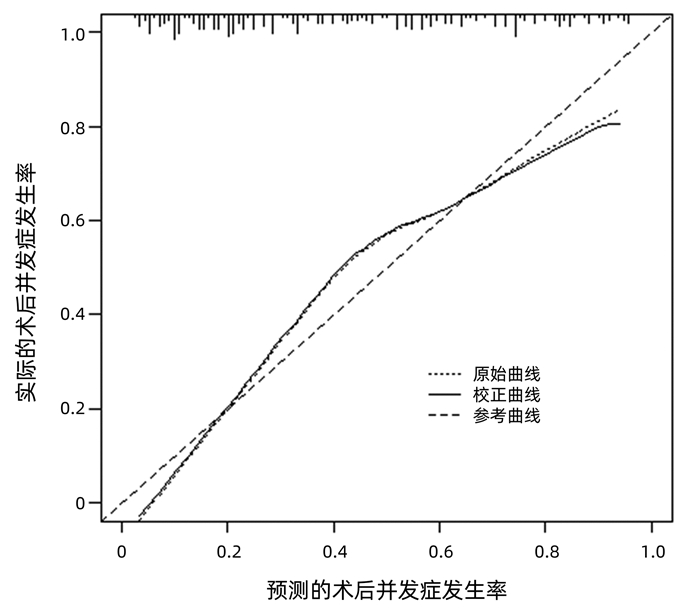
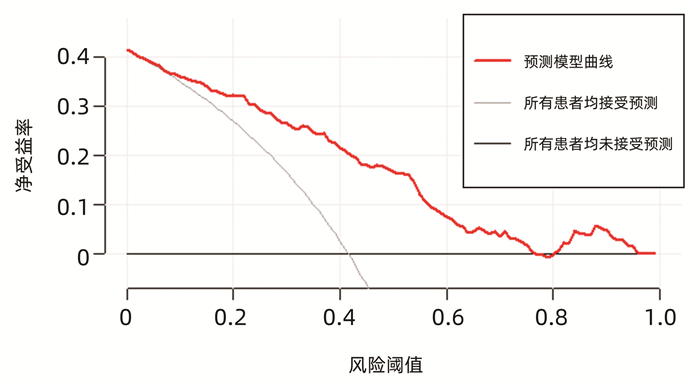
运用bootstrap法(抽样1000次)对该预测模型进行内部验证,其一致性指数为0.828,95%CI: 0.826~0.829。AUC=0.812,P<0.001(图 2),95%CI: 0.756~0.860,敏感度为0.792,特异度为0.751,最佳约登指数为0.507,表明该预测模型具有良好的区分度。该预测模型校正曲线接近参考曲线(图 3),Hosmer-Lemeshow检验表明该预测模型具有良好的拟合度(χ2=8.525,P=0.382)。决策曲线显示大部分患者均能从预测模型中获益,且净获益率较高(图 4),表明该预测模型具有良好的临床实用性。
2.4 风险评分分组及并发症发生率
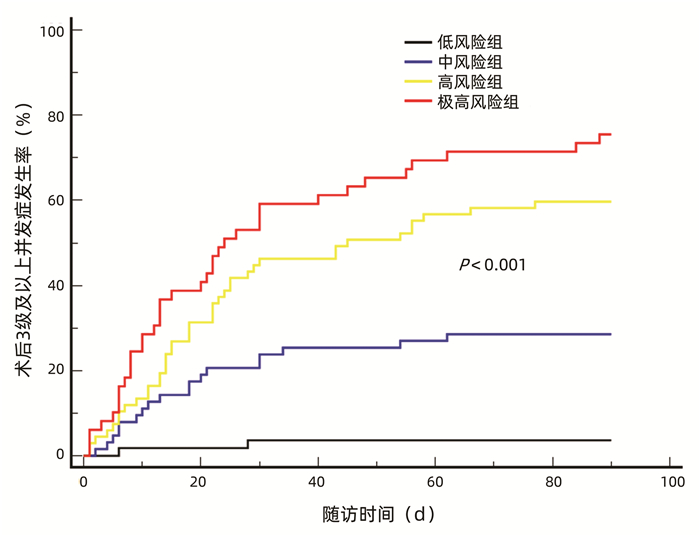
根据最佳约登指数,选择11分为截点值,并根据受者术后实际并发症发生情况,将风险评分进一步划分为低风险组(<8分,n=55),中风险组(8~10分,n=63)、高风险组(11~14分,n=67)、极高风险组(≥15分,n=49)。根据4组3级以上并发症发生率分别制作Kaplan-Meier曲线,结果显示,术后90 d,低风险组、中风险组、高风险组、极高风险组累积并发症发生率分别为3.6%、28.6%、59.7%、75.5%,并发症发生率随着风险评分的上升而递增(P<0.001)(图 5)。
3. 讨论
近年来,肝移植技术不断完善发展,但对术后各类并发症的控制仍不理想,严重影响受者和移植肝的长期存活[12]。据报道[13-14],营养状态是影响肝移植受者预后的因素之一。目前,临床常用的营养状态评估工具主要包括BMI、营养风险筛查2002(nutrition risk screening 2002,NRS2002)、皇家自由医院-营养优先排序工具(Royal Free Hospital-nutritional prioritizing tool,RFH-NPT)、上臂围、肌量和肌肉功能测定等[13, 15-16]。由于部分终末期肝病患者存在大量腹腔积液,难以精确地测量其体质量,并且部分患者由于长期卧床,缺少术前体质量数据,因此,使用BMI对肝移植术前患者进行营养评估缺乏准确性。而NRS2002和RFH-NPT均需要评估一段时间内患者体质量和进食量变化[17-18],实际统计时往往掺杂患者的主观因素,且对于依从性较差的患者往往难以获取相关数据;此外,部分患者因为病情严重,短期内亟需行肝移植术,难以完成长期检测,影响了NRS2002、RFH-NPT的临床应用。上臂围是非常客观的营养评估指标,其不受液体潴留以及周围水肿的影响,操作方法简单、易行,有学者[19-20]推荐其作为慢性肝病的筛查指标,但其并不是我国肝移植患者的基本检测项目,且因测量者不同,测量结果可能存在一定误差。测量全身的骨骼肌含量是诊断肌肉减少症的金标准,但是测量工作复杂、繁琐,需要通过测量第3腰椎水平面的骨骼肌指数(skeletal muscle index,SMI)并依赖相关软件实现对骨骼肌含量的计算[21-23]。
笔者团队在设计建立肝移植术后早期并发症风险预测模型前,全面分析了数种营养相关指标,并结合临床实际,最终选定纳入CONUT评分、PMTH、血清白蛋白、总淋巴细胞计数、血清总胆固醇、MELD评分作为参数。CONUT评分的计算需要的3个指标(血清白蛋白、血清总胆固醇、总淋巴细胞计数)均与临床紧密相关,且为患者定期检查项目,容易及时获得数据,计算方法简单。而相比于需要计算第3腰椎水平面的SMI,PMTH仅需要在CT图像上测量右侧腰大肌的横向厚度,其过程方便、简洁。研究[24]表明,在肝硬化患者中,PMTH与第3腰椎水平面的SMI高度相关,是肝硬化患者死亡的独立危险因素。腰大肌的横向厚度与性别、年龄、人种相关,因此,笔者根据本研究数据确定出截点值,即男性患者PMTH<17.9 cm/m2诊断为低PMTH,女性患者PMTH<14.1 cm/m2诊断为低PMTH。本研究结果显示,低PMTH受者术后3级以上并发症发生风险明显增加,究其原因可能是由于骨骼肌含量减少导致氨基酸存储降低,从而不能为细胞修复提供足量的氨基酸,进而导致血管、胆道相关并发症以及伤口不愈合[25];再者,骨骼肌可以释放谷氨酰胺激活淋巴细胞,从而提高机体免疫力[26-28],而骨骼肌减少使受者免疫力下降,同时,受者呼吸肌肌肉含量减少,一定程度上引起术后咳痰能力下降,导致肺相关并发症发生[29]。而受者白蛋白、总淋巴细胞计数水平降低将导致机体免疫力降低,使受者术后易发肺炎、伤口感染等并发症。在终末期肝病患者中,由于肝功能受损,导致肝细胞合成胆固醇能力下降,而胆固醇是细胞膜的组成成分,发挥着维持细胞结构和功能的作用,胆固醇的减少可能会使细胞修复功能受损,导致术后相关并发症[30]。另据报道[10],较长的供肝冷、热缺血时间是术后胆道并发症发生的危险因素。然而,本研究中未见其与术后早期3级以上并发症的发生存在相关性,可能是由于本中心供肝的冷、热缺血时间较短,一直处于安全的时间范围内[31]。
本研究的局限性包括:(1)纳入的女性患者较少,在选取女性患者PMTH截点值时可能存在一定程度上的偏倚,影响结果的准确性;(2)受者PMTH值为术前2个月内,血清总胆固醇值为术前1周内,部分病情较重患者的PMTH以及血清总胆固醇会随着病情变化而改变,在一定程度上影响模型的准确性;(3)该预测模型仅完成内部验证,尚未开展外部验证,笔者希望今后可以联合各个移植中心,扩大样本量,进一步开展临床可行性验证。
综上所述,术前MELD评分、PMTH和CONUT评分是肝移植术后3级以上并发症发生的独立危险因素,本研究纳入MELD评分、PMTH、血清白蛋白、血清总胆固醇、总淋巴细胞计数作为参数,建立并验证了我国18~65岁人群中初次行原位肝移植的患者术后90 d内并发症发生的风险预测模型,该预测模型能够有效识别高风险患者,进而指导临床医师加强对高风险患者围手术期的管理。
-
[1] BRAY F,FERLAY J,SOERJOMATARAM I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424. [2] LEE SM,KIM HS,LEE S,et al. Emerging role of18F-fluorodeoxyglucose positron emission tomography for guiding management of hepatocellular carcinoma[J]. World J Gastroenterol,2019,25(11):1289-1306. [3] PANT V,SEN IB,SOIN AS. Role of18F-FDG PET CT as an independent prognostic indicator in patients with hepatocellular carcinoma[J]. Nucl Med Commun,2013,34(8):749-757. [4] KORNBERG A,SCHERNHAMMER M,FRIESS H.18F-FDGPET for assessing biological viability and prognosis in liver transplant patients with hepatocellular carcinoma[J]. J Clin Transl Hepatol,2017,5(3):224-234. [5] MAZZAFERRO V,REGALIA E,DOCI R,et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis[J]. N Engl J Med,1996,334(11):693-699. [6] LI HB,FU HY,LU TY,et al. Key research advances in liver transplantation in 2017[J]. Ogran Transplantation,2018,9(1):41-50,82.(in Chinese)李海波,符洪源,陆桐宇,等.肝移植领域2017年度重要进展盘点[J].器官移植,2018,9(1):41-50,82. [7] YAO FY,FERRELL L,BASS NM,et al. Liver transplantation for hepatocellular carcinoma:Expansion of the tumor size limits does not adversely impact survival[J]. Hepatology,2001,33(6):1394-1403. [8] MARSH JW,DVORCHIK I,BONHAM CA,et al. Is the pathologic TNM staging system for patients with hepatoma predictive of outcome?[J]. Cancer,2000,88(3):538-543. [9] LEE SG,HWANG S,MOON DB,et al. Expanded indication criteria of living donor liver transplantation for hepatocellular carcinoma at one large-volume center[J]. Liver Transpl,2008,14(7):935-945. [10] DUBAY D,SANDROUSSI C,SANDHU L,et al. Liver transplantation for advanced hepatocellular carcinoma using poor tumor differentiation on biopsy as an exclusion criterion[J].Ann Surg,2011,253(1):166-172. [11] MAZZAFERRO V,LLOVET JM,MICELI R,et al. Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria:A retrospective,exploratory analysis[J]. Lancet Oncol,2009,10(1):35-43. [12] ZHENG SS,WANG K,XU X,et al. Clinical value of Hangzhou Criteria in selection of patients with hepatocellular carcinoma for living donor liver transplantation[J]. Chin J Organ Transplant,2011,32(6):330-333.(in Chinese)郑树森,汪恺,徐骁,等.肝移植治疗肝癌的受者选择杭州标准在亲属活体供肝移植中的应用价值[J].中华器官移植杂志,2011,32(6):330-333. [13] FAN J,ZHOU J,XU Y,et al. Indication of liver transplantation for hepatocellular carcinoma:Shanghai Fudan Criteria[J].Natl Med J China,2006,86(18):1227-1231.(in Chinese)樊嘉,周俭,徐泱,等.肝癌肝移植适应证的选择:上海复旦标准[J].中华医学杂志,2006,86(18):1227-1231. [14] CHANG XJ,LU YY,RONG GH,et al. Risk factors for vascular invasion of primary liver cancer[J]. J Clin Hepatol,2018,34(5):1038-1041.(in Chinese)常秀娟,陆荫英,荣光华,等.原发性肝癌发生血管侵犯的危险因素分析[J].临床肝胆病杂志,2018,34(5):1038-1041. [15] HSU CC,CHEN CL,WANG CC,et al. Combination of FDGPET and UCSF Criteria for predicting HCC recurrence after living donor liver transplantation[J]. Transplantation,2016,100(9):1925-1932. [16] SUN DW,AN L,WEI F,et al. Prognostic significance of parameters from pretreatment(18)F-FDG PET in hepatocellular carcinoma:A meta-analysis[J]. Abdom Radiol(NY),2016,41(1):33-41. [17] IJICHI H,SHIRABE K,TAKETOMI A,et al. Clinical usefulness of(18)F-fluorodeoxyglucose positron emission tomography/computed tomography for patients with primary liver cancer with special reference to rare histological types,hepatocellular carcinoma with sarcomatous change and combined hepatocellular and cholangiocarcinoma[J]. Hepatol Res,2013,43(5):481-487. [18] WANG YT,ZUO CJ,ZHANG J,et al. Value of Fluorine-18-fluorodeoxyglucose PET/CT examination to predict microvascular invasion of hepatocellular carcinoma[J]. Chin J Dig Surg,2018,17(1):109-115.(in Chinese)王玉涛,左长京,张建,等.18氟-氟代脱氧葡萄糖PET/CT检查预测肝细胞癌微血管侵犯的价值[J].中华消化外科杂志,2018,17(1):109-115. [19] KOBAYASHI T,AIKATA H,HONDA F,et al. Preoperative fluorine 18 fluorodeoxyglucose positron emission tomography/computed tomography for prediction of microvascular invasion in small hepatocellular carcinoma[J]. J Comput Assist Tomogr,2016,40(4):524-530. [20] BAILLY M,VENEL Y,ORAIN I,et al.18F-FDG PET in liver transplantation setting of hepatocellular carcinoma:Predicting histology?[J]. Clin Nucl Med,2016,41(3):e126-e129. [21] LIN CY,LIAO CW,CHU LY,et al. Predictive value of18FFDG PET/CT for vascular invasion in patients with hepatocellular carcinoma before liver transplantation[J]. Clin Nucl Med,2017,42(4):e183-e187. [22] YANG SH,SUH KS,LEE HW,et al. The role of(18)F-FDG-PET imaging for the selection of liver transplantation candidates among hepatocellular carcinoma patients[J]. Liver Transpl,2006,12(11):1655-1660. [23] KORNBERG A,WITT U,SCHERNHAMMER M,et al. Combining18F-FDG positron emission tomography with Up-toSeven criteria for selecting suitable liver transplant patients with advanced hepatocellular carcinoma[J]. Sci Rep,2017,7(1):14176. [24] LEE SD,KIM SH,KIM SK,et al. Clinical impact of18F-fluorodeoxyglucose positron emission tomography/computed tomography in living donor liver transplantation for advanced hepatocellular carcinoma[J]. Transplantation,2015,99(10):2142-2149. [25] REFAAT R,BASHA MAA,HASSAN MS,et al. Efficacy of contrast-enhanced FDG PET/CT in patients awaiting liver transplantation with rising alpha-fetoprotein after bridge therapy of hepatocellular carcinoma[J]. Eur Radiol,2018,28(12):5356-5367. [26] TAKADA Y,KAIDO T,SHIRABE K,et al. Significance of preoperative fluorodeoxyglucose-positron emission tomography in prediction of tumor recurrence after liver transplantation for hepatocellular carcinoma patients:A Japanese multicenter study[J]. J Hepatobiliary Pancreat Sci,2017,24(1):49-57. 期刊类型引用(4)
1. 李正优,李荷,周俊. 预见性护理结合舒适护理干预在肝移植术后患者中的应用. 西藏医药. 2024(06): 123-125 .  百度学术
百度学术2. 李珊珊,王媛,高春辉. 早期下床活动对肝移植术后患者胃肠功能及下肢血流的影响. 国际移植与血液净化杂志. 2023(01): 41-44 .  百度学术
百度学术3. 张欣悦,王海刚,王昊,杨传伟. 他克莫司治疗1例肝移植术后患者的药学监护. 中国医药导报. 2023(14): 183-187 .  百度学术
百度学术4. 种庚,彭晓春,吴若林,赵红川,邵敏. 成人肝移植术后早期严重并发症相关危险因素分析. 肝胆外科杂志. 2022(06): 454-459 .  百度学术
百度学术其他类型引用(0)
-




 PDF下载 ( 1982 KB)
PDF下载 ( 1982 KB)


 下载:
下载:




 百度学术
百度学术
 下载:
下载: