游离脂肪酸诱导的肝细胞脂肪变性对巨噬细胞极化的影响
DOI: 10.3969/j.issn.1001-5256.2021.02.027
Effect of hepatocyte fatty degeneration induced by free fatty acid on macrophage polarization
-
摘要:
目的 探讨游离脂肪酸诱导的肝细胞脂肪变性对巨噬细胞极化的影响及可能机制。 方法 胶原酶原位灌注法分离C57BL/6小鼠原代肝细胞,将细胞分为对照(NC)组和混合游离脂肪酸(FFA)处理组,并制备肝细胞条件培养液(CM),以CM干预巨噬细胞株RAW264.7。油红O染色检测肝细胞内脂质沉积情况,Real-time PCR检测肝细胞脂质代谢相关基因和巨噬细胞M1/M2型极化基因表达,ELISA检测肝细胞培养上清细胞因子水平。Western Blot检测巨噬细胞Toll样受体4(TLR4)/核因子-κB(NF-κB)信号通路相关蛋白表达。计量资料两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用Tukey检验。 结果 与NC组相比,FFA孵育诱导肝细胞内大量脂滴沉积,细胞内甘油三酯和总胆固醇含量明显升高(t值分别为15.65、3.49,P值均 < 0.05)。FFA显著上调肝细胞脂质合成基因固醇调节元件结合蛋白1C和脂肪酸合酶的mRNA表达(t值分别为2.89、2.82,P值均 < 0.05),并降低脂质分解基因脂酰辅酶A氧化酶1和肉碱棕榈酰转移酶1A的mRNA表达(t值分别为14.30、3.36,P值均 < 0.05)。FFA诱导肝细胞培养上清炎性细胞因子IL-6、IL-1β和TNFα的水平明显增加(P值均 < 0.05)。相比CM-NC,CM-FFA显著增加巨噬细胞M1型基因诱生型一氧化氮合酶2、TNFα和IL-6 mRNA表达(P值均 < 0.05),降低M2型基因IL-10 mRNA表达水平(P < 0.05)。Western Blot检测结果显示,CM-FFA显著增加巨噬细胞TLR4、磷酸化NF-κBp65和磷酸化NF-κB抑制因子表达水平(t值分别为2.88、3.69、3.54,P值均 < 0.05)。 结论 FFA诱导的肝细胞脂肪变性和炎症反应可促进巨噬细胞M1型极化,启动和触发非酒精性脂肪性肝病发生发展。 Abstract:Objective To investigate the effect of hepatocyte fatty degeneration induced by free fatty acid on macrophage polarization and the possible mechanism. Methods Primary hepatocytes of C57BL/6 mice were isolated by in situ collagenase perfusion, and then the hepatocytes were divided into control (NC) group and mixed free fatty acid (FFA) treatment group. A conditioned medium (CM) was prepared for hepatocytes and was used for the intervention of RAW264.7 macrophages. Oil red O staining was used to observe lipid deposition in hepatocytes; real-time PCR was used to measure the mRNA expression of lipid metabolism genes and macrophage M1/M2 polarization markers; ELISA was used to measure the levels of cytokines in supernatant; Western blot was used to measure the expression of proteins involved in the Toll-like receptor 4 (TLR4)/nuclear factor-kappa B (NF-κB) pathway in macrophages. The independent samples t-test was used for comparison between two groups; a one-way analysis of variance was used for comparison between multiple groups, and the Tukey test was used for further comparison between two groups. Results Compared with the NC group, the FFA treatment group had the deposition of massive lipid droplets in hepatocytes and significant increases in triglyceride and total cholesterol (t=15.65 and 3.49, both P < 0.05). Besides, FFA significantly increased the mRNA expression of the lipid synthesis genes SREBP1C and FASN (t=2.89 and 2.82, both P < 0.05) and reduced the mRNA expression of the lipid decomposition genes ACOX1 and CPT1A (t=14.30 and 3.36, both P < 0.05) in hepatocytes. FFA also induced significant increases in the levels of the inflammatory cytokines interleukin-6 (IL-6), interleukin-1β, and tumor necrosis factor-α (TNF-α) in supernatant (all P < 0.05). Compared with the CM-NC group, the CM-FFA group had significant increases in the mRNA expression of the M1 phenotype markers iNOS2, TNF-α, and IL-6 (all P < 0.05) and a significant reduction in the mRNA expression of the M2 phenotype marker interleukin-10 (P < 0.05). Moreover, Western blot showed that CM-FFA significantly upregulated the protein expression of TLR4, p-NF-κBp65, and p-ⅠκBα in macrophages (t=2.88, 3.69, and 3.54, all P < 0.05). Conclusion FFA-induced hepatocyte fatty degeneration and inflammation can promote M1 macrophage polarization, thereby initiating and triggering the development and progression of nonalcoholic fatty liver disease. -
Key words:
- Non-alcoholic Fatty Liver Disease /
- Macrophages /
- Fatty Acids
-
随着经济水平的发展和膳食结构的改变,我国2型糖尿病(T2DM)的患病率一直处于上升趋势,流行病学调查显示我国18岁及以上成年人中T2DM的患病率已达11.2%[1]。非酒精性脂肪性肝病(NAFLD)是肝细胞内脂质的过度沉积[2],T2DM与NAFLD的关系已得到充分认可。T2DM合并NAFLD的全球患病率为55.5%[3],对于T2DM合并NAFLD的预测具有重要的意义。肥胖和胰岛素抵抗(IR)是T2DM合并NAFLD的危险因素[4]。BMI是判断肥胖的常用指标,甘油三酯葡萄糖乘积指数(triglyceride-glucose index,TyG)可反应体内的IR。因此,本研究通过回顾性分析中国医科大学附属盛京医院T2DM合并NAFLD患者的临床资料,探讨TyG联合BMI对T2DM合并NAFLD的预测价值。
1. 资料与方法
1.1 研究对象
收集2020年5月—2021年7月经本院诊治为T2DM患者的临床资料,T2DM的诊断符合《中国2型糖尿病防治指南(2020年版)》[5],按照有无NAFLD分为T2DM合并NAFLD组和单纯T2DM组,NAFLD的诊断符合《非酒精性脂肪性肝病防治指南(2018更新版)》[6]。
排除标准:(1)年龄<18岁或>65岁的患者;(2)1型糖尿病及其他类型糖尿病患者,2型糖尿病并发酮症酸中毒或高渗昏迷等急性并发症的患者;(3)酒精性肝病、病毒性肝炎、药物性肝损伤、自身免疫性肝病、遗传代谢性肝病等其他肝病患者;(4)恶性肿瘤患者;(5)近3个月口服保肝药物的患者。
1.2 研究指标
1.2.1 一般资料测量
(1) 测量患者的身高和晨起体质量,计算BMI;(2)测量晨起静息状态下右上臂收缩压及舒张压。
1.2.2 生化指标检测
清晨空腹采肘静脉血,采用日立7600全自动生化分析仪检测AST、ALT、GGT、TBil、IBil、DBil、TG、TC、HDL-C、LDL-C、空腹血糖(FBG)、糖化血红蛋白(HbA1c)。计算TyG指数,TyG=ln[TG(mg/dL)× FBG(mg/dL)/2]。
1.2.3 肝脏彩超检测
使用TOSHIBA Aplio500彩色多普勒超声于空腹状态下检查肝脏,NAFLD表现包括肝脏近场回声增强、肝内管道结构显示不清、远场回声衰减等特征。
1.3 统计学方法
采用SPSS 25.0统计学软件进行分析。符合正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U检验;计数资料两组间比较采用χ2检验。采用logistic回归分析TyG及BMI与T2DM合并NAFLD的关系;绘制受试者工作特征曲线(ROC曲线)评价TyG、BMI及TyG联合BMI对T2DM合并NAFLD的预测效能,测量曲线下面积(AUC),根据约登指数最大原则确定最佳截断点,并计算敏感度、特异度、阳性预测值、阴性预测值,采用Kappa系数分析预测结果的一致性程度。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
共纳入T2DM患者349例。T2DM合并NAFLD组213例,其中男139例,女74例,年龄21~65岁,平均(45.59±12.53) 岁;单纯T2DM组136例,其中男95例,女41例,年龄19~64岁,平均(43.82±12.95)岁。两组的年龄(t=1.265)、性别(χ2=0.793)差异均无统计学意义(P值均>0.05)。
2.2 两组BMI、血压及生化指标的比较
T2DM合并NAFLD组的BMI、舒张压、FBG、HbA1c、ALT、AST、GGT、TG、TC、LDL-C、TyG均高于单纯T2DM组(P值均<0.05),T2DM合并NAFLD组的HDL-C低于单纯T2DM组(P<0.05),两组在收缩压、TBil、DBil、IBil间的差异均无统计学意义(P值均>0.05)(表 1)。
表 1 两组一般资料的比较Table 1. Comparison of general data between two groups指标 T2DM合并NAFLD组(n=213) 单纯T2DM组(n=136) 统计值 P值 BMI(kg/m2) 26.33(24.52~29.37) 23.23(21.92~25.39) Z=-9.044 <0.001 收缩压(mmHg) 130.00(120.00~140.00) 130.00(120.00~140.00) Z=-1.729 0.084 舒张压(mmHg) 80.00(80.00~90.00) 80.00(75.00~84.00) Z=-3.251 0.001 FBG(mmol/L) 9.85(8.20~12.29) 7.96(6.36~9.68) Z=-6.126 <0.001 HbA1c(%) 8.90(7.45~10.25) 7.35(6.50~9.05) Z=-5.075 <0.001 ALT(U/L) 31.00(22.00~44.00) 21.00(13.00~26.00) Z=-7.820 <0.001 AST(U/L) 22.00(17.00~29.00) 18.00(15.00~21.00) Z=-5.447 <0.001 GGT(U/L) 36.00(24.00~56.00) 18.00(13.00~25.25) Z=-9.402 <0.001 TBil(μmol/L) 10.25(8.30~13.40) 10.40(7.80~13.20) Z=-0.098 0.922 DBil(μmol/L) 3.20(2.50~4.18) 3.30(2.53~4.38) Z=-1.129 0.259 IBil(μmol/L) 7.25(5.40~9.20) 7.05(5.25~9.00) Z=-0.226 0.821 TG(mmol/L) 2.42(1.74~3.63) 1.07(0.81~1.50) Z=-11.831 <0.001 TC(mmol/L) 5.04(4.28~5.96) 4.21(3.86~4.70) Z=-7.188 <0.001 HDL-C(mmol/L) 1.02(0.88~1.25) 1.16(1.02~1.37) Z=-4.897 <0.001 LDL-C(mmol/L) 3.28(2.63~3.97) 2.87(2.63~3.87) Z=-4.042 <0.001 TyG 9.98±0.79 8.87±0.61 t=13.832 <0.001 2.3 TyG、BMI与T2DM合并NAFLD的logistic回归分析
以是否合并NAFLD为因变量,TyG和BMI为自变量纳入logistic回归方程,提示TyG和BMI为T2DM合并NAFLD的危险因素。校正单因素分析具有统计学差异的舒张压、FBG、HbA1c、ALT、AST、GGT、TG、TC、LDL-C、HDL-C后,仍具有统计学意义,表示TyG和BMI均为T2DM合并NAFLD的独立危险因素(表 2)。
表 2 TyG、BMI与T2DM合并NAFLD的logistic回归分析Table 2. Logistic regression analysis of TyG, BMI in T2DM combined with NAFLD指标 β值 标准误 Wald值 OR值 95%CI P值 校正前BMI 0.392 0.051 59.377 1.479 1.339~1.634 <0.001 校正前TyG 2.439 0.269 82.237 11.459 6.764~19.411 <0.001 校正后BMI 0.314 0.071 19.390 1.369 1.191~1.575 <0.001 校正后TyG 1.874 0.633 8.766 6.513 1.884~22.517 0.003 2.4 TyG、BMI及TyG联合BMI对T2DM合并NAFLD的预测价值
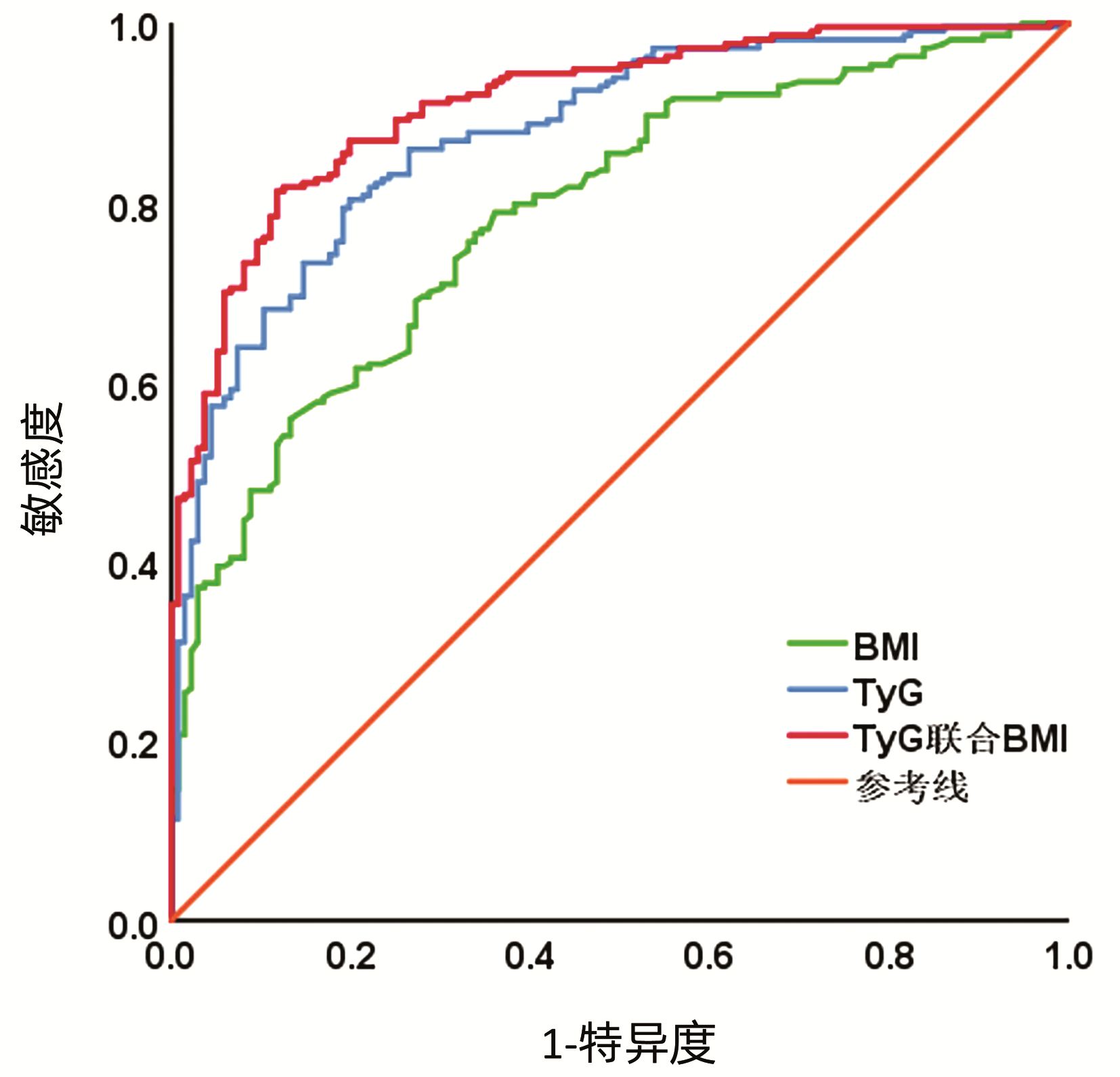
根据ROC曲线结果可见,TyG和BMI预测T2DM合并NAFLD的最佳截断点分别为9.41、24.22,TyG预测的AUC、特异度、敏感度、阳性预测值、阴性预测值均高于BMI,二者联合可以进一步提高预测效能。Kappa系数显示TyG联合BMI预测T2DM合并NAFLD具有更好的一致性(图 1,表 3)。
表 3 TyG、BMI及TyG联合BMI对T2DM合并NAFLD的预测价值Table 3. Predictive value of TyG, BMI and TyG combined BMI for T2DM combined with NAFLD指标 最佳截断点 AUC 95%CI 敏感度(%) 特异度(%) 阳性预测值(%) 阴性预测值(%) Kappa系数 BMI 24.22 0.787 0.740~0.834 78.9 64.0 77.36 64.23 0.416 TyG 9.41 0.875 0.839~0.911 80.3 80.1 86.36 72.19 0.592 TyG联合BMI 0.910 0.881~0.940 81.2 88.2 91.53 75.00 0.673 3. 讨论
超声作为最常用的影像学检查方法,广泛用于临床上对于脂肪肝的诊断,但超声对于轻度脂肪肝的检出率及敏感性较低[7],且超声在诊断脂肪肝过程中易受操作者主观判断及患者皮下脂肪厚度、脾肾回声、肝纤维化的影响,使其有一定的局限性[8]。因此,寻找一个简单可行的,不受操作者主观影响的无创指标,对于NAFLD的预测具有重要的临床意义。BMI包含身高和体质量,TyG包含TG和FBG,均为日常工作中最基础的指标,构成简单,应用方便,因此具有用于预测T2DM合并NAFLD的基本要求。
BMI升高反映着超重和肥胖的存在,本研究结果显示BMI是T2DM合并NAFLD的独立危险因素,原因在于:(1)超重或肥胖时出现脂肪营养不良,肝细胞则会储存多余的脂质[9];(2)脂肪细胞肥大、增生的过程中产生细胞因子,释放脂肪酸,在肝脏内积聚后诱发肝脏炎症反应、细胞损伤及凋亡[10];(3)肥胖时分泌的脂肪因子向更具脂肪及纤维生成性、炎症性的方向转移[11],加重肝损伤。超重或肥胖与NAFLD有着密切的关系,因此BMI可用于预测T2DM合并NAFLD的发生。
IR是T2DM和NAFLD的发病基础。TyG指数最早由Simental-Mendía于2008年提出[12],与评估IR金标准的高胰岛素-正葡萄糖钳夹试验显著相关[13],因此也被看作是IR的标志物[14]。IR在T2DM合并NAFLD中的影响在于:(1)IR时外周组织对胰岛素的敏感性下降,胰岛素对脂解的抑制作用也减弱,导致游离脂肪酸异位沉积于肝脏中[15-16]。(2)IR状态下的高胰岛素和高血糖上调SREBP1c和ChEBP活性,激活糖分解和脂肪生成酶,刺激肝脏脂肪的从头合成[17]。(3)IR活化巨噬细胞,介导肝巨噬细胞和肝星状细胞关联,促进NAFLD发展为肝纤维化甚至肝癌[18]。因此,作为IR标志物的TyG可预测T2DM中的NAFLD。
本研究结果指出TyG联合BMI对T2DM合并NAFLD的预测效能和一致性水平上高于单一指标检测,考虑在于二者联合综合了IR和肥胖对T2DM合并NAFLD的影响,所以提高了预测价值。目前对于NAFLD的筛查要求,也指出在明确NAFLD的同时应评估患者是否同时存在其他代谢综合征组分[19],所以,TyG联合BMI在预测NAFLD的同时,也能对肥胖、IR、血糖血脂等代谢组分的评估进行指导,因此具有较高的应用价值。
综上所述,应重视T2DM合并NAFLD的预测,TyG和BMI可作为预测T2DM合并NAFLD的指标,联合用于T2DM合并NAFLD的筛查与管理。
-
表 1 Real-time PCR引物序列表
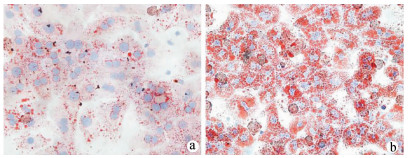
基因名称 引物序列 iNOS2 F:5′-GTGTTCCACCAGGAGATGTTG-3′ R:5′-CTCCTGCCCACTGAGTTCGTC-3′ TNFα F:5′-TCTTCTCATTCCTGCTTGTGG-3′ R:5′-GGTCTGGGCCATAGAACTGA-3′ IL-6 F:5′-GTTCTCTGGGAAATCGTGGA-3′ R:5′-GGAAATTGGGGTAGGAAGGA-3′ Arg1 F:5′-CTCCAAGCCAAAGTCCTTAGA-3′ R:5′-AGGAGCTGTCATTAGGGACATC-3′ Mrc2 F:5′-TACAGCTCCACGCTATGGATT-3′ R:5′-CACTCTCCCAGTTGAGGTACT-3′ IL-10 F:5′-GTTACTTGGGTTGCCAAG-3′ R:5′-TTGATCATCATGTATGCTTC-3′ IL-1β F:5′-TCTTTGAAGTTGACGGACCC-3′ R:5′-TGAGTGATACTGCCTGCCTG-3′ ACOX1 F:5′-AACAGCCCAACTGTGACTTC-3′ R:5′-ACAAAGGCATGTAACCCGTA-3′ CPT1A F:5′-CTTCCCATTTGACACCTTTG-3′ R:5′-ATACGTGAGGCAGAACTTGC-3′ SREBP1C F:5′-ACAGCAACCAGAAGCTCAAG-3′ R:5′-TGCCCTCCATAGACACATCT-3′ FASN F:5′-TTGGGTGCTGACTACAACCT-3′ R:5′-TGGATGATGTTGATGATGGA-3′ β-actin F:5′-TGTTACCAACTGGGACGACA-3′ R:5′-CTGGGTCATCTTTTCACGGT-3′ 注:iNOS2,诱生型一氧化氮合酶2;Arg1,精氨酸酶1;Mrc2,甘露糖受体c2;SREBP1C,固醇调节元件结合蛋白1C;FASN,脂肪酸合酶;ACOX1,脂酰辅酶A氧化酶1;CPT1A,肉碱棕榈酰转移酶1A。 表 2 两组肝细胞内脂质沉积及脂质代谢相关基因相对表达量的比较
组别 脂质沉积 脂质合成基因mRNA 脂质分解基因mRNA TG T-CHO SREBP1C FASN ACOX1 CPT1A NC组 1.00 1.00 1.00 1.00 1.00 1.00 FFA组 4.80±0.42 1.79±0.39 2.93±1.16 2.49±0.91 0.55±0.05 0.70±0.15 t值 15.65 3.49 2.89 2.82 14.30 3.36 P值 < 0.001 0.025 0.044 0.048 < 0.001 0.028 表 3 FFA对肝细胞分泌细胞因子的影响
组别 IL-6(pg/ml) IL-1β(pg/ml) TNFα(pg/ml) NC组 55.60±16.56 52.65±19.45 47.24±16.50 LPS组 307.40±69.861) 332.40±75.141) 139.20±42.981) FFA组 243.80±47.131) 246.20±34.011) 152.50±14.891) F值 20.93 25.73 12.63 P值 < 0.001 0.002 0.008 注:与NC组相比,1)P < 0.05。 表 4 3组巨噬细胞M1/M2型极化基因相对表达量的比较
组别 iNOS2 TNFα IL-6 Arg1 Mrc2 IL-10 CM-NC组 1.00 1.00 1.00 1.00 1.00 1.00 CM-FFA组 4.08±0.231) 2.78±0.171) 2.43±0.201) 1.24±0.53 0.89±0.10 0.36±0.081) 低浓度FFA组 1.33±0.292) 1.22±0.382) 1.28±0.222) 1.34±0.13 1.14±0.14 1.04±0.212) F值 191.80 50.24 58.16 0.92 4.53 25.08 P值 < 0.001 < 0.001 < 0.001 0.449 0.063 0.001 注:与CM-NC组相比,1)P < 0.05;与CM-FFA组组比,2)P < 0.05。 表 5 两组巨噬细胞TLR4/NF-κB通路相关蛋白相对表达量的比较
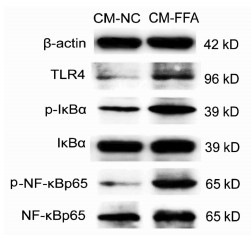
组别 TLR4 p-ⅠκBα/ⅠκBα p-NF-κBp65/NF-κBp65 CM-NC组 1.00 1.00 1.00 CM-FFA组 2.50±0.52 3.53±1.24 5.95±1.34 t值 2.88 3.54 3.69 P值 0.045 0.024 0.021 -
[1] YOUNOSSI ZM. Non-alcoholic fatty liver disease - A global public health perspective[J]. J Hepatol, 2019, 70(3): 531-544. DOI: 10.1016/j.jhep.2018.10.033 [2] TACKE F. Targeting hepatic macrophages to treat liver diseases[J]. J Hepatol, 2017, 66(6): 1300-1312. DOI: 10.1016/j.jhep.2017.02.026 [3] WANG Q, XU QY, WU HM, et al. Effect of lipid-induced macrophage M1/M2 polarization on lipid metabolism in hepatocytes[J]. Chin J Hepatol, 2018, 26(4): 276-281. (in Chinese) DOI: 10.3760/cma.j.issn.1007-3418.2018.04.009王祺, 许钦瑜, 吴惠敏, 等.脂质诱导的巨噬细胞M1/M2型极化对肝细胞脂质代谢的影响[J].中华肝脏病杂志, 2018, 26(4): 276-281. DOI: 10.3760/cma.j.issn.1007-3418.2018.04.009 [4] GÓMEZ-LECHÓN MJ, DONATO MT, MARTÍNEZ-ROMERO A, et al. A human hepatocellular in vitro model to investigate steatosis[J]. Chem Biol Interact, 2007, 165(2): 106-116. DOI: 10.1016/j.cbi.2006.11.004 [5] XIAO WS, LE YY, ZENG SL, et al. Research advances in the pathogenesis of nonalcoholic fatty liver disease[J]. J Clin Hepatol, 2020, 36(8): 1874-1879. (in Chinese) DOI: 10.3969/j.issn.1001-5256.2020.08.043肖伟松, 乐滢玉, 曾胜澜, 等.非酒精性脂肪性肝病的发病机制研究进展[J].临床肝胆病杂志, 2020, 36(8): 1874-1879. DOI: 10.3969/j.issn.1001-5256.2020.08.043 [6] HOLLAND WL, BIKMAN BT, WANG LP, et al. Lipid-induced insulin resistance mediated by the proinflammatory receptor TLR4 requires saturated fatty acid-induced ceramide biosynthesis in mice[J]. J Clin Invest, 2011, 121(5): 1858-1870. DOI: 10.1172/JCI43378 [7] KAZANKOV K, JØRGENSEN S, THOMSEN KL, et al. The role of macrophages in nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(3): 145-159. DOI: 10.1038/s41575-018-0082-x [8] TOSELLO-TRAMPONT AC, LANDES SG, NGUYEN V, et al. Kuppfer cells trigger nonalcoholic steatohepatitis development in diet-induced mouse model through tumor necrosis factor-α production[J]. J Biol Chem, 2012, 287(48): 40161-40172. DOI: 10.1074/jbc.M112.417014 [9] WU HM, NI XX, XU QY, et al. Regulation of lipid-induced macrophage polarization through modulating peroxisome proliferator-activated receptor-gamma activity affects hepatic lipid metabolism via a Toll-like receptor 4/NF-κB signaling pathway[J]. J Gastroenterol Hepatol, 2020, 35(11): 1998-2008. DOI: 10.1111/jgh.15025 [10] KOU XN, XIE XK, HAO MX, et al. Effects and mechanism of microRNA-140 inhibition on the development of non-alcoholic fatty liver disease in mice[J/CD]. Chin J Liver Dis (Electronic Version), 2020, 12(3): 34-40. (in Chinese)寇小妮, 解新科, 郝明霞, 等.微小RNA-140抑制对小鼠非酒精性脂肪性肝病进展的影响及机制[J/CD].中国肝脏病杂志(电子版), 2020, 12(3): 34-40. [11] ZHENG Y, WANG JR, LIU LL, et al. Molecular mechanism of the anti -liver fibrosis effect of curcumol: An analysis based on the TLR4 /NF-κB signaling pathway[J]. J Clin Hepatol, 2020, 36(7): 1508-1513. (in Chinese) DOI: 10.3969/j.issn.1001-5256.2020.07.013郑洋, 王嘉孺, 刘露露, 等.基于Toll样受体4 /核因子-κB信号通路研究莪术醇抗肝纤维化的分子机制[J].临床肝胆病杂志, 2020, 36(7): 1508-1513. DOI: 10.3969/j.issn.1001-5256.2020.07.013 [12] ZHANG CH, LI Y, LI ZY, et al. Protective effect of procyanidine B1 on LPS-induced injury of mouse macrophages RAW264.7 and its mechanism[J]. J Jilin Univ(Med Edit), 2019, 45(6): 1243-1247. (in Chinese) http://www.cnki.com.cn/Article/CJFDTotal-BQEB201906008.htm张宸豪, 李瑶, 李正祎, 等.原花青素B1对LPS诱导小鼠巨噬细胞RAW264.7损伤的保护作用及其机制[J].吉林大学学报(医学版), 2019, 45(6): 1243-1247. http://www.cnki.com.cn/Article/CJFDTotal-BQEB201906008.htm [13] GORDON S, MARTINEZ F O. Alternative activation of macrophages: Mechanism and functions[J]. Immunity, 2010, 32(5): 593-604. DOI: 10.1016/j.immuni.2010.05.007 期刊类型引用(5)
1. 白伟,李帅. TyG-BMI联合血尿酸对2型糖尿病合并非酒精性脂肪性肝病的预测价值. 罕少疾病杂志. 2024(07): 68-70 .  百度学术
百度学术2. 李梦婷,陆璧,张彦,蒋琳. 基于胰岛素抵抗替代指标评估非肥胖2型糖尿病患者NAFLD的价值. 海军医学杂志. 2024(07): 739-744 .  百度学术
百度学术3. 徐瑞君,薛一,周姣姣,杨奇超. 2型糖尿病患者甘油三酯葡萄糖乘积指数与非酒精性脂肪性肝病患病风险的相关性研究. 中国医药科学. 2024(23): 177-180 .  百度学术
百度学术4. 熊琦君,朱雯. 2型糖尿病合并非酒精性脂肪性肝病患者血尿酸水平变化及临床意义. 肝脏. 2023(12): 1476-1479 .  百度学术
百度学术5. 刘婧,彭松. 三酰甘油-葡萄糖指数对急性缺血性脑卒中合并代谢综合征患者短期预后的影响. 实用心脑肺血管病杂志. 2022(12): 35-39 .  百度学术
百度学术其他类型引用(3)
-




 PDF下载 ( 2265 KB)
PDF下载 ( 2265 KB)

 下载:
下载:

 下载:
下载:
 百度学术
百度学术