白蛋白-胆红素评分对肝硬化食管胃静脉曲张出血患者预后的预测价值
DOI: 10.3969/j.issn.1001-5256.2021.05.022
Value of albumin-bilirubin score in predicting the prognosis of patients with liver cirrhosis and esophagogastric variceal bleeding
-
摘要:
目的 探讨白蛋白-胆红素评分(ALBI)评估肝硬化食管胃静脉曲张出血患者预后的价值,并与Child-Turcotte-Pugh(CTP)评分和终末期肝病模型联合Na评分(MELD-Na)进行比较。 方法 回顾性分析2018年8月—2019年4月吉林大学第一医院确诊的肝硬化食管胃静脉曲张出血患者155例。根据随访1年的疾病转归情况将所纳入的患者分为生存组(n=98)和死亡组(n=57)。分析影响预后的相关因素,并评估ALBI评分对患者预后的预测价值。正态分布的计量资料两组间比较采用t检验; 非正态分布的计量资料两组间比较采用Mann-Whitney U检验,计数资料两组间比较采用χ2检验。采用Spearman相关分析评估两变量间的相关性。采用多因素logistic回归分析患者1年死亡的独立影响因素,绘制受试者工作特征(ROC)曲线,计算ROC曲线下面积(AUC),并根据约登指数确定最佳临界值。各评分系统之间AUC的比较采用Z捡验。 结果 生存组和死亡组患者在首次出血量(U=1994.5,P=0.002)、有无肝性脑病(χ2=14.154,P<0.001)、腹水严重程度(χ2=10.537,P=0.005)、TBil(U=1694.0,P<0.001)、Alb(t=-6.633,P<0.001)、AST(U=2223.5,P=0.035)、Na(U=1859.5,P=0.001)、INR(U=1259.5,P<0.001)、PT(U=1331.5,P<0.001)、WBC (U=2008.5,P=0.004)、RBC (t=-2.633,P=0.009)、RDW(U=1719.5,P<0.001)、Hb(U=2150.0,P=0.017)、ALBI分级(χ2=48.732,P<0.001)、CTP分级(χ2=34.646,P<0.001)等方面差异均有统计学意义。死亡组入院时ALBI评分为-1.11±0.59,明显高于生存组(-1.79±0.44)(t=7.618,P<0.001);MELD-Na评分为18.0(14.5~24.0),高于生存组的12.0(10.0~16.0)(U=1176.0,P<0.001);CTP评分为9.0(8.0~11.0),高于生存组的7.0(6.0~8.0)(U=1078.0,P<0.001)。Spearman相关分析显示ALBI评分与CTP评分、MELD-Na评分均呈正相关(r值分别为0.753、0.668,P值均<0.001)。多因素logistic回归分析后显示ALBI评分(OR=8.349,95%CI:2.658~26.232)、CTP评分(OR=1.586,95%CI:1.157~2.175)及MELD-Na评分(OR=1.188,95%CI:1.062~1.328)是影响患者1年死亡的独立危险因素。ALBI评分、CTP评分及MELD-Na评分预测患者1年预后最佳临界值分别为-1.485、8.5、17.5,AUC分别为0.818、0.807、0.789。3种评分系统预测1年病死率比较,差异无统计学意义(P值均>0.05)。 结论 ALBI评分与CTP评分和MELD-Na评分对于肝硬化食管胃静脉曲张出血患者1年死亡预测的预后表现相当,ALBI评分具有良好的评估能力。 Abstract:Objective To investigate the value of albumin-bilirubin (ALBI) score in evaluating the prognosis of patients with liver cirrhosis and esophagogastric variceal bleeding, and to compare it with Child-Turcotte-Pugh (CTP) score and Model for End-stage Liver Disease combined with serum sodium concentration (MELD-Na) score. Methods A retrospective analysis was performed for the clinical data of 155 patients who were diagnosed with liver cirrhosis and esophagogastric variceal bleeding in The First Hospital of Jilin University from August 2018 to April 2019, and according to disease outcome after 1 year of follow-up, these patients were divided into survival group with 98 patients and death group with 57 patients. The influencing factors for prognosis were analyzed, and the value of ALBI score in predicting prognosis was assessed. The t-test was used for comparison of normally distributed continuous data between two groups, and the Mann-Whitney U test was used for comparison of non-normally distributed continuous data between two groups; the chi-square test was used for comparison of categorical data between two groups. A Spearman correlation analysis was performed to investigate the correlation between two variables. A multivariate logistic regression analysis was used to investigate independent influencing factors for death within 1 year. The receiver operating characteristic (ROC) curve was plotted, and the area under the ROC curve (AUC) was calculated; the optimal cut-off value was determined based on Youden index. The Z test was used for comparison of AUC between these three scoring systems. Results There were significant differences between the survival group and the death group in initial blood loss (U=1994.5, P=0.002), presence or absence of hepatic encephalopathy (χ2=14.154, P < 0.001), severity of ascites (χ2=10.537, P=0.005), total bilirubin (U=1694.0, P < 0.001), albumin (t=-6.633, P < 0.001), aspartate aminotransferase (U=2223.5, P=0.035), Na (U=1859.5, P=0.001), international normalized ratio (U=1259.5, P < 0.001), prothrombin time (U=1331.5, P < 0.001), white blood cell count (U=2008.5, P=0.004), red blood cell count (t=-2.633, P=0.009), red blood cell volume distribution width (U=1719.5, P < 0.001), hemoglobin (U=2150.0, P=0.017), ALBI grade (χ2=48.732, P < 0.001), and CTP class (χ2=34.646, P < 0.001). The death group had a significantly higher ALBI score on admission than the survival group (-1.11±0.59 vs -1.79±0.44, t=7.618, P < 0.001), as well as significantly higher MELD-Na score (18.0[14.5-24.0] vs 12.0[10.0-16.0], U=1176.0, P < 0.001) and CTP score (9.0[8.0-11.0] vs 7.0[6.0-8.0], U=1078.0, P < 0.001). The Spearman correlation analysis showed that ALBI score was positively correlated with CTP score and MELD-Na score (r=0.753 and 0.668, both P < 0.001). The multivariate logistic regression analysis showed that ALBI score (odds ratio [OR]=8.349, 95% confidence interval [CI]: 2.658-26.232), CTP score (OR=1.586, 95%CI: 1.157-2.175), and MELD-Na score (OR=1.188, 95%CI: 1.062-1.328) were independent risk factors for predicting death within 1 year. The optimal cut-off value was -1.485 for ALBI score, 8.5 for CTP score, and 17.5 for MELD-Na score in predicting the 1-year prognosis of patients, with an AUC of 0.818, 0.807, and 0.789, respectively. There was no significant difference between the three scoring systems in predicting the 1-year mortality rate (P > 0.05). Conclusion The performance of ALBI score is comparable to that of CTP and MELD-Na scores in predicting the risk of death within 1 year in patients with liver cirrhosis and esophagogastric variceal bleeding, and ALBI score has a good evaluation ability. -
Key words:
- Liver Cirrhosis /
- Esophageal and Gastric Varices /
- Albumin-Bilirubin Score /
- Prognosis
-
肝硬化是由多种原因引起的一种慢性、进行性、弥漫性肝病,在致病因子反复或持续作用下,肝细胞弥漫性增生逐渐进展至以假小叶形成、肝内外血管增殖为特征的晚期病理阶段,代偿期无明显临床症状,失代偿期以门静脉高压和肝功能严重损伤为特征[1],食管胃静脉曲张出血是慢性肝病中可能出现的致命并发症之一,也是肝硬化患者死亡的主要原因[2]。已经建立了Child-Turcotte-Pugh(CTP)评分、终末期肝病模型(MELD)等来评估这些患者肝损伤的严重程度。最近,一个新的、简单的、客观的评分——白蛋白-胆红素评分(albumin-bilirubin score,ALBI)被用于评估肝硬化失代偿期患者的肝功能,该评分仅使用白蛋白和胆红素水平计算[3],易于操作。本研究旨在比较ALBI评分、CTP评分、MELD-Na评分对肝硬化食管胃静脉曲张出血患者预后的预测价值,以指导临床实践。
1. 资料与方法
1.1 研究对象
选取2018年8月—2019年4月本院肝病科收治的肝硬化食管胃静脉曲张出血的患者,所有患者均经病史、临床表现、实验室检查、胃镜检查、影像学检查或病理组织学检查确诊,纳入标准:(1)诊断符合肝硬化诊断标准;(2)5 d内(120 h) 有上消化道出血征象(如呕血、黑便、便潜血试验阳性等),通过胃镜检查证实为急性胃食管静脉曲张出血,并经内镜下曲张静脉套扎术(endoscopic variceal ligation,EVL)或硬化剂注射(endoscopic injection sclerotherapy,EIS)治疗。排除标准:(1)病历资料不完整;(2)非急性期发生上消化道出血(非近5 d内发生的上消化道出血);(3)合并肝癌或其他恶性肿瘤,合并严重的心、肺、肾脏疾病,合并血液系统原发性疾病者; (4)从入院到随访日期截止,行经颈静脉肝内门体分流术、脾切除术、肝移植的患者; (5)年龄<18岁,>85岁的患者。
1.2 研究方法
采用回顾性分析的方法,收集患者性别、年龄、病因、病史、入院后首次的实验室检查资料,如TBil、Alb、AST、ALT、GGT、ALP、肌酐(Cr)、血清钠(Na)、国际标准化比值(INR)、凝血酶原时间(PT)、WBC、红细胞计数(RBC)、血红蛋白(Hb)、红细胞分布宽度(RDW)、PLT。以患者首次入院确诊为肝硬化食管胃静脉曲张出血为随访起点,以死亡为终点事件。随访1年后根据患者的预后分为存活组和死亡组。相关公式的计算方法如下:ALBI评分=-0.085×(Alb,g/L)+0.66× lg(TBil,μmol/L)。1级: ALBI评分≤-2. 6;2级: -2.6<ALBI评分≤-1.39;3级:ALBI评分>-1.39。MELD评分=3.78×ln(TBil,μmol/L)+11.2×ln(INR)+9.57×ln(Cr,μmol/L)+6.4×病因(胆汁性或酒精性肝硬化为0,其他原因为1)[4]。MELD-Na评分=MELD+1.59×(135-Na,mmol/L)。CTP评分根据血清Alb、TBil、PT、腹水、肝性脑病5种指标对每位患者进行评分及分级,其中A级5~6分,B级7~9分,C级10~15分[5]。
1.3 伦理学审查
本研究经吉林大学第一医院伦理委员会批准,批号:(2020年)临申第(2020-558)号,所有入选者均知情同意。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析。正态分布的计量资料采用x±s表示,两组间比较采用t检验;偏态分布的计量资料采用M (P25~P75)表示,两组间比较采用Mann-Whitney U检验,计数资料两组间比较采用χ2检验。采用Spearman相关分析评估两变量间的相关性。采用多因素logistic回归分析各相关因素与肝硬化食管胃静脉曲张出血患者预后的关系。绘制受试者工作特征曲线(ROC曲线),计算ROC曲线下面积(AUC),并根据约登指数确定最佳临界值(cut-off值)。AUC的比较采用MedCalc v.16.4.3软件,两两比较采用Z检验。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
共纳入155例肝硬化食管胃静脉曲张出血患者,男113例,女42例,平均(54.81±11.15)岁。其中乙型肝炎肝硬化81例,丙型肝炎肝硬化12例,酒精性肝硬化29例,原发性胆汁性肝硬化9例,病因不明肝硬化23例,非酒精性脂肪性肝病1例。随访1年内死亡57例,男44例,女13例,平均(55.95±12.07)岁;存活98例,男69例,女29例,平均(54.15±10.59)岁。生存组与死亡组患者在首次出血量、有无肝性脑病、腹水严重程度、TBil、Alb、AST、Na、INR、PT、WBC、RBC、RDW、Hb、ALBI评分、ALBI分级、MELD-Na评分、CTP评分、CTP分级方面差异均有统计学意义(P值均<0.05)(表 1)。
表 1 纳入研究的两组患者基线临床特征比较指标 生存组(n=98) 死亡组(n=57) 统计值 P值 年龄(岁) 54.15±10.59 55.95±12.07 t=0.966 0.336 性别(男/女) 69/29 44/13 χ2=0.840 0.359 首次出血量(ml) 200(175~300) 500(200~775) U=1994.5 0.002 EVL或EIS治疗频次(1次/2次) 78/20 48/9 χ2=0.505 0.477 再次出血(有/无) 33/65 16/41 χ2=0.523 0.469 肝性脑病(有/无) 8/90 18/39 χ2=14.154 <0.001 腹水(无/轻度/中重度) 41/37/20 12/21/24 χ2=10.537 0.005 TBil(μmol/L) 22.20(13.40~30.05) 29.10(20.90~90.80) U=1694.0 <0.001 Alb(g/L) 31.40±4.88 25.76±5.57 t=-6.633 <0.001 AST(U/L) 29.95(24.58~42.45) 35.20(24.70~90.95) U=2223.5 0.035 ALT(U/L) 21.75(15.3~36.53) 24.40(14.35~42.50) U=2572.5 0.413 GGT(U/L) 37.25(22.45~68.76) 29.40(16.00~118.00) U=2755.0 0.888 ALP(U/L) 61.15(49.50~79.68) 58.00(39.80~91.55) U=2637.5 0.564 Cr(μmol/L) 61.05(50.65~73.13) 66.20(54.95~87.25) U=2308.5 0.072 Na(mmol/L) 136.95(134.60~140.10) 135.00(131.10~137.55) U=1859.5 0.001 PT(s) 14.55(13.40~16.40) 16.90(15.60~20.70) U=1331.5 <0.001 INR 1.24(1.15~1.39) 1.48(1.34~1.76) U=1259.5 <0.001 WBC(×109/L) 4.16(2.79~6.19) 5.90(3.63~10.21) U=2008.5 0.004 RBC(×1012/L) 2.90±0.69 2.60±0.65 t=-2.633 0.009 Hb(g/L) 80.0(66.25~100.50) 72.00(59.00~88.00) U=2150.0 0.017 PLT(×109/L) 72.50(51.75~113.00) 68.00(43.00~106.50) U=2454.0 0.208 RDW(%) 15.80(14.68~17.83) 17.60(15.95~20.35) U=1719.5 <0.001 CTP评分(分) 7.0(6.0~8.0) 9.0(8.0~11.0) U=1078.0 <0.001 CTP分级(A/B/C,例) 34/55/9 4/26/27 χ2=34.646 <0.001 MELD-Na评分(分) 12.0(10.0~16.0) 18.0(14.5~24.0) U=1176.0 <0.001 ALBI评分(分) -1.79±0.44 -1.11±0.59 t=7.618 <0.001 ALBI分级(1/2/3,例) 2/79/17 0/15/42 χ2=48.732 <0.001 2.2 ALBI评分与CTP评分及MELD-Na评分的关系
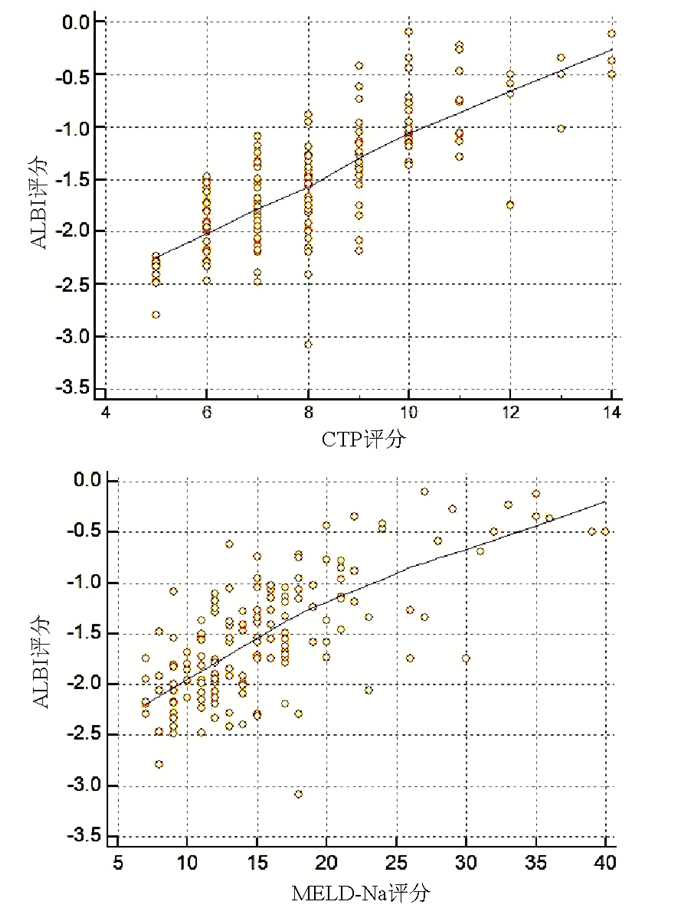
采用Spearman相关分析评估两变量间的相关性,结果显示ALBI评分与CTP评分和MELD-Na评分均呈正相关(r值分别为0.753、0.668,P值均<0.001)(图 1)。
2.3 肝硬化食管胃静脉曲张出血患者1年预后分析
由于ALBI评分与CTP评分、MELD-Na评分存在多重线性关系(共线性),为减少变量间的相互作用,构建了3种回归变量模型,其中回归模型1纳入多因素回归分析的变量为AST、WBC、RDW、RBC、Na、INR、Hb、ALBI评分,最终ALBI评分是患者预后的独立影响因素(P<0.001);纳入回归模型2的变量为AST、WBC、RDW、RBC、Hb、PT、MELD-Na评分,分析显示MELD-Na评分、RDW是患者预后的独立影响因素(P值分别为0.003、0.045);纳入回归模型3的变量是AST、WBC、RBC、RDW、Hb、Na、INR、CTP评分,多因素回归分析结果显示CTP评分是患者预后的独立影响因素(P=0.004)(表 2)。
表 2 多因素logistic回归分析肝硬化食管胃静脉曲张出血患者预后的影响因素回归模型 B值 SE Wald P值 OR 95%CI 回归模型1 AST 0.001 0.001 0.661 0.416 1.001 0.999~1.003 WBC 0.043 0.055 0.604 0.437 1.044 0.937~1.163 RDW 0.133 0.098 1.831 0.176 1.142 0.942~1.386 RBC 0.662 0.786 0.709 0.400 1.938 0.415~9.050 Na -0.027 0.042 0.423 0.515 0.973 0.897~1.056 INR 1.381 0.893 2.392 0.122 3.979 0.691~22.895 Hb -0.030 0.025 1.507 0.220 0.970 0.924~1.018 ALBI评分 2.122 0.584 13.201 <0.001 8.349 2.658~26.232 回归模型2 AST 0.001 0.001 1.313 0.252 1.001 0.999~1.003 WBC 0.020 0.054 0.143 0.705 1.020 0.919~1.134 RDW 0.191 0.095 4.018 0.045 1.210 1.004~1.458 RBC -0.228 0.618 0.136 0.713 0.797 0.237~2.673 Hb -0.013 0.021 0.403 0.526 0.987 0.948~1.028 PT 0.048 0.078 0.380 0.538 1.050 0.900~1.224 MELD-Na评分 0.172 0.057 9.062 0.003 1.188 1.062~1.328 回归模型3 AST 0.001 0.001 0.801 0.371 1.001 0.999~1.003 WBC 0.017 0.054 0.104 0.747 1.018 0.916~1.131 RDW 0.179 0.094 3.631 0.057 1.197 0.995~1.439 RBC -0.059 0.664 0.008 0.929 0.942 0.256~3.465 Hb -0.014 0.022 0.401 0.527 0.986 0.945~1.029 INR 1.457 0.871 2.796 0.095 4.293 0.778~23.681 Na -0.025 0.042 0.344 0.558 0.976 0.899~1.059 CTP评分 0.461 0.161 8.208 0.004 1.586 1.157~2.175 2.4 ALBI评分、MELD-Na评分及CTP评分预测患者1年预后价值比较
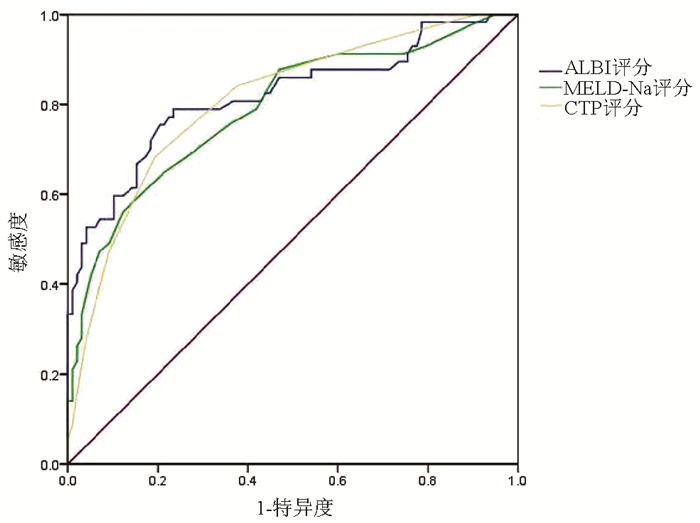
ROC曲线结果显示,ALBI评分、MELD-Na评分及CTP评分的AUC分别为0.818、0.789、0.807,其中ALBI评分的诊断效能最大,其次为CTP评分(表 3,图 2)。比较各评分之间判断患者1年病死率的AUC,3种评分辨别能力均无显著差异(P值均>0.05)。
表 3 ALBI评分、MELD-Na评分及CTP评分预测肝硬化食管胃静脉曲张出血患者1年内死亡的ROC曲线结果指标 AUC 95% CI cut-off值 敏感度(%) 特异度(%) 约登指数 P值 ALBI评分 0.818 0.744~0.893 -1.485 78.9 76.5 0.555 <0.001 CTP评分 0.8071) 0.736~0.878 8.5 68.4 80.6 0.490 <0.001 MELD-Na评分 0.7891)2) 0.713~0.866 17.5 56.1 87.8 0.439 <0.001 注:与ALBI评分比较,1) Z=0.359,P=0.719;Z=0.826,P=0.409;与CTP评分比较,2) Z=0.470,P=0.638。 3. 讨论
肝硬化是一种高发病率和高病死率的疾病,并可能伴有多种形式的并发症,包括上消化道出血。上消化道出血的原因可分为静脉曲张出血(食管和胃底静脉曲张)和非静脉曲张出血(门静脉高压性胃病、消化性溃疡、糜烂性胃十二指肠炎、反流性食管炎、肿瘤等),其中食管胃底静脉曲张破裂出血最多,占60%~65%[6]。静脉曲张的存在会影响预后,在代偿性肝硬化和失代偿性肝硬化患者之间存在显著差异,其病死率分别为每年3.4%和≥20%[7]。因此,及时有效的判断此类患者的预后情况至关重要。
传统的肝功能评估主要基于肝硬化的CTP评分和MELD评分。CTP评分考虑了血清Alb和胆红素水平、PT以及腹水和肝性脑病的存在和严重程度。然而,它们有几个主要缺点。据报道,并非所有的CTP A级患者都有相似的预后[8]。一方面由于在判断腹水和肝性脑病时存在主观偏差,在准确反映肝功能方面存在一定的局限性[9]。另一方面,不同病因或同一分级的肝硬化患者,其临床病情可能有较大差异。MELD-Na评分系统包括血清胆红素、Cr、INR、血清Na及肝脏病因5个指标。MELD评分是在一个统计模型的基础上发展起来的,该模型最初是用来预测接受经颈静脉肝内门体分流术患者的死亡率[10]。随后发现MELD评分可较准确地判定终末期肝病患者的预后,也用于优先选择肝移植患者[4],但是由于血清Cr测定受非肝病因素的影响,可能导致MELD评分对肝脏疾病严重程度的误判。并且在计算中使用了INR,由于特定的实验室方法,INR有很大的实验室间差异[11-12]。
近期关于ALBI评分与肝脏疾病的相关性研究不断被报道,ALBI评分最初被建立为评估肝细胞癌患者肝功能及疾病风险的模型[8, 13],它只涉及两个客观参数(Alb和TBil),这两个参数很容易通过血液检查获得。Lei等[14]研究指出ALBI评分是评估乙型肝炎相关慢加急性肝衰竭患者肝损伤严重程度的良好指标。Chan等[15]一项回顾性研究探索ALBI评分在原发性胆汁性肝硬化患者中的预后意义,并与CTP评分、MELD评分进行了比较,结果ALBI评分是影响生存的独立预后因素,与其他预后评分相比,提供了更好或相似的预后表现。由此可知肝硬化患者血清Alb和TBil水平的变化可能意味着肝功能不全和预后不良[3]。
本研究结果显示,在1年的随访期内生存组与死亡组在ALBI评分、ALBI分级之间存在显著差异(P<0.001),同时ALBI评分与CTP评分和MELD-Na评分均呈正相关,提示ALBI评分和分级反映了肝硬化食管胃静脉曲张出血患者肝损伤的严重程度,死亡患者肝功能受损更为严重。多因素logistic回归分析显示ALBI评分、CTP评分及MELD-Na评分是预测患者1年死亡的独立危险因素。绘制ROC曲线分析ALBI评分与CTP评分和MELD-Na评分预测1年内患者死亡风险,结果显示ALBI、CTP评分和MELD评分的AUC分别为0.808、0.785和0.787,三者之间无显著差异(P值均>0.05), 这与Zou等[16]回顾性研究相一致。Xavier等[11]在比较肝硬化合并上消化道出血患者住院期间和30 d病死率时,3个评分(ALBI评分、CTP评分、MELD评分)中只有ALBI评分有统计学意义,AUC为0.80。在比较1年死亡率时,3个评分间没有显著差异。本研究发现CTP评分作为传统肝硬化严重程度评价方法,仍然可以作为有效评判肝硬化食管胃静脉曲张出血患者预后的工具。这与陆京京等[17]的报道相似,动态观察CTP评分有助于预测和评估肝硬化食管胃静脉曲张破裂出血患者的预后,且本研究发现MELD-Na评分系统与CTP评分相比并没有明显优势。
虽然ALBI评分的性能与CTP评分、MELD-Na评分相似,但它基于更简单的实验数据,并且完全客观,实际中更易于实施。它依赖较少的变量,可能更容易适用于大规模的国际研究。在前瞻性研究的基础上,未来有能结合肝病严重程度联合并发症的评分系统,可能有利于进一步提高该类患者早期死亡风险预测的准确性[18]。考虑到ALBI评分只需要两个简单的因子,并且在评估肝硬化食管胃静脉曲张出血的严重程度方面显示出优等性,因此它有望作为一个简单的评分系统广泛应用于临床。
-
表 1 纳入研究的两组患者基线临床特征比较
指标 生存组(n=98) 死亡组(n=57) 统计值 P值 年龄(岁) 54.15±10.59 55.95±12.07 t=0.966 0.336 性别(男/女) 69/29 44/13 χ2=0.840 0.359 首次出血量(ml) 200(175~300) 500(200~775) U=1994.5 0.002 EVL或EIS治疗频次(1次/2次) 78/20 48/9 χ2=0.505 0.477 再次出血(有/无) 33/65 16/41 χ2=0.523 0.469 肝性脑病(有/无) 8/90 18/39 χ2=14.154 <0.001 腹水(无/轻度/中重度) 41/37/20 12/21/24 χ2=10.537 0.005 TBil(μmol/L) 22.20(13.40~30.05) 29.10(20.90~90.80) U=1694.0 <0.001 Alb(g/L) 31.40±4.88 25.76±5.57 t=-6.633 <0.001 AST(U/L) 29.95(24.58~42.45) 35.20(24.70~90.95) U=2223.5 0.035 ALT(U/L) 21.75(15.3~36.53) 24.40(14.35~42.50) U=2572.5 0.413 GGT(U/L) 37.25(22.45~68.76) 29.40(16.00~118.00) U=2755.0 0.888 ALP(U/L) 61.15(49.50~79.68) 58.00(39.80~91.55) U=2637.5 0.564 Cr(μmol/L) 61.05(50.65~73.13) 66.20(54.95~87.25) U=2308.5 0.072 Na(mmol/L) 136.95(134.60~140.10) 135.00(131.10~137.55) U=1859.5 0.001 PT(s) 14.55(13.40~16.40) 16.90(15.60~20.70) U=1331.5 <0.001 INR 1.24(1.15~1.39) 1.48(1.34~1.76) U=1259.5 <0.001 WBC(×109/L) 4.16(2.79~6.19) 5.90(3.63~10.21) U=2008.5 0.004 RBC(×1012/L) 2.90±0.69 2.60±0.65 t=-2.633 0.009 Hb(g/L) 80.0(66.25~100.50) 72.00(59.00~88.00) U=2150.0 0.017 PLT(×109/L) 72.50(51.75~113.00) 68.00(43.00~106.50) U=2454.0 0.208 RDW(%) 15.80(14.68~17.83) 17.60(15.95~20.35) U=1719.5 <0.001 CTP评分(分) 7.0(6.0~8.0) 9.0(8.0~11.0) U=1078.0 <0.001 CTP分级(A/B/C,例) 34/55/9 4/26/27 χ2=34.646 <0.001 MELD-Na评分(分) 12.0(10.0~16.0) 18.0(14.5~24.0) U=1176.0 <0.001 ALBI评分(分) -1.79±0.44 -1.11±0.59 t=7.618 <0.001 ALBI分级(1/2/3,例) 2/79/17 0/15/42 χ2=48.732 <0.001 表 2 多因素logistic回归分析肝硬化食管胃静脉曲张出血患者预后的影响因素
回归模型 B值 SE Wald P值 OR 95%CI 回归模型1 AST 0.001 0.001 0.661 0.416 1.001 0.999~1.003 WBC 0.043 0.055 0.604 0.437 1.044 0.937~1.163 RDW 0.133 0.098 1.831 0.176 1.142 0.942~1.386 RBC 0.662 0.786 0.709 0.400 1.938 0.415~9.050 Na -0.027 0.042 0.423 0.515 0.973 0.897~1.056 INR 1.381 0.893 2.392 0.122 3.979 0.691~22.895 Hb -0.030 0.025 1.507 0.220 0.970 0.924~1.018 ALBI评分 2.122 0.584 13.201 <0.001 8.349 2.658~26.232 回归模型2 AST 0.001 0.001 1.313 0.252 1.001 0.999~1.003 WBC 0.020 0.054 0.143 0.705 1.020 0.919~1.134 RDW 0.191 0.095 4.018 0.045 1.210 1.004~1.458 RBC -0.228 0.618 0.136 0.713 0.797 0.237~2.673 Hb -0.013 0.021 0.403 0.526 0.987 0.948~1.028 PT 0.048 0.078 0.380 0.538 1.050 0.900~1.224 MELD-Na评分 0.172 0.057 9.062 0.003 1.188 1.062~1.328 回归模型3 AST 0.001 0.001 0.801 0.371 1.001 0.999~1.003 WBC 0.017 0.054 0.104 0.747 1.018 0.916~1.131 RDW 0.179 0.094 3.631 0.057 1.197 0.995~1.439 RBC -0.059 0.664 0.008 0.929 0.942 0.256~3.465 Hb -0.014 0.022 0.401 0.527 0.986 0.945~1.029 INR 1.457 0.871 2.796 0.095 4.293 0.778~23.681 Na -0.025 0.042 0.344 0.558 0.976 0.899~1.059 CTP评分 0.461 0.161 8.208 0.004 1.586 1.157~2.175 表 3 ALBI评分、MELD-Na评分及CTP评分预测肝硬化食管胃静脉曲张出血患者1年内死亡的ROC曲线结果
指标 AUC 95% CI cut-off值 敏感度(%) 特异度(%) 约登指数 P值 ALBI评分 0.818 0.744~0.893 -1.485 78.9 76.5 0.555 <0.001 CTP评分 0.8071) 0.736~0.878 8.5 68.4 80.6 0.490 <0.001 MELD-Na评分 0.7891)2) 0.713~0.866 17.5 56.1 87.8 0.439 <0.001 注:与ALBI评分比较,1) Z=0.359,P=0.719;Z=0.826,P=0.409;与CTP评分比较,2) Z=0.470,P=0.638。 -
[1] Chinese Society of Hepatology, Chinese Medical Association. Chinese guidelines on the management of liver cirrhosis[J]. J Clin Hepatol, 2019, 35(11): 2408-2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006.中华医学会肝病学分会. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35(11): 2408-2425. DOI: 10.3969/j.issn.1001-5256.2019.11.006. [2] SASS DA, CHOPRA KB. Portal hypertension and variceal hemorrhage[J]. Med Clin North Am, 2009, 93(4): 837-853, ⅶ-ⅷ. DOI: 10.1016/j.mcna.2009.03.008. [3] WAN SZ, NIE Y, ZHANG Y, et al. Assessing the prognostic performance of the Child-Pugh, Model for End-Stage Liver Disease, and Albumin-Bilirubin scores in patients with decompensated cirrhosis: A large asian cohort from gastroenterology department[J]. Dis Markers, 2020, 2020: 5193028. DOI: 10.1155/2020/5193028. [4] KAMATH PS, WIESNER RH, MALINCHOC M, et al. A model to predict survival in patients with end-stage liver disease[J]. Hepatology, 2001, 33(2): 464-470. DOI: 10.1053/jhep.2001.22172. [5] PUGH RN, MURRAY-LYON IM, DAWSON JL, et al. Transection of the oesophagus for bleeding oesophageal varices[J]. Br J Surg, 1973, 60(8): 646-649. DOI: 10.1002/bjs.1800600817. [6] CREMERS I, RIBEIRO S. Management of variceal and nonvariceal upper gastrointestinal bleeding in patients with cirrhosis[J]. Therap Adv Gastroenterol, 2014, 7(5): 206-216. DOI: 10.1177/1756283X14538688. [7] D'AMICO G, GARCIA-TSAO G, PAGLIARO L. Natural history and prognostic indicators of survival in cirrhosis: A systematic review of 118 studies[J]. J Hepatol, 2006, 44(1): 217-231. DOI: 10.1016/j.jhep.2005.10.013. [8] JOHNSON PJ, BERHANE S, KAGEBAYASHI C, et al. Assessment of liver function in patients with hepatocellular carcinoma: A new evidence-based approach-the ALBI grade[J]. J Clin Oncol, 2015, 33(6): 550-558. DOI: 10.1200/JCO.2014.57.9151. [9] BIYIK M, UCAR R, SOLAK Y, et al. Blood neutrophil-to-lymphocyte ratio independently predicts survival in patients with liver cirrhosis[J]. Eur J Gastroenterol Hepatol, 2013, 25(4): 435-441. DOI: 10.1097/MEG.0b013e32835c2af3. [10] MALINCHOC M, KAMATH PS, GORDON FD, et al. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts[J]. Hepatology, 2000, 31(4): 864-871. DOI: 10.1053/he.2000.5852. [11] XAVIER SA, VILAS-BOAS R, BOAL CARVALHO P, et al. Assessment of prognostic performance of Albumin-Bilirubin, Child-Pugh, and Model for End-stage Liver Disease scores in patients with liver cirrhosis complicated with acute upper gastrointestinal bleeding[J]. Eur J Gastroenterol Hepatol, 2018, 30(6): 652-658. DOI: 10.1097/MEG.0000000000001087. [12] PORTE RJ, LISMAN T, TRIPODI A, et al. The International Normalized Ratio (INR) in the MELD score: Problems and solutions[J]. Am J Transplant, 2010, 10(6): 1349-1353. DOI: 10.1111/j.1600-6143.2010.03064.x. [13] KNOX JJ. Addressing the interplay of liver disease and hepatocellular carcinoma on patient survival: The ALBI scoring model[J]. J Clin Oncol, 2015, 33(6): 529-531. DOI: 10.1200/JCO.2014.59.0521. [14] LEI Q, ZHANG Y, KE C, et al. Value of the albumin-bilirubin score in the evaluation of hepatitis B virus-related acute-on-chronic liver failure, liver cirrhosis, and hepatocellular carcinoma[J]. Exp Ther Med, 2018, 15(3): 3074-3079. DOI: 10.3892/etm.2018.5748. [15] CHAN AW, CHAN RC, WONG GL, et al. New simple prognostic score for primary biliary cirrhosis: Albumin-bilirubin score[J]. J Gastroenterol Hepatol, 2015, 30(9): 1391-1396. DOI: 10.1111/jgh.12938. [16] ZOU D, QI X, ZHU C, et al. Albumin-bilirubin score for predicting the in-hospital mortality of acute upper gastrointestinal bleeding in liver cirrhosis: A retrospective study[J]. Turk J Gastroenterol, 2016, 27(2): 180-186. DOI: 10.5152/tjg.2016.15502. [17] LU JJ, ZHANG L, DING SG, et al. The prognosis of liver cirrhotic patients with acute esophageal variceal bleeding: A Cox regression analysis[J]. Chin J Dig, 2011, 31(4): 217-220. DOI: 10.3760/cma.j.issn.0254-1432.2011.04.001.陆京京, 张莉, 丁士刚, 等. 肝硬化食管静脉曲张破裂出血患者预后Cox回归分析[J]. 中华消化杂志, 2011, 31(4): 217-220. DOI: 10.3760/cma.j.issn.0254-1432.2011.04.001. [18] CUI S, WANG F, LYU HM, et al. Value of Glasgow-Blatchford score in predicting early prognosis of cirrhotic patients with esophagogastric variceal bleeding[J]. J Clin Hepatol, 2017, 33(10): 1939-1943. DOI: 10.3969/j.issn.1001-5256.2017.10.018.崔舒, 王芳, 吕洪敏, 等. Glasgow-Blatchford评分对肝硬化食管胃底静脉曲张破裂出血患者早期预后的预测价值[J]. 临床肝胆病杂志, 2017, 33(10): 1939-1943. DOI: 10.3969/j.issn.1001-5256.2017.10.018. 期刊类型引用(16)
1. 何艳婷,苏有盛,叶宇龙. ALBI联合NLR预测肝硬化合并食管胃底静脉曲张破裂出血的作用. 广州医药. 2025(03): 387-392 .  百度学术
百度学术2. 李欣忆,李娇娇,李莹莹,魏虹合,熊雨凡,张新驰,孙蔚,陈丽. 基于APRI和PALBI构建的列线图对肝硬化并发食管胃底静脉曲张破裂出血的预测价值. 临床肝胆病杂志. 2024(03): 521-526 .  本站查看
本站查看3. 韩磊,苏宁,刘晓林,邬超. 基于DECT的碘斜率无创评估肝硬化患者肝功能的相关研究. 影像科学与光化学. 2024(02): 160-166 .  百度学术
百度学术4. 韩磊,苏宁,邬超,杨佳敏,刘晓林. 基于DECT的NIC评估肝硬化患者肝功能分级的研究. 中国医疗设备. 2024(07): 124-128+135 .  百度学术
百度学术5. 石红. 延续性护理服务方案对肝硬化食管胃静脉曲张内镜下精准断流术后的临床影响研究. 基层医学论坛. 2024(20): 114-116+142 .  百度学术
百度学术6. 吴美儿,杨军勤,江新华,黄义华. 快速康复理念在肝硬化脾切除围术期护理中的应用. 现代诊断与治疗. 2024(08): 1233-1235+1238 .  百度学术
百度学术7. 许娟,闫涛涛,李严锋,侯静涛,樊研. ALBI评分联合PCT在肝硬化腹水患者自发性细菌性腹膜炎的预测作用. 胃肠病学和肝病学杂志. 2023(01): 85-89 .  百度学术
百度学术8. 杨金艳,李飞飞,谢元元,穆亚娟,韩瑞瑞,王蒙,高晓霞. 肝硬化上消化道出血患者预后营养指数与病情严重程度和短期预后相关性研究. 陕西医学杂志. 2023(11): 1530-1534 .  百度学术
百度学术9. 王燕秋,周玲华,顾永梅,濮尊国. APRI、ALBI和AIMS65评分联合评价肝硬化EGVB病情程度和疾病预后的临床价值. 肝脏. 2023(12): 1430-1434+1439 .  百度学术
百度学术10. 邓悦,姚欢,谢宇欣,石国庆. 肝硬化食管胃静脉曲张内镜下治疗后营养支持治疗的研究进展. 海南医学. 2022(04): 522-525 .  百度学术
百度学术11. 高艳颖,张旭,李凤慧,向慧玲,梁静,刘华,吕洪敏,韩涛. 不同Child-Pugh分级肝硬化患者糖化白蛋白的测定及其应用价值. 临床肝胆病杂志. 2022(02): 347-351 .  本站查看
本站查看12. 李学勇,季云,孙沂,高怡. ALBI评分联合NLR在肝硬化食管胃底静脉曲张破裂出血预后中的作用. 现代消化及介入诊疗. 2022(05): 606-609 .  百度学术
百度学术13. 廖翔. 肝硬化患者SAAG与食管胃底静脉曲张破裂出血的关系研究. 现代诊断与治疗. 2022(11): 1646-1648+1692 .  百度学术
百度学术14. 郑秀丽,李静. RAR联合MELD评分对乙型肝炎肝硬化严重程度的评估价值. 锦州医科大学学报. 2022(05): 73-78 .  百度学术
百度学术15. 黄义华,江新华,聂秋兰,万勇,谢文星,毛卫. 艾灸在肝硬化脾切除围术期ERAS理念中的应用. 中西医结合肝病杂志. 2022(12): 1140-1143 .  百度学术
百度学术16. 孙秋,李广鉴,杜丽明,赵利,袁楠,张亚丽,曹立赢,陈朔华,任庆帅. 镜下不同分级肝硬化门静脉高压性胃病的临床特征和危险因素分析. 现代消化及介入诊疗. 2021(05): 639-642 .  百度学术
百度学术其他类型引用(7)
-




 PDF下载 ( 2209 KB)
PDF下载 ( 2209 KB)

 下载:
下载:



 下载:
下载:
 百度学术
百度学术