过表达HBx的肝细胞对肝星状细胞增殖和活化的影响及其机制
DOI: 10.3969/j.issn.1001-5256.2021.07.017
Effect of hepatitis B x gene-overexpressed hepatocytes on the proliferation and activation of hepatic stellate cells and related mechanism
-
摘要:
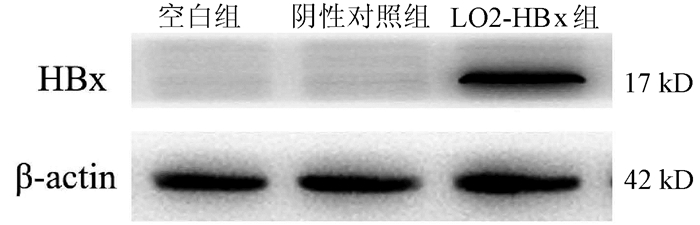
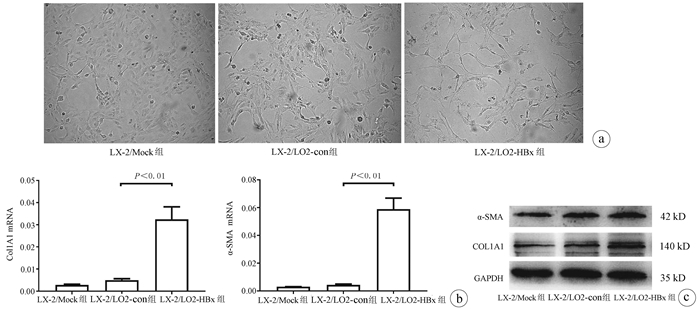
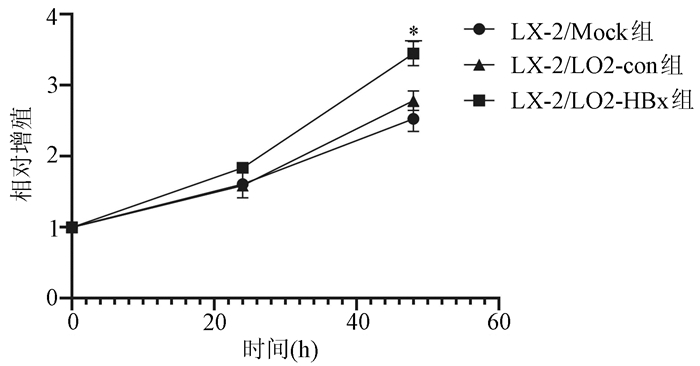
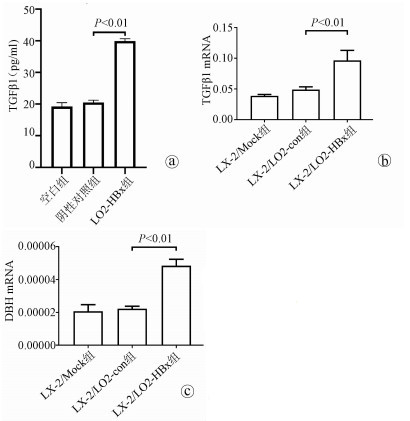
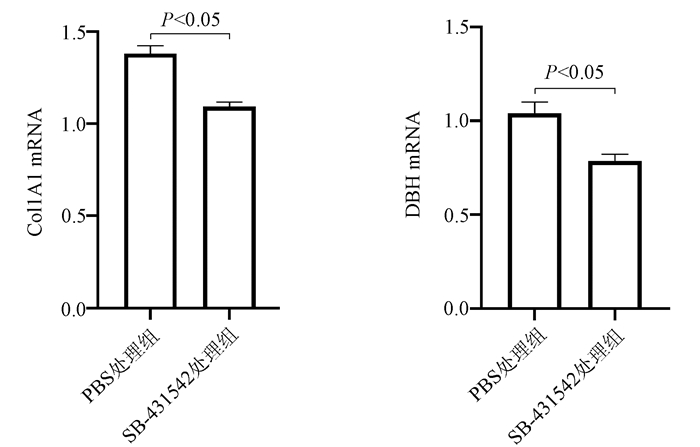
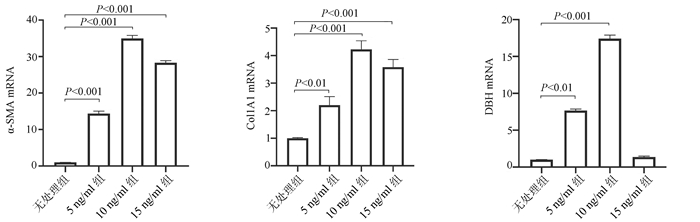
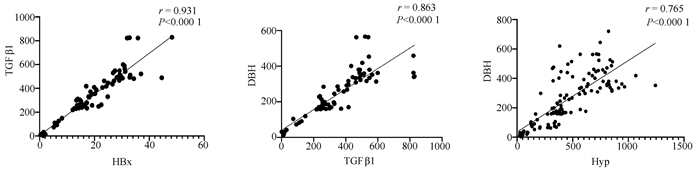
目的 探讨HBV感染对肝星状细胞(HSC)活化的影响及作用机制。 方法 收集2020年11月—2021年1月慢性乙型肝炎患者血浆30份、乙型肝炎肝硬化患者血浆42份、肝细胞癌患者血浆30份及健康体检者(健康对照组)的血浆18份,ELISA法检测血浆和条件培养液中HBx、TGFβ1、多巴胺β羟化酶(DBH)和羟脯氨酸(Hyp)的含量。采用LO2细胞构建过表达HBx稳转株细胞, LO2细胞分为LO2-HBx组(稳定表达HBx)、阴性对照组(LO2-con)、空白组,分别制备LO2-HBx、LO2-con和LO2细胞(Mock)的条件培养基,孵育人HSC株LX-2,分为LX-2/LO2-HBx、LX-2/LO2-con、LX-2/Mock 3组,采用CCK-8法检测各组细胞增殖变化。采用rhTGFβ1刺激LX-2细胞,另采用TGFβ1受体抑制剂处理LX-2/LO2-HBx组细胞。荧光定量PCR或Western Blot法检测LO2细胞中的HBx及上述LX-2细胞中α-SMA、Col1A1、DBH和TGFβ1的表达。多组间比较采用单因素方差分析,进一步比较方法采用Bonferroni法;2组间比较采用t检验;相关性分析采用Pearson法。 结果 LO2-HBx可稳定表达HBx蛋白,其培养上清中TGFβ1含量升高(F=324.701,P<0.01);共培养LX-2/LO2-HBx组细胞发生明显细胞形态变化,出现细胞收缩,胞突明显伸长,胞内脂滴减少,与LX-2/LO2-con组比较其增殖活力明显增强(P<0.05),且α-SMA和Col1A1的mRNA(F值分别为144.712和76.680,P值均<0.01)及蛋白(F值分别为234.142和528.708,P值均<0.001)表达水平升高;LX-2/LO2-HBx组细胞中TGFβ1 mRNA(F=29.382, P<0.01)及DBH mRNA水平升高(F=42.662, P<0.01)。随着rhTGFβ1刺激浓度的增加,LX-2细胞中α-SMA(F=1 794.031,P<0.01)、Col1A1(F=91.340,P<0.01)及DBH(F=2 501.011,P<0.01)表达增加,在rhTGFβ1 10 ng/ml时达到峰值。在LO2-HBx组条件培养液中加入TGFβ1受体抑制剂后LX-2细胞中DBH和Col1A1的表达较对照组下调(t值分别为3.603、5.798,P值均<0.05)。慢性乙型肝炎、乙型肝炎肝硬化、肝细胞癌患者的血浆TGFβ1(F=51.188,P<0.001)、HBx(F=39.227,P<0.001)、DBH(F=34.431,P<0.001)及Hyp(F=16.211,P<0.001)较健康对照组升高,血浆中HBx与TGFβ1、TGFβ1与DBH、Hyp与DBH的表达量呈正相关,r分别为0.931、0.863、0.765(P值均<0.001)。 结论 HBx蛋白可促进LO2细胞分泌TGFβ1,诱导LX-2的增殖和活化,促进肝纤维化的发生,并上调LX-2细胞中TGFβ1及DBH的表达;rhTGFβ1刺激可诱导LX-2活化和DBH表达上调。 Abstract:Objective To investigate the effect of hepatitis B virus (HBV) infection on the activation of hepatic stellate cells (HSCs) and its mechanism of action. Methods A total of 30 plasma samples of chronic hepatitis B patients, 42 plasma samples of hepatitis B cirrhosis patients, 30 plasma samples of hepatocellular carcinoma patients, and 18 plasma samples of the individuals undergoing physical examination were collected from November 2020 to January 2021, and ELISA was used to measure the content of hepatitis B X protein (HBx), transforming growth factor-β1 (TGFβ1), dopamine beta-hydroxylase (DBH), and hydroxyproline (HYP) in plasma and conditioned medium. LO2 cells were used to establish a cell line with stable overexpression of HBx (LO2-HBx) and negative control cells (LO2-con), and a conditioned medium was prepared for LO2-HBx, LO2-Con, and LO2 cells (Mock), respectively; human HSC cell line LX-2 was incubated and divided into LX-2/LO2-HBx, LX-2/LO2-con, and LX-2/Mock groups, and CCK-8 assay was used to measure the change in cell proliferation. LX-2 cells were stimulated by rhTGFβ1, and the cells in the LX-2/LO2-HBx group were treated with a TGFβ1 receptor inhibitor. Quantitative real-time PCR and Western blot were used to measure the expression of HBx in LO2 cells and the expression of alpha-smooth muscle actin (α-SMA), collagen type Ⅰ alpha 1 (Col1A1), DBH, and TGFβ1 in the above LX-2 cells. An analysis of variance was used for comparison between multiple groups, and the Bonferroni method was used for further comparison; the t-test was used for comparison between two groups; the Pearson method was used for correlation analysis. Results LO2-HBx stably expressed HBx protein and showed an increase in the content of TGFβ1 in supernatant (F=324.701, P < 0.01). The co-cultured LX-2/LO2-HBx group had a significant change in cell morphology, with the presence of cell shrinkage, extended cytoplasmic process, and reduced lipid droplets, and compared with the LX-2/LO2-con group, the LX-2/LO2-HBx group had significant increases in proliferative activity (P < 0.05) and the mRNA and protein expression levels of α-SMA and Col1A1 (mRNA: F=144.712 and 76.680, both P < 0.01; protein: F=234.142 and 528.708, both P < 0.001). The LX-2/LO2-HBx group had significant increases in the content of TGFβ1 (F=29.382, P < 0.01) and DBH (F=42.662, P < 0.01). With the increase in the stimulating concentration of rhTGFβ1, there were significant increases in the expression of α-SMA (F=1 794.031, P < 0.01), Col1A1 (F=91.340, P < 0.01), and DBH (F=2 501.011, P < 0.01), which reached the peak values at the rhTGFβ1 concentration of 10 ng/ml, and after a TGFβ1 receptor inhibitor was added to the conditioned medium, the LO2-HBx group had significant reductions in the expression of DBH and Col1A1 compared with the control group (t=3.603 and 5.798, both P < 0.05). Compared with the healthy control group, the chronic hepatitis B, liver cirrhosis, and hepatocellular carcinoma groups had significant increases in the plasma levels of TGFβ1 (F=51.188, P < 0.001), HBx (F=39.227, P < 0.001), DBH (F=34.431, P < 0.001), and HYP (F=16.211, P < 0.001), and a positive correlation was observed between plasma HBx and TGFβ1, between TGFβ1 and DBH, and between HYP and DBH (r= 0.931, 0.863, and 0.765, all P < 0.001). Conclusion HBx protein can promote the secretion of TGFβ1 in LO2 cells, induce the proliferation and activation of LX-2 cells, promote the development of liver fibrosis, and upregulate the expression of TGFβ1 and DBH in LX-2 cells, and rhTGFβ1 stimulation can induce the activation of LX-2 cells and the upregulation of DBH expression. -
Key words:
- Hepatitis B /
- Liver Cirrhosis /
- Hepatic Stellate Cells /
- HBV-X Protein
-
表 1 ELISA检测4组临床样本中HBx、TGFβ1、Hyp及DBH含量
组别 例数 HBx(ng/ml) TGFβ1(pg/ml) Hyp(μmol/L) DBH(ng/ml) 健康对照组 18 0.86±0.37 16.01±6.32 201.87±95.64 50.87±20.83 慢性乙型肝炎组 30 26.41±9.161) 471.00±176.011) 591.53±216.401) 365.44±130.621) 乙型肝炎肝硬化组 42 17.87±7.151)2) 500.94±157.621) 652.83±236.171) 378.66±127.131) 肝细胞癌组 30 23.34±9.491) 513.09±163.841) 560.29±195.701) 349.00±138.531) F值 39.227 51.188 16.211 34.431 P值 <0.001 <0.001 <0.001 <0.001 注: 与对照组比较,1)P<0.01, 与慢性乙型肝炎组比较,2)P<0.05。 -
[1] VITTAL A, GHANY MG. WHO guidelines for prevention, care and treatment of individuals infected with HBV: A US perspective[J]. Clin Liver Dis, 2019, 23(3): 417-432. DOI: 10.1016/j.cld.2019.04.008. [2] WANG M, XI D, NING Q. Virus-induced hepatocellular carcinoma with special emphasis on HBV[J]. Hepatol Int, 2017, 11(2): 171-180. DOI: 10.1007/s12072-016-9779-5. [3] BAGLIERI J, BRENNER DA, KISSELEVA T. The Role of fibrosis and liver-associated fibroblasts in the pathogenesis of hepatocellular carcinoma[J]. Int J Mol Sci, 2019, 20(7). DOI: 10.3390/ijms20071723. [4] ZHU J, LUO Z, PAN Y, et al. H19/miR-148a/USP4 axis facilitates liver fibrosis by enhancing TGF-β signaling in both hepatic stellate cells and hepatocytes[J]. J Cell Physiol, 2019, 234(6): 9698-9710. DOI: 10.1002/jcp.27656. [5] XU Y, ZHANG DQ, CHEN JM, et al. Effect of various cells on the activation of hepatic stellate cells in liver microenvironment[J]. J Clin Hepatol, 2019, 35(2): 424-430. DOI: 10.3969/j.issn.1001-5256.2019.02.042.徐莹, 张定棋, 陈佳美, 等. 肝脏微环境中各种细胞对肝星状细胞活化的影响[J]. 临床肝胆病杂志, 2019, 35(2): 424-430. DOI: 10.3969/j.issn.1001-5256.2019.02.042. [6] EL-SERAG HB, MARRERO JA, RUDOLPH L, et al. Diagnosis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2008, 134(6): 1752-1763. DOI: 10.1053/j.gastro.2008.02.090. [7] REN CZ, HAO LS. Signal transduction involved in activation of hepatic stellate cells[J]. J Clin Hepatol, 2015, 31(3): 452-456. DOI: 10.3969/j.issn.1001-5256.2015.03.034.任昌镇, 郝礼森. 肝星状细胞活化过程中的信号转导[J]. 临床肝胆病志, 2015, 31(3): 452-456. DOI: 10.3969/j.issn.1001-5256.2015.03.034. [8] WEN X, HUAN H, WANG X, et al. Sympathetic neurotransmitters promote the process of recellularization in decellularized liver matrix via activating the IL-6/Stat3 pathway[J]. Biomed Mater, 2016, 11(6): 065007. DOI: 10.1088/1748-6041/11/6/065007. [9] HUAN HB, WEN XD, CHEN XJ, et al. Sympathetic nervous system promotes hepatocarcinogenesis by modulating inflammation through activation of alpha1-adrenergic receptors of Kupffer cells[J]. Brain Behav Immun, 2017, 59: 118-134. DOI: 10.1016/j.bbi.2016.08.016. [10] KAMIMURA K, INOUE R, NAGOYA T, et al. Autonomic nervous system network and liver regeneration[J]. World J Gastroenterol, 2018, 24(15): 1616-1621. DOI: 10.3748/wjg.v24.i15.1616. [11] WANG L, ZHU L, WU K, et al. Mitochondrial general control of amino acid synthesis 5 like 1 regulates glutaminolysis, mammalian target of rapamycin complex 1 activity, and murine liver regeneration[J]. Hepatology, 2020, 71(2): 643-657. DOI: 10.1002/hep.30876. [12] OBEN JA, ROSKAMS T, YANG S, et al. Hepatic fibrogenesis requires sympathetic neurotransmitters[J]. Gut, 2004, 53(3): 438-445. DOI: 10.1136/gut.2003.026658. [13] COLL M, GENESCÀ J, RAURELL I, et al. Down-regulation of genes related to the adrenergic system may contribute to splanchnic vasodilation in rat portal hypertension[J]. J Hepatol, 2008, 49(1): 43-51. DOI: 10.1016/j.jhep.2008.03.015. [14] LI P, WU G. Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth[J]. Amino Acids, 2018, 50(1): 29-38. DOI: 10.1007/s00726-017-2490-6. [15] SRIVASTAVA AK, KHARE P, NAGAR HK, et al. Hydroxyproline: A potential biochemical marker and its role in the pathogenesis of different diseases[J]. Curr Protein Pept Sci, 2016, 17(6): 596-602. DOI: 10.2174/1389203717666151201192247. [16] SHIN SK, KIM KO, KIM SH, et al. Exogenous 8-hydroxydeoxyguanosine ameliorates liver fibrosis through the inhibition of Rac1-NADPH oxidase signaling[J]. J Gastroenterol Hepatol, 2020, 35(6): 1078-1087. DOI: 10.1111/jgh.14979. 期刊类型引用(11)
1. 肖春桃,李贤秋,甘佩灵,潘潇,周贤. 基于倾向性评分匹配分析门静脉血栓对肝硬化患者预后的影响. 临床肝胆病杂志. 2021(08): 1829-1835 .  本站查看
本站查看2. 王彤,牛焕章,杜廷伟,魏乐群. 乙型肝炎肝硬化患者门静脉血栓发生的影响因素及抗凝治疗效果研究. 深圳中西医结合杂志. 2021(17): 134-136 .  百度学术
百度学术3. 姜炅,袁佳,史海涛,戴社教. 血清ALT、AST联合NFS评分对非酒精性脂肪性肝硬化患者食管胃底静脉曲张严重程度的评估价值. 中西医结合肝病杂志. 2020(04): 314-317 .  百度学术
百度学术4. 李英,高磊,胡扬喜,胡德升. 低分子肝素钙联合右旋糖酐在肝硬化门静脉高压症术后静脉血栓形成预防中的应用. 肝脏. 2019(07): 788-790 .  百度学术
百度学术5. 吕靖,董思思,顾宏图,赵长青,刘成海. 肝硬化并发门静脉血栓的危险因素及中医证候特点. 临床肝胆病杂志. 2019(10): 2210-2213 .  本站查看
本站查看6. 陈仙艳. 肝硬化合并上消化道出血患者门静脉血栓形成危险因素分析与护理. 护理实践与研究. 2019(18): 13-15 .  百度学术
百度学术7. 牟思玉,杨哲,吴力群,邱轩,郭珈铭. 肝硬化门静脉高压脾切除术后门静脉血栓形成的预测因素分析. 临床肝胆病杂志. 2018(01): 106-111 .  本站查看
本站查看8. 张津瑜,陈文显,沈华,王雁,张国雷,慎华平,吴万波,魏云海. 大鼠门静脉系统血栓形成模型的建立和观察. 中国普通外科杂志. 2018(06): 724-731 .  百度学术
百度学术9. 邢文立,李谦. 重症监护病房肝病患者的血栓预防与出血控制. 临床肝胆病杂志. 2018(10): 2237-2240 .  本站查看
本站查看10. 李志州,向俊峰,周威,唐亮. 探讨门脉高压及外伤性脾破裂行脾切除术后血小板升高及门静脉血栓形成情况. 肝胆外科杂志. 2018(04): 280-282 .  百度学术
百度学术11. 王士浩,张宏伟. 肝硬化合并门静脉血栓形成危险因素的病例对照研究. 中国中西医结合消化杂志. 2017(11): 867-870 .  百度学术
百度学术其他类型引用(12)
-




 PDF下载 ( 3213 KB)
PDF下载 ( 3213 KB)

 下载:
下载:
 百度学术
百度学术

