发布日期:2020-04-16
来源:本站原创
信达生物合作伙伴Incyte公司近日宣布,美国食品和药物管理局(FDA)已批准Pemazyre(pemigatinib),该药是一种选择性成纤维细胞生长因子受体(FGFR)激酶抑制剂,适应症为:用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌(cholangiocarcinoma)患者。Pemazyre是根据总缓解率(ORR)和缓解持续时间(DOR)数据在加速审批程序和优先审批程序下获得批准,针对该适应症的持续批准,将取决于验证性试验中对临床益处的验证和描述。目前,Pemazyre也正在接受欧洲药品管理局(EMA)的审查。
值得一提的是,Pemazyre是第一个也是唯一一个获FDA批准用于治疗胆管癌的靶向药物,该药可通过阻断肿瘤细胞中的FGFR2来阻止肿瘤细胞的生长和扩散。由于胆管癌是一种医疗需求严重未满足的毁灭性癌症,Pemazyre之前已被授予了孤儿药资格、突破性药物资格、优先审查资格。
此次批准,基于FIGHT-202研究的数据。该研究在先前已接受过治疗的局部晚期或转移性胆管癌患者中开展,评估了Pemazyre的疗效和安全性。该研究的结果最近在欧洲肿瘤内科学会(ESMO)2019年大会上公布,数据显示:在携带FGFR2融合或重排的患者(队列A)中,中位随访15个月,Pemazyre单药治疗的总缓解率(ORR)为36%(主要终点),中位缓解持续时间(DoR)为9.1个月(次要终点)。
该研究中,不良事件可控,并与Pemazyre的作用机制一致。在接受Pemazyre治疗的患者,发生在≥20%患者中的最常见不良反应是高磷血症和低磷血症(电解质紊乱)、脱发(斑秃)、腹泻、指甲毒性、疲劳、味觉障碍、恶心、便秘、口腔炎(口腔内疼痛或炎症)、干眼症、口干、食欲减退、呕吐、关节痛、腹痛、背痛和皮肤干燥。眼毒性也是Pemazyre的一个风险。
纪念斯隆-凯特琳癌症中心Ghassan Abou-Alfa医学博士表示:“尽管胆管癌被认为是一种罕见的疾病,但在过去30年里发病率一直在上升。对于先前接受过一线化疗或手术后选择有限、复发率高居不下的患者群体而言,拥有一种新的靶向疗法是非常令人鼓舞的,将为患者带来新的希望。”
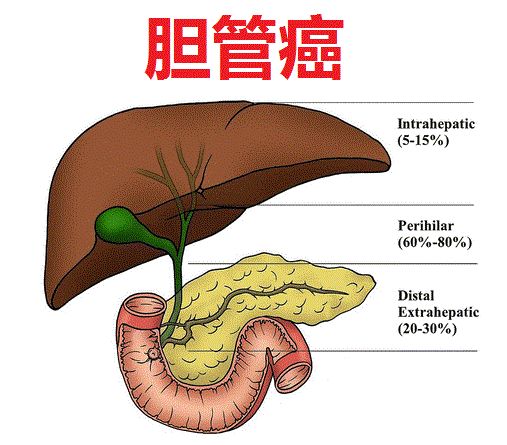
胆管癌(cholangiocarcinoma)是一种罕见的胆管癌症,可根据其解剖学起源进行分类:肝内胆管癌(iCCA)发生于肝内胆管,肝外胆管癌发生于肝外胆管。胆管癌患者在确诊时通常已处于预后不佳的后期或晚期阶段。胆管癌的发病率因地区而异,在北美和欧洲的发病率在0.3-3.4/100000。FGFR2融合或重排几乎只发生在iCCA中,在10-16%的患者中观察到。
成纤维细胞生长因子受体(FGFR)在肿瘤细胞增殖、存活、迁移和血管生成(新生血管的形成)中起着重要作用。FGFR中的融合、重排、易位和基因扩增与多种肿瘤的发生发展密切相关。
Pemazyre的活性药物成分pemigatinib是一种针对FGFR异构体1、2、3的强效、选择性、口服小分子抑制剂。在临床前研究中,pemigatinib已被证实针对发生FGFR基因改变的癌细胞具有强效和选择性药理学活性。
pemigatinib(FGFR抑制剂,图片来源:medchemexpress.cn)
目前,pemigatinib正在多项临床研究中进行评估,治疗FGFR基因变异驱动的恶性肿瘤,包括:胆管癌(II期FIGHT-202,III期FIGHT-302)、膀胱癌(II期FIGHT-201)、骨髓增殖性肿瘤(8p11 MPN,II期FIGHT-203)、肿瘤不可知论癌种(tumor-agnostic,II期FIGHT-207)、膀胱癌(一线治疗,II期FIGHT-205)、一线治疗FGFR2融合或重排胆管癌(III期FIGHT-302)。
2018年12月,信达生物与Incyte公司达成战略合作和独家授权许可协议,推进3款药物(itacitinib,parsaclisib,pemigatinib)的单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化。根据合作协议条款,Incyte公司将收到信达生物支付的4000万美元首付款,以及2019年在中国首次递交新药申请后的第二笔2000万美元现金付款。此外,Incyte将有资格获得高达1.29亿美元的潜在开发里程碑付款,以及高达2.025亿美元的潜在商业里程碑付款。(生物谷Bioon.com)
原文出处:FDA Approves Incyte’s Pemazyre™ (pemigatinib) as First Targeted Treatment for Adults with Previously Treated, Unresectable Locally Advanced or Metastatic Cholangiocarcinoma
值得一提的是,Pemazyre是第一个也是唯一一个获FDA批准用于治疗胆管癌的靶向药物,该药可通过阻断肿瘤细胞中的FGFR2来阻止肿瘤细胞的生长和扩散。由于胆管癌是一种医疗需求严重未满足的毁灭性癌症,Pemazyre之前已被授予了孤儿药资格、突破性药物资格、优先审查资格。
此次批准,基于FIGHT-202研究的数据。该研究在先前已接受过治疗的局部晚期或转移性胆管癌患者中开展,评估了Pemazyre的疗效和安全性。该研究的结果最近在欧洲肿瘤内科学会(ESMO)2019年大会上公布,数据显示:在携带FGFR2融合或重排的患者(队列A)中,中位随访15个月,Pemazyre单药治疗的总缓解率(ORR)为36%(主要终点),中位缓解持续时间(DoR)为9.1个月(次要终点)。
该研究中,不良事件可控,并与Pemazyre的作用机制一致。在接受Pemazyre治疗的患者,发生在≥20%患者中的最常见不良反应是高磷血症和低磷血症(电解质紊乱)、脱发(斑秃)、腹泻、指甲毒性、疲劳、味觉障碍、恶心、便秘、口腔炎(口腔内疼痛或炎症)、干眼症、口干、食欲减退、呕吐、关节痛、腹痛、背痛和皮肤干燥。眼毒性也是Pemazyre的一个风险。
纪念斯隆-凯特琳癌症中心Ghassan Abou-Alfa医学博士表示:“尽管胆管癌被认为是一种罕见的疾病,但在过去30年里发病率一直在上升。对于先前接受过一线化疗或手术后选择有限、复发率高居不下的患者群体而言,拥有一种新的靶向疗法是非常令人鼓舞的,将为患者带来新的希望。”

胆管癌(cholangiocarcinoma)是一种罕见的胆管癌症,可根据其解剖学起源进行分类:肝内胆管癌(iCCA)发生于肝内胆管,肝外胆管癌发生于肝外胆管。胆管癌患者在确诊时通常已处于预后不佳的后期或晚期阶段。胆管癌的发病率因地区而异,在北美和欧洲的发病率在0.3-3.4/100000。FGFR2融合或重排几乎只发生在iCCA中,在10-16%的患者中观察到。
成纤维细胞生长因子受体(FGFR)在肿瘤细胞增殖、存活、迁移和血管生成(新生血管的形成)中起着重要作用。FGFR中的融合、重排、易位和基因扩增与多种肿瘤的发生发展密切相关。
Pemazyre的活性药物成分pemigatinib是一种针对FGFR异构体1、2、3的强效、选择性、口服小分子抑制剂。在临床前研究中,pemigatinib已被证实针对发生FGFR基因改变的癌细胞具有强效和选择性药理学活性。

pemigatinib(FGFR抑制剂,图片来源:medchemexpress.cn)
目前,pemigatinib正在多项临床研究中进行评估,治疗FGFR基因变异驱动的恶性肿瘤,包括:胆管癌(II期FIGHT-202,III期FIGHT-302)、膀胱癌(II期FIGHT-201)、骨髓增殖性肿瘤(8p11 MPN,II期FIGHT-203)、肿瘤不可知论癌种(tumor-agnostic,II期FIGHT-207)、膀胱癌(一线治疗,II期FIGHT-205)、一线治疗FGFR2融合或重排胆管癌(III期FIGHT-302)。
2018年12月,信达生物与Incyte公司达成战略合作和独家授权许可协议,推进3款药物(itacitinib,parsaclisib,pemigatinib)的单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化。根据合作协议条款,Incyte公司将收到信达生物支付的4000万美元首付款,以及2019年在中国首次递交新药申请后的第二笔2000万美元现金付款。此外,Incyte将有资格获得高达1.29亿美元的潜在开发里程碑付款,以及高达2.025亿美元的潜在商业里程碑付款。(生物谷Bioon.com)
原文出处:FDA Approves Incyte’s Pemazyre™ (pemigatinib) as First Targeted Treatment for Adults with Previously Treated, Unresectable Locally Advanced or Metastatic Cholangiocarcinoma







