经颈静脉肝内门体分流术对脾切除术后门静脉血栓患者食管静脉曲张再出血的预防价值
DOI: 10.3969/j.issn.1001-5256.2021.06.023
Value of transjugular intrahepatic portosystemic shunt in the prevention of esophageal variceal rebleeding in patients with portal vein thrombosis after splenectomy
-
摘要:
目的 探讨预防脾切除术后门静脉血栓(PVT)患者发生食管静脉曲张再出血,行经颈静脉肝内门体分流术(TIPS)的技术成功率和结局。 方法 回顾性分析2009年12月—2017年1月山东省立医院收治的因预防食管静脉曲张再出血行TIPS的46例脾切除术后PVT患者的临床资料。根据TIPS是否成功, 将患者分为TIPS成功组(38例)和TIPS失败组(8例),分析两组患者术后曲张静脉再出血、支架功能障碍、肝性脑病(HE)及生存状况。计量资料两组间比较采用配对t检验,计数资料两组间比较采用χ2检验。Kaplan-Meier曲线分析无曲张静脉再出血率、支架通畅率、无HE发生率和生存率。累积无再出血率和累积生存率比较采用log-rank检验。 结果 TIPS成功率为82.6%。TIPS成功组与失败组6、12、24个月累积无再出血率分别为94.3%、89.8%、89.8%和85.7%、85.7%、28.6%,两组比较差异有统计学意义(χ2=4.563,P=0.033)。TIPS成功组支架在6、12、24个月累积通畅率分别为79.3%、74.3%、69.0%,TIPS术后累积无HE发生率在6、12、24个月分别为72.1%、55.5%、55.5%。TIPS成功组与失败组6、12、24个月累积生存率分别为94.0%、94.0%、86.2%和71.4%、71.4%、71.4%,两组比较差异有统计学意义(χ2=4.988,P=0.026)。 结论 TIPS是预防脾切除术后PVT患者食管静脉曲张再出血的一种安全可行的方法。将TIPS与经皮经肝途径相结合可以促进技术成功。 -
关键词:
- 门体分流术,经颈静脉肝内 /
- 门静脉血栓 /
- 脾切除术 /
- 食管和胃静脉曲张
Abstract:Objective To investigate the technical success rate and outcome of transjugular intrahepatic portosystemic shunt (TIPS) in preventing esophageal variceal rebleeding in patients with portal vein thrombosis (PVT) after splenectomy. Methods A retrospective analysis was performed for the clinical data of 46 patients with PVT after splenectomy who were admitted to Shandong Provincial Hospital from December 2009 to January 2017 and underwent TIPS to prevent esophageal variceal rebleeding. According to the success or failure of TIPS, the patients were divided into TIPS success group with 38 patients and TIPS failure group with 8 patients. The two groups were compared in terms of postoperative variceal rebleeding, stent dysfunction, hepatic encephalopathy (HE), and survival. The paired t-test was used for comparison of continuous data between two groups, and the chi-square test was used for comparison of categorical data between two groups. The Kaplan-Meier curve was used to analyze variceal rebleeding-free rate, stent patency rate, HE-free rate, and survival rate, and the log-rank test was used for comparison of cumulative rebleeding-free rate and cumulative survival rate. Results The technical success rate of TIPS was 82.6%. There were significant differences in 6-, 12-, and 24-month cumulative rebleeding-free rates between the TIPS success group and the TIPS failure group (94.3%/89.8%/89.8% vs 85.7%/85.7%/28.6%, χ2=4.563, P=0.033). In the TIPS success group, the 6-, 12-, and 24-month cumulative stent patency rates were 79.3%, 74.3%, and 69.0%, respectively, and the 6-, 12-, and 24-month cumulative HE-free rates after TIPS were 72.1%, 55.5%, and 55.5%, respectively. There were significant differences in 6-, 12-, and 24-month cumulative survival rates between the TIPS success group and the TIPS failure group (94.0%/94.0%/86.2% vs 71.4%/71.4%/71.4%, χ2=4.988, P=0.026). Conclusion TIPS is a safe and feasible method for preventing esophageal variceal rebleeding in patients with PVT after splenectomy, and TIPS combined with a percutaneous transhepatic approach may promote technical success. -
在我国,脾切除术联合食管胃断流术被广泛用于治疗肝硬化门静脉高压症并发的食管胃底静脉曲张破裂出血和脾功能亢进,但5年和10年后静脉曲张再出血率分别为6.2%和13.3%[1]。肝硬化患者脾切除术后,门静脉血栓(portal vein thrombosis, PVT)的发生率可高达50%[2-5]。当PVT变为慢性血栓时,门静脉主干(main portal vein, MPV)和/或分支被完全或部分阻塞,MPV周围大量侧支静脉形成,发生门静脉海绵样变(cavernous transformation of the portal vein,CTPV)[6]。这种现象可能加重门静脉高压继而增加曲张静脉再次破裂出血的风险,此时内镜或抗凝治疗效果均不佳,并影响肝移植的预后[1]。经颈静脉肝内门体分流术(TIPS)可有效预防PVT患者食管静脉曲张再出血,技术成功率为70%~100%[7-10]。但是,针对脾切除术后预防PVT患者食管静脉曲张再出血的TIPS研究有限。本研究目的是报告TIPS预防46例脾切除术后PVT患者食管静脉曲张再出血的临床结果。
1. 资料和方法
1.1 研究对象
回顾性分析2009年12月—2017年1月山东省立医院为预防食管静脉曲张再出血接受TIPS治疗的脾切除术后PVT患者的临床资料。纳入标准:(1)年龄18~80岁;(2)曾因食管静脉曲张出血行脾切除术或脾切除术联合食管胃断流术;(3)曲张静脉出血被控制与行TIPS时间间隔>5 d。排除标准:(1)存在恶性肿瘤证据;(2)MPV管腔内血栓阻塞程度<50%。
入组患者术前均完善血常规、肝肾功能、凝血功能、胃镜、腹部超声、CT或MRI等检查。MPV阻塞程度分为部分阻塞、完全阻塞和条索化。门静脉左、右支和肠系膜上静脉(superior mesenteric vein,SMV)的阻塞程度分为部分阻塞和完全阻塞[11]。
1.2 手术方法
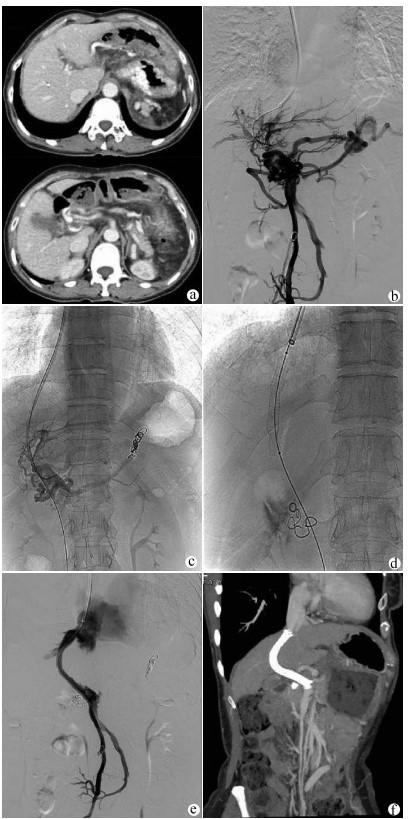
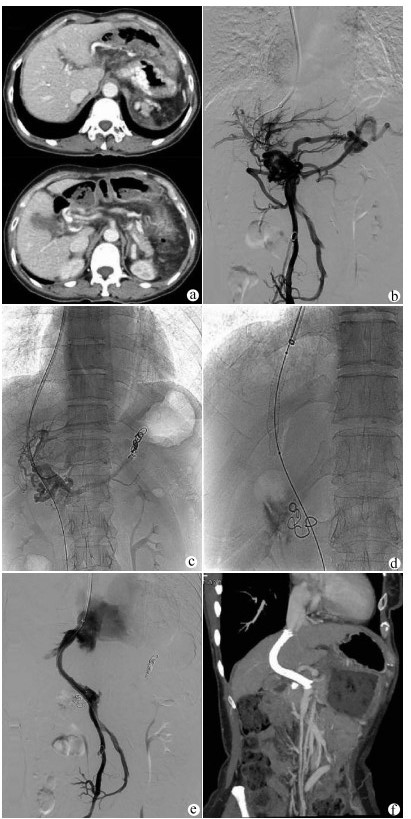
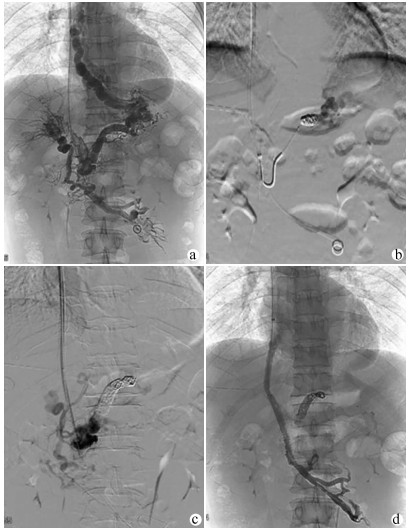
TIPS在局部麻醉下进行,经右颈内静脉入路,将RUPS-100导管鞘送入肝右静脉。经肠系膜上动脉行间接门静脉正侧位造影评估门静脉系统的通畅性及与肝右静脉的空间关系。如门静脉左、右支通畅,经颈静脉入路穿刺门静脉右或左支。使用导丝和导管尝试通过血栓阻塞的门静脉进入MPV或SMV的通畅部分。交换猪尾巴导管行门静脉造影观察血栓的位置、程度及食管曲张静脉的情况,测量MPV和下腔静脉压力以计算门静压力梯度(portal venous pressure gradient,PPG)。栓塞曲张静脉后沿导丝送入球囊导管扩张肝内穿刺道。根据分流道长度置入直径7~8 mm的覆膜支架(Angiomed GmbH & Co Medizintechnik KG, Karlsruhe, Germany)覆盖肝实质内分流道。必要时在覆膜支架内置入裸支架(Bard, Peripheral Vascular, Inc., Tempe, AZ, USA)形成组合支架,使支架的近心端位于肝静脉与下腔静脉汇合处,远心端完全覆盖MPV/SMV内的血栓至其通畅部分中(图 1)。
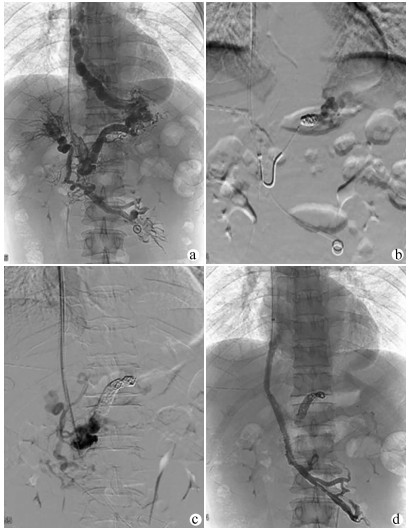
如间接门静脉造影无法显示MPV及左、右支,则选择超声引导下经皮经肝穿刺门静脉右支或左支。使用导丝和导管对血栓阻塞的MPV进行探查,将导管头端置于门静脉内作为RUPS-100穿刺的靶点,引导完成TIPS过程(图 2)。TIPS术后用弹簧圈栓塞经皮经肝穿刺门静脉的穿刺道。
1.3 术后处理及随访
根据TIPS成功与否分为成功组和失败组。TIPS成功组患者接受常规抗凝治疗,并口服乳果糖保持大便通畅。所有患者均接受随访,截止时间为2017年6月30日或死亡。观察患者有无静脉曲张再出血,TIPS分流道功能障碍,肝性脑病(HE)和任何原因导致的死亡。
1.4 伦理学审查
本研究经山东省立医院伦理委员会批准,批号:NO.2018-237。TIPS术前,患者及其家属均签署知情同意书。
1.5 统计学方法
应用SPSS 22.0软件进行统计分析。计量资料以x ±s表示,组间比较采用配对t检验;计数资料两组间比较采用χ2检验。Kaplan-Meier曲线分析TIPS术后无再出血率、支架通畅率、无HE发生率和生存率。TIPS成功组和失败组累积无再出血率和累积生存率比较采用log-rank检验。P<0.05为差异有统计学意义。
2. 结果
2.1 一般资料
共纳入46例脾切除术后伴PVT接受TIPS预防食管静脉曲张再出血的患者,其中男28例,女18例,平均(51.13±10.70)岁。24例(52.2%)患者MPV条索化或完全阻塞,28例(60.9%)患者存在CTPV。46例患者的基线特征见表 1。共4例患者(TIPS成功组3例,TIPS失败组1例)失访。中位随访时间13(1~86)个月。
表 1 患者基线特征指标 数值 年龄(岁) 51.13±10.70 男/女(例) 28/18 TIPS与脾切除术间隔(年) 8.30±5.79 肝炎类型(例) 乙型肝炎 22 丙型肝炎 1 酒精性肝炎 4 其他 19 Child-Pugh分级(A/B/C,例) 16/28/2 总胆红素(μmol/L) 19.23±10.31 血清白蛋白(g/L) 30.73±4.66 血尿素氮(mmol/L) 5.02±2.47 肌酐(μmol/L) 60.20±23.73 血清钠(mmol/L) 136.40±18.94 凝血酶原时间(s) 14.27±1.65 国际标准化比值 1.20±0.14 血红蛋白(g/L) 87.45±20.68 白细胞(×109/L) 6.73±5.74 血小板(×109/L) 252.96±118.58 食管静脉曲张分级(轻度/中度/重度,例) 4/2/40 门静脉海绵样变(有/无,例) 28/18 MPV (条索化/完全阻塞/部分阻塞,例) 10/14/22 RPV (完全阻塞/部分阻塞/通畅,例) 7/29/10 LPV (完全阻塞/部分阻塞/通畅,例) 9/24/13 SMV (完全阻塞/部分阻塞/通畅,例) 8/16/22 注:LPV,门静脉左支;RPV,门静脉右支。 2.2 技术成果
46例患者中38例(82.6%)成功实施TIPS,其中13例仅采用经颈静脉入路完成TIPS,25例采用经颈静脉/经肝联合通路;8例使用单一覆膜支架,30例采用覆膜支架联合裸支架以确保分流道中有足够的血流,覆膜支架的平均直径为(7.79±0.61) mm;25例TIPS同时进行了曲张静脉栓塞术,13例因直接门静脉造影未显示曲张静脉或曲张静脉过于迂曲无法超选到位未进行食管曲张静脉栓塞术。
在TIPS成功组中,PPG从(24.84±6.08)mm Hg下降至(14.67±5.03) mm Hg(t=55.321,P<0.01)。TIPS术中1例患者发生腹腔内出血(曲张静脉开口迂曲,导丝穿出血管壁,直接门静脉造影发现对比剂进入腹腔,在出血静脉中放置4枚弹簧圈进行栓塞,术后未再出血,见图 1d)。1例穿刺进入胆道(撤出穿刺针,没有发生后遗症)。在所有患者中,未发现与手术相关的大出血或死亡等严重并发症。
2.3 再出血
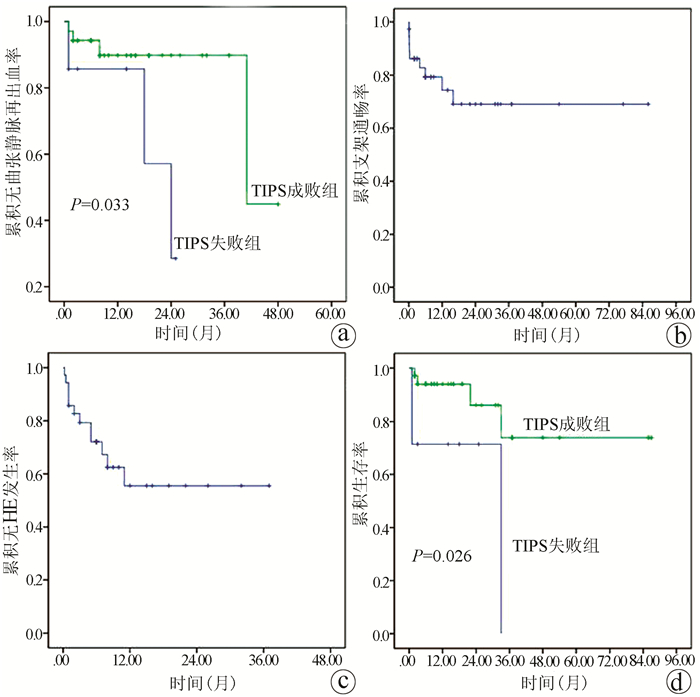
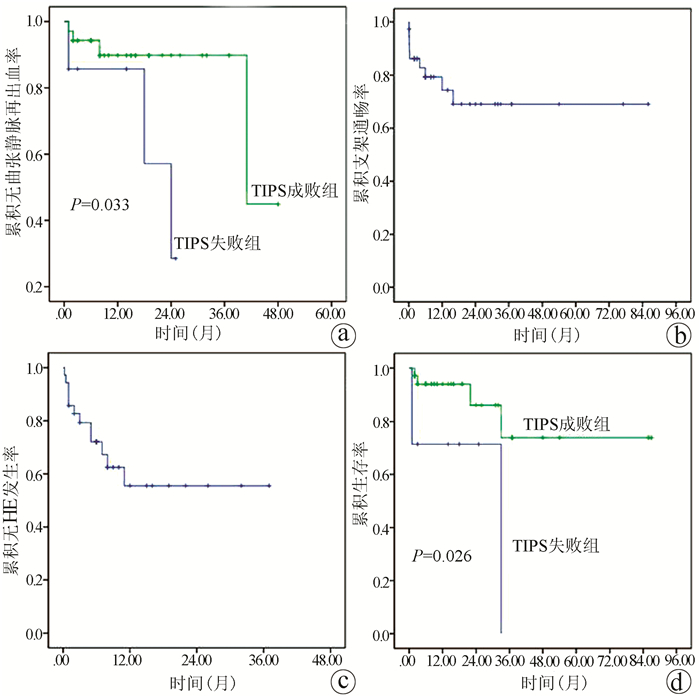
成功随访42例,其中TIPS成功组35例,TIPS失败组7例。TIPS成功组4例患者(11.4%,4/35)共计发生5次曲张静脉再出血,其中3例未行曲张静脉栓塞术,1例因支架功能障碍发生了2次曲张静脉再出血。TIPS失败组中3例(42.9%,3/7)发生了静脉曲张再出血。TIPS失败组的再出血率高于TIPS成功组,差异有统计学意义(χ2=4.149,P=0.042)。6、12和24个月累积无曲张静脉再出血率在TIPS成功组中分别为94.3%、89.8%和89.8%,在TIPS失败组中分别为85.7%、85.7%和28.6%(χ2=4.563,P=0.033)(图 3a)。
2.4 分流道功能障碍
TIPS术后9例发生了分流道功能障碍。4例出现在TIPS术后2周内,3例出现在TIPS术后2周~6个月,2例出现在术后12个月以后。3例分流功能障碍的患者接受了再次支架置入,5例患者接受了置管溶栓或球囊血管成形术。支架在6、12和24个月累积通畅率分别为79.3%、74.3%和69.0%(图 3b)。
2.5 肝性脑病(HE)
TIPS成功组的35例患者中有12例(34.3%)出现了HE。10例患者(分级Ⅰ~Ⅱ级)通过药物治疗和低蛋白饮食好转,1例患者因顽固性HE死亡。6、12和24个月累积无HE发生率分别为72.1%、55.5%和55.5%(图 3c)。失败组中未观察到HE发作。
2.6 病死率
在TIPS成功组和失败组分别有4(11.4%)例和3(42.9%)例患者死亡(χ2=4.149,P=0.042)。TIPS成功组的死亡原因包括顽固性HE 1例、肝衰竭1例和肝细胞癌2例,而TIPS失败组中死亡原因是曲张静脉再出血(n=2)和肝衰竭(n=1)。6、12和24个月的累积生存率在TIPS成功组中分别为94.0%、94.0%和86.2%,在TIPS失败组中分别为71.4%、71.4%和71.4%(χ2=4.988,P=0.026)(图 3d)。
3. 讨论
PVT是脾切术后可能危及生命的并发症,可导致静脉曲张再出血或缺血性肠坏死[5, 12-13]。对于短期PVT且无出血的患者,建议早期抗凝和溶栓[8, 14]。然而,当PVT变为慢性时,闭塞的门静脉管腔缩小甚至消失,并发生CTPV[15-16]。对于脾切除术后慢性门静脉闭塞和CTPV的患者,尚无共识指南[17]。对于脾切除术后的PVT患者,TIPS可能存在一定的困难。首先,由于MPV及其分支的狭窄和闭塞,由肝静脉穿刺门静脉难度增加;其次,陈旧的栓子可能会导致原始MPV消失,发生CTPV,从而增加了导丝通过MPV的难度;最后,脾切除术后的患者无法采用经皮经脾途径联合TIPS的方式。
本研究证明在脾切除术后PVT患者中进行TIPS(82.6%)的可行性。相似的临床研究[1, 17-18]显示:脾切除术后PVT患者TIPS成功率在66.7%~91.7%。起初,脾切除术与行TIPS间隔的时间长短被认为是TIPS失败的重要原因。成功组中脾切除术距TIPS的平均时间间隔为(7.84±5.24)年,TIPS失败组为(10.50±7.98)年,两者差异无统计学意义。这可能与本研究纳入患者数量相对较少,无法根据脾切除术距TIPS时间设立亚组进行分析有关。Senzolo等[7]报道存在可供穿刺的肝内门静脉是预测TIPS成功的主要因素。Han等[18]发现MPV阻塞程度是TIPS失败的独立预测因素。在本研究中TIPS失败的原因为3例患者MPV及左、右支均未显示,5例患者因MPV条索化致导丝不能穿过血栓进入MPV。B超导向下无法完成经皮经肝穿刺门静脉分支时,经皮脾途径为开通阻塞门静脉有效的重要方式,显然本组患者没有机会接受此操作。无法经皮经肝途径进入门静脉,经颈静脉穿刺门静脉缺少靶点,会增加手术难度,甚至导致TIPS失败。MPV完全阻塞甚至条索化会增加导丝通过的难度,如导丝无法通过血栓阻塞的MPV到达通畅的SMV内,则无法完成TIPS。实践指南和研究[1]表明:PPG<12 mm Hg或较基线值下降20%~50%足以预防曲张静脉再出血,并具有降低HE和肝衰竭风险的潜在益处。本研究中患者均有静脉曲张出血史,PPG较术前平均下降41.4%。成功实施TIPS后降低了PPG和食管静脉曲张再出血率。未行曲张静脉栓塞和分流道失功为TIPS成功组再出血的危险因素。TIPS成功组4例再出血患者中3例(75%)行门静脉造影时无法发现曲张静脉未进行栓塞,可能因曲张静脉发自布满血栓的脾静脉盲端,未与MPV直接相通,TIPS并没有降低这些曲张静脉的压力。早期严密的监测分流道并及时对失功分流道再通可能会减少再曲张静脉出血的概率。
Luca等[8]报道,未行脾切除术的PVT患者覆膜支架TIPS术后1年及2年累积支架功能障碍发生率分别为21%、29%。Dong等[19]报道,未行脾切除术伴或不伴PVT患者TIPS术后1年及2年支架的通畅率分别为69.4%、51.0%。本研究中分流功能障碍发生率与未行脾切除术伴PVT的TIPS研究中观察到的结果相似[8-9]。考虑这一结果可能的原因如下:首先,无论有或无脾切除术史,PVT患者多伴有血栓危险因素处于高凝状态,易发生分流道障碍;其次,将组合支架的远端完全覆盖MPV和/或SMV内的血栓,虽无脾静脉回流,但仍保持分流道中有足够的血流。关于脾切除术是否为导致TIPS支架功能障碍的原因之一,还需要进一步的随机对照试验来证实。
HE是TIPS患者常见和潜在的并发症,通常在TIPS术后3个月内发生[20]。有研究[8, 10]报道,PVT患者1年及2年累积HE发生率为17.7%~27%与29%~46.5%。本组HE大多数发生在术后早期,可以通过药物或低蛋白饮食控制。对通过药物和低蛋白饮食无法控制的顽固性HE可通过置入直径较小的覆膜支架改善HE。本研究与之前研究HE发生的上限相近,可能与本研究纳入病例均为脾切除术患者、TIPS分流道内没有脾静脉血液回流、主要为含血氨较高的SMV内血液有关。
脾切除术后的PVT可能加重肝损伤,并导致曲张静脉出血或难治性腹水等肝硬化门静脉高压的并发症。PVT患者因静脉曲张破裂出血的病死率为30%~70%[21]。在脾切除术后的PVT患者中,TIPS成功组的病死率低于失败组。可能原因为静脉曲张再出血与病死率高相关,脾切术后的PVT患者可通过TIPS降低曲张静脉再出血而使患者收益。
本研究存在以下局限性:(1)本研究为回顾性研究,缺乏随机对照组,还需进一步的前瞻性随机试验证实TIPS在预防脾切除术后PVT患者食管曲张静脉再出血和增加生存率方面的优势。(2)本研究为单中心研究且TIPS失败组仅纳入7例,两组病例数量构成存在偏差,研究结果可靠性受限,还需要进一步扩大样本量。
总之,本研究证实TIPS预防脾切除术后PVT患者食管曲张静脉再出血的安全性和有效性。联合药物和内镜治疗仍反复发生食管曲张静脉出血的脾切除后PVT患者应当考虑接受TIPS治疗。将TIPS与经皮经肝途径相结合可以促进技术成功。
-
表 1 患者基线特征
指标 数值 年龄(岁) 51.13±10.70 男/女(例) 28/18 TIPS与脾切除术间隔(年) 8.30±5.79 肝炎类型(例) 乙型肝炎 22 丙型肝炎 1 酒精性肝炎 4 其他 19 Child-Pugh分级(A/B/C,例) 16/28/2 总胆红素(μmol/L) 19.23±10.31 血清白蛋白(g/L) 30.73±4.66 血尿素氮(mmol/L) 5.02±2.47 肌酐(μmol/L) 60.20±23.73 血清钠(mmol/L) 136.40±18.94 凝血酶原时间(s) 14.27±1.65 国际标准化比值 1.20±0.14 血红蛋白(g/L) 87.45±20.68 白细胞(×109/L) 6.73±5.74 血小板(×109/L) 252.96±118.58 食管静脉曲张分级(轻度/中度/重度,例) 4/2/40 门静脉海绵样变(有/无,例) 28/18 MPV (条索化/完全阻塞/部分阻塞,例) 10/14/22 RPV (完全阻塞/部分阻塞/通畅,例) 7/29/10 LPV (完全阻塞/部分阻塞/通畅,例) 9/24/13 SMV (完全阻塞/部分阻塞/通畅,例) 8/16/22 注:LPV,门静脉左支;RPV,门静脉右支。 -
[1] LUO J, LI M, ZHANG Y, et al. Percutaneous transhepatic intrahepatic portosystemic shunt for variceal bleeding with chronic portal vein occlusion after splenectomy[J]. Eur Radiol, 2018, 28(9): 3661-3668. DOI: 10.1007/s00330-018-5360-z. [2] MAKDISSI FF, HERMAN P, MACHADO MA, et al. Portal vein thrombosis after esophagogastric devascularization and splenectomy in schistosomal portal hypertension patients: What's the real importance?[J]. Arq Gastroenterol, 2009, 46(1): 50-56. DOI: 10.1590/s0004-28032009000100014. [3] DANNO K, IKEDA M, SEKIMOTO M, et al. Diameter of splenic vein is a risk factor for portal or splenic vein thrombosis after laparoscopic splenectomy[J]. Surgery, 2009, 145(5): 457-464; discussion 465-466. DOI: 10.1016/j.surg.2008.06.030. [4] IKEDA M, SEKIMOTO M, TAKIGUCHI S, et al. High incidence of thrombosis of the portal venous system after laparoscopic splenectomy: A prospective study with contrast-enhanced CT scan[J]. Ann Surg, 2005, 241(2): 208-216. DOI: 10.1097/01.sla.0000151794.28392.a6. [5] HE S, HE F. Predictive model of portal venous system thrombosis in cirrhotic portal hypertensive patients after splenectomy[J]. Int J Clin Exp Med, 2015, 8(3): 4236-4242. [6] DIAO YP, YANG N, GUO LL, et al. Unconventional interventional therapy for cavernous transformation of the portal vein[J]. Ann Vasc Surg, 2014, 28(7): 1791. e9-1791. e11. DOI: 10.1016/j.avsg.2014.03.005. [7] SENZOLO M, TIBBALS J, CHOLONGITAS E, et al. Transjugular intrahepatic portosystemic shunt for portal vein thrombosis with and without cavernous transformation[J]. Aliment Pharmacol Ther, 2006, 23(6): 767-775. DOI: 10.1111/j.1365-2036.2006.02820.x. [8] LUCA A, MIRAGLIA R, CARUSO S, et al. Short- and long-term effects of the transjugular intrahepatic portosystemic shunt on portal vein thrombosis in patients with cirrhosis[J]. Gut, 2011, 60(6): 846-852. DOI: 10.1136/gut.2010.228023. [9] RADOSEVICH PM, RING EJ, LABERGE JM, et al. Transjugular intrahepatic portosystemic shunts in patients with portal vein occlusion[J]. Radiology, 1993, 186(2): 523-527. DOI: 10.1148/radiology.186.2.8421759. [10] LUO X, WANG Z, TSAUO J, et al. Advanced cirrhosis combined with portal vein thrombosis: A randomized trial of TIPS versus endoscopic band ligation plus propranolol for the prevention of recurrent esophageal variceal bleeding[J]. Radiology, 2015, 276(1): 286-293. DOI: 10.1148/radiol.15141252. [11] FANELLI F, ANGELONI S, SALVATORI FM, et al. Transjugular intrahepatic portosystemic shunt with expanded-polytetrafuoroethylene-covered stents in non-cirrhotic patients with portal cavernoma[J]. Dig Liver Dis, 2011, 43(1): 78-84. DOI: 10.1016/j.dld.2010.06.001. [12] QI X, HAN G, YE C, et al. Splenectomy causes 10-fold increased risk of portal venous system thrombosis in liver cirrhosis patients[J]. Med Sci Monit, 2016, 22: 2528-2550. DOI: 10.12659/msm.898866. [13] WANG MQ, LIN HY, GUO LP, et al. Acute extensive portal and mesenteric venous thrombosis after splenectomy: Treated by interventional thrombolysis with transjugular approach[J]. World J Gastroenterol, 2009, 15(24): 3038-3045. DOI: 10.3748/wjg.15.3038. [14] QI X, BAI M, GUO X, et al. Pharmacologic prophylaxis of portal venous system thrombosis after splenectomy: A meta-analysis[J]. Gastroenterol Res Pract, 2014, 2014: 292689. DOI: 10.1155/2014/292689. [15] SONG B, MIN P, OUDKERK M, et al. Cavernous transformation of the portal vein secondary to tumor thrombosis of hepatocellular carcinoma: Spiral CT visualization of the collateral vessels[J]. Abdom Imaging, 2000, 25(4): 385-393. DOI: 10.1007/s002610000057. [16] KINJO N, KAWANAKA H, AKAHOSHI T, et al. Risk factors for portal venous thrombosis after splenectomy in patients with cirrhosis and portal hypertension[J]. Br J Surg, 2010, 97(6): 910-916. DOI: 10.1002/bjs.7002. [17] LUO X, NIE L, ZHOU B, et al. Transjugular intrahepatic portosystemic shunt for the treatment of portal hypertension in noncirrhotic patients with portal cavernoma[J]. Gastroenterol Res Pract, 2014, 2014: 659726. DOI: 10.1155/2014/659726. [18] HAN G, QI X, HE C, et al. Transjugular intrahepatic portosystemic shunt for portal vein thrombosis with symptomatic portal hypertension in liver cirrhosis[J]. J Hepatol, 2011, 54(1): 78-88. DOI: 10.1016/j.jhep.2010.06.029. [19] DONG F, LUO SH, ZHENG LJ, et al. Incidence of portal vein thrombosis after splenectomy and its influence on transjugular intrahepatic portosystemic shunt stent patency[J]. World J Clin Cases, 2019, 7(17): 2450-2462. DOI: 10.12998/wjcc.v7.i17.2450. [20] WANG L, HE F, YUE Z, et al. Techniques and long-term effects of transjugular intrahepatic portosystemic shunt on liver cirrhosis-related thrombotic total occlusion of main portal vein[J]. Sci Rep, 2017, 7(1): 10868. DOI: 10.1038/s41598-017-11455-y. [21] STAMOU KM, TOUTOUZAS KG, KEKIS PB, et al. Prospective study of the incidence and risk factors of postsplenectomy thrombosis of the portal, mesenteric, and splenic veins[J]. Arch Surg, 2006, 141(7): 663-669. DOI: 10.1001/archsurg.141.7.663. 期刊类型引用(6)
1. 崔婷,王涛,张裕,张丹,岳振东,王磊,范振华,吴一凡,董成宾,刘福全. TIPS联合置管溶栓(或联合局部处理)治疗门静脉血栓临床疗效. 介入放射学杂志. 2024(01): 22-27 .  百度学术
百度学术2. 李瑾艳,吴予,蒋旭燕,葛文贤. 血栓弹力图对乙肝肝硬化患者脾切除术后门静脉血栓形成的预测价值及其列线图模型的构建. 血管与腔内血管外科杂志. 2024(10): 1264-1269 .  百度学术
百度学术3. 朱梁燕,刘璐,舒涵艺,吴雪凤. 经颈静脉肝内门体分流术治疗在门静脉系统血栓性疾病的疗效分析. 浙江创伤外科. 2023(03): 530-533 .  百度学术
百度学术4. 王玲玲,陈佳,罗冰,雎瑶,陈方璐,李亚玲. 经颈静脉肝内门体静脉分流术后门静脉内血栓形成的影响因素分析. 血管与腔内血管外科杂志. 2023(10): 1218-1222 .  百度学术
百度学术5. 张盼盼,王朝阳,鹿璐,燕彦. 早期肠内营养支持在门脉高压行TIPS术后患者中的应用价值. 国际医药卫生导报. 2022(16): 2250-2254 .  百度学术
百度学术6. 申艳,陈欣,武涛,陈琳. 肝硬化患者门静脉血栓形成合并消化道出血的研究进展. 临床肝胆病杂志. 2022(08): 1901-1905 .  本站查看
本站查看其他类型引用(5)
-




 PDF下载 ( 3009 KB)
PDF下载 ( 3009 KB)


 下载:
下载:


 下载:
下载:
 百度学术
百度学术