Association between serum macrophage polarization-related factors and liver fibrosis in echinococcosis multilocularis
-
摘要:
目的 探究血清巨噬细胞极化相关因子与多房棘球蚴病(AE)患者肝纤维化的关系。 方法 选择2018年9月—2020年10月青海大学附属医院肝胆胰外科AE患者120例,另外选取33例健康对照者作为正常对照组。比较2组受试者间及不同肝纤维化程度患者IL-6、IL-10、TNFα、TGFβ1水平。符合正态分布的计量资料2组间比较采用独立样本t检验;不符合正态分布的计量资料组间比较采用Mann-Whitney U检验或Kruskal-Wallis H检验。计数资料组间比较采用χ2检验。采用单因素及多因素logistic回归分析法分析血清巨噬细胞极化相关因子与AE患者肝纤维化的关系,采用受试者工作特征曲线(ROC曲线)分析血清学检查对AE患者肝纤维化的诊断价值。采用Spearman法分析各指标与HAI评分和Metavir分期的相关性。 结果 与正常对照组比较,AE组血清IL-6[(13.97(9.64~23.62)pg/mL vs 1.30(0.35~2.71)pg/mL,Z=-5.980,P<0.001]、TNFα[2.26(1.65~4.13)pg/mL vs 1.40 (1.04~2.10)pg/mL,Z=-3.114,P<0.01]、TGFβ1[3.64(2.71~5.72)pg/mL vs 2.91(2.20~3.35)pg/mL,Z=-2.594,P<0.05] 水平均显著升高。且血清IL-6、TNFα水平升高是肝AE患者发生肝纤维化的独立危险因素[HR(95%CI):2.721(1.730~4.280)、3.527(1.158~10.747),P值均<0.05]。经ROC曲线分析,包虫抗体IgG联合血清IL-6、TNFα对于肝纤维化的诊断敏感度和特异度分别为88.4%和95.8%,曲线下面积为0.951(95%CI:0.937~0.964),均高于IL-6、TNFα、包虫抗体IgG的单独诊断(Z值分别为-3.458、-4.011、2.379,P值均<0.05)。经Spearman分析,血清IL-6、TNFα、TGFβ水平与HAI评分(r值分别为0.560、0.644、0.465,P值均<0.001)、Metavir纤维化评分(r值分别为0.530、0.758、0.567,P值均<0.001)均呈正相关性,而血清IL-10与HAI评分(r=-0.232,P=0.011)和Metavir纤维化评分(r=-0.288,P=0.001)则呈负相关性。 结论 肝AE患者普遍存在巨噬细胞极化状态,且巨噬细胞极化相关因子IL-6、TNFα、TGFβ1水平与肝纤维化发生和进展有关,对于预测肝纤维化可提供一定的参考信息。 Abstract:Objective To investigate the association between serum macrophage polarization-related factors and liver fibrosis in patients with alveolar echinococcosis (AE). Methods A total of 120 patients with AE who attended Department of Hepatobiliary and Pancreatic Surgery in The Affiliated Hospital of Qinghai University from September 2018 to October 2020 were enrolled as AE group, and 33 healthy controls were enrolled as normal control group. The two groups and the patients with varying degrees of liver fibrosis were compared in terms of the levels of interleukin-6 (IL-6), interleukin-10 (IL-10), tumor necrosis factor-α (TNF-α), and transforming growth factor-β1 (TGF-β1). Comparison of normally distributed continuous data between two groups was made by the independent samples t-test, while comparison of non-normally distributed continuous data was made by the Mann-Whitney U test or Kruskal-Wallis H test. Comparison of categorical data between groups was made by the chi-square test. Univariate and multivariate logistic regression analyses were used to investigate the association between serum macrophage polarization-related factors and liver fibrosis in patients with AE, and the receiver operating characteristic (ROC) curve was used to analyze the value of serological examination in the diagnosis of liver fibrosis in patients with AE. A Spearman correlation analysis was used to analyze the correlation of each index with HAI score and Metavir score. Results Compared with the normal control group, the AE group had significant increases in the serum levels of IL-6 [13.97 (9.64-23.62) pg/mL vs 1.30 (0.35-2.71) pg/mL, Z=-5.980, P < 0.001], TNF-α [2.26 (1.65-4.13) pg/mL vs 1.40 (1.04-2.10) pg/mL, Z=-3.114, P < 0.01], and TGF-β1 [3.64(2.71-5.72) pg/mL vs 2.91(2.20-3.35) pg/mL, Z=-2.594, P < 0.05], and increases in the serum levels of IL-6 (hazard ratio [HR]=2.721, 95% confidence interval [CI]: 1.730-4.280, P < 0.05) and TNF-α(HR=3.527, 95%CI: 1.158-10.747, P < 0.05) were independent risk factors for the onset of liver fibrosis in AE patients. The ROC curve analysis showed that hydatid IgG combined with the serum levels of IL-6 and TNF-α had a sensitivity of 88.4%, a specificity of 95.8%, and an area under the ROC curve of 0.951(95%CI: 0.937-0.964) in the diagnosis of liver fibrosis, which were significantly higher than those of IL-6, TNF-α, or hydatid IgG alone (Z=-3.458, -4.011, and 2.379, all P < 0.05). The Spearman analysis showed that the serum levels of IL-6, TNF-α, and TGF-β1 were positively correlated with HAI score (r=0.560, 0.644, and 0.465, all P < 0.001) and Metavir fibrosis score (r=0.530, 0.758, and 0.567, all P < 0.001), and the serum level of IL-10 was negatively correlated with HAI score (r=-0.232, P=0.011) and Metavir fibrosis score (r=-0.288, P=0.001). Conclusion Macrophage polarization is often observed in patients with hepatic AE, and the levels of the macrophage polarization-related factors IL-6, TNF-α, and TGF-β1 are associated with the development and progression of liver fibrosis, which can provide certain reference information for predicting the onset of liver fibrosis. -
多房棘球蚴病(alveolar echinococcosis,AE)是我国最危险的寄生虫病之一,潜伏期较长,且早期通常无明显症状[1-2]。多房棘球蚴的肝内定植和持续增殖通常会引起严重的肝脏肉芽肿性炎症反应,形成“免疫抑制”微环境,导致免疫细胞(包括巨噬细胞)在病灶周围大量浸润[3],其中增加的巨噬细胞迅速浸润肉芽肿,数量远超过T淋巴细胞,这说明巨噬细胞是肝AE组织浸润的主要细胞群之一。然而,由于巨噬细胞具有明显的异质性和功能多样性,其在AE发病中的作用尚未完全阐明[4]。本研究旨在讨论巨噬细胞极化(促炎性M1巨噬细胞和抗炎性M2巨噬细胞)与AE肝纤维化的关系。
1. 资料与方法
1.1 研究对象
回顾性分析2018年9月—2020年10月期间,在本院肝胆胰外科住院治疗的AE患者120例(男49例,女71例,年龄为18~77岁,中位年龄40岁)作为AE组。符合世界卫生组织AE非正式工作小组2003年版分型标准[5]和中国医师协会外科医师分会包虫病外科专业委员会2015年版专家共识[6],根据常规腹部磁共振成像(MRI)-DWI检查诊断为AE,接受部分肝切除术,收集活检组织标本。术前未接受任何相关治疗如抗寄生虫化疗、保肝药物、经皮肝穿刺胆道外引流术等。术前Child-Pugh肝功能分级为A~B级。排除标准:(1)急性和慢性病毒感染和自身免疫性疾病;(2)风湿性疾病和恶性肿瘤;(3)与棘球蚴病感染没有直接关系的感染性疾病,包括严重呼吸道感染、肝胆管感染、败血症和高热;(4)长期使用抗炎药物,包括激素类、非甾体抗炎药和阿片类药物。另外从医院血库捐献者中选取33例健康对照者(年龄、性别相匹配),其中男20例,女13例,平均年龄45.42(20~73)岁。血常规检查、心电图和B超检查均无明显异常。
1.2 实验方法
1.2.1 资料收集
所有患者均记录了身高、体质量、职业、民族及是否有肝性脑病的基本资料。通过腹部超声检查评估肝脏肿块的位置、数量、横径、纵径及腹水情况。另外,根据Knodell的组织学活动指数(Histologicalactivity index,HAI)进行炎症评分。
1.2.2 获取血液样本和组织样本
(1) 血液样本:对照组受试者于入组后静坐20 min后、观察组患者于手术治疗前1 h分别采集外周静脉血置于离心管中,4 ℃环境下3000 r/min离心25 min,留取血清待测。(2)组织样本:将观察组患者切除肝脏标本分为距病灶中心≤2 cm的肝组织及距病灶中心>2 cm的正常肝组织,两组肝脏样本均用10%甲醛固定,经石蜡包埋后制成3 μm切片,用于苏木精-伊红染色(HE)和Masson三色染色分析。
1.2.3 HE染色及肝纤维化分级
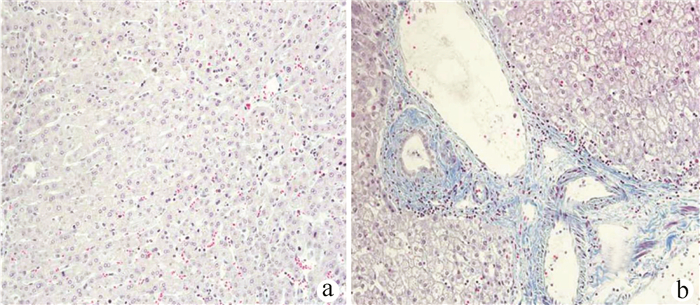
将切片置于60 ℃的烘箱中2 h烤片后,依次用二甲苯Ⅰ、Ⅱ脱蜡,梯度乙醇溶液水化。滴加苏木素染液5 min后,1%盐酸酒精分化5~10 s。伊红染液二次染色3 min,再依次从低浓度至高浓度顺序用乙醇溶液脱水。最后用二甲苯透明后干燥封片。由同一组经验丰富的病理科医生对组织切片进行Metavir纤维化分期:F0表示无肝纤维化;F1表示门静脉区域纤维化;F2表示肝纤维化并不局限于门静脉区域,还包括肝小叶部分;F3表示肝小叶中央静脉纤维化;F4表示假小叶形成,甚至发展成肝硬化(图 1、2)。
1.2.4 血清巨噬细胞相关因子检测
采用酶联免疫吸附法检测IL-6、IL-10、TNFα、TGFβ,试剂盒购自上海晶抗生物工程有限公司。
1.3 伦理学审查
研究方案得到了本院伦理委员会的批准,所有研究对象均提供了书面的知情同意书。
1.4 统计学方法
采用SPSS 21.0进行数据处理,符合正态分布的计量资料采用x ±s表示,2组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25~P75)表示,组间比较采用Mann-Whitney U检验或Kruskal-Wallis H检验。计数资料组间比较采用χ2检验。采用单因素及多因素logistic回归模型分析血清巨噬细胞相关因子与AE患者肝纤维化的关系,并采用受试者工作特征曲线(ROC曲线)评估血清IL-6、TNFα对肝AE患者肝纤维化的诊断价值,计算ROC曲线下面积(AUC)、敏感度和特异度。另外采用Spearman法分析各指标与HAI评分和Metavir分期的相关性。P<0.05为差异有统计学意义。
2. 结果
2.1 2组基线资料比较
AE组和正常对照组性别及年龄差异均有统计学意义(P值均<0.05);2组人群其他指标比较,差异均无统计学意义(P值均>0.05)(表 1)。
表 1 AE组和正常对照组人群基线资料指标 AE组(n=120) 正常对照组(n=33) 统计值 P值 男[例(%)] 49(40.83) 20(60.61) χ2=4.087 0.043 年龄(岁) 39.55±12.75 45.42±15.31 t=2.240 0.026 民族[例(%)] χ2=0.290 0.865 汉族 42(35.00) 12(36.36) 藏族 70(58.33) 18(54.55) 其他 8(6.67) 3(9.09) 职业背景[例(%)] χ2=1.049 0.306 牧民 84(70.00) 20(60.61) 非牧民 36(30.00) 13(3.03) 血型[例(%)] χ2=0.117 0.990 A型 51(42.50) 14(42.42) B型 32(26.67) 9(27.27) AB型 20(16.67) 6(18.18) O型 17(14.17) 4(12.12) 2.2 2组人群血清IL-6、IL-10、TNFα、TGFβ1水平比较
AE组IL-6、TNFα、TGFβ1水平均显著高于正常对照组(P值均<0.05)(表 2)。
表 2 2组人群血清IL-6、IL-10、TNFα、TGFβ1水平分析血清学指标 AE组(n=120) 正常对照组(n=33) Z值 P值 IL-6(pg/mL) 13.97(9.64~23.62) 1.30(0.35~2.71) -5.980 <0.001 IL-10(pg/mL) 1.79(1.27~2.43) 1.70(1.50~2.14) -1.002 0.541 TNFα(pg/mL) 2.26(1.65~4.13) 1.40(1.04~2.10) -3.114 0.007 TGFβ1(pg/mL) 3.64(2.71~5.72) 2.91(2.20~3.35) -2.594 0.040 2.3 血清IL-6、IL-10、TNFα、TGFβ1与肝AE患者肝纤维化的关系
利用Masson染色法观察胶原沉积区域。结果显示,距病灶中心>2 cm的正常肝组织肝门区无炎性细胞浸润,胶原纤维较少或无。而距病灶中心≤2 cm的肝组织肝小叶正常结构消失,肝细胞排列紊乱,体积增大,核溶解,蓝藻纤维组织明显增生和沉积。比较不同肝纤维化程度肝AE患者的血清学指标,随着肝纤维化程度的加重,IL-6、TNFα水平明显升高,其中肝纤维化F4级患者的IL-6、TNFα水平最高,差异均有统计学意义(P值均<0.05);肝AE患者的TGFβ1水平也随着肝纤维化程度加重而升高,差异均有统计学意义(P值均<0.05),但F4级患者的TGFβ1水平有低于F3级的趋势。经Spearman分析,血清IL-6(r=0.530,P<0.001)、TNFα(r=0.758,P<0.001)、TGFβ1(r=0.567,P<0.001)水平与Metavir纤维化评分均呈正相关性,而血清IL-10(r=-0.288,P=0.001) 与Metavir纤维化评分则呈负相关性(表 3、图 3)。
表 3 血清IL-6、IL-10、TNFα、TGFβ1与肝AE患者肝纤维化的关系分析血清学指标 F0(n=23) F1(n=28) F2(n=34) F3(n=19) F4(n=16) H值 P值 IL-6(pg/mL) 12.83(9.97~15.09) 8.56(6.31~13.37) 13.26(9.52~17.92) 23.70(22.88~27.89) 34.50(26.53~52.98) 50.104 <0.001 IL-10(pg/mL) 1.80(1.48~2.83) 1.78(1.52~2.35) 1.91(1.50~2.57) 1.52(0.98~2.11) 1.70(0.89~2.35) 9.522 0.105 TNFα(pg/mL) 1.35(1.21~1.71) 1.85(1.40~2.16) 2.46(2.04~3.74) 5.06(3.43~5.96) 5.43(4.01~7.25) 70.494 <0.001 TGFβ1(pg/mL) 2.61(2.00~2.85) 3.33(2.73~4.13) 3.77(2.97~5.86) 6.80(3.85~12.67) 5.58(3.24~11.25) 42.330 <0.001 2.4 单因素及多因素logistic回归分析血清巨噬细胞相关因子与AE肝纤维化的关系
经单因素和多因素logistic回归分析,血清IL-6、TNFα水平升高是肝AE患者发生肝纤维化的独立危险因素(P值均<0.05)(表 4)。
表 4 单因素和多因素logistic回归分析肝AE患者发生肝纤维化的相关因素变量 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 IL-6 2.490(1.668~3.716) <0.001 2.721(1.730~4.280) <0.001 TNFα 2.012(1.291~3.137) 0.002 3.527(1.158~10.747) 0.027 TGFβ1 1.225(0.992~1.514) 0.060 2.5 ROC曲线分析血清学检查对肝AE患者发生肝纤维化的诊断价值
经ROC曲线分析,血清学检查联合IL-6、TNFα对于肝纤维化的诊断敏感度和特异度分别为88.4%和95.8%,AUC为0.951(95%CI:0.937~0.964),均高于IL-6、TNFα、包虫抗体IgG单独诊断(Z值分别为-3.458、-4.011、2.379,P值均<0.05)(表 5)。
表 5 AE组患者血清IL-6、TNFα水平联合诊断肝纤维化的临床价值变量 AUC P值 敏感度 特异度 约登指数 截断值 95%CI IL-6 0.708 <0.001 57.9% 63.9% 0.218 15.97 pg/mL 0.669~0.747 TNFα 0.654 <0.001 63.9% 60.6% 0.245 1.889 pg/mL 0.612~0.696 包虫抗体IgG 0.918 <0.001 83.7% 100.0% 0.837 1 0.900~0.936 联合诊断 0.951 <0.001 88.4% 95.8% 0.842 0.611 0.937~0.964 2.6 血清IL-6、IL-10、TNFα、TGFβ1与肝AE患者HAI评分的关系
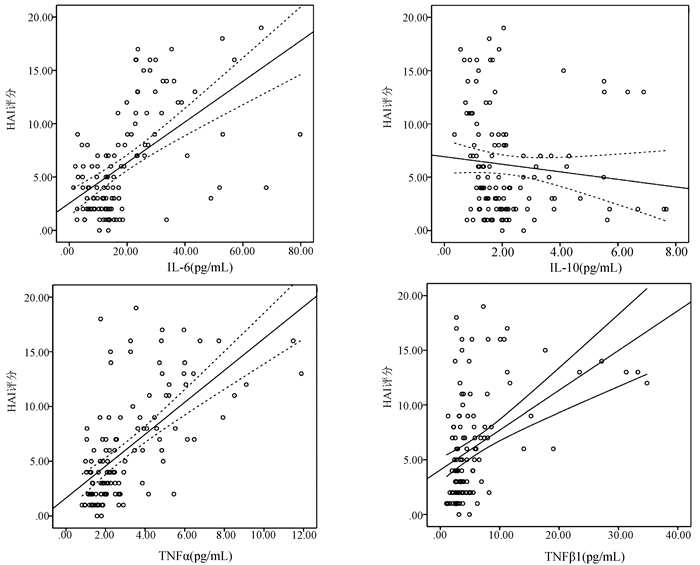
经Spearman分析,血清IL-6(r=0.560,P<0.001)、TNFα(r=0.644,P<0.001)、TGFβ(r=0.465,P<0.001)水平与HAI评分均呈正相关性,而血清IL-10(r=-0.232,P=0.011)与HAI评分则呈负相关性(图 4)。
3. 讨论
肝脏是多房棘球绦虫感染的主要靶器官,肝AE虽为良性疾病,但形态上与肝癌相似,并能通过局部侵袭、转移扩散至肺、脑、肾等器官[7]。免疫应答在AE疾病的发生、发展中起着重要作用,有研究表明虫体对宿主机体的免疫系统有影响,其可通过调节固有免疫及获得性免疫来逃逸宿主的免疫追击,创造虫体长期寄生的条件[8]。因此本研究对属固有免疫的巨噬细胞极化相关因子与AE疾病的相关性进行研究。
巨噬细胞作为具有异质性、可塑性的免疫细胞,可以极化成M1巨噬细胞和M2巨噬细胞。损伤的肝组织中肝细胞索排列紊乱、细胞间间隙扩张还伴随着炎性细胞浸润,若肝损伤持续未愈会导致肝纤维化,目前已有很多研究发现巨噬细胞极化参与着肝纤维化的发生、发展过程[9-10]。例如刘新等[11]对四氯化碳诱导小鼠肝纤维化模型的肝纤维化进程中M1及M2型巨噬细胞表型改变情况进行分析,证实随着小鼠肝小叶结构破坏、肝纤维化生成,M2/M1型巨噬细胞表达比值在进展中呈先减小后逐渐增大的趋势,其中M1型巨噬细胞标志物CD11c mRNA先升高后降低,而M2型巨噬细胞标志物CD206、Arg-1 mRNA则在下降后逐渐升高。因此作者推断在肝纤维化过程中,巨噬细胞极化是由M1型主导逐渐演变为M2型主导的过程。而如CD11c等此类M1型巨噬细胞标志物可表示M1型巨噬细胞活化状态,相同的CD206等M2型巨噬细胞标志物也提示着M2型巨噬细胞的活性。M1型巨噬细胞可以分泌促炎细胞因子(如IL-6、IL-12、TNFα、IL-18等)[12]、释放趋化因子招募其他免疫细胞、诱导Th1反应发生,使肝组织持续处于炎症阶段、促纤维化生成;而M2型巨噬细胞被发现与寄生虫、蠕虫、真菌感染关系密切,其可分泌抑炎因子(如IL-10、TGFβ1等),招募中性粒细胞、单核细胞、T淋巴细胞以调节炎症反应,具有抑制炎症反应及纤维化作用,加速肝损伤后的肝组织修复[13]。
此外,有研究[14-16]发现在器官组织纤维化进展中,巨噬细胞极化与TGFβ1/Smad调节起着重要作用,如Smad3和Smad4阻断TGFβ1的信号传导有利于抑制巨噬细胞极化,进而抑制相关疾病进展。例如槲皮素能够抑制肝纤维化肝组织中巨噬细胞M1型极化及M1型巨噬细胞相关的炎性细胞因子IL- 1β、IL-6水平,从而减轻四氯化碳诱导的小鼠肝纤维化进展[17]。此外由寄生虫引起的肝纤维化与巨噬细胞极化也密切相关,如陈聪等[18]证实血吸虫感染肝脏细胞后,Kupffer细胞以及血吸虫虫卵产生的可溶性抗原会激活CD4+T淋巴细胞,使其募集大量巨噬细胞和炎性细胞至病灶,促使肉芽肿和肝纤维化进展,而M1巨噬细胞和M2巨噬细胞的形成及相互转换与肝纤维化密切相关。因此本研究结果也证实AE组的IL-6、TNFα、TGFβ1水平显著高于正常对照组,且血清IL-6、TNFα水平升高是肝AE患者发生肝纤维化的独立危险因素,同时经ROC曲线分析,血清学检查联合IL-6、TNFα对于肝纤维化的诊断敏感度和特异度良好。因此检测IL-6、TNFα水平对于诊断肝纤维化可提供一定的参考信息。此外,随着肝纤维化程度的加重,AE患者血清IL-6、TNFα水平明显升高,其中肝纤维化F4级升高最明显。说明血清巨噬细胞极化相关因子与肝纤维化的发生和进展都有一定关联,但是其因果关系尚不能明确。
综上,肝AE患者普遍存在巨噬细胞极化状态,且巨噬细胞极化相关因子IL-6、TNFα、TGFβ1水平与肝纤维化的发生和进展有关,对于预测肝纤维化的发生可提供一定的参考信息。
-
表 1 AE组和正常对照组人群基线资料
指标 AE组(n=120) 正常对照组(n=33) 统计值 P值 男[例(%)] 49(40.83) 20(60.61) χ2=4.087 0.043 年龄(岁) 39.55±12.75 45.42±15.31 t=2.240 0.026 民族[例(%)] χ2=0.290 0.865 汉族 42(35.00) 12(36.36) 藏族 70(58.33) 18(54.55) 其他 8(6.67) 3(9.09) 职业背景[例(%)] χ2=1.049 0.306 牧民 84(70.00) 20(60.61) 非牧民 36(30.00) 13(3.03) 血型[例(%)] χ2=0.117 0.990 A型 51(42.50) 14(42.42) B型 32(26.67) 9(27.27) AB型 20(16.67) 6(18.18) O型 17(14.17) 4(12.12) 表 2 2组人群血清IL-6、IL-10、TNFα、TGFβ1水平分析
血清学指标 AE组(n=120) 正常对照组(n=33) Z值 P值 IL-6(pg/mL) 13.97(9.64~23.62) 1.30(0.35~2.71) -5.980 <0.001 IL-10(pg/mL) 1.79(1.27~2.43) 1.70(1.50~2.14) -1.002 0.541 TNFα(pg/mL) 2.26(1.65~4.13) 1.40(1.04~2.10) -3.114 0.007 TGFβ1(pg/mL) 3.64(2.71~5.72) 2.91(2.20~3.35) -2.594 0.040 表 3 血清IL-6、IL-10、TNFα、TGFβ1与肝AE患者肝纤维化的关系分析
血清学指标 F0(n=23) F1(n=28) F2(n=34) F3(n=19) F4(n=16) H值 P值 IL-6(pg/mL) 12.83(9.97~15.09) 8.56(6.31~13.37) 13.26(9.52~17.92) 23.70(22.88~27.89) 34.50(26.53~52.98) 50.104 <0.001 IL-10(pg/mL) 1.80(1.48~2.83) 1.78(1.52~2.35) 1.91(1.50~2.57) 1.52(0.98~2.11) 1.70(0.89~2.35) 9.522 0.105 TNFα(pg/mL) 1.35(1.21~1.71) 1.85(1.40~2.16) 2.46(2.04~3.74) 5.06(3.43~5.96) 5.43(4.01~7.25) 70.494 <0.001 TGFβ1(pg/mL) 2.61(2.00~2.85) 3.33(2.73~4.13) 3.77(2.97~5.86) 6.80(3.85~12.67) 5.58(3.24~11.25) 42.330 <0.001 表 4 单因素和多因素logistic回归分析肝AE患者发生肝纤维化的相关因素
变量 单因素分析 多因素分析 HR(95%CI) P值 HR(95%CI) P值 IL-6 2.490(1.668~3.716) <0.001 2.721(1.730~4.280) <0.001 TNFα 2.012(1.291~3.137) 0.002 3.527(1.158~10.747) 0.027 TGFβ1 1.225(0.992~1.514) 0.060 表 5 AE组患者血清IL-6、TNFα水平联合诊断肝纤维化的临床价值
变量 AUC P值 敏感度 特异度 约登指数 截断值 95%CI IL-6 0.708 <0.001 57.9% 63.9% 0.218 15.97 pg/mL 0.669~0.747 TNFα 0.654 <0.001 63.9% 60.6% 0.245 1.889 pg/mL 0.612~0.696 包虫抗体IgG 0.918 <0.001 83.7% 100.0% 0.837 1 0.900~0.936 联合诊断 0.951 <0.001 88.4% 95.8% 0.842 0.611 0.937~0.964 -
[1] WEN H, VUITTON L, TUXUN T, et al. Echinococcosis: Advances in the 21st Century[J]. Clin Microbiol Rev, 2019, 32(2): e00075-18. DOI: 10.1128/CMR.00075-18. [2] ZHAO SY, ZHU HH, WANG XQ, et al. Present situation and progress of comprehensive treatments for hepatic alveolar echinococcosis[J]. Chin J Schisto Control, 2019, 31(6): 676-678. DOI: 10.16250/j.32.1374.2018086.赵顺云, 朱海宏, 王向前, 等. 肝多房棘球蚴病的综合治疗现状和进展[J]. 中国血吸虫病防治杂志, 2019, 31(6): 676-678. DOI: 10.16250/j.32.1374.2018086. [3] NONO JK, LUTZ MB, BREHM K. Expansion of host regulatory T cells by secreted products of the tapeworm echinococcus multilocularis[J]. Front Immunol, 2020, 11: 798. DOI: 10.3389/fimmu.2020.00798. [4] CAI J, HUANG L, WANG LJ, et al. The role of macrophage polarization in parasitic infections: A review[J]. Chin J Schisto Control, 2020, 32(4): 432-435. DOI: 10.16250/j.32.1374.2019252.蔡娟, 黄琳, 王灵军, 等. 巨噬细胞极化在寄生虫感染中的作用研究进展[J]. 中国血吸虫病防治杂志, 2020, 32(4): 432-435. DOI: 10.16250/j.32.1374.2019252. [5] International classification of ultrasound images in cystic echinococcosis for application in clinical and field epidemiological settings[J]. Acta Trop, 2003, 85(2): 253-261. DOI: 10.1016/s0001-706x(02)00223-1. [6] Chinese Doctor Association, Chinese College of Surgeons, Echinococcosis Professional Committee. Expert consensus on diagnosis and treatment of two types of hydatid disease (2015 edition)[J]. Chin J Dig Surg, 2015, 14(4): 253-264. DOI: 10.3760/cma.j.issn.1673-9752.2015.04.001.中国医师协会外科医师分会包虫病外科专业委员会. 两型包虫病诊断和治疗的专家共识(2015版)[J]. 中华消化外科杂志, 2015, 14(4): 253-264. DOI: 10.3760/cma.j.issn.1673-9752.2015.04.001. [7] WANG H, ZHANG CS, FANG BB, et al. Dual role of hepatic macrophages in the establishment of the echinococcus multilocularis metacestode in mice[J]. Front Immunol, 2020, 11: 600635. DOI: 10.3389/fimmu.2020.600635. [8] KASIMU AHT, ABUDUSALAMU AN, TUERGANAILI AJ, et al. Analysis of hospital expenses for patients with end-stage hepatic alveolar echinococcosis receiving ex vivo liver resection and autotransplantation[J]. Chin J Parasitol Parasit Dis, 2020, 38(1): 53-57. DOI: 10.12140/j.issn.1000-7423.2020.01.021.喀斯木·艾海提, 阿卜杜萨拉木·艾尼, 吐尔干艾力·阿吉, 等. 离体肝切除和自体肝移植术治疗终末期肝多房棘球蚴病的住院医疗费用分析[J]. 中国寄生虫学与寄生虫病杂志, 2020, 38(1): 53-57. DOI: 10.12140/j.issn.1000-7423.2020.01.021. [9] SUN YY, LI XF, MENG XM, et al. Macrophage phenotype in liver injury and repair[J]. Scand J Immunol, 2017, 85(3): 166-174. DOI: 10.1111/sji.12468. [10] ZHANG K, SHI Z, ZHANG M, et al. Silencing lncRNA Lfar1 alleviates the classical activation and pyoptosis of macrophage in hepatic fibrosis[J]. Cell Death Dis, 2020, 11(2): 132. DOI: 10.1038/s41419-020-2323-5. [11] LIU X, LOU JL, BAI L, et al. Phenotypic transformation of macrophages in the liver during the development of liver fibrosis in mice[J]. Labeled Immunoassays Clin Med, 2019, 26(9): 1532-1536, 1564. DOI: 10.11748/bjmy.issn.1006-1703.2019.09.020.刘新, 娄金丽, 白丽, 等. 小鼠肝纤维化形成过程中肝内巨噬细胞的表型转换[J]. 标记免疫分析与临床, 2019, 26(9): 1532-1536, 1564. DOI: 10.11748/bjmy.issn.1006-1703.2019.09.020. [12] JI C, ZHANG WJ, GUAN N, et al. Effect of M1 macrophages on immune status in chronic periodontitis model mice[J]. J Jilin Univ(Med Edit), 2020, 46(6): 1137-1142. DOI: 10.13481/j.1671-587x.20200605.籍辰, 张文娟, 关宁, 等. M1型巨噬细胞对慢性牙周炎模型小鼠免疫状态的影响[J]. 吉林大学学报(医学版), 2020, 46(6): 1137-1142. DOI: 10.13481/j.1671-587x.20200605. [13] ATRI C, GUERFALI FZ, LAOUINI D. Role of human macrophage polarization in inflammation during infectious diseases[J]. Int J Mol Sci, 2018, 19(6). DOI: 10.3390/ijms19061801. [14] GUO ZJ, ZHAI HQ, WANG NN, et al. Study of macrophage polarization on pulmonary fibrosis and signaling pathway[J]. China J Chin Mater Med, 2018, 43(22): 4370-4379. DOI: 10.19540/j.cnki.cjcmm.2018.0117.郭兆娟, 翟华强, 王宁宁, 等. 巨噬细胞极化在肺纤维化中的作用及信号通路研究[J]. 中国中药杂志, 2018, 43(22): 4370-4379. DOI: 10.19540/j.cnki.cjcmm.2018.0117. [15] TACKE F. Targeting hepatic macrophages to treat liver diseases[J]. J Hepatol, 2017, 66(6): 1300-1312. DOI: 10.1016/j.jhep.2017.02.026. [16] E WJ, LU YL, ZHANG LQ, et al. Characteristics and clinical value of macrophage polarization in tissues and serum of patients with hepatic alveolar echinocococosis[J]. J Pract Med, 2020, 36(9): 1198-1202. DOI: 10.3969/j.issn.1006-5725.2020.09.016.鄂维建, 芦永良, 张灵强, 等. 肝泡型包虫病肝组织和血清中巨噬细胞极化特点及临床意义[J]. 实用医学杂志, 2020, 36(9): 1198-1202. DOI: 10.3969/j.issn.1006-5725.2020.09.016. [17] LI X, JIN Q, YAO Q, et al. The flavonoid quercetin ameliorates liver inflammation and fibrosis by regulating hepatic macrophages activation and polarization in mice[J]. Front Pharmacol, 2018, 9: 72. DOI: 10.3389/fphar.2018.00072. [18] CHEN C, SHEN WT, LIU Y. Advances in research on the effect of macrophages in microenvironment on liver fibrosis due to schistosomiasis[J]. J Pathog Biol, 2020, 15(2): 241-245. DOI: 10.13350/j.cjpb.200225.陈聪, 沈文涛, 刘彦. 微环境中巨噬细胞影响血吸虫肝纤维化的研究进展[J]. 中国病原生物学杂志, 2020, 15(2): 241-245. DOI: 10.13350/j.cjpb.200225. 期刊类型引用(5)
1. 陈欣怡,严得刚,梁宏,李菊英,加央次仁,王登云,赵海龙,唐文强. TGF-β1和Collagen-Ⅲ在牦牛感染细粒棘球蚴肝纤维化中的表达. 动物医学进展. 2024(04): 45-50 .  百度学术
百度学术2. 沈银红,张涛,杨紫晗,张耀刚,黄登亮,侯静,田美媛,马艳艳. 多房棘球蚴对巨噬细胞糖代谢表型转变及极化类型影响的初步研究. 中国血吸虫病防治杂志. 2023(06): 590-603+613 .  百度学术
百度学术3. 张伶慧,陈根,种世桂,沈辉,马慧,赵玉敏. 多房棘球蚴病中免疫细胞调控机制的研究进展. 中国寄生虫学与寄生虫病杂志. 2022(01): 109-113+120 .  百度学术
百度学术4. 李琛,董丹,许军英,卜媛媛,刘程豪,乔世源,高风亦,谭小武,吴向未,陈雪玲. 大蒜素对细粒棘球蚴囊液诱导巨噬细胞氧化损伤的保护作用. 石河子大学学报(自然科学版). 2022(06): 765-771 .  百度学术
百度学术5. 张仁杰,庞华胜,李景中,罗钊辉,艾琳,宋鹏,蔡玉春,卢艳,莫筱瑾,陈木新,陈家旭. 棘球绦虫诱导肝纤维化机制研究进展. 中国血吸虫病防治杂志. 2022(06): 646-653 .  百度学术
百度学术其他类型引用(2)
-




 PDF下载 ( 3391 KB)
PDF下载 ( 3391 KB)


 下载:
下载:




 下载:
下载:

 百度学术
百度学术





